даны правые части уравнений диссоциации h so4
Даны правые части уравнений диссоциации h so4
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Задание 4
Напишите уравнения электролитической диссоциации кислот и назовите образующиеся анионы:
а) азотной, серной;
HNO3 ⟶ H + + NO3 − нитрат-анионы
H2SO4 ⟶ 2H + + SO4 2− сульфат-анионы
б) бромоводородной HBr, азотистой HNO2.
HBr ⟶ H + + Br − бромид-анионы
HNO2 ⟶ H + + NO2 − нитрит-анионы
Задание 7
Расставьте заряды ионов в формулах следующих веществ и назовите эти вещества:
а) Na2S, Na2SO4, MgSO4, Na3PO4, AlPO4;
Na2 + S 2- ― сульфид натрия
Na2 + SO4 2- ― сульфат натрия
Mg 2+ SO4 2- ― сульфат магния
Na3 + PO4 3- ― фосфат натрия
Al 3+ PO4 3- ― фосфат алюминия
Задание 9
Составьте формулы и напишите уравнения диссоциации сульфата железа (II) и сульфата железа (III).
FeSO4 ⟶ Fe 2+ + SO4 2-
Fe2(SO4)3 ⟶ 2Fe 3+ + 3SO4 2-
Чем отличаются эти соли? Зарядом иона железа.
Диссоциация оснований, кислот, солей
Урок 35. Химия 8 класс
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Диссоциация оснований, кислот, солей»
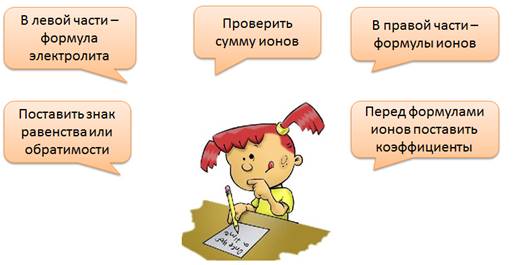
При составлении уравнений электролитической диссоциации следует поступать следующим образом: в левой части уравнения записать формулу электролита, затем поставить знак равенства или обратимости в зависимости от силы электролита. В правой части записать формулы образующихся положительно и отрицательно заряженных ионов, указав значения и знаки их зарядов. Перед формулами ионов поставить коэффициенты, затем проверить сумму положительных и отрицательных ионов, она должна быть равна нулю.
Кислоты – это электролиты, при диссоциации которых образуются катионы водорода и анионы кислотного остатка.
Сильные кислоты диссоциируют полностью по одной ступени:
При диссоциации сильных кислот ставится знак равенства, а при диссоциации слабых кислот вместо знака равенства ставится знак обратимости.
Многоосновные слабые кислоты диссоциируют ступенчато. На каждой стадии отщепляется ион водорода. Например, диссоциация фосфорной кислоты идет в 3 ступени:
Следует учитывать, что диссоциация, в данном случае, по второй ступени протекает намного слабее, чем по первой, а диссоциация по третьей ступени при обычных условиях почти не происходит.
Как видно, все кислоты при диссоциации образуют катионы водорода, поэтому они имеют кислый вкус и изменяют окраску индикаторов: лакмус и метилоранж становятся красными.
Основания – это электролиты, при диссоциации которых образуются катионы металла и в качестве анионов гидроксид-ионы.
Сильные электролиты – щёлочи – диссоциируют полностью по первой ступени.
Многоосновные слабые основания диссоциируют ступенчато и вместо знака равенства ставится знак обратимости. Например, гидроксид меди (II) диссоциирует по двум ступеням:
Т.к. при диссоциации оснований образуются гидроксид-ионы, то они будут иметь схожие свойства, такие как мыльность на ощупь, изменение окраски индикаторов: лакмус становится синим, метилоранж – жёлтым, фенолфталеин – малиновым.
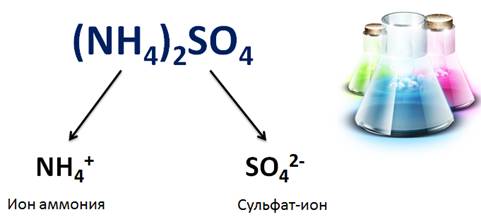
Соли – это электролиты, при диссоциации которых образуются катионы металлов (или аммония) и анионы кислотного остатка.
Соли диссоциируют по одной ступени, в отличие от кислот и оснований.
Свойства солей определяются как катионами металла, так и анионами кислотного остатка. Например, соли аммония имеют общие свойства, обусловленные наличием иона аммония (NH4 + ), так и различные, обусловленные анионами кислотного остатка. Общие свойства сульфатов – солей серной кислоты – обусловлены наличием сульфат-ионов, а специфические свойства обусловлены различными катионами.
Кислые соли, в отличие от средних, диссоциируют ступенчато: первая ступень сопровождается диссоциацией катиона металла и аниона кислотного остатка, содержащего ион водорода, вторая ступень – это отщепление иона водорода и кислотного остатка.
Даны правые части уравнений диссоциации h so4
Контрольная работа № 2 по химии в 9 классе «Химические реакции в водных растворах» с ответами (3 варианта) для УМК Рудзитис, Фельдман. Автор работы: Т.А.Боровских. Цитаты из пособия использованы в учебных целях. Химия 9 Рудзитис Контрольная работа 2.
Контрольная работа № 2
«Химические реакции в водных растворах»
КР-2. Вариант 1
3) В трёх пробирках под номерами 1–3 находятся растворы хлоридов натрия и алюминия и карбоната натрия. Как различить эти растворы, имея в своём распоряжении только лакмус? Ответ поясните.
Ответы на задания Варианта 1
№ 1. Катионы — положительно заряженные ионы, 2; 3; 6; 7; 10.
№ 2. Молекула/ион, отсутствием/наличием заряда.
№ 3. 3; 5; 7; 8; 9; уравнение диссоциации можно записать только для солей и щелочей.
№ 4. 1; 3; 5; 6.
№ 5. Слабые электролиты диссоциируют обратимо, а многоосновные — ступенчато.
№ 6. α = N/NA = 4,1214•10 23 /6,02•10 23 = 0,7 (70%).
№ 7. 2Н + + SO3 2– = SO2 + Н2O; Mg(OH)2 + 2Н + = Mg 2+ + 2Н2O; Fe2O3 + 6Н + = 2Fe 3+ + 3Н2O; 2OН – + СO2 = СО3 2– + Н2O; Ag + + Сl – = AgCl.
№ 8. Бромоводород + нитрат серебра(I) →↑; Бромоводород + карбонат натрия →↑
№ 9. Сильная кислота + щёлочь.
№ 10. 1) СO3 2– + 2Н + = CO2↑ + Н2O; 2) + Ba(NO3)2 + AgNO3; 3) лакмус — фиолетовый/красный/синий.
КР-2. Вариант 2
3) В трёх пробирках под номерами 1–3 находятся растворы нитратов калия и алюминия и сульфида натрия. Как различить эти растворы, имея в своём распоряжении только лакмус? Ответ поясните.
Ответы на задания Варианта 2
№ 1. Анионы — отрицательно заряженные ионы, 2; 4; 5; 8; 11; 12.
№ 2. Молекула/ион, отсутствием/наличием заряда.
№ 3. 2; 4; 6; 7; 8; уравнение диссоциации можно записать только для солей и щелочей.
№ 4. 1; 2; 4; 6.
№ 5. Слабые электролиты диссоциируют обратимо, а многоосновные— ступенчато. 6. α = N/NA = 1,5•10 23 /6,02•10 23 = 0,3 (30%).
№ 7. 2OН – + N2O5 = 2NO3 – + Н2O; 2Н + + СO3 2– = СO2 + Н2O; Na2O + 2Н + = Na + + Н2O; Аl(ОН)3 + ЗН + = Аl 3+ + ЗН2O; ЗСа 2+ + 2РO4 3– = Са3(РO4)2.
№ 8. Йодоводород + гидроксид калия —> Н2O; сульфат цинка + ортофосфат натрия →↑.
№ 9. Нитрат серебра + соляная кислота или хлорид щелочного металла.
№ 10. 1) фенолфталеин окрасится малиновым; 2)НСl/ВаСl2/AgNO3; 3) лакмус — фиолетовый/красный/синий.
КР-2. Вариант 3
3) В трёх пробирках под номерами 1–3 находятся растворы хлоридов кальция и цинка и фосфата натрия. Как различить эти растворы, имея в своём распоряжении только лакмус? Ответ поясните.
Ответы на задания Варианта 3
№ 1. Катионы — положительно заряженные ионы, 1; 3; 6; 7; 9; 10.
№ 2. Молекула/ион, отсутствием/наличием заряда.
№ 3. 2; 4; 6; 7; 8; уравнение диссоциации можно записать только для солей и щелочей.
№ 4. 1; 2; 4; 6; 7.
№ 5. Слабые электролиты диссоциируют обратимо, а многоосновные— ступенчато.
№ 6. α = N/NA = 1,204•10 23 /6,02•10 23 = 0,2 (20%).
№ 7. S 2– + Zn 2+ = ZnS; 2Н + + MgCO3 = Mg 2+ + CO3 2– + Н2O; S 2– + 2H + = H2S; SO3 + 2OH – = SO3 2– + Н2O; Fe2O3 + 6H + = 2Fe 3+ + 3Н2O.
№ 8. Сульфит натрия + + хлорид никеля (II) →↑; хлорид никеля (II) + гидроксид натрия →↑.
№ 9. Растворимая соль меди + щёлочь.
№ 10. 1) Ва 2+ + SO4 2– = BaSO4; 2) соляная кислота; нитрат серебра; 3) лакмус — фиолетовый/красный/синий.
Вы смотрели: Контрольная работа по химии 9 класс «Химические реакции в водных растворах» с решениями и ответами (3 варианта). Автор работы: Т.А.Боровских. Используется в комплекте с учебником Г. Е. Рудзитиса, Ф. Г. Фельдмана «Химия. 9 класс». Цитаты из пособия использованы в учебных целях. Химия 9 Рудзитис Контрольная работа 2.
Химический факультет
Кемеровский государственый университет
Материалы
Тема 11.Ионные реакции в растворах. Задания
1. При диссоциации 1 моль Na2SO4 образуются:
2. В разбавленном растворе серной кислоты наиболее высока концентрация частиц:
3. Наибольшей электропроводностью обладает раствор, 1 л которого содержит 1 моль:
4. Наименьшую степень диссоциации имеет:
5. Не является электролитом:
6. Одновременно в растворе не могут находиться ионы:
7. Электрический ток хорошо проводит:
8. Электрический ток практически не проводит водный раствор:
9. В растворе электролита под действием электрического поля:
10. Химическая связь в электролитах:
11. Сумма коэффициентов в уравнении электролитической диссоциации средней соли, полученной при взаимодействии гидроксида железа (III) и серной кислоты, равна:
12. Наибольшее количество ионов в 1 л раствора, содержащего 1 моль вещества, содержится в случае:
13. Какая из приведенных ниже пар веществ может реагировать в водном растворе:
15. Сумма всех коэффициентов в полном и сокращенном ионном уравнении реакции NaCl и AgNO3 в растворе равна:
16. Реакция ионного обмена идет до конца, если в результате реакции образуется:
17. Реактивом на ион Ag + является растворимое вещество, содержащее ион:
18. Реакция сульфита натрия и соляной кислоты идет потому, что в результате реакции образуется:
19. Реактивом на ион NH4 + является:
21. Левая часть краткого ионного уравнения реакции CO3 2- + 2H + =…. соответствует взаимодействию в растворе:
22. Правая часть краткого ионного уравнения ……. = CO2 + H2O соответствует взаимодействию:
23. Не может быть правой частью краткого ионного уравнения реакции запись:
24. Реакция между карбонатом магния и уксусной кислотой отражается кратким ионным уравнением:
25. Гидроксид калия может быть получен в реакции ионного обмена, в растворе между:
26. В результате реакции хлорида алюминия с водой образуется:
27. При реакции хлорида магния с водой образуется:
28. При реакции карбоната натрия с водой образуется:
29. При растворении хлорида цинка в воде среда становится:
30. При растворении ортофосфата калия в воде среда становится:
31. При растворении нитрата кальция в воде среда становится:
32. В растворе нитрата алюминия метилоранж имеет окраску:
33. Щелочную среду имеет раствор:
34. Фенолфталеин приобретет малиновую окраску в растворе:
35. Кислая среда в растворе:
36. В растворе йодида цинка лакмус имеет окраску:
37. Нейтральная среда в растворе:
38. Щелочную среду имеют растворы:
39. В большей степени гидролиз протекает в растворе каждой из двух солей:
40. При сливании растворов AlCl3 и Na2CO3 продуктами являются:
41. Установите соответствие между составом соли и типом её гидролиза в водном растворе:
| Состав соли | Тип гидролиза |
| 1) FeCl2 | А) по катиону |
| 2) КNO3 | Б) по аниону |
| 3) Al2S3 | В) по катиону и аниону |
| Г) гидролизу не подвергается; |
42. Установите соответствие между составом соли и типом её гидролиза в водном растворе:
| Состав соли | Тип гидролиза |
| 1) Zn(NO3)2 | А) по катиону |
| 2) Na2CO3 | Б) по аниону |
| 3) CaCl2 | В) по катиону и аниону |
| Г) гидролизу не подвергается; |
43. Установите соответствие между формулой соли и её способностью к гидролизу:
| Формула соли | Способность к гидролизу: |
| 1) NH4NO3 | А) по катиону |
| 2) NaI | Б) по аниону |
| 3) CH3COOK | В) по катиону и аниону |
| 4) Al2S3 | Г) гидролизу не подвергается |
| 5) Ba(NO2)2; |
| Формула соли: | Концентрации H+ и OH-: |
| 1) ZnCl2 | А) [H+] = [OH-] |
| 2) КI | Б) [H+] > [OH-] |
| 3) Na2SO3 | В) [H+] Copyright Химический факультет КемГУ © 2014. All Rights Reserved. Помогите, пожалуйста, решить ЕГЭ по химии. А и Б частиА1. Элемент, расположенный во IIA группе, 4 периоде А2. Схема электронной оболочки атома: 2,8,4. Формула его летучего водородного соединения А3. Наибольший радиус атома у А4. Химическая связь в вещ-вах аммиак и оксид натрия соответственно A6. Высшую валентность VI проявляет A7. Ионную кристаллическую решетку имеет A9. Хлорид-ион Cl в водном растворе можно распознать, используя Часть Б: Б2. Установите соответствие между реагентами и уравнениями реакций в сокращенной ионной форме между ними. Б3. Водный раствор серной кислоты взаимодействует с
|