диссекция правой позвоночной артерии
Диссекция (расслоение) церебральных артерий и ишемический инсульт
Опубликовано в журнале:
«Атмосфера. Нервные болезни», 2011, № 2, с. 2-5
Диссекция церебральных артерий (ДЦА) является частой причиной ишемического инсульта в молодом возрасте. Ее доля среди прочих причин составляет 25% или более, что выше частоты кардиогенной эмболии и антифосфолипидного синдрома [1]. Интенсивное изучение ДЦА, показавшее ее высокую распространенность, началось в конце прошлого века, когда в клинике стала широко применяться неинвазивная ангиография (магнитно-резонансная и компьютерно-томографическая), обеспечившая прижизненную верификацию этого вида сосудистой патологии головного мозга. Ранее диссекция считалась раритетом, поскольку ее диагноз подтверждался, как правило, только патоморфологическим исследованием; последнее, однако, не отражало распространенность диссекции, так как обусловленный ею ишемический инсульт чаще всего имеет благоприятный для жизни исход [16, 21, 28]. В России целенаправленное изучение этой проблемы впервые началось в Научном центре неврологии РАМН также в конце прошлого века 6.
Основным клиническим проявлением ДЦА служат ишемические нарушения мозгового кровообращения (94%) (инсульты, преходящие нарушения мозгового кровообращения). Значительно реже, в 5% случаев по нашим данным и в 2,2–8% – по данным литературы [10, 11], диссекция проявляется изолированной головной или шейной болью. Это наблюдается при диссекции ВСА или ПА, когда ИМГ преимущественно распространяется в сторону адвентиции и не вызывает гемодинамически значимого сужения просвета артерии. Еще более редким клиническим проявлением диссекции (1% случаев) служит изолированное поражение черепных нервов, чаще всего каудальной группы [3, 22]. Причиной этого является нарушение кровообращения в питающих нерв артериях, которые отходят от артерии, подвергнувшейся диссекции. Иногда единственным проявлением диссекции ВСА может служить симптом Горнера, обусловленный повреждением периартериального симпатического сплетения [12, 17].
Нарушения мозгового кровообращения при диссекции представлены ишемическими инсультами и преходящими нарушениями мозгового кровообращения. Как правило, они развиваются у лиц, считавших себя практически здоровыми, за исключением того, что часть из них ранее страдали головными болями, обычно мигренеподобными. Развитие диссекции нередко провоцируется различными факторами, такими как ушиб, сотрясение головы, физическое напряжение, повороты, наклоны, запрокидывание головы, ее вынужденное неудобное положение, мануальная терапия на шейном отделе позвоночника, прием алкоголя, банальная инфекция, прием контрацептивов [2, 27].
Характерной особенностью ДЦА различной локализации является сочетание симптомов очаговой ишемии головного мозга с головной или шейной болью. Боль, как правило, регистрируется на стороне диссекции и при поражении экстракраниального отдела ВСА и ПА предшествует очаговым неврологическим симптомам инсульта на 3–4 нед, а при диссекции интракраниальных артерий обычно возникает почти одновременно с ними. Патофизиологической основой боли является раздражение рецепторов артериальной стенки развивающейся в ней гематомой. Очаговая неврологическая симптоматика определяется бассейном, в котором произошло нарушение мозгового кровообращения.
Прогноз для жизни в большинстве случаев благоприятный, летальный исход наблюдается, по нашим данным, в 4% случаев. На такую же частоту указывают и данные литературы [28]. Обычно летальный исход наступает при обширных инфарктах мозга вследствие диссекции интракраниальных артерий. У большинства больных наблюдается хорошее восстановление нарушенных функций. Диссекция церебральных артерий может рецидивировать. Частота рецидивов среди наших больных составила 6%, W.I. Schievink et al. [30] отмечают, что в течение 1-го месяца диссекция рецидивирует у 2% больных, в дальнейшем частота рецидивов составляет 1% в год. При этом риск повторных диссекций выше у больных с наследственной отягощенностью [24, 29].
Механизм развития нарушений мозгового кровообращения чаще всего связан с сосудисто-мозговой недостаточностью в условиях стенозирующе-окклюзирующего процесса, обусловленного диссекцией кровоснабжающих головной мозг артерий. Значительно реже он представлен артерио-артериальной эмболией из псевдоаневризмы, сформировавшейся вследствие диссекции. Некоторые авторы основное значение придают артериальной эмболии из места надрыва интимы [13, 20].
Важная роль в диагностике диссекций принадлежит ангиографии, особенно неинвазивной – магнитно-резонансной и компьютерной рентгеновской [2, 19, 26]. Патогномоничными симптомами диссекции магистральных артерий являются “симптом пламени свечи”, который обнаруживается при окклюзии или субтотальном стенозе ВСА вследствие “косого” отслоения интимы на 1–2 см выше ее устья, “симптом струны” – пролонгированное, достаточно равномерное сужение просвета артерии, “симптом четок, или нитки бус”, обусловленный неравномерным сужением просвета артерии на разных уровнях, наличие псевдоаневризмы. Частым признаком служит и постепенное, в течение 2–3 мес, полное или частичное восстановление проходимости по артерии, обусловленное рассасыванием ИМГ. Признаки атеросклеротического поражения артерий отсутствуют, иногда выявляются гемодинамически незначимые атеросклеротические бляшки. Нередкой находкой служат извитость и гипоплазия артерий. Большое диагностическое значение принадлежит магнитно-резонансной томографии шеи в режиме Т1 с подавлением сигнала от жировой ткани (T1 fs), позволяющей обнаружить ИМГ.
Морфологическое исследование артерий мозга при ДЦА позволяет выявить расслоение, истончение, а местами и отсутствие внутренней эластической мембраны, участки фиброза в интиме, неправильную ориентировку миоцитов в медии. Эти изменения обусловливают слабость сосудистой стенки, которая предрасполагает к надрыву интимы и диссекции [3, 4]. Предполагается, что причиной изменений сосудистой стенки служит генетически детерминированная слабость соединительной ткани, однако генетические исследования не дали положительных результатов [14]. Впервые в мире нами было предположено, что причиной слабости артериальной стенки служит митохондриальная цитопатия. Исследование биоптатов мышц и кожи подтвердило это предположение. При гистологическом и гистохимическом исследовании мышц обнаружены красные рваные волокна, снижение реакции на сукцинатдегидрогеназу и цитохромоксидазу, субсарколеммальный тип окрашивания в волокнах с сохранной реакцией. При электронно-микроскопическом исследовании артерий кожи выявлены изменения митохондрий, вакуолизацию, отложение жира, липофусцина и гликогена в клетках с измененными митохондриями, отложения кальция в экстраклеточном матриксе. Комплекс выявленных изменений, характерных для митохондриальную цитопатии, позволил предложить термин митохондриальная артериопатия – для обозначения патологии артерий, предрасполагающих к диссекции [8, 9].
Лечение ишемического инсульта, обусловленного диссекцией, окончательно не определено, так как отсутствуют рандомизированные плацебоконтролируемые исследования, выполненные на большом числе больных [18, 19, 23, 25]. Чаще всего рекомендуется введение прямых антикоагулянтов (АК) с последующим переходом на непрямые АК, которые применяются в течение 3–6 мес. Основой для такой рекомендации служит представление о том, что основным механизмом развития инсульта при диссекции служит артерио-артериальная эмболия. Согласно нашим данным, основным механизмом ДЦА является не эмболия, а сосудисто-мозговая недостаточность вследствие окклюзирующего процесса в артериях мозга, обусловленного диссекцией, в связи с чем строгие показания к назначению АК отсутствуют. Исход инсульта, по нашим данным, не зависит от того, применялись АК или нет. Более того, введение гепарина может привести к увеличению ИМГ и нарастанию окклюзирующего процесса в артериях головного мозга. Вместе с тем введение небольших доз гепарина теоретически может быть полезно, так как препятствует сворачиванию крови в области ИМГ и способствует ее разрешению. Абсолютные показания к назначению АК, по нашему мнению, существуют в случаях, когда инсульт развивается по механизму артерио-артериальной эмболии из псевдоаневризмы магистральных артерий головы, сформировавшейся вследствие диссекции.
В качестве альтернативы антикоагулянтам в остром периоде инсульта рекомендуется применение антиагрегантов, причем какие-либо различия в исходах инсульта, по предварительным данным, отсутствуют [25]. S.T. Engelter et al. [18] полагают, что при тяжелом ишемическом инсульте, обусловленном интракраниальной диссекцией, анамнестических указаниях на склонность к кровоточивости более оправданно применение антиагрегантов. С другой стороны, при окклюзии экстракраниальных артерий, вызванной диссекцией, при множественных эпизодах ишемии в одном и том же бассейне или при выявлении флотирующего тромба в месте разрыва интимы предпочтение следует отдавать антикоагулянтам [18].
Целесообразно подчеркнуть, что применение АК и антиагрегантов ограничивается периодом 2–3 мес, в течение которых происходит организация ИМГ. Дальнейший профилактический прием АК и антикоагулянтов нецелесообразен, так как причиной инсульта при диссекции служит не гиперкоагуляция, а слабость артериальной стенки.
Имеются описания тромболитической терапии при ДЦА с хорошим восстановлением нарушенных функций головного мозга. Однако отнести улучшение только на счет тромболизиса нельзя, так как для инсульта, обусловленного диссекцией, характерен хороший регресс очаговых неврологических симптомов вне зависимости от проведения тромболизиса [26].
В связи с тем, что основной причиной, предрасполагающей к развитию диссекции, является “слабость” артериальной стенки, лечебные мероприятия как в остром, так и в отдаленном периоде инсульта должны быть направлены и на ее “укрепление”. Учитывая наши данные о митохондриальной цитопатии, приводящей к энергетической недостаточности клеток артериальной стенки и ее дисплазии [8, 9], показано применение препаратов с трофическим и энерготропным действием. Одним из широко применяемых нами препаратов, как в остром, так и в отдаленном периоде инсульта при диссекции, служит Актовегин. Он представляет собой биологически активное вещество естественного происхождения – гемо-диализат крови телят. Основное действие Актовегина заключается в активации клеточного метаболизма, которое опосредуется его активными компонентами – инозитолфосфат-олигосахаридами. Они облегчают поступление кислорода и глюкозы в клетку, обеспечивая тем самым дополнительный приток энергетических субстратов и увеличивая в 18 раз продукцию аденозинтрифосфата – универсального донатора энергии, необходимой для жизнедеятельности клетки и ее функционирования. Универсальностью действия Актовегина объясняется широкий спектр его клинического применения. Клинические и экспериментальные исследования показали эффективность Актовегина при трофических повреждениях кожи, нарушениях кровообращения, гипоксическом повреждении миокарда, ишемии мозга [16]. Следует особо подчеркнуть, что применение Актовегина при ишемическом инсульте, обусловленном ДЦА, показано не только с целью “укрепления” сосудистой стенки, но и для улучшения метаболизма мозга после перенесенной ишемии. Актовегин назначается внутривенно капельно (250 мл – 2000 мг) в течение 10 дней с последующим переходом на прием препарата внутрь (1–2 драже 3 раза в день перед едой) в течение 1–1,5 мес. Используются и другие препараты с нейротрофическим действием для улучшения восстановления нарушенных вследствие инсульта функций: церебролизин, пирацетам, глиатилин (церепро), цераксон.
Наряду с медикаментозным лечением в остром периоде диссекции большое значение имеет соблюдение режима: следует избегать резких движений головой, травм, физического напряжения, натуживания, которые могут привести к нарастанию диссекции.
В заключение еще раз следует отметить, что диссекция артерий головного мозга является частой причиной ишемического инсульта в молодом возрасте и у детей, реже она служит причиной ишемического инсульта в старших возрастных категориях. Знание клинических и ангиографических особенностей данного вида сосудистой патологии головного мозга является основой для выбора лечения и проведения вторичной профилактики.
Диссекция позвоночной артерии в практике сосудистого неврологического отделения
Резюме.В статье приведены два клинических случая диагностики и эффективного лечения диссекции позвоночной артерии, осложнившейся ишемическим инсультом в вертебрально-базилярном бассейне.
Одной из причин ишемических инсультов в молодом возрасте, наряду с тромбофилией, употреблением наркотиков, аномалией развития церебральных сосудов, в 25% случаев является диссекция артерий, кровоснабжающих головной мозг (1). Впервые данная патология была описана в середине ХХ века, а ее возникновение практически всегда считали следствием перенесенной травмы (6). Более детальное изучение диссекции экстра и интракраниальных артерий началось с середины 70-х годов ХХ века в связи с широким применением метода церебральной ангиографии (3).
Как правило, данная патология развивается вследствие продольного надрыва сосудистой стенки с образованием интрамуральной гематомы в зоне интима-медиа. По литературным данным, диссекция чаще наблюдается в экстракраниальных сосудах — 88% (каротидная — 58%, вертебральная –30%), и только в 12% она происходит в интракраниальном бассейне (5). Нередко при диссекции экстракраниальных артерий встречаются указания на травму, предшествовавшую развитию клинической картины инсульта. Травматическое расслоение стенки артерии возникает после тупой закрытой или проникающей травмы шеи, общего сотрясения (например, при падении) и чаще всего локализуется экстракраниально (4).
Иногда диссекция носит ятрогенный характер. Так, в некоторых клинических наблюдениях встречаются указания на отчетливую связь двусторонней диссекции позвоночных артерий с мануальной терапией на шейном отделе позвоночника (8). Спонтанной диссекции, как правило, предшествует резкое движение головой (ее повороты, наклоны, разгибание), во время которых может возникать компрессия или резкое растяжение сосудистой стенки расположенным рядом костносвязочным аппаратом (4).
Возникновению спонтанной диссекции иногда предшествует бессимптомная системная патология сосудистой стенки, обусловленная фибромускулярной дисплазией, наследственным поражением соединительной ткани (синдромы Элерса—Данлоса и Марфана), артериитом, ангиолипоматозом, костной патологией в шейном отделе позвоночника (синдром Клиппеля—Фейля) (2), (3). Доказана также связь спонтанной множественной диссекции с перенесенной незадолго острой инфекцией (9). Как правило, клинические проявления цервикальной диссекции складываются из повторяющихся транзиторных ишемических атак, инфарктов мозга, субарахноидальных кровоизлияний. Наиболее часто, (в 62-84%) при диссекции диагностируется инфаркт мозга (7), причиной развития которого является артериальная эмболия из области повреждения сосуда. Значительно реже имеет место гемодинамический вариант ишемического инсульта.
В 2015 году в сосудистом неврологическом отделении ГКБСМП им.Н.С.Карповича г.Красноярска наблюдались двое больных.
Клинический пример №1: больная Л., 21 год, поступила в отделение нейрореанимации с жалобами на слабость в правых конечностях, онемение в правой половине тела, головокружение, боль в области шеи слева. При детальном опросе выяснилось, что 19 дней назад, в период новогодних праздников, пациентка, катаясь с ледяной горки, получила «незначительную», по ее оценке, травму. Она описала падение, сопровождающееся запрокидыванием головы «назад». Ухудшение наступило без видимых причин, в связи с чем на догоспитальном этапе верификация диагноза была затруднена.
При неврологическом осмотре: сознание ясное, критична, инструкции выполняет. Отмечается резкая болезненность в области задней поверхности шеи слева. Выявляется сглаженность правой носогубной складки, центральный правосторонний гемипарез со снижением мышечной силы до 3 баллов, правосторонняя гемигипестезия по проводниковому типу, признаки динамической мозжечковой атаксии (интенция при пальце-носовой и коленно-пяточных пробах) с обеих сторон. Правосторонняя гомонимная гемианопсия.
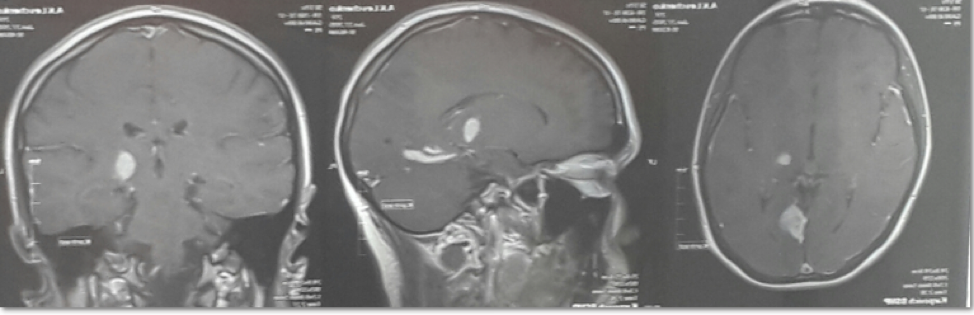
Рис.1. Больная Л. МРТ головного мозга.
На МРТ головного мозга : в медиобазальных отделах левой затылочной доли (в области язычковой извилины с распространением в гиппокамп) определяются мономорфные зоны цитотоксического отека неправильной формы, локализованные преимущественно в сером веществе мозга, размерами 2,3х7,6х2,3 см. Масс-эффект незначительный в виде сужения субарахноидальных борозд на уровне выявленных изменений. В области таламусов с двух сторон определяются очаги измененного МР сигнала. При внутривенном усилении определяется выраженное однородное накопление контраста (рис.1).
На МРА головного мозга определяется значительное сужение просвета и снижение кровотока (снижение интенсивности МР-сигнала) V4 сегмента правой позвоночной артерии на всем видимом протяжении. Вариант соединения позвоночных артерий – неслияние (правая позвоночная артерия не соединяется с аналогичным сегментом слева, продолжается в заднюю нижнюю мозжечковую артерию; слева – продолжается в основную артерию, равную по диаметру.
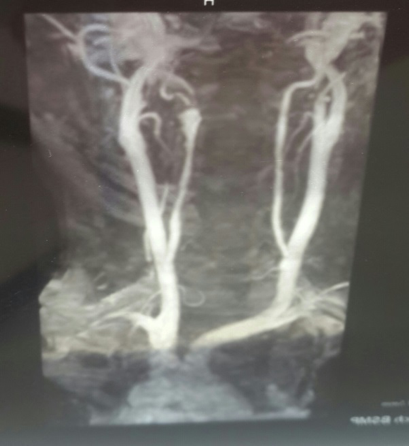
Рис.2.Больная Л. МРА артерий шеи.
На МРА артерий шеи: определяется выраженное расширение левой позвоночной артерии на уровне V2 верхнего края тела С3 позвонка до 0,7 см и последующее сужение менее 0,1-0,2 см на уровне тела С2 позвонка протяженностью 0,7 см. После сужения сохраняется расширение левой позвоночной артерии до V3 сегмента и на уровне сегмента (картина выраженного стеноза левой позвоночной артерии, выраженной престенотической дилатации в сегменте V2 левой позвоночной артерии (рис.2).
Данные нейровизуализации позволили установить диагноз: ишемический инсульт по типу артериальной тромбоэмболии в бассейне левой задней мозговой артерии с синдромом правостороннего центрального гемипареза, гемигипестезии, правосторонней гомонимной гемианопсии на фоне травматической диссекции левой позвоночной артерии с формированием критического стеноза этой артерии. Вариант развития сосудов Виллизиева круга (гипоплазия V3 сегмента и неслияние правой позвоночной артерии).
Немаловажное значение в развитии инсульта у данной больной играет выявленная на МРА аномалия развития сосудов Виллизиева круга. Так, «пострадавшая» артерия является практически единственным сосудом, из которого формируется весь вертебрально-базилярный бассейн. После консультации сосудистого хирурга было предложено проведение церебральной ангиографии с последующим решением вопроса об эндоваскулярном лечении стеноза левой позвоночной артерии.
Проведенное эндоваскулярное контрастное исследование, подтвердило стеноз V2 сегмента левой позвоночной артерии 70% с постаневризматическим расширением (диссекция) и постаневризматическим критическим стенозом V3 сегмента (рис.3). Ангиографическими признаками диссекции левой позвоночной артерии у данной больной являются: неравномерность просвета сосуда, стеноз по типу «крысиного хвоста».
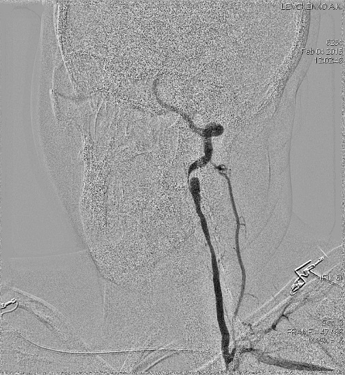
Рис.3.Больная Л. Ангиография левой позвоночной артерии (исходная).
Выполнено оперативное вмешательство: Эндопротезирование левой позвоночной артерии: РЭД (рентгенэндоваскулярная дилатация) в зоне стенозов баллонным катетером диаметром 2,0 мм, установлено 2 стента( BioMime 4,5х 16мм ), просвет артерии восстановлен. Рентгенконтраст: Визипак 320-160мл.
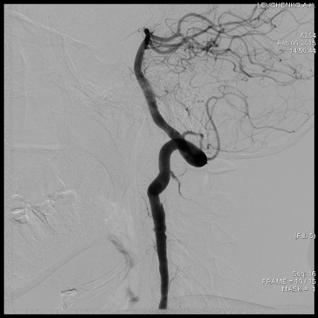
Рис.4.Больная Л. Ангиография левой позвоночной артерии (после операции).
На представленном снимке видно, что стеноза в сегментах V2 и V3 не выявляется, кровоток в левой позвоночной артерии восстановлен (рис.4).
После проведенного лечения: состояние больной удовлетворительное, мышечная сила восстановилась до 5 баллов в правой ноге и 4 баллов в правой руке, в которой также остается ощущение «онемения». Гомонимная гемианопсия регрессировала. С рекомендацией не прерывать прием дезагрегантов (плавикс, аспирин), а также продолжить нейропротективную, сосудистую терапию, пациентка была выписана под наблюдение невролога по месту жительства.
Клинический пример №2:
Больной Т., 31 год, поступил в стационар с жалобами на онемение и неловкость в левых конечностях, зрительные нарушения, головокружение. В неврологическом статусе при поступлении выявлялся: центральный парез VII,XII слева, центральный левосторонний гемипарез со снижением мышечной силы до 3б в руке и 4б в ноге, левосторонняя гомонимная гемианопсия, левосторонняя гемигипестезия.
На основании данных дообследования был выставлен диагноз: Повторный ишемический инсульт по типу артериальной тромбоэмболии в бассейне правой задней мозговой артерии с синдромом левостороннего центрального гемипареза, гемигипестезии, левосторонней гомонимной гемианопсии, на фоне диссекции правой позвоночной артерии с формированием аневризмы на уровне СI-CII.
Из анамнеза известно, что впервые был доставлен бригадой «скорой помощи» в неврологическое отделение ГКБСМП три месяца назад с жалобами на остро возникшую слабость в левых конечностях, нарушение зрения. После дообследования был установлен диагноз: ишемический инсульт в вертебрально-базилярном бассейне с синдромом левосторонней гомонимной гемианопсии, левостороннего центрального гемипареза. Выявленная на МСКТА мешотчатая аневризма на уровне С1-2 правой позвоночной артерии не была расценена как возможная причина ишемического инсульта.
Пациент выписан из стационара со значительным улучшением. Повторный инсульт в бассейне правой задней мозговой артерии развился через три месяца. Углубленный сбор анамнеза позволил установить, что в 2013 году больной перенес спинальную травму с компрессионным переломом L2-3 позвонков. Отмечался нижний парапарез, симптомы которого регрессировали на фоне лечения. В 2014 году — повторный эпизод падения с высоты, после чего появились боли в шейном отделе позвоночника.
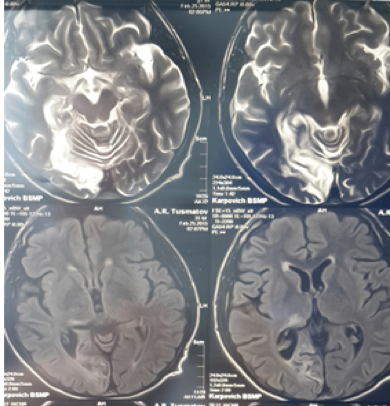
Рис.5. Больной Т.МРТ головного мозга.
На МРТ головного мозга: супратенториально, на медиальной поверхности правой затылочной доли обширная зона кистозно-ликворной трансформации размерами 56х20х18 мм. В таламусе справа — «застарелый» ишемический инсульт 14х8 мм с кистозно-ликворной трансформацией (рис.5).
На МРА головного мозга картина гипоплазии интракраниального сегмента позвоночной артерии справа.
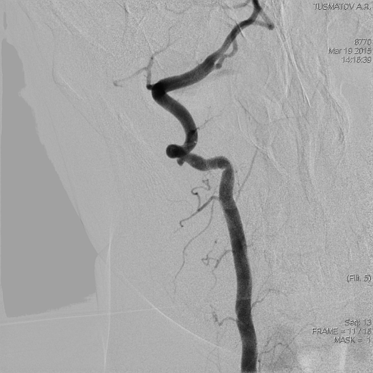
Рис.6. Больной Т. Ангиография правой позвоночной артерии (исходная).
На МСКТА и церебральной ангиографии: справа, на уровне СI-СII в позвоночной артерии определяется мешотчатая аневризма (рис.6) с широким основанием, размерами 3х1,5 мм в экстракраниальной части правой позвоночной артерии.
Проведено эндоваскулярное вмешательство на сосудах шеи, позволившее выявить стеноз позвоночной артерии в V3-V4, с аневризматическим мешком 2,4 на 1,9 мм; шейка аневризмы- 3,4мм. Выполнена РЭО аневризмы (спиралью CompassComplex 2,5х3,5см) со стент ассистенцией (LVIS 5х23мм). Просвет артерии восстановлен.Аневризматический мешок не контрастируется (рис.7). Рентгенконтраст: Визипак 320-160мл.
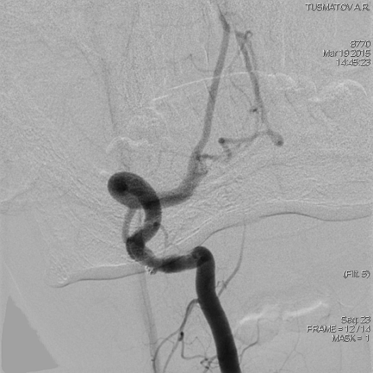
Рис.7. Больной Т. Ангиография правой позвоночной артерии (после операции).
Пациент выписан из стационара в удовлетворительном состоянии с рекомендациями принимать плавикс 75 мг в течение 2 месяцев, аспирин кардио 100 мг — пожизненно.
Таким образом, очевидно, что инсульт, развившийся в молодом возрасте, требует пристального внимания клиницистов. Для уточнения причины сосудистой катастрофы, помимо рутинных методов, необходимо проводить целенаправленное исследование брахиоцефальных артерий (МРА сосудов шеи, МСКТА сосудов шеи, а при необходимости — ангиографическое исследование по Сельдингеру).
Приведенные в данной статье клинические наблюдения показывают, что улучшение оснащенности сосудистого центра, привлечение технологий эндоваскулярной хирургии, способствует значительному повышению качества диагностики и лечения данного заболевания.
Атеросклероз и синдром позвоночной артерии

могут возникать в любом ее отделе и могут стать причиной ишемического инсульта. В отличие от сужений сонных артерий, роль которых в развитии инсульта известна уже давно и отработаны методы их лечения, патология позвоночных артерий изучена еще недостаточно. Однако современные технологии диагностических исследований и методов эндоваскулярного лечения открыли новые возможности для вмешательства при этом заболевании.
Синдром позвоночной артерии является состоянием, связанным с нарушением проходимости проявляющийся симптомами недостаточности мозгового кровообращения в области задней части головного мозга.
Причины нарушенной проходимости могут быть самыми различными, поэтому основной задачей в ведении пациентов является точная диагностика, так, как только выявление точной причины позволит ее устранить и убрать тягостные для пациентов симптомы. С каждым годом заболевание молодеет, что связано с увеличением количества молодых людей, подолгу сидящих за компьютерами и малоподвижным образом жизни.
Своевременная диагностика гарантирует благоприятный результат лечения синдрома позвоночной артерии в нашей клинике.
Причины синдрома позвоночной артерии
Наиболее распространенная причина нарушений кровообращения позвоночной артерии является атеросклеротическая бляшка. Реже встречается расслоение (диссекция) артерии, сдавление ее на шее или на входе в череп, воспалительные заболевания (васкулит). Точно установить вероятность развития инсульта при подобной локализации поражения достаточно сложно. По данным анатомических исследований поражение позвоночных артерий при смерти от ишемического инсульта отмечалось в 12% случаев.
Поражение внутримозговых отделов вертебробазилярной системы чаще приводят к ишемическим инсультам, чем сужение артерии на шее. Риск развития ишемических событий при таких поражениях составляет около 7% в год. Симптомы синдрома позвоночной артерии диагностируются все чаще. Множество факторов влияет на развитие синдрома. Обычно он представляет собой комбинацию цереброваскулярного артериосклероза и шейного спондилеза (дегенеративно-дистрофические изменения тканей межпозвоночных дисков) в качестве основных клинико-патологических компонентов.
 Аномалия Киммерли
Аномалия Киммерли
Патологическая костная дужка на 1 шейном позвонке. Позвоночная артерия проходит через узкое костное отверстие перед входом в череп. В ряде случаев её компрессия может вызывать синдром позвоночной артерии с мучительными жалобами. На фотографии показана эта аномалия, выявленная при обследовании.
К причинам вызывающим синдром также относятся:
Осложнения
В зависимости от причин появления симптомов заболевания могут наблюдаться различные осложнения. Чаще всего это мучительное состояние, вызывающее депрессию у пациентов, однако могут быть и объективные осложнения, угрожающие жизни.
Прогноз
При атеросклерозе позвоночной артерии прогноз для жизни и здоровья пациента давать достаточно сложно. При больших сужениях компенсация кровотока осуществляется за счет второй позвоночной артерии, кроме того, имеется коллатеральный кровоток. Больших исследований, оценивающих риск инсульта при поражении позвоночных артерий пока не проводилось. Однако остается фактом, что инсульты в вертебро-базилярной системе составляют не менее 25% всех инсультов и протекают значительнее тяжелее, чем инсульты связанные с сонной артерией. Поэтому выявление значимого сужения позвоночной артерии должно стать поводом для устранения этого рискованного состояния.
Без выявления и устранения причин развития синдрома позвоночной артерии прогноз выздоровления неблагоприятный. Чаще всего состояние пациентов постепенно ухудшается, что отрицательно сказывается на качестве жизни.
Самое сложное это выявить точную причину. Знание причины позволит устранить ее хирургическим или эндоваскулярным методом и избавить пациента от мучительных симптомов.
Преимущества лечения в клинике
Диагностика
Жалобы и симптомы
Часто сужение позвоночной артерии протекает без каких-либо жалоб и является случайной находкой при обследовании. Однако примерно у половины пациентов подобное поражение вызывает симтомы недостаточности кровообращения в задних отделах мозга.
Синдром позвоночной артерии представляет собой повторяющиеся эпизоды непостоянных симптомов нарушения мозгового кровообращения, главными из которых являются головокружение, нистагм (непроизвольные быстрые движения глаз), внезапный постуральный коллапс (обморок).
Также наблюдаются следующие симптомы:
Консультация невролога и УЗИ
Первый шаг для диагностики поражений позвоночных артерий. Невролог, проводя обследование, устанавливает факт вертебробазилярной недостаточности. Изучая функции равновесия, вегетативной нервной системы и анализируя жалобы пациента, специалист может составить правильный диагностический алгоритм для выявления патологии позвоночных артерий.

Компьютерная томография


 Аномалия Киммерли
Аномалия Киммерли