дистопия и гипоплазия правой почки
Дистопия почки
Дистопия почки – это врожденное нарушение топографии почки, при котором орган может быть расположен низко, смещен в полость таза, крестцово-подвздошную область, грудную клетку и т. д. Могут отмечаться боли в пояснице или животе, дизурические и пищеварительные расстройства, а также развиваться мочекаменная болезнь, пиелонефрит, гидронефроз. Патология диагностируется с помощью УЗИ почек, экскреторной урографии, ангиографии. Лечение дистопии почки требуется при развитии осложнений. При воспалительных процессах назначается антибактериальная терапия, при нефролитиазе осуществляется удаление камней.
МКБ-10
Общие сведения
Дистопию почки в клинической урологии относят к врожденным аномалиям. Патология составляет около 2,8% от общего количества пороков развития почек. Та или иная форма дистопии почки встречается у 1 из 800-1000 новорожденных. Дистопия правой почки встречается в популяции чаще, чем левой, и составляет 58,3% от общего количества случаев данной аномалии против 33,1% соответственно. Двусторонняя дистопия наблюдается в 8,4% случаев.
Причины
Дистопия почки является результатом задержки перемещения и ротации почки из тазовой области в поясничную в процессе эмбриогенеза. Изначально у плода почки закладываются в малом тазу и по мере развития перемещаются вверх, занимая свое нормальное анатомическое положение в поясничной области на уровне XI-XII грудного – I-III поясничных позвонков по обе стороны от позвоночного столба. Под воздействием неблагоприятных условий миграция и ротация почки может быть нарушена; в этом случае ребенок рождается с аномальной топографией почек или дистопией. В отличие от нефроптоза, при дистопии почка фиксирована и лишена мобильности.
Классификация
Аномальное расположение почек может быть двусторонним или односторонним. Если отсутствует смещение почки на противоположную сторону, то говорят о гомолатеральной дистопии. Реже встречается перекрестная (гетеролатеральная) аномалия, характеризующаяся миграцией одной или двух дистопированных почек на противоположную сторону. При перекрестной дистопии может наблюдаться слияние двух почек.
По месту расположения почки выделяют несколько видов дистопии:
В основе классификации лежит уровень отхождения почечных артерий от ствола аорты, который в норме должен соответствовать I поясничному позвонку.
При поясничной дистопии почки (66,8%) наблюдается отхождение почечных артерий на участке от II-III поясничных позвонков до бифуркации аорты. При этом почка располагается несколько ниже нормального анатомического уровня. Обычно такая почка обращена вперед лоханкой, пальпируется в области подреберья и может быть принята за нефроптоз или опухоль.
Подвздошная дистопия (11,9%) характеризуется отхождением аномального количества почечных артерий от общей подвздошной и расположением почки в подвздошной ямке. Пальпторно такая почка иногда ошибочно принимается за кисту яичника или объемное образование брюшной полости.
В случае тазовой дистопии (21,3%) почечные артерии ответвляются от внутренней подвздошной, в связи с чем почка оказывается расположенной между прямой кишкой и мочевым пузырем у мужчин или прямой кишкой и маткой у женщин. Мочеточник у такой дистопированной почки всегда укорочен. Смещенная в полость таза почка ошибочно может приниматься за гематометру, воспалительно измененный придаток при аднексите, внематочную беременность.
Субдиафрагмальная (торакальная, внутригрудная) дистопия почки отмечается при отхождении почечных артерий на уровне тела XII грудного позвонка. При этом почка располагается высоко, иногда в грудной полости. Сосуды и мочеточник у торакальной почки значительно длиннее обычных. Торакальная дистопия почки может быть принята за кисту средостения или легкого, опухолевое образование, абсцесс, осумкованный плеврит.
Симптомы дистопии почки
Клиническая картина определяется анатомической формой аномалии. Поясничная дистопия почки может быть бессимптомной или проявляться незначительными тупыми болями в пояснице. При подвздошной дистопии частыми жалобами служат боли в животе и подвздошной области, которые у женщин обостряются в период менструации. Болевые ощущения связаны с давлением, которое оказывает дистопированная почка на нервные сплетения и соседние органы. В связи с этим также возможно развитие уродинамических нарушений – затруднение оттока мочи. При сдавлении какого-либо отдела кишечника могут отмечаться метеоризм, запоры, тошнота, гастралгия, рвота.
Тазовая дистопия почки сопровождается болями в прямой кишке и в области придатков у женщин, альгодисменореей, диспареунией. Боль при тазовом расположении почки иногда может симулировать клинику острой хирургической патологии. При компрессии мочевого пузыря и прямой кишки отмечаются запоры, учащенное и болезненное мочеиспускание. Внутригрудная дистопия почки может провоцировать появление болей за грудиной, обычно связанных с приемом пищи. Торакальная дистопия почки часто сочетается с врожденной диафрагмальной грыжей.
Осложнения
Тазовая дистопия может вызывать токсикозы беременности и осложнять течение произвольных родов. Кроме того, растущая матка еще больше смещает дистопированную почку, вызывая характерную клиническую симптоматику. Перекрестная дистопия нередко сопровождается развитием хронической почечной недостаточности, а в случае сужения почечных сосудов – стойкой нефрогенной артериальной гипертензией уже в молодом возрасте.
Диагностика
При подвздошной и поясничной дистопии почка может пальпироваться через переднюю брюшную стенку. Тазовая дистопия может быть выявлена в ходе ректального (у мужчин) или бимануального гинекологического (у женщин) исследования. При пальцевом ректальном или влагалищном обследовании дистопированная почка пальпируется в виде плотного малоподвижного образования, расположенного рядом с прямой кишкой или задним сводом влагалища.
Торакальная дистопия диагностируется при проведении профилактической флюорографии или обзорной рентгенографии грудной клетки. Дистопированная почка чаще определяется как плотная округлая тень в заднем средостении над диафрагмой. Для правильной диагностики патологии и определения формы заболевания применяются визуализирующие урологические методы – УЗИ почек, ретроградная и экскреторная урография, радиоизотопная ренография (сцинтиграфия), почечная ангиография, МРТ, МСКТ почек.
УЗИ почек позволяет определить отсутствие почки на своем анатомическом месте и дифференцировать дистопию с нефроптозом. Экскреторная урография, как правило, точно выявляет аномальную локализацию почки, степень ее ротации и ограниченную подвижность. При резком снижении функции почек выполняется ретроградная пиелография. В ходе почечной ангиографии устанавливается уровень отхождения почечных артерий от ствола аорты. Дифференциальную диагностику аномалии проводят с нефроптозом, опухолями почки, кишечника, придатков.
Лечение дистопии почек
Лечение патологии по возможности консервативное, направленное на ликвидацию инфекционного процесса, профилактику образования конкрементов или их выведение. В случае развития пиелонефрита проводится курсовое лечение антибактериальными препаратами, сульфаниламидами, нитрофуранами, средствами, улучшающими почечный кровоток.
Дистопия почки, осложненная калькулезом или гидронефрозом, может потребовать хирургического удаления камней из почек (пиелолитотомии, нефролитотомии, нефролитотрипсии и др.). При гибели аномально расположенной почки показана нефрэктомия. Хирургическое перемещение почки представляет значительные трудности в связи с рассыпным типом кровоснабжения и малым калибром сосудов.
Прогноз и профилактика
Лечение дистопии почки
Дистопия почки — наследственная аномалия этого органа, характеризующаяся неправильностью ее расположения. По статистике, эта патология самая частая среди аномалий в нефрологии. Различают двустороннюю и одностороннюю дистопию, в 80% случаев встречается лишь одностороннее поражение
Классификация видов заболевания
В зависимости от нюансов аномального расположения почек выделяют несколько типов смещения:
Запишитесь на прием по телефону
+7 (495) 021-12-26 или заполнив форму online
Администратор свяжется с Вами для подтверждения записи.
Конфиденциальность Вашего обращения гарантирована.
Цены на лечение дистопии почки
Причины развития дистопии почки
Многочисленные исследования подтверждают, что описываемая болезнь относится исключительно к врожденным патологиям с генетическим предрасположением. Патогенез этой аномалии обусловлен отклонениями в эмбриогенезе — во время внутриутробного роста эмбриона нарушается ротация предшественников почечных структур и их перемещение, в ходе которого она должна занять предназначенное ей природой место. Доказано, что акушерские манипуляции. в том числе и кесарево сечение, не влияют на частоту дистопий.
На этапе эмбриогенеза зачатки почечной ткани закладываются в области будущего малого таза человека, затем происходит миграция этой ткани в поясничную область, где и занимает нормальное анатомическое положение. Некоторые негативные факторы мешают этому процессу, провоцируя формирование данного типа аномалий развития. Определено большое число предрасполагающих факторов:
Крымкин Юрий Михайлович
Заведующий урологическим отделением, врач-уролог, хирург-андролог
Кармолиев Рустам Рафикович
Корнеева Лариса Николаевна
Врач-уролог высшей категории, кандидат медицинских наук
Симптомы дистопии почки
Клиническая картина при этой патологии не имеет четко специфических особенностей — очень часто смещение выявляется случайно врачом на профосмотре ребенка. Из значимых клинических признаков, которые косвенно указывают на патологию, стоит отметить:
При редких формах дистопии возможно появление и других симптомов, обусловленных особенностями локализации. Так, при торакальной дистопии описаны следующие жалобы пациентов:
Из-за низкой специфичности симптомов клиника напоминает таковую при новообразованиях горла, легких. Не стоит заниматься самодиагностикой — необходимо как можно раньше обратиться за квалифицированной консультацией к врачам. В Москве это можно сделать в “Клинике ABC”.
При поясничной форме аномалии клиническая картина еще менее специфична — схожие симптомы отмечаются при большом числе болезней внутренних органов. Пациентов могут беспокоить:
При тазовой дистопии возможны следующие клинические проявления:
Подвздошный вариант заболевания может проявляться с преобладанием следующих явлений:
При любом варианте аномалии расположения почек точно установить диагноз только по клинической картине невозможно, поэтому следует при любых подозрительных симптомах обратиться к врачу урологу, который проведет более углубленное обследование.
Диагностика
Важнейшее место в диагностическом поиске при подозрении на дистопию занимает так называемая дифференциальная диагностика. Она позволяет отличить почечное смещение от других болезней, протекающих со схожей симптоматикой:
Лечение дистопии почки
Тактика лечения определяется степенью интенсивностью симптомов и наличием сопутствующих болезней. При отсутствии прямой угрозы жизни пациента, неосложненном течении болезни достаточно консервативного лечения, подразумевающего использование лекарств и неинвазивных методик. В соответствии с мировыми стандартами, в лечении врачи нашей клиники в Москве применяют:
Комплексы упражнений ЛФК модернизированы специально для данной патологии и выполняются под контролем специалистов (врачей и инструкторов ЛФК). Хирургическая операция показана лишь в очень ограниченном числе случаев. К показаниям относятся:
Последний вариант предусматривает проведение нефрэктомии. Следует знать, что операция по удалению дистопичной почки весьма сложна технически ввиду рассыпного типа кровоснабжения. Вне зависимости от способа лечения, пациентам назначается диетическое питание — стол №7 по Певзнеру. Согласно структуре этой диеты, из рациона исключаются:
Рацион пациента следует обогатить следующими продуктами:
Допускается употреблять небольшое количество меда и варенья и съедать не более 2 куриных яиц в день. Приготовленные блюда следует употреблять в теплом виде, рекомендуемый режим приготовления – отваривать, запекать или тушить, готовить на пару. Рекомендован дробный режим питания — порции пищи небольшого объема, но более частый прием.
Профилактические мероприятия
Людям с описываемой врожденной патологией следует находиться на диспансерном наблюдении у уролога, в Москве регулярное наблюдение могут обеспечить специалисты нашей клиники по удобному для Вас графику. Женщинам следует знать, что определенные формы дистопии почек являются противопоказанием к беременности.
Профилактика этой патологии невозможна в принципе, так как ее причина — врожденная аномалия развития.
Запишитесь на прием по телефону
+7 (495) 021-12-26 или заполнив форму online
Администратор свяжется с Вами для подтверждения записи.
Конфиденциальность Вашего обращения гарантирована.
Эмбриональные аспекты врожденных аномалий почек и мочевых путей (cakut-синдром)
Васильев А.О., Говоров А.В., Пушкарь Д.Ю.
Кафедра урологии ГБОУ ВПО Московский государственный медико-стоматологический университет имени А.И. Евдокимова Минздрава России, Россия, Москва
Адрес: 127206, Москва, ул. Вучетича д. 21, корп. 2, тел. 8(495)6113129 Эл.почта: alexgovorov@newmail.ru, alexvasilyev@me.com, pushkardm@mail.ru
Введение. Спектр врожденных аномалий почек и мочевых путей чрезвычайно широк и варьирует от легких и бессимптомных пороков, таких как удвоение мочеточника до тяжелых, подчас не совместимых с жизнью, таких как двусторонняя почечная агенезия или дисплазия. В результате тесной эмбриогенетической связи мочевой и половой систем человека аномалии развития органов мочевой системы (ОМС) в 33% случаев связаны с пороками развития половых органов, что в дальнейшем может приводить к развитию бесплодия. В общем числе поражений аномалии развития ОМС составляют в среднем 25% от общего числа всех генетических пороков, диагностируемых внутриутробно [1]. Врожденные пороки развития (ВПР) мочеполовой системы одна из самых многочисленных групп врожденных аномалий, включающих поражение почек, мочеточников, мочевого пузыря, уретры, а также мужских и женских гениталий.
CAKUT может быть как составнойчастью различных мультиорганных г енетических синдромов, так и самостоятельным поражением. В составе других генетических синдромов CAKUT описан приблизительно при 500 мультиорганных синдромах, как например, синдром почечного кистоза и сахарного диабета [7]. По данным Renkema K.Y. и соавт. до 10% изолированных форм CAKUT-синдрома могут быть сопряжены с наследственным фактором. В большинстве случаев семейных форм у ближайших родственников состояние протекает бессимптомно [8]. К синдрому CAKUT относят почечную дисплазию с/без гипоплазии, обструкцию мочевого тракта и пузырно-мочеточниковый рефлюкс (ПМР) (Таблица 1).
К основным причинам развития CAKUT-синдрома относят одновременную мутацию генов PAX2 и EMX2. Исследования показали отсутствие подобной мутации генов у здоровых эмбрионов мышей и у человека, причем у людей оба гена находятся на хромосоме 10 q и их мутация сопровождается полнойд еструкцией хромосомы [9]. Изучив роль PАХ2 в развитии ОМС, Chuary Ya. пришел к выводу, что отрицательное влияние на нефрогенез оказывает взаимоотношение исследуемого гена с такими транскрипционными факторами, как Gdnt, Ret, SHH, Wnt4, Fgt [10].
Таблица 1. Структура CAKUT-синдрома
| Почка | Мочевые пути |
| Агенезия почки | Агенезия – отсутствие треугольника мочевого пузыря |
| Дисплазия почки (в том числе кистозная и мультикистозная) | Стеноз прилоханочного отдела мочеточника |
| Гипоплазия почки | Мегауретер |
| Удвоение собирательной системы | Задний клапан уретры |
| Подковообразная почка | Пузырно-мочеточниковый рефлюкс |
Для полного понимания причин возникновения врожденных аномалий развития мы считаем целесообразным кратко изложить основные этапы эмбриогенеза ОМС [11].
Внутриутробное развитие человека продолжается в среднем 280 суток, в течение которых принято выделять три периода: начальный (1-я нед.), зародышевый (2-8-я нед.), плодный (с 9-й нед. развития до рождения). К концу зародышевого периода завершается закладка основных эмбриональных зачатков тканей и органов. В процессе эмбриогенеза человека последовательно закладываются три парных выделительных органа: передняя почка или предпочка (pronephros), первичная почка (mesonephros) и постоянная (окончательная) почка (metanephros).
Предпочка образуется из передних 8-10 сегментных ножек (нефротомов) мезодермы и состоит из эпителиальных трубочек, один конец которых слепо замкнут, а другой конец обращен в сторону сомитов, где канальцы, объединяясь, формируют мезонефральный (Вольфов) проток. У зародыша человека предпочка не функционирует в качестве мочеобразующего органа и вскоре после закладки подвергается обратному развитию. Мезонефральный проток сохраняется и растет в каудальном направлении.
Первичная почка формируется из большего числа нефротомов (до 25), расположенных в области туловища зародыша. С течением времени сегментные ножки отделяются от сомитов и спланхнотома и превращаются в слепые канальцы первичной почки. Канальцы растут по направлению к мезонефральному протоку и одним концом сливаются с ним. Навстречу к другому концу канальца первичной почки растут сосуды от аорты, которые распадаются на капиллярные клубочки. Каналец своим слепым концом обрастает капиллярный клубочек, образуя капсулу клубочка. Капиллярные клубочки и капсулы вместе формируют почечные тельца. Возникший при развитии предпочки мезонефральный проток открывается в заднюю кишку
Закладка окончательной почки происходит на 2-м мес. внутриутробного развития, но окончательное ее развитие завершается лишь после рождения ребенка. Эта почка образуется из двух источников мезонефрального протока и нефрогенной ткани. Последняя представляет собой не разделенные на сегментные ножки участки мезодермы в каудальной части зародыша. Мезонефральный проток растет по направлению к нефрогенному зачатку, и из него в дальнейшем формируются мочеточник, почечная лоханка с почечными чашками, а от последних возникают выросты, превращающиеся в собирательные протоки и трубочки. Эти трубочки играют роль индуктора при развитии канальцев в нефрогенном зачатке. Из последнего образуются скопления клеток, которые превращаются в замкнутые пузырьки. Разрастаясь в длину, пузырьки превращаются в слепые почечные канальцы, которые в процессе роста S-образно изгибаются. При взаимодействии стенки канальца, прилежащей к слепому выросту собирательной трубочки, происходит объединение их просветов. Противоположный слепой конец почечного канальца приобретает вид двуслойной чаши, в углубление которой врастает клубочек артериальных капилляров. Здесь формируется сосудистый клубочек почки, который вместе с капсулой образует почечное тельце. Образовавшись, окончательная почка начинает быстро расти и с 3-го мес. оказывается лежащей выше первичной почки, которая во второй половине беременности атрофируется.
Воздействие неблагоприятных факторов на организм беременной женщины в зародышевый период (с 4 по 8 нед.) может привести к агенезии почек и мочеточников, эктопии устья мочеточника, образованию дополнительного мочеточника со слепым концом или слабо развитой почкой.
Воздействие различных неблагоприятных факторов на 9-12 нед. развития может привести к формированию ретрокавального, ретроилиакального мочеточника, гетеролокальной дистопии почек и мочеточников, эктопии устья мочеточников, формированию сужений или клапанов различных отделов мочеточников, недостаточности складок слизистой устья мочеточников, врожденному недоразвитию или отсутствию мышечного слоя, высокому отхождению мочеточника от почечной лоханки.
В плодный период (с 13-й недели) возможно формирование извилистости мочеточника, его изгибов, укорочения, удлинения, дисбаланса сократительной функции, врожденной недостаточности иннервационного аппарата и дисплазии мочеточника [12].
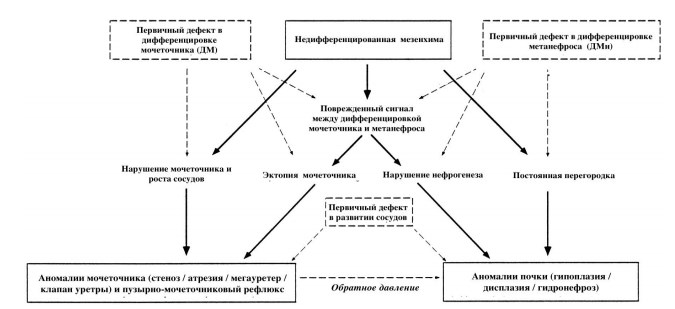
Онтогенетические механизмы, лежащие в основе этиологии аномалий развития и CAKUT-синдрома являются многофакторными. Многие из них были получены путем вскрытия человеческих эмбрионов, другие – в эксперименте на животных. Подробная их характеристика представлена на рисунке 1 [5].
Рис.1. Онтогенетические основы формирования CAKUT-синдрома. Пунктирной стрелкой указана перекрестная аномалия.
Материалы и методы. Были проанализированы источники в англоязычной литературе, поиск которых проводили по базам данных Cochrane Library’s, Medline (Pubmed, BioMedNet), Scopus и Biosis, используя ключевые слова «аномалии развития», «врожденные пороки развития», «CAKUT», «эмбриогенез органов мочевыой системы».
Обсуждение. Проявление врожденных пороков ОМС, в том числе CAKUT-синдрома, достаточно полно отражено в мировой литературе, однако данным аномалиям характерны особенности, которые до конца не изучены. Например, такие аномалии как стеноз лоханочно-мочеточникового сегмента (ЛМС), атрезия и мультикистозная дисплазия почки чаще всего являются односторонними; пренатальный гидронефроз новорожденных, связанный с ПМР и первичным мегауретером в подавляющем большинстве находят у мужчин [13, 14]. Некоторые из описанных аномалий часто развиваются одновременно [15]. Например, гипоплазия и дисплазия часто сопровождаются ПМР или стенозом ЛМС, атрезией ипсилатеральной или контралатеральной почки.
Самым распространенной врожденной аномалией ОМС является удвоение мочеточника, которое может быть полным и неполным. Неполное удвоение часто протекает вместе с раздвоением чашечно-лоханочной системы (ЧЛС). Большинство случаев протекает бессимптомно, однако риск инфицирования верхних мочевых путей возрастает в 20 раз [16]. Atwell J.D. и соавт. при обследовании 30 детей с неполным удвоением мочеточника пришли к выводу, что данная аномалия носит аутосомно-доминантный тип наследования, поскольку до 66% родственников первой степени родства имели такое же поражение [17].
Обструкция ЛМС является наиболее частой причиной антенатального гидронефроза и встречается с частотой 1 на 1000-1500 новорожденных [18]. Из всех известных причин развития данной аномалии большинством авторов высказывается предположение, что неполная мускуляризация мочеточника и чрезмерный апоптоз гладкомышечных клеток являются основными [19, 20].
В случае сращения нижних полюсов почек происходит образование подковообразной почки, расположенной в большинстве случаев ниже, чем обычно. В редких случаях наличие подковообразной почки связано с обструкцией ЛМС и инфицированием мочевых путей, гематурией и пальпируемой абдоминальной массой. Одним из наилучших вариантов лечения данной аномалии является трансперитонеальная лапароскопическая пиелопластика, позволяющая детально рассмотреть ЧЛС почки и наличие аномалий почечных сосудов [21].
Клапан задней уретры считается наиболее распространенной причиной обструкции нижних мочевых путей у новорожденных и эмбрионов мужского пола [22]. С данным пороком развития часто описывают синдром сливового живота, который по частоте встречаемости составляет 3,8 на 100 000 новорожденных мужского пола и характеризуется врождѐнным отсутствием, недостаточностью или гипоплазией мышц брюшной стенки в сочетании с мегацистисом, расширением мочеточников и простатического отдела уретры, а также двусторонним крипторхизмом. Одними из возможных методов лечения в данной ситуации является выполнение пузырно-амниотического шунтирования или выполнение везикоцентеза после рождения. Отличительной особенностью является характерный морщинистый вид передней брюшной стенки после операции, давший название этому синдрому [23, 24].
В большинстве случаев проявление обструктивной почечной дисплазии (в частности, мегацистис) может быть обнаружено при УЗИ плода, тогда как расширение мочеточника, чашечек или лоханки может быть заподозрено только при тщательном обследовании. Гистологическая картина может быть различной в зависимости от срока внутриутробной обструкции и включает сжатое мозговое вещество в результате избыточного гидростатического давления, создаваемого накопленной мочой в области малого таза [25]. К наиболее распространенным и изученным синдромам почечной дисплазии (группа цилиопатий) относят синдром Меккеля-Грубера, синдром Жубера, синдром короткого ребра, синдром Барде-Бидля, синдром асплении или полисплении и VACTER-L.
Синдром Меккеля-Грубера был впервые описан немецким биологом F. Meckel в 1822 году. Частота проявления у новорождѐнных составляет 1:9000. Синдром, как правило, приводит к летальному исходу в раннем детстве из-за тяжелой патологии почек и центральной нервной системы и характеризуется сочетанием поликистоза почек, аномалии развития центральной нервной системы (затылочное энцефалоцеле), фиброзных изменений печени и полидактилии [26] Синдром является генетически гетерогенным, аутосомно-рецессивным заболеванием. В настоящее время известно около 10 генов, мутации которых могут приводить к развитию синдрома, среди которых MKS1, TMEM216, TMEM67 и др.
Синдром Жубера редкая аутосомно-рецессивная патология, характеризующаяся полным отсутствием или недоразвитием червя мозжечка, умственной отсталостью, дистрофией сетчатки, глазной колобомой, нистагмом, полидактилией, кистозной почечной дисплазией и врожденным фиброзом печени. Синдром впервые описала M. Joubert в 1969 г. при обследовании четырех новорожденных в одной французско-канадской семье. Распространенность заболевания почек (кистозная почечная дисплазия и тубулоинтерстициальный нефрит) при синдроме Жубера и связанных с ними нарушений составляет в среднем 30% [27].
Синдром короткого ребра – генетическая патология, также относящаяся к группе цилиопатий и характеризующаяся наличием коротких рѐбер, укороченных конечностей, полидактилии и смертностью в раннем возрасте вследствие дыхательной недостаточности. Традиционно различают четыре подтипа этого синдрома: синдром Салдино — Нунана, синдром Маевского (Majewski syndrome), синдром Верма — Наумова (Verma-Naumoff syndrome) и синдром Бимер — Лангера (Beemer-Langer syndrome) [28]. Гистологическая картина почек схожа с таковой при синдромах Меккеля-Грубера и Жубера. Большинство генов, ассоциированных с синдромом короткого ребра, контролируют процесс интрафлагеллярного транспорта. Наиболее изучены мутации в гене NEK1 и TTC21B [29, 30].
Синдром Барде—Бидля является генетически гетерогенным заболеванием и встречается с частотой 1:120000 новорожденных. Характеризуется наличием как минимум четырѐх из шести первичных симптомов — ожирения, деградации сетчатки глаза, полидактилии, поликистоза почек, гипогонадизма и замедления умственного развития. К вторичными симптомам могут быть отнесены диабет, фиброз печени, атаксия, различные расстройства речи, асимметрия висцеральных органов, патология зубов, аносмия и потеря слуха. Известно 18 генов, мутации которых могут приводить к развитию синдрома [31].
В 1959 г. Ivemark B.L. и соавт. был описан вариант почечно-печеночноподжелудочной дисплазии в сочетании с аспленией [32]. В настоящее время в литературе отражено не более 10 сообщений, описывающих детей с данным аутосомно-рецессивным синдромом, характуризующимся мультикистозной дисплазией почки, печени и поджелудочной железы, недоразвитием легких, пороками сердца и в большинстве случаев приводящих к ранней младенческой смертности. На молекулярном уровне изучены два гена, мутация которых приводит к развитию данного состояния: NPNP3 и NEK8. Макроскопически отчетливо видна мультикистозная дисплазия почки [33].
Ассоциация VACTER-L — группа сочетанных аномалий развития, название которой составлено из первых букв пороков, входящих в состав синдрома [34]:
Выводы. Врожденные аномалии почек и мочевых путей группа состояний с различной степенью тяжести, многие из которых требуют междисциплинарного подхода для точной диагностики и улучшения последующего лечения. Учитывая, что многие из описанных врожденных аномалий являются наследственными, достижения в пренатальной диагностике, фетальной хирургии, а также целенаправленной терапии позволят улучшить прогноз и качество жизни новорожденных.
Литература
1. dos Santos Junior, A.C. Congenital anomalies of the kidney and urinary tract: an embryogenetic review / A.C. dos Santos Junior, D.M. de Miranda, Silva A.C. e Simões // Birth Defects Res C Embryo Today. – 2014, Vol. 102, №4 – P. 374-381.
2. Пытель, А.Я. Избранные главы урологии и нефрологии. Часть 1 / А.Я. Пытель, С.Д. Голигорский. Л.: Медицина, 1968. 312 с..
3. Yerkes, E. Role of angiotensin in the congenital anomalies of the kidney and urinary tract in the mouse and the human / E. Yerkes, H. Nishimura, Y. Miyazaki // Kidney Int. – 1998; Vol. 67, P. 75–77.
4. Toka, H.R. Congenital Anomalies of Kidney and Urinary Tract / H.R. Toka, O. Toka, A. Hariri, H.T. Nguyen // Samin Nephril. – 2010, Vol. 30, №4 – P. 374– 386.
5. Pope, J.C. IV. How they begin and how they end classic and new theories for the development and deterioration of congenital anomalies of the kidney and urinary tract, CAKUT / J.C. Pope IV, J.W. Brock III, M.C. Adams // JASN. – 1999, Vol. 10, №9 – P. 2018–2028.
6. Loane, M. EUROCAT statistical monitoring: identification and investigation of ten year trends of congenital anomalies in Europe / M. Loane, H. Dolk, A. Kelly // Birth defects Res A Clin Mol Teratol. – 2011, Vol. 91, №1 – P. 31-43.
7. Эрман, М.В. Нефрология детского возраста / М.В. Эрман. СанктПетербург: СпецЛит, 2010. 683 с.
8. Renkema, K.Y. EUCAKUT consortium/Novel perspectives for investigating congenital anomalies of the kidney and urinary tract (CAKUT) / K.Y. Renkema, P.J. Winyard, I.N. Skovorodkin // Nephrol. Dial. Transplant. – 2011, Vol. 26, №12 – P. 3843–3851.
9. Boualia, SK. Vesicoureter Reflux and Other Urinary Tract Malformation in Mice Compaund / S.K. Boualia, Y. Gartan, I. Murawski // PRoS One. – 2011, Vol. 6, №6 –P. 215–224.
10. Chuary, Ya. The role of PAX2 is regulation of kidney development and kidney diseases / Ya Chuary, // Ya Chion. – 2011, Vol. 33, №3 – P. 231– 238.
11. Афанасьев, Ю.И. Гистология, эмбриология, цитология. 6-е издание / Ю.И. Афанасьев, Н.А. Юрина. – М.: ГЭОТАР-Медиa, 2012. – 800 с.
12. Zwolińska, D. Genetics of congenital anomalies of the kidney and urinary tract / D. Zwolińska, D. Polak-Jonkisz, I. Makulska // Postepy Hig Med Dosw. – 2011, Vol. 15, №65 – P. 829-837.
13. Uehling, D.T. Urologic implications of the VATER association / D.T. Uehling, E. Gilbert, R. Chesney // J Urol. – 1983, Vol. 129, P. 352–354.
14. Solomon, B.D. VACTERL/VATER association / B.D. Solomon // Orphanet J Rare Dis. – 2011, Vol. 6, P. 6.
15. Atiyeh, B. Contralateral renal abnormalities in multicyctic-dysplastic kidney disease / B. Atiyeh, D. Husmann, M. Baum // J Pediatr. – 1992, Vol. 121, P. 6567.
16. Decter, R. Renal duplication and fusion anomalies / R. Decter // Pediatr Clin North Am. – 1997, Vol. 44, P. 1323–1341.
17. Atwell, J.D. Familial incidence of bifid and double ureters / J.D. Atwell, P.L. Cook, C. Howell // Arch Dis Child. – 1974, Vol. 49, P. 390–393.
18. Williams, B. Pathophysiology and treatment of ureteropelvic junction obstruction / B. Williams, B. Tareen, M.I. Resnick // Curr Urol Rep. – 2007, Vol. 8, P. 111–117.
19. Aoki, Y. Id2 haploinsufficiency in mice leads to congenital hydronephrosis resembling that in humans / Y. Aoki, S. Mori, K. Kitajima // Genes Cells. – 2004, Vol. 9, P. 1287–1296.
20. Kajbafzadeh, A.M. Smooth muscle cell apoptosis and defective neural development in congenital ureteropelvic junction obstruction / A.M. Kajbafzadeh, S. Payabvash, A.H. Salmasi // J Urol. – 2006, Vol. 176, P. 718–723.
21. Blanc, T. Laparoscopic pyeloplasty in children with horseshoe kidney / T. Blanc, E. Koulouris, N. Botto // J Urol. – 2014, Vol. 191, P. 1097–1103.
22. Quintero, R.A. In utero management of fetal lower urinary tract obstruction with a novel shunt: a landmark development in fetal therapy / R.A. Quintero, L.A. Gomez, L.A. Castro, C. Bermudez // J Matern Fetal Neonatal Med. – 2010, Vol. 23, P. 806–812.
23. Tonni, G. Prune-belly syndrome: case series and review of the literatura regarding early prenatal diagnosis, epidemiology, genetic factors, treatment, and prognosis / G. Tonni, V. Ida, V. Alessandro, M.P. Bonasoni // Fetal Pediatr Pathol. – 2013, Vol. 31, P. 13–24.
24. Granberg, C.F. Genetic basis of prune belly syndrome: Screening for HNF1β gene / C.F. Granberg, S.M. Harrison, D. Dajusta // J Urol. – 2012,Vol. 187, P. 272–278.
25. Yosypiv, I.V. Congenital anomalies of the kidney and urinary tract: a genetic disorder? / I.V. Yosypiv // Int J Nephrol. – 2012, Vol. 90, P. 83-90.
26. Opitz, J.M. Annals of morphology. Meckel on developmental pathology / J.M. Opitz, R. Schultka, L. Göbbel // Am J Med Genet. – 2006, Vol. 140A, P. 115– 128.
27. Joubert, M. Familial agenesis of the cerebellar vermis. A syndrome of episodic apnea, abnormal eye movements, ataxia, and retardation / M. Joubert, E. JeanJacques, J.P. Robb, F. Anderman // Neurology. – 1969, Vol. 19, P. 813–825.
29. Thiel, C. NEK1 mutations cause short-rib polydactyly syndrome type Majewski / Thiel, A. Giessl //Am J Hum Genet. – 2011, Vol. 88, P. 106–114.