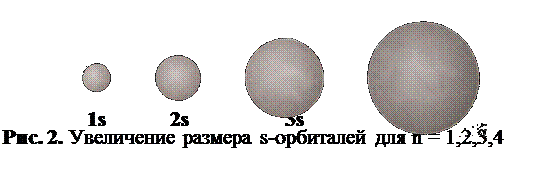гантелеобразная форма характерна для f орбиталей s орбиталей p орбиталей d орбиталей
Тест по теме
«СТРОЕНИЕ АТОМА»
ВАРИАНТ 1
1. Определите элемент со схемой распределения электронов в атоме 2, 8, 4:
а) Mg; б) Si; в) Cl; г) S.
2. Максимальное число электронов на третьем энергетическом уровне:

3. Орбитали, имеющие сферическую форму, называют:
4. Максимальное число электронов на р-орбиталях:
5. Укажите химический элемент, атомы которого имеют электронную формулу
а) Na; б) P; в) Al; г) Ar.
6. Сколько орбиталей в атоме водорода, на которых находятся электроны?
7. Атом какого химического элемента содержит три протона?
8. Атом какого химического элемента имеет заряд ядра +22?
9. Число нейтронов в атоме марганца равно:
а) 25; б) 29; в) 30; г) 55.
10. Количество неспаренных электронов в атоме серы равно:
ВАРИАНТ 2
1. Определите элемент со схемой распределения электронов в атоме 2, 8, 8:
а) Na; б) P; в) Al; г) Ar.
2. Максимальное число электронов на четвертом энергетическом уровне:
а) 14; б) 32; в) 26; г) 18.
3. Орбитали, имеющие гантелеобразную форму, называют:
4. Максимальное число электронов на s-орбиталях:
5. Укажите химический элемент, атомы которого имеют электронную формулу
а) Mg; б) P; в) Cl; г) Si.
6. Сколько орбиталей в атоме гелия, на которых находятся электроны?
7. Атом какого химического элемента содержит десять электронов?
8. Атом какого химического элемента имеет заряд ядра +35?
а) Ni; б) Pt; в) Br; г) Te.
9. Число нейтронов в атоме цинка равно:
а) 65; б) 22; в) 30; г) 35.
10. Количество неспаренных электронов в атоме хлора равно:
Гантелеобразная форма характерна для f орбиталей s орбиталей p орбиталей d орбиталей
в) Магнитное квантовое число (ml). Если атом поместить во внешнее магнитное поле, то происходит дальнейшее расщепление спектральных линий. Это означает, что при данных значениях n и l может существовать несколько состояний электрона с одинаковой энергией. Такие энергетические состояния называются вырожденными. Вырождение исчезает при воздействии на атом внешнего магнитного поля, что и приводит к появлению новых линий в спектре.
Энергетические изменения под действием магнитного поля объясняются различием в характере расположения электронных облаков в пространстве и, следовательно, их различной ориентацией по отношению к силовым линиям поля. Магнитное квантовое число ml для данного подуровня – это целочисленная величина в диапазоне от –l до +l. Таким образом, при данном l оно имеет (2l+1) различных значений. Например, для s-подуровня (l=0) имеется только одно значение ml, равное нулю. Поэтому s-подуровень содержит единственную орбиталь. Для p-подуровня (l=1) возможны три значения: ml∈<–1,0,1>. В соответствии с этим каждый p-подуровень состоит из трех орбиталей гантелеобразной формы, ориентированных перпендикулярно друг другу вдоль трех координатных осей и обозначаемых px, py, pz. Легко определить, что на d-подуровне (l=2) содержится 2l+1=5 орбиталей, а на f-подуровне (l=3) – 7 орбиталей.
На рисунке 3.3 показано постепенное усложнение представлений о структуре электронной оболочки атома (от уровней к подуровням и далее к орбиталям).
Рисунок 3.3 – Эволюция представлений о строении электронной оболочки атома. Энергетическая диаграмма уровней с 1-го по 3-й
г) Спиновое квантовое число (ms) не связано с движением электрона вокруг ядра, а определяет его собственное состояние. Природа этого состояния неизвестна до сих пор. Предполагается, что она связана с вращением электрона вокруг собственной оси[24]. Число ms принимает два значения: +1/2 и –1/2.
Для определения состояния электрона в многоэлектронном атоме важное значение имеет принцип Паули, согласно которому в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковыми. Следовательно, каждая орбиталь, характеризующаяся определенными значениями n, l и ml, может быть занята не более чем двумя электронами, спины которых имеют противоположные знаки. Такие электроны называются спаренными.
Пользуясь принципом Паули, можно подсчитать, какое максимальное число электронов может находиться на каждом подуровне, т.е. определить емкость подуровней:
Здесь электроны на орбиталях изображены стрелками, направленными вверх или вниз в зависимости от знака спинового квантового числа.
3.1.3 Электронная структура атомов и периодическая система элементов
При l=0, т.е. на s-подуровне *, имеется всего одна орбиталь *, которую принято изображать в виде клетки. В атоме Н единственный электрон находится на самом низком из возможных энергетических состояний, т.е. на s-подуровне первого электронного слоя (на 1s-подуровне). Электронную структуру атома Н можно представить схемой:
В атоме гелия, порядковый номер которого в периодической системе * (или заряд ядра Z) равен 2, второй электрон тоже находится в состоянии 1s. Электронная структура атома гелия:
У этого атома завершается заполнение ближайшего к ядру K-слоя и тем самым завершается построение первого периода системы элементов.
Рассмотренные для атомов H и He способы описания электронных оболочек называются электронно-графическими формулами (орбитали изображаются в виде клеток) и электронными формулами (подуровни обозначаются буквами, а количество электронов на них указано верхним индексом).
Далее формирование электронных оболочек у элементов 2-го периода происходит следующим образом:
Для атома углерода уже можно предположить три возможных схемы заполнения электронных оболочек в соответствии с электронно-графическими формулами:
Анализ атомного спектра показывает, что правильна последняя схема. Такой порядок размещения электронов в атоме углерода представляет собой частный случай общей закономерности, выражаемой правилом Хунда: устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально. Пользуясь правилом Хунда, нетрудно составить схему электронного строения для атома азота (Z=7):
O 1s 2 2s 2 2p 4 F 1s 2 2s 2 2p 5 Ne 1s 2 2s 2 2p 6
У атома неона заканчивается заполнение второго энергетического уровня, и завершается построение второго периода системы элементов.
Третий период, подобно второму, начинается с двух элементов (Na, Mg), у которых электроны размещаются на s-подуровне внешнего электронного слоя. Такие элементы называются s-элементами[27] (т.е. они относятся к s-семейству элементов). Затем следуют шесть элементов (от Al до Ar), у которых происходит формирование p-подуровня внешнего электронного слоя. Это атомы p-элементов (принадлежат к p-семейству). Структура внешнего электронного слоя соответствующих элементов второго и третьего периодов оказывается аналогичной. Иначе говоря, с увеличением заряда ядра электронная структура внешних слоев атомов периодически повторяется. Однако электронное строение атомов определяет свойства элементов и их соединений. В этом состоит сущность периодического закона: свойства элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядра.
Состояние электронов в атоме
Состояние электронов в атоме описывается с помощью четырёх квантовых чисел: главного, орбитального, магнитного и спинового.
Главное квантовое число обозначается буквой n. Оно характеризует общий запас энергии электрона и выражается целыми числами натурального ряда: 1,2,3,4 и т.д. Электроны вокруг ядра образуют слои. Они называются квантовыми слоями или энергетическими уровнями и имеют буквенные обозначения: K,L,M,N и т.д. Номер слоя, в котором находится электрон, равен его главному квантовому числу. Если для какого-то электрона главное квантовое число равно 1, то он находится в первом (самом близком к ядру) энергетическом слое (K) и обладает минимальным запасом энергии. Если n = 2, электрон находится во втором квантовом слое (L) и т.д. Энергетический уровень объединяет все электроны с одинаковым значением главного квантового числа.
Количество квантовых слоёв в атоме определённого элемента зависит от его положения в периодической системе Д.И.Менделеева. Оно равно номеру периода, в котором находится данный элемент. Химические свойства атома зависят от строения его внешнего (самого удалённого от ядра) квантового слоя, номер которого также совпадает с номером периода. Для конкретного энергетического уровня существуют подуровни, определяемые орбитальным квантовым числом. Орбитальное квантовое число обозначается буквой l. Оно имеет столько значений, какова величина числа «n». Если n =1, то l имеет только одно значение; если n = 2, оно имеет два значения и т.д. Орбитальное квантовое число зависит от главного и принимает значения от 0 до (n–1). Каждому значению l соответствует свой подуровень в данном квантовом слое:n = 1 l = 0; один подуровень;n = 2 l = 0, 1; два подуровня;n = 3 l = 0, 1, 2; три подуровня;n = 4 l = 0, 1, 2, 3; четыре подуровня.Формально (математически) орбитальное квантовое число показывает количество узловых поверхностей, которые проходят через центральную точку атома — ядро. Под узловой поверхностью понимают плоскость, в которой электронная плотность равна нулю. Геометрически орбитальное квантовое число определяет форму электронной орбитали.Если l = 0, через ядро не проходит ни одной узловой поверхности. В этом случае электронная орбиталь обладает сферической симметрией. Она называется s-орбиталью и имеет форму шара (рис. 1).

Значение l = 1 показывает, что орбиталь имеет одну узловую поверхность, т.е. через ядро проходит одна плоскость, в которой электрон находиться не может. Тогда орбиталь принимает форму объёмной восьмёрки (или гантелеобразную форму) и называется p-орбиталью (рис. 3).
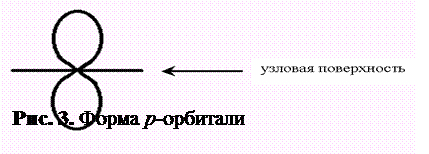 |
Если p-орбиталь принадлежит второму квантовому слою (n = 2), она обозначается 2p; если она находится в третьем квантовом слое, — 3p и т.д.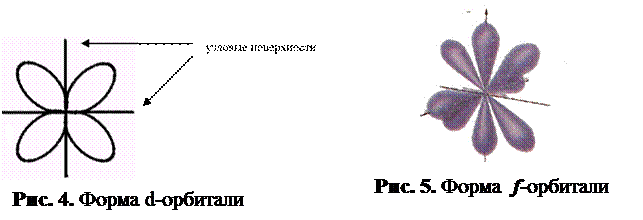
Магнитное квантовое число обозначается ml или просто mи принимает все значения от –l до +l. Оно характеризует положение орбитали в пространстве и показывает количество одноимённых орбиталей в данном квантовом слое.
Строение электронных оболочек атомов элементов первых четырёх периодов: s-, p-, d-элементы
Содержание:
Тема строения атома – это место встречи химии и квантовой физики. В атоме всё подчиняется строгим законам, но в то же время атом не совсем понятен для человеческого ума. Например, количество электронов строго равно количеству протонов, но невозможно точно сказать, в каком месте атома находится электрон. Шрёдингер рассматривал электрон как облако с отрицательным зарядом. Большинство своего времени электрон в отдельном участке атома – орбитали.
Все электроны в атоме расположены на своём расстоянии от ядра – в электронной оболочке. Электрон не может приблизиться к ядру, но и отдалиться тоже не может. Дело в том, что у электрона есть свой запас энергии. Чем её меньше, тем ближе от ядра располагается электрон. Электроны с одинаковым уровнем энергии группируются в один слой – энергетический уровень.
Главное квантовое число и энергетический уровень
Квантовые числа — это своеобразный код записи положения электрона в атоме. Если сравнить атом с домом, то квантовые числа – это адрес электрона: этаж, квартира, комната.
Электроны в атоме сосредоточены на энергетических уровнях – «этажах». Их нумеруют числами 1, 2, 3, … или буквами K, L, M, N, O, P, Q. Главное квантовое число n – это и есть номер энергетического уровня.
С удалением от ядра число электронов возрастает. Чем выше энергетический уровень, тем больше электронов на нём находится. Их максимальное число для каждого уровня определяется по формуле:
На внешнем энергетическом уровне не может находиться больше 8 электронов.
В энергетических уровнях также выделяют подуровни. Их количество также соответствует главному квантовому числу. Это напоминает расположение квартир в доме: на первом этаже располагается одна квартира, на втором – две, на третьем – три и т.д.
| Номер уровня (n) и его буквенное обозначение | Количество подуровней | Максимальное количество электронов на уровне |
| 1 К | 1 (s) | 2 |
| 2 L | 2 (s, p) | 8 |
| 3 M | 3 (s, p, d) | 18 |
| 4 N | 4 (s, p, d, f) | 32 |
Орбитальное (побочное), магнитное квантовые числа и форма орбитали
Конкретное место в атоме, «комната», в которой почти постоянно находится электрон, называется орбиталью. Орбитали напоминают облака разной формы из электронов. Подуровни и форму орбиталей обозначают латинскими буквами: s, p, d, f.
Эту схему предложил Бор, она помогает разобраться в строении атома, но не отражает реальной картины. Наши представления об атоме расходятся с реальностью. И выглядит это примерно так:
На первом энергетическом уровне есть только сферическая s-орбиталь. На втором энергетическом уровне появляются три p-орбитали. Их форма напоминает гантель или восьмёрку. На третьем энергетическом уровне уже есть пять d-орбиталей, которые как бы состоят из нескольких лепестков. На четвёртом уровне возникают семь f-орбиталей.
Форму орбиталей обозначают орбитальным (побочным) квантовым числом l (эль). Оно на единицу меньше главного квантового числа, то есть l = n – 1. Тогда получается, что орбитальное число единственной s-орбитали первого энергетического уровня равно нулю. Орбиталь p имеет число 1, орбиталь d – 2, f – 3.
Но как же располагаются орбитали внутри одного подуровня? Дело в том, что движущийся электрон создаёт магнитное поле, в котором по осям x, y, z ориентируются орбитали.
Сферическая s-орбиталь не имеет ориентации в пространстве. Три p-орбитали располагаются в трёх различных проекциях, d – в пяти, f – в семи проекциях. Другими словами, сколько орбиталей одного типа, столько и проекций.
Магнитное квантовое число ml показывает, какие проекции есть у орбитали. Количество таких вариантов определяется по формуле 2l+1.
Для s-орбитали l = 0 и ml = 0, так и получается, что сфера принимает только одно положение в пространстве.
Спин электрона
Еще два квантовых числа – спиновое и проекция спина – характеризуют уникальное квантовое свойство электрона. Спин не имеет аналогов в классической механике. Можно представить, что электрон вращается вокруг своей оси в одну или другую сторону.
Квантовые числа
В атомах первого периода таблицы Менделеева есть один энергетический уровень. В нём один или два электрона движутся по s-единственной орбитали.
В атомах второго периода появляется второй уровень. Он состоит из s-и p-подуровней. Второй s-подуровень – это тоже s-орбиталь, на p-подуровне есть три орбитали, которые по-разному расположены в пространстве. Каждая p-орбиталь вмещает 1 или 2 электрона, поэтому максимально на p-подуровне их может быть 6.
В атомах третьего периода появляется d-подуровень с пятью d-орбиталями, в атомах четвёртого периода – f-подуровень с семью f-орбиталями.
Как заполняются орбитали?
Электроны заполняют орбитали в соответствии с 3 принципами (правилами).
Гантелеобразная форма характерна для f орбиталей s орбиталей p орбиталей d орбиталей
2. ХИМИЧЕСКАЯ СВЯЗЬ. ВЗАИМНОЕ ВЛИЯНИЕ АТОМОВ В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
Остановимся на одном из важнейших вопросов химии, как осуществляется связь атомов в молекулах? Используя знания, полученные в курсе неорганической химии, рассмотрим вопросы природы химической связи между атомами или типы химических связей.
Современная теория химической связи базируется на квантово-механических представлениях о строении молекулы. Впервые электронную теорию химической связи, предложили в 1916 г. немецкий ученый В. Коссель и американский ученый Дж. Н. Льюис. Авторы электронной теории выдвинули идею о том, что химическая связь – результат взаимодействия внешних электронных оболочек атомов. Образуя химическую связь, каждый атом стремится заполнить внешнюю электронную оболочку до конфигурации, присущей инертным газам. При этом он принимает участие в образовании обшей электронной пары, отдает или принимает электроны. Принцип заполнения валентных оболочек до конфигурации инертных газов получил название октетное правило.
ТИПЫ ХИМИЧЕСКИХ СВЯЗЕЙ
Согласно принятой в настоящее время классификации существует несколько типов химической связи: ионная, ковалентная, водородная, металлическая и др. По способу образования химической связи различают две основные: ионную и ковалентную.
Ионная связь – характерна для атомов значительно отличающихся по электроотрицательности. Ионный тип связи характерен для неорганических соединений.
Рассмотрим, как осуществляется связь в хлориде натрия:
Хлор по сравнению с натрием обладает большей электроотрицательностью, то есть большим сродством к электрону. Вследствие этого электрон переходит с внешней оболочки натрия на внешнюю оболочку хлора, при этом образуются положительный и отрицательный заряды, между которыми действуют силы электростатического притяжения. Ион натрия приобретает электронную конфигурацию неона, а ион хлора – конфигурацию аргона.
Соединения с ионной связью характеризуются относительно большим дипольным моментом, хорошей электропроводимостью, высокими температурами плавления.
Ковалентная связь – основной тип связи в органических соединениях, характеризующийся увеличением электронной плотности между химически связанными атомами в молекуле по сравнению с распределением электронной плотности в свободных атомах.
Ковалентная связь возникает между атомами, имеющими одинаковую или близкую по значению электроотрицательность. Для образования ковалентной связи каждый из атомов предоставляет по одному электрону, при этом образуется общая пара электронов, которая в равной степени принадлежит обоим атомам. На письме ковалентная связь изображается черточкой между атомами.
Классическим примером ковалентной связи является молекула метана:
Атом углерода содержит на внешнем электронном уровне четыре валентных электрона и, чтобы доукомплектовать этот слой до октетной конфигурации, он образует четыре общие электронные пары с четырьмя атомами водорода.
В зависимости от электроотрицательности атомов между которыми образовалась ковалентная связь, она может быть полярной или неполярной.
Если электроотрицательность атомов одинакова, то общая электронная пара находится на одинаковом расстоянии от ядра каждого из атомов. Такая связь называется ковалентной неполярной:
При возникновении ковалентной связи между атомами с различной электроотрицательностью общая электронная пара смещается к более электроотрицательному атому. В этом случае образуется ковалентная полярная связь.
Стрелка в формуле указывает на полярность ковалентной связи. С помощью греческой буквы δ («дельта») обозначают частичные заряды на атомах: δ + – пониженную, δ – – повышенную электронную плотность.
По числу электронных пар, образующих ковалентную связь, различают связи простые – с одной парой электронов и кратные – с двумя или тремя парами.
Основные характеристики ковалентной связи: длина связи (расстояние между центрами атомов в молекуле); энергия связи (энергия, которую необходимо затратить на разрыв связи); полярность связи (неравномерное распределение электронной плотности между атомами, обусловленное различной электроотрицательностью); поляризуемость (легкость, с которой смещается электронная плотность связи к одному из атомов под влиянием внешних факторов); направленность (ковалентная связь, направленная до линии, соединяющей центры атомов).
Атомы некоторых элементов (кислорода, азота, серы, галогенов и др.) расходуют не все внешние электроны для формирования октетной оболочки. Такие электроны называют неподеленные, необобществленные или n-электроны.
Донорно-акцепторная связь или координационная – разновидность ковалентной связи, которая отличается способом образования.
Донор – атом, который должен иметь пару неподеленных электронов, а акцептором может быть любой атом (в том числе и протон), у которого не хватает до образования октета двух электронов.
Например, образование иона аммония протекает по донорно-акцепторному механизму. Ковалентная связь образуется за счет того, что атом азота (донор электронов) отдает неподеленную пару электронов на образование ковалентной связи протону (акцептору электронов):
Вновь образовавшаяся связь Н–N ничем не отличается от остальных связей Н–N, которые имелись у аммиака. Такая связь называется еще координационной.
Семиполярная связь – частный случай донорно-акцепторной связи. Она образуется между атомами, один из которых имеет неподеленную пару электронов, а другой содержит на внешнем энергетическом уровне шесть электронов (секстет), то есть имеет вакантную атомную орбиталь.
Рассмотрим образование семиполярной связи в молекуле оксида триметиламина:
В результате образования связи атом кислорода (акцептор) приобретает отрицательный заряд, а атом азота (донор) – положительный. Такой вид связи обозначают следующим образом:
Соединения с семиполярной связью не проводят электрический ток, несмотря на наличие наряду с ковалентной связью и ионного взаимодействия.
Водородная связь образуется в результате электростатического взаимодействия между атомом водорода, несущим дробный положительный заряд, и неподеленной парой электронов другого атома. Обычно такие атомы водорода называют активными.
Водородную связь графически изображают тремя точками:
Водородная связь бывает внутримолекулярная и межмолекулярная.
Примером соединений с внутримолекулярной водородной связью могут быть салициловый альдегид и о-хлорфенол.
Межмолекулярные водородные связи (МВС) возникают между двумя или большим числом молекул с образованием димеров или ассоциатов:
Прежде чем говорить о строении молекулы и о свойствах различных классов соединений, остановимся на строении атома с точки зрения квантово-механических представлений.
Как уже отмечалось, современная теория химической связи основана на квантово-механическом рассмотрении молекулы как системы из электронов и атомных ядер.
Из курса неорганической химии и физики известно, что электроны представляют собой вид материи, обладающий одновременно свойствами частицы и электромагнитной волны.
Согласно квантовой теории состояние электронов в атоме описывается с помощью четырех квантовых чисел: п – главное квантовое число, l – азимутальное квантовое число, т – магнитное квантовое число и s – спиновое квантовое число.
Электрон в атоме находится на определенной атомной орбитали. Атомная орбиталь – это область пространства внутри которой наиболее вероятно нахождение электрона.
Состояние электрона определяется расстоянием электронного облака от ядра, его формой, ориентацией в пространстве и вращением электрона вокруг собственной оси.
Для атомных орбиталей s-типа характерна сферическая симметрия, для электронов р-типа существуют три одинаковых по энергии гантелеобразной формы орбитали, которые отличаются друг от друга лишь ориентацией в пространстве: рx, рy рz-атомные орбитали. В каждой из них существует узловая область р-орбитали. где вероятность нахождения электрона равна нулю. Для f-атомных орбиталей существуют пять более сложных геометрических форм.
Атомная орбиталь. не занятая электронами, называется вакантной и условно обозначается как □.
ГИБРИДИЗАЦИЯ АТОМНЫХ ОРБИТАЛЕЙ
Согласно квантово-механическим представлениям о химической связи число образуемых атомом ковалентных связей определяется количеством одноэлектронных атомных орбиталей, то есть количеством неспаренных электронов. Однако в действительности атомы элементов образуют большее число ковалентных связей, чем содержат неспаренных электронов на внешнем энергетическом уровне. Например, атом углерода в основном состоянии имеет два неспаренных электрона (1s2 2s2 2р2), а образует четыре ковалентных связи. Это можно объяснить возможностью перехода 2s-электрона на 2p-подуровень (1s2 2s1 2р1).
Таким образом, на внешнем энергетическом уровне атома углерода находятся четыре неспаренных электрона: один s и три р. Поскольку химические связи образуются валентными электронами, то связи, например, в молекуле метана СН4 должны были бы быть неравноценными: одна связь С–Н образована s-электроном, а три остальные – р. В действительности в молекуле метана все связи совершенно равноценны. Для объяснения этого факта в квантовой механике вводится понятие о гибридизации атомных орбиталей (АО). Слово гибридизация означает взаимодействие, перекрывание, перемешивание. При взаимодействии одного s-электронного облака с тремя р-электронны-ми облаками образуются четыре качественно новых гибридизированных электронных облака или атомные орбитали: 1s + 3р = 4sp3
Таким образом, из нескольких различных по форме и близких по энергии АО путем комбинирования (смешивания, сочетания) образуется такое же количество одинаковых по форме и равных по энергии гибридизованных атомных орбиталей.
Гибридизованные орбитали по сравнению с негибридизованными более выгодны геометрически, т. к. позволяют увеличить площадь перекрывания с орбиталями других атомов, что ведет к образованию более прочных связей. Результатом перекрывания большей доли гибридной орбитали с орбиталями других атомов является ковалентная связь.
Атом углерода характеризуется тремя видами гибридизации с участием s- и p-орбиталей, каждому из которых соответствует определенное валентное состояние атома.
Состояние sр3-гибридизаиии – результат взаимодействия одной s- и трех р-атомных орбиталей.
Четыре равноценные орбитали между собой образуют угол 109°28′ и ориентированы в пространстве от центра правильного тетраэдра к его вершинам. Такое размещение связано со стремлением АО к максимальному удалению друг от друга за счет взаимного электростатического отталкивания. Расположение атомных орбиталей определяет название состояния sp3 гибридизации как тетраэдрическое.
Состояние sp2-гибридизации – результат взаимодействия одной s- и двух р-орбиталей (рх, pv).\
Образованные три эквивалентные sр2-гибридные орбитали находятся в одной плоскости под углом 120°, поэтому sр2-гибридизация называется тригональной Негибридизованная р-орбиталь расположена в плоскости, которая перпендикулярна плоскости расположения гибридных орбиталей. Условно доля s-облака в каждой из трех sp2-гибридных орбиталей равна 1/3. Такая гибридизация характерна для соединений с двойными связями, например, для этилена.
Третье валентное состояние (sp-гибридизация)
Состояние sp-гибридизации – результат взаимодействия одной s- и одной р-орбитали (рх).
Для описания химической связи с позиций квантовой механики пользуются двумя основными методами: валентных связей (ВС) и молекулярных орбиталей (МО).
Метод валентных связей был предложен в 1927 году В. Гайтлером и Ф. Лондоном. Основные положения метода заключаются в следующем. Химическая связь представлена в виде пары электронов с противоположными спинами. Она образуется в результате перекрывания атомных орбиталей.
При образовании молекулы атомные орбитали остаются без изменений, а пара связывающих электронов локализована между двумя атомами.
В отличие от метода валентных связей метод молекулярных орбиталей рассматривает молекулу не как совокупность атомов, сохраняющих свою индивидуальность, а как единое целое. Предполагается, что каждый электрон в молекуле движется в суммарном поле, создаваемом остальными электронами и всеми ядрами атомов. Иначе говоря, в молекуле различные АО взаимодействуют между собой с образованием нового типа орбиталей, называемых молекулярными орбиталями (МО).
Перекрывание двух атомных орбиталей приводит к образованию двух молекулярных орбиталей.
Одна из них имеет более низкую энергию, чем исходные АО, и называется связывающей орбиталью, другая обладает более высокой энергией, чем образующая ее АО, и называется разрыхляющей или антисвязывающей орбиталью. Заполнение молекулярных орбиталей электронами происходит аналогично заполнению атомных, то есть по принципу Паули и в соответствии с правилом Гунда. Молекулярная разрыхляющая орбиталь в основном состоянии остается вакантной. Ее заполнение электронами происходит при возбуждении молекулы, что ведет к разрыхлению связи и распаду молекулы на атомы.
ВЗАИМНОЕ ВЛИЯНИЕ АТОМОВ В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
Согласно современным представлениям, природа и механизм взаимного влияния атомов определяется характером распределения электронной плотности в молекуле и поляризуемостью ковалентных связей.
Поляризация одной связи углерод-галоген вызывает поляризацию молекулы в целом и следовательно появление дипольного момента.
По направлению электронного влияния заместителей различают положительный +I и отрицательный –I индуктивный эффект.
Отрицательный индуктивный эффект, как правило, увеличивается с ростом электроотрицательности атомов. Он сильнее выражен для заместителя с тройной связью, т. к. в его составе находится более электроотрицательный sp-гибридизованный атом углерода. В свою очередь атом углерода в sp3-гибридизации, как менее электроотрицательный, в составе заместителя проявляет +I по отношению к атомам углерода в sp и sp2-гибридизации:
Суммируя вышеизложенное, кратко остановимся на основных свойствах индуктивного эффекта:
Сопряженной называется система, в которой имеет место чередование простых и кратных связей, либо соседство атома, имеющего вакантную р-орбиталь или неподеленную пару р-электронов. Сопряженные системы бывают с открытой и замкнутой цепью:
Сопряжение – энергетически выгодный процесс, происходящий с выделением энергии. Сопряженные системы характеризуются повышенной термодинамической устойчивостью.
Дав определение сопряжению и сопряженным системам, рассмотрим электронные эффекты, которые наблюдаются при введении в такие системы различного рода заместителей.
Мезомерный эффект обозначают буквой М, а смещение электронной плотности в сопряженной системе – изогнутой стрелкой. По направляющему действию заместителя мезомерный эффект делится на положительный (+М) и отрицательный (-М).
Положительный мезомерный эффект проявляют заместители (электронодонорные атомы или атомные группы), предоставляющих электроны в сопряженную систему, т. е. имеющие неподеленные пары электронов или отрицательный заряд:
Максимальный +М у атомов с отрицательным зарядом. Заместители, содержащие неподеленные пары электронов, имеют тем больше +М, чем меньше в пределах периода электроотрицательность атомов, содержащих неподеленные пары электронов.
Отрицательный мезомерный эффект проявляют заместители, смещающие на себя электронную плотность сопряженной системы:
Максимальный –М проявляют заместители, несущие положительный заряд. В ненасыщенных группировках –М- эффект возрастает с увеличением разности электроотрицательности атомов кратной связи.
Рассмотрим несколько примеров проявления мезомерного эффекта:
Мезомерный эффект по сравнению с индуктивным вызывает более сильное смещение электронной плотности и практически не затухает.
Совместное проявление индуктивного и мезомерного эффектов заместителя
Мезомерный и индуктивный эффекты одного заместителя могут совпадать и не совпадать по направлению. Например, в молекуле акролеина альдегидная группа – С проявляет –I и –М, а гидроксильная группа в молекуле фенола обладает –I, но +М- эффектом.
Как видно из приведенного примера, в молекуле фенола противоположное электронное смешение приводит к тому, что эти два эффекта как бы «гасят» друг друга. А в молекуле акролеина индуктивный и мезомерный эффекты усиливают друг друга. Мезомерный эффект заместителя обычно больше, чем индуктивный, так как л-связи поляризуются легче, чем о-связи.
В молекулах с открытой цепью сопряжения обычно указывают частичные заряды, которые сосредоточены на концах сопряженной системы:
Величина эффекта гиперконъюгации тем выше, чем больше атомов водорода при углероде, связанном с ненасыщенной системой. Понятие о сверхсопряжении объясняет повышенную реакционную способность, подвижность а-водородных атомов в молекулах альдегидов, кетонов, кислот и их производных. Иногда сверхсопряжение называют по имени открывших его ученых эффектом Натана – Бекера.