генерация активных форм кислорода
Активные формы кислорода и их генерация



Свободные радикалы, образующиеся в тканях животных.
Перечисленные в табл.1 и 2 радикалы можно считать природными, поскольку они в определенном количестве всегда образуются в наших клетках. При действии ионизирующей и ультрафиолетовой радиации, а также при превращениях некоторых неприродных соединений, попавших в организм человека, в клетках и тканях также могут появляться радикалы.
Активные формы кислорода и их генерация
Сам по себе молекулярный кислород не вступает в неконтролируемые химические реакции внутри организма (в основном состоянии он представляет собой триплет, имеет 2 неспаренных электрона с параллельными спинами, которые локализованы на различных орбиталях). Большинство органических молекул синглетны, их электроны обладают антипараллельными спинами, и вследствие различий в направлении спинов электронов взаимодействие органических молекул с молекулой кислорода протекает достаточно медленно.
Из первичного радикала – супероксида, а также в результате других реакций, в организме образуются весьма активные молекулярные соединения: пероксид водорода, гипохлорит и гидроперекиси липидов. Такие молекулы, наряду с радикалами, получили в англоязычной литературе название “reactive species”, что в русской литературе чаще всего переводится как «активные формы». Чтобы провести черту между радикалами и молекулярными продуктами, некоторые ученые предлагают называть последние «реактивными молекулами». Таким образом, исходя из этого, можно сказать, что активные формы – это свободные радикалы + реактивные молекулы. Напомним, что свободные радикалы – молекулярные частицы, имеющие неспаренный электрон на внешней электронной оболочке.
Некоторые авторы предлагают такие термины как активные формы азота и хлора. Окись азота и результат ее взаимодействия с супероксидом – пероксинитрит, предлагается называть активными формами азота. Активной формой хлора можно назвать гипохлорит, образуемый в реакции пероксида водорода с ионом хлорида, катализируемой ферментом миелопероксидазой.
Несмотря на сказанное большинство ученых склонны к объединению всех перечисленных продуктов (и реагентов) цепного окисления липидов. Для биолога и врача все же важнее, не у какого именно атома локализован неспаренный электрон, а какая молекула при этом становится химически агрессивной, т.е. приобретает черты свободного радикала или его реактивного предшественника. Итак, к активным формам липидов можно отнести алкильные, аллоксильные и диоксид-радикалы, а также гидроперекиси полинасыщенных. жирных кислот и соответствующих цепей фосфолипидов или холестерина.
Активные формы кислорода и состояние окислительного стресса
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Активные формы кислорода и состояние окислительного стресса
Активные формы кислорода (АФК), накапливающиеся в ходе клеточного метаболизма, исторически привыкли считать вредными веществами, поскольку их чрезмерное накопление приводит к окислительному повреждению клеточных структур и гибели клеток. Таким образом, было постулировано, что как в норме, так и при патологических процессах необходимо ингибировать наработку активных форм кислорода и снижать активность перекисного окисления липидов (ПОЛ). Применяемые для этой цели разнообразные антиоксиданты стали усиленно рекомендовать клиницистам. Более того, современные производителей разнообразных пищевых добавок особенно подчеркивают, что эти добавки являются сильными антиоксидантами.
Исследования последних лет выявили важное регуляторное участие активных форм кислорода во многих физиологических и биохимических процессах – регуляции тонуса сосудов, клеточной пролиферации, синтезе простагландинов, в регуляции метаболических процессов в качестве внутриклеточных мессенджеров, а также, конечно, и в микробицидном действии фагоцитов. Неумеренное применение антиоксидантов, в том числе витаминов Е, С, и β-каротина будет затруднять выполнение клеточными активными формами кислорода вышеуказанных функций.
УЧАСТИЕ АКТИВНЫХ ФОРМ КИСЛОРОДА В ЛЕЙКОЦИТАРНОМ ВЗРЫВЕ И СИНТЕЗЕ ПРОСТАГЛАНДИНОВ
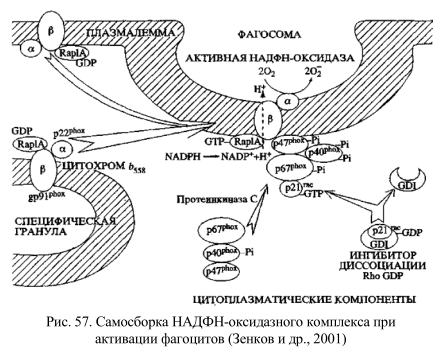
Как уже отмечалось выше, в ряде случаев усиление генерации АФК является физиологически нормальной реакцией. Для объяснения прямой зависимости микробицидного, цитотоксического и мутагенного действия фагоцитов от активности ферментативных систем образования АФК предложено несколько механизмов (рис. 56).
При стимуляции фагоцитов происходит быстрая самосборка из мембранных и цитозольных компонентов НАДФН-оксидазного комплекса (рис. 57), осуществляющего перенос электрона с цитозольного НАДФН на О2 с образованием О2 ˙. Индукция хемотаксическими пептидами происходит в течение 2 с. Цитохимическое изучение клеточных компартментов, в которых в нейтрофилах осуществляется продукция О2˙ показало, что уже через 1 мин после стимуляции большая часть НАДФН-оксидазной активности обнаруживается на внутриклеточных цилиндрических гранулах, содержащих также щелочную фосфатазу; в последующем (через 5 мин) основная активность НАДФН-оксидазы локализуется на внешней стороне цитоплазматической мембраны, попадая туда в результате экзоцитоза О2 ˙–продуцирующих гранул.
В ходе эволюции аэробных организмов выработалась регуляторная система, обеспечивающая связь между ферментативными и неферментативными механизмами утилизации кислорода, защиты от вредного действия его высокореакционных форм и продуктов свободнорадикальной и перекисной природы, а также способами восстановления поврежденных биомолекул (ДНК, белков, липидов) и клеточных структур. Динамический баланс между этими процессами позволяет нормально функционировать биологическим системам, а его нарушение, приводящее к усилению синтеза АФК и/или антиоксидантной недостаточности, ведет к окислительному стрессу.
АКТИВНЫЕ ФОРМЫ КИСЛОРОДА И ПРОДУКТЫ ПОЛ КАК СИГНАЛЬНЫЕ МОЛЕКУЛЫ
В последние годы выявлен широкий спектр физиологических эффектов АФК, к которым, прежде всего, относятся регуляция клеточной пролиферации и тонуса сосудов, индукция транскрипции определенных генов. Показано функционирование активных форм кислорода в качестве вторичных внутриклеточных мессенджеров. Так, активные формы кислорода непосредственно участвуют в активации онкогенов, а также гена, кодирующего главную форму фактора транскрипции АР–1, в ответ на ионизирующую радиацию. О2˙ и Н 2 О2 активируют фактор транскрипции NFκB, который вызывает экспрессию генов, кодирующих ряд цитокинов и вирусов, в том числе ВИЧ, a NO’ подавляет активацию NFκB, увеличивая индукцию ингибитора фактора транскрипции NFκB и стабилизируя его. В индукции синтеза белков теплового шока, повышающих резистентность клеток к высоким температурам, радиации, токсическому действию ионов тяжелых металлов и лекарственных препаратов, основная роль отводится перекиси водорода. NO* и СО* связываются с гемовой частью гуанилатциклазы и обратимо изменяют синтез цГМФ, тем самым управляя работой этих важных внутриклеточных регуляторов внутриклеточной коммуникации.
Одним из наиболее изученных факторов межклеточных сигнализации является оксид азота (нитроксид, NO-радикал), образующийся из L–аргинина и молекулярного кислорода с помощью фермента NO–синтазы: L-аргинин + НАДФН + О2 → цитруллин + NO + НАДФ + Радикал NO является важнейшим нейромедиатором, интермедиатом иммунной системы и регулятором сердечно–сосудистой системы человека. В животном организме NO работает как вторичный мессенджер и в периферической, и центральной нервной системе.
Существуют две основные формы NO-синтазы – конституционная, выделенная главным образом из эндотелия и нейронов, и индуцибельная, выделенная из макрофагов, гладких мышц и печени. Они отличаются по структуре и способу регуляции. Конституционная NO-синтаза постоянно присутствует в клетках и ее активность находится в прямой зависимости от уровня ионов Са, а регуляция осуществляется через кальмодулин, являющийся кофактором этого фермента. Индуцибельная форма не зависит от содержания кальция и транскрипционно регулируема. Эта форма индуцируется в макрофагах, гладких мышцах, гепатоцитах, нейтрофилах и других клетках под действием эндо- и экзотоксинов, цитокининов и продуцирует большое количество NО• в течение длительного времени. Последнее свойство важно, как основа адаптации клеток к изменяющимся условиям функционирования.
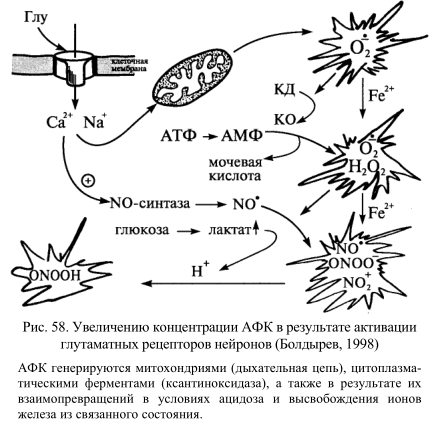
В результате повышения концентрации NO активируется цитозольная гуанилатциклаза, катализирующая превращение ГТФ в цГМФ, который активирует специфическую протеинкиназу (G-киназу) или непосредственно, или с помощью дополнительного сигнального пути, включающего еще один вторичный мессенджер – аденозиндифосфатрибозу. Последняя открывает Са-каналы внутриклеточных Са-депо, в результате чего повышается концентрация кальция в цитозоле, активируются Са-зависимые протеинкиназы, фосфорилируется белковый фактор регуляции транскрипции и начинается синтез белков теплового шока, обеспечивающих клеточную защиту. Оксид азота обладает широким спектром биологического действия. Он участвует в межклеточной сигнализации в центральной и периферической нервных систем. Его идентифицируют с эндотелиальным фактором релаксации, расслабляющим гладкие мышцы и предотвращающим агрегацию тромбоцитов и адгезию нейтрофилов к эндотелию. Его синтез фагоцитирующими клетками регулирует пролиферацию лимфоцитов. Он вносит вклад в, микробицидное и противоопухолевое действие фагоцитов. Более того нитроксид является регулятором внутриклеточной концентрации ионов Са 2+ и, соответственно, активности ряда Сa-зависимых ферментов. Источником NO в центральной и периферической нервной системе являются эндотелиоциты сосудов, клетки микроглии и астроциты, неадренергические нервные волокна и глутаматэргические нейроны (рис. 58).
Функции нейронального NO чрезвычайно разнообразны: он контролирует осцилляторную активность нейронов, является медиатором ноцицепции, участвует в формировании циркадных ритмов процессах термогенеза, обоняния, принятия пищи и воды, снижает тревожность, регулирует выход нейромедиаторов; играет существенную роль в процессах потенциации и, соответственно, долговременной памяти. Нейрональный NO является важнейшим вторичным мессенджером, с помощью которых нервная система управляет тонусом сосудов, снабжающих кровью все системы организма, причем он может действовать как непосредственно, так и опосредованно (например, стимулируя высвобождение вазопрессина).
Рис. 58. Увеличение концентрации АФК в результате активации глутаматных рецепторов нейронов (Болдырев, 1998)
Показано участие оксида азота, выделяющегося в синоатриальном узле, в автономном контроле сердцебиения. Снижение содержания цитоплазматического цГМФ при активации клеточных рецепторов L-глутаматом и его производными является NO-зависимым процессом. В зависимости от уровня NO он может или ингибировать, или потенцировать высвобождение глутамата и аспартата, тем самым защищая нейроны от экзайтотоксических эффектов медиатора. Избыточная продукция или недостаточно быстрая нейтрализация глутаминовой и аспарагиновой аминокислот, выполняющих роль возбуждающих медиаторов в нейронах, приводит к нейротоксическим эффектам. В основе токсического действия лежит стимуляция АФК, способная приводить к окислительному повреждению тканей. Кроме того, NO защищает головной мозг от ишемических и нейротоксических инсультов, контролирует осцилляторную активность нейронов.
Генерация активных форм кислорода
Глава 1. Активные формы кислорода и их роль в норме
и в условиях оксидативного стресса
Рис. 1. Электронные структуры некоторых активных форм кислорода;
Общим для всех этих соединений является их высокая реакционная способность. АФК отличаются друг от друга реакционной способностью, временем жизни и выполняемыми функциями (табл. 1).
Таблица 1. Основные виды АФК ( Беленичев и др., 2009)
Время полужизни при
О 2
Хороший восстановитель, умеренный окислитель. Обладает свойствами внутриклеточного мессенджера : сигнальный механизм при взаимодействии различных подтипов глутаматных и аспартатных рецепторов, регуляция активности хлорных каналов, индукция образования пор в митохондриальной мембране. Участвует в окислительной модификации S Н- и N Н2-групп низкомолекулярных соединений. Вазоконстриктор. Антисептик
Мощный окислитель. Чрезвычайно активен в реакциях акцептирования и переноса электронов. Участвует в окислительной модификации нуклеиновых кислот, белков, липидов, простагландинов. Диффундирует на очень малые расстояния
Эффективен при взаимодействии с липидами, приводит к их окислительной модификации. Окислительные свойства на уровне НО •
В физиологических условиях АФК образуются преимущественно в следующих системах [4]:
· при синтезе простагландинов как по циклооксигеназному пути – в процессе превращения PgG2 в PgН2 ( пероксидазная функция Pg Н-синтазы ), так и по липоксигеназному пути – в процессе превращения гидроперекиси арахидоновой кислоты в оксикислоту ; этот процесс контролируется рядом пептидных гормонов ( ангиотензин ), цитокинов (TNF-β) и ростовых факторов;
· при спонтанном или катализируемом моноаминоксидазой окислении дофамина и адреналина (при спонтанном окислении образуется О 2 
Действие АФК в организме фактически направлено на 3 типа клеточных мишеней: белки, нуклеиновые кислоты и липиды. В норме они активно участвуют в их метаболизме, а при патологических состояниях – в их окислительной деструкции.
Окислительная модификация белков, нуклеиновых кислот, липидов при участии АФК постоянно наблюдается в тканях и играет важную роль в распаде этих соединений. Это один из этапов обновления химического состава тканей.
В последнее время большое внимание уделяется изучению роли АФК в процессах метаболизма белков. Белки в силу особенностей своего строения являются одними из основных ловушек АФК. В связи с разнообразием химического строения, особенностями структурной организации белков процесс окислительной модификации белков носит сложный и специфический характер, что сопряжено с образованием большого количества окисленных продуктов радикальной и нерадикальной природы. Окислительное повреждение белков может быть связано с первичным нарушением или самого скелета полипептидной цепи, или отдельных аминокислотных остатков. Разделить эти процессы можно сугубо условно, т. к. окисление полипептидной цепи влечет за собой окисление остатков аминокислот и, наоборот, окислительная модификация радикалов отдельных аминокислот может сопровождаться либо агрегацией, либо фрагментацией белков. Наиболее чувствительными к окислению являются серосодержащие (метионин, цистеин) и ароматические (гистидин, триптофан, тирозин и фенилаланин ) аминокислотные остатки белков. Однако селективное повреждение этих лабильных аминокислотных остатков и механизм их окисления зависят от природы АФК.
Ответственным за протеолиз окисленных белков является мультикаталитический протеосомный комплекс, который существует в АТФ-независимой 19-20 S и АТФ-стимулируемой 26 S формах в клетках млекопитающих.
АФК вызывают окислительную модификацию нуклеотидов и нуклеиновых кислот, особенно ДНК. Это приводит к образованию гидропероксидов ROOH (так, из тимина образуется 5-СН2ООН-урацил), а затем и гидроксипроизводных ROH или R ( OH )2, основными из которых являются 8-ОН-2′-дезоксигуанозин и тимингликоль (их определение в тканях и моче используют как индексы окислительной модификации ДНК).
Существует большое количество данных, свидетельствующих о том, что живые организмы не только приспособились к сосуществованию со свободными радикалами, но фактически развили механизмы для выгодного использования их. Об этом свидетельствуют обнаруженные в последнее время новые функции АФК – регуляторные. Имеются определенные экспериментальные данные, свидетельствующие о том, что действия ряда первичных мессенджеров осуществляются либо через активацию процессов генерации АФК и повышение их уровня в тканях, либо через ингибирование компонентов АОЗ.
Следует отметить, что образование АФК различными изоформами НАДФН-оксидазы играет важную роль в регуляции каскада межклеточной сигнализации в различных типах нефагоцитирующих клеток, включая фибробласты, эндотелиальные клетки, гладкомышечные клетки сосудов, миоциты и клетки тироидной ткани.
Кроме того, установлено, что АФК образуются в клетках, стимулированных цитокинами, такими, как трансформирующий фактор роста р-1 (TGF-J31), интерлейкин-1, ФН О- α; пептидными факторами роста – тромбоцитарный фактор роста PDGF, основной фактор роста фибробластов bFGF ( basic fibroblast growth factor ); эпидермальный фактор роста EGF ( epidermal growth factor ); агонистами рецепторов ангиотензина II, тромбина и лизофосфатидной кислоты. Цитокины стимулируют освобождение АФК из многих типов клеток, включая фибробласты, эпителиальные и эндотелиальные клетки.
Таким образом, АФК играют важную роль в регуляции физиологических функций в тканях, вызывая стимуляцию различных сигнальных трансдукционных процессов, поэтому говорить о токсическом действии АФК не совсем верно. В нормально функционирующем организме АФК следует рассматривать с позиций их биологической значимости. С одной стороны, это продукты нормально протекающих окислительно-восстановительных реакций, с другой – специфические регуляторы метаболических процессов.
Свободнорадикальные реакции свойственны нормально метаболизирующей клетке. Окисление биомолекул идет со значительной скоростью, но стационарная концентрация продуктов окисления довольно мала вследствие наличия сложной системы взаимодействующих путей ее регуляции. Организм обладает многоуровневой стратегией защиты от повреждающего действия АФК. Защита осуществляется путем снижения образования первой АФК – О 2 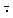
Ключевым ферментом антиокислительной защиты является супероксиддисмутаза (СОД), т. к. при ее участии прерывается цепь свободнорадикальных процессов в начале своего зарождения на стадии одноэлектронного восстановления кислорода с образованием О 2 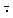

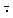
Глутатионпероксидаза (ГПО) эффективно расщепляет не только Н2О2, но и гидроперекисные соединения, образовавшиеся при ПОЛ:
2 GSH + ROOH → 2 GSSG + ROH + Н2О.
Таким образом, АОЗ тканей включает различные по своему химическому строению соединения. Однако действие всех компонентов ферментативной и неферментативной АОЗ в нормально функционирующем организме четко сбалансировано между собой, что обеспечивает поддержание количества оксидантов тканей на физиологическом уровне.
Для оксидативного стресса в первую очередь характерно нарушение в соотношении ант и- и прооксидантной систем в сторону повышения последней, отсутствие мобилизации активности АОЗ и нарушение сбалансированности самих компонентов этой системы. Начальные этапы запуска реакции генерации АФК при различных патологических состояниях могут отличаться, но уже на следующих этапах направленность и интенсивность свободнорадикальных процессов теряют свою специфичность и зависят от состояния и степени мобилизации АОЗ.
Т. к. нервная ткань является особенно чувствительной к АФК, что обусловлено высоким уровнем метаболизма, уникальным липидным составом и минимальным клеточным обновлением, окислительный стресс может способствовать инициации и прогрессированию ряда нейродегенеративных заболеваний. В настоящее время установлена роль окислительного стресса в развитии различных нейродегенеративных расстройств, таких, как амиотрофический латеральный склероз, болезнь Паркинсона, болезнь Альцгеймера, сосудистая деменция и др.
Немаловажным фактором усиления продукции АФК при гипоксии является увеличение содержания Fe 2+ в цитоплазме. Освобождению ионов железа из белок-связанной формы может способствовать О 2 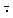
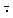
На более поздних стадиях ишемического поражения наблюдается приток в ткань нейтрофилов и других фагоцитирующих клеток, продуцирующих АФК, которые можно считать важными источниками образования активных метаболитов кислорода при гипоксии. Гипоксия непосредственно является одной из причин повышения адгезивных свой ств гр анулоцитов, а повреждение эндотелия сосудов вследствие активации фагоцитирующих клеток крови считают одним из основных факторов патогенеза реперфузионных или реоксигенационных нарушений.
Следует отметить, что на модели ишемии/ реперфузии печени мышей установлена критическая роль в продукции АФК Rac 1-регулируемой НАДФН-оксидазы, отличной от НАДФН-оксидазы фагоцитов.
При патологических состояниях на фоне интенсивной генерации радикальных продуктов снижается АОЗ. Снижение активности ферментов-антиоксидантов может быть связано с мутацией и окислительной деструкцией соответствующих форм ДНК. В то же время сами АФК могут ингибировать активность ферментов-антиоксидантов. Так, Н2О2 тормозит активность СОД, а О 2 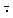
В условиях окислительного стресса наблюдается истощение компонентов неферментативной АОЗ, которые при нейтрализации радикальных продуктов переходят в неактивное состояние или образуют радикальные продукты разной степени токсичности. Процесс восстановления антирадикальной способности этих соединений в условиях оксидативного стресса снижен.
Таким образом, при состоянии оксидативного стресса наблюдаются глубокие изменения в метаболизме белков, липидов, нуклеиновых кислот, углеводов, водно-электролитном обмене, которые могут являться причиной тяжелых поражений тканей при ряде патологических состояний. Оценка интенсивности свободнорадикальных процессов при состоянии оксидативного стресса, их роли в патогенезе ряда заболеваний может быть произведена только при комплексном анализе пр о- и антиоксидантных систем. Более того, в каждом конкретном случае выбор исследуемых звеньев свободнорадикального окисления и компонентов АОС должен быть целенаправленным, необходимым, достаточным и адекватным поставленным задачам. Это особенно важно в клинических и патофизиологических исследованиях.
2. Болдырев А.А. Роль активных форм кислорода в жизнедеятельности нейрона // Успехи физиол. наук. – 2003. – № 3. – С. 21–34.
5. Зенков Н.К., Ланкин В.З., Меньщикова Е.Б. Окислительный стресс. Биохимический и патофизиологический аспекты. – М.: Наука / Интерпериодика, 2001. – 343 с.
12. Drőge W. Free radicals in the physiological control of cell function // Physiol. Rev. – 2002. – V. 82. – P. 47–95.