гепатит с в активной форме что это
Гепатит C. Симптомы, диагностика, лечение, профилактика
Гепатит C – хроническое инфекционное заболевание, вызываемое вирусом HCV, который поражает в первую очередь печень. Инфекция часто протекает бессимптомно, так что большинство больных даже не подозревают о ее существовании в течение многих лет. Если лечение отсутствует, то инфекция может привести к серьезным осложнениям, таким как цирроз и рак печени. Вирус HCV передается в основном при прямом контакте с кровью.
Строение и функции печени
Печень при весе около 1,2-1,5 кг (около 2% от фактического веса тела) является не только самым большим органом человеческого тела, но и самой большой железой. Находится в правой верхней части живота, чуть ниже диафрагмы. Печень делится на две части: правую и левую доли. Обе доли печени хорошо различимы, потому что они разделены ленточной структурой, исходящей от диафрагмы. Печень состоит из эпителиальных клеток (гепатоцитов), которые выходят наружу из центральной вены. Между этими клетками находятся тончайшие кровеносные сосуды, которые переносят кровь к центральной вене.
Благодаря своему расположению вблизи органов пищеварения печень играет важную роль в утилизации пищевых компонентов. В минуту через печень проходит около 1,5 л крови, что составляет около ¼ части. Она фильтрует кровь, чтобы сохранить другие органы тела от повреждений. Важные вещества, такие как углеводы и белки, могут храниться в клетках печени, а вредные (яды, лекарства), обезвреживаться.
Важной функцией печени является выведение билирубина из кровотока. Гемоглобин, превращается в билирубин в кровотоке в несколько этапов. Конечный продукт направляется через желчный проток в кишечник, где он выводится со стулом. Если эта функция печени нарушена, билирубин не отфильтровывается. В организме образуется его избыток, так называемый затор, что приводит к желтухе.
Формы гепатита C
В зависимости от формы заболевания определяется ход лечения. При своевременном обращении к врачу вероятность полного выздоровления возрастает.
При отсутствии лечения происходит стремительное поражение гепатоцитов, что чревато развитием онкологических заболеваний или цирроза.
Хронический гепатит С: клиника, диагностика, лечение
В настоящее время проблемой хронической HCV-инфекции интересуются как врачи-специалисты, так и люди, никак не связанные с медициной. От гепатита С во всем мире страдают по меньшей мере 200 млн человек.
В настоящее время проблемой хронической HCV-инфекции интересуются как врачи-специалисты, так и люди, никак не связанные с медициной.
От гепатита С во всем мире страдают по меньшей мере 200 млн человек. Последствиями перенесенного заболевания могут быть хронический гепатит, цирроз и первичный рак печени.
Эпидемиология
Распространенность хронической HCV-инфекции на земном шаре варьирует от 0,5 до 2%. Существуют регионы, для которых характерна более высокая распространенность этого заболевания: 6% в Заире и Саудовской Аравии, 16% в изолированных поселениях в Японии. В России наблюдается рост заболеваемости гепатитом С (3,2 на 100 тыс. населения в 1994 году и 19,3 в 1999 году). Источниками заражения вирусным гепатитом C служат больные острыми и хроническими формами HCV-инфекции, причем в основном это люди, у которых отсутствует желтуха и наблюдается бессимптомное или малосимптомное течение заболевания.
В настоящее время HCV чаще всего инфицируются молодые люди, преимущественно мужчины в возрасте около 20 лет, примерно 40% из них заражаются при внутривенном введении наркотиков. Основным путем инфицирования HCV является парентеральный. Так, у 6,1% больных, которым производилось переливание крови и ее компонентов во время кардиохирургических операций, развивался острый вирусный гепатит C, у 60% из них гепатит принимал хроническую форму.
Существует и риск заражения гепатитом C половым путем, однако он невелик (5-8%). Возможна передача HCV от матерей с острой или хронической формой инфекции; это также редкое явление, встречается не чаще чем в 5-6% случаев. Риск заражения вышеуказанными путями уступает таковому при гепатите В.
Приблизительно у половины больных путь инфицирования HCV установить не удается.
Вирус гепатита С
Вирус гепатита С относится к семейству флавивирусов. Геном вируса представлен однонитевой РНК протяженностью около 10 000 нуклеотидов. Вирус гепатита С вызывает заболевание только у человека. В экспериментальных условиях воспроизвести инфекцию можно у высших обезьян.
Популяция вируса неоднородна. Идентифицированы 6 генотипов (классификация по Simmonds), более 90 субтипов и множество вариантов вируса, обозначаемых как квазивиды. Зарегистрирована территориальная неравномерность циркуляции генотипов вируса гепатита С. В России чаще всего выявляются генотипы 1b и 3а этого вируса.
Определение генотипов вируса гепатита С имеет большое значение для практической медицины. Хотя до сих пор не установлено четкой корреляции между генотипами и уровнем виремии, характеристиками пациента, тяжестью течения заболевания, большинство исследователей соглашаются с выводами о значении генотипов вируса как важного фактора, влияющего на эффективность противовирусной терапии.
Вакцину против гепатита С создать пока не удалось из-за высокой изменчивости вируса гепатита С (ВГС).
Патогенез
Считают, что вирус оказывает прямое цитопатическое действие и вызывает иммуноопосредованное повреждение гепатоцитов. Высокая степень хронизации вирусного гепатита С обусловлена некоторыми особенностями действия вируса:
В течении хронической HCV-инфекции может происходить нейтрализация мажорного варианта вируса, но тогда генерируются минорные варианты. Квазивиды HCV представляют собой движущуюся мишень, которую ограничивает иммунная система хозяина. Появление нового мажорного квазивида сопровождается повышением виремии и увеличением титра Ig M антител к вирусным белкам. Постепенно и этот новый мажорный вариант заменяется. Такой процесс приводит к периодической волнообразной виремии, сопровождающейся обострением хронического гепатита С (ХГС) и повышением уровня антител.
Возможно, антивирусному Т-клеточному ответу отведена центральная роль в элиминации ВГC, так как нейтрализующие антитела, по-видимому, очень часто оказываются неэффективными. Т-хелперные (Th) лимфоциты распознают вирусные антигенные пептиды, представленные HLA-комплексом II класса на поверхностной мембране антиген-презентирующих клеток. В зависимости от типа цитокинового профиля Th-клетки делятся на две группы: Th1 и Th2. Первые продуцируют IFNg и IL2, стимулируя Т-клеточный ответ и цитотоксическую Т-лимфоцитную активность, а вторые продуцируют IL4 и IL10, стимулируя В-клеточный ответ. Таким образом, Тh-лимфоциты играют существенную роль в регуляции иммунного ответа. У пациентов, у которых болезнь перешла в хроническую стадию, в острой фазе вирус-специфический Th ответ был ниже и преобладали цитокины типа Th2.
У хронически ВГC-инфицированных пациентов значительно увеличено содержание вирусоспецифических Th2-клеток и их цитокинов. Нарушение баланса Th1/Th2 цитокиновой продукции может играть важную роль в иммунопатогенезе хронической ВГC-инфекции. Показано снижение уровня IFNg и IL12 при ХГС. Этот дефицит является следствием повышенного уровня IL10, предполагаемого отрицательного регулятора для IFNg. Повышенное содержание Th2-клеток при ХГС может снижаться при комбинированной терапии рибавирином и IFNa. Обнаружено, что у пациентов с клинико-биохимическим улучшением после лечения IFNa произошло увеличение уровня Th1-цитокинов.
Цитотоксические лимфоциты (CTL) играют, по-видимому, некоторую роль в ограничении репликации ВГС. Этот ответ недостаточен для полной элиминации вируса при хронической инфекции и, кроме того, может вызывать повреждение печени. Известно, что CTL способны быстро опознавать и направленно лизировать клетки, несущие ВГC-антигены, не провоцируя значительного воспаления, с помощью перфоринового, FasL- и TNFα-базируемых механизмов.
ТNF, как предполагается, индуцируют апоптоз клеток, опосредуя высвобождение свободных радикалов из митохондриальных электронно-транспортных путей и модуляцию синтеза некоторых белков. Взаимодействие нуклеокапсидного белка ВГC с внутрицитоплазматической частью рецептора TNFb, вероятно, представляет собой эволюционно-отобранный механизм, с помощью которого вирус препятствует преждевременному апоптозу клетки-хозяина. В отсутствие доступных модельных клеточных культур прямая цитопатичность вируса гепатита С не может быть исследована в полном объеме.
В подавляющем большинстве случаев острого гепатита С иммунной системе не удается элиминировать вирус. До сих пор нет ясного представления о том, почему это происходит. Очевидно, ВГС обладает эволюционно-закрепленными способностями, обеспечивающими ему персистенцию.
Однако иммунная система может оказывать существенное влияние на ВГC-инфекцию. В 15% случаев острого гепатита С она эффективно уничтожает вирус, а у хронически ВГC-инфицированных обеспечивает умеренное ограничение инфекции в течение почти 20 лет. Возможно, ослабление какого-либо звена антивирусных иммунных механизмов позволяет вирусу активно воздействовать на иммунную систему. Длительная ВГC-персистенция может привести к развитию В-клеточных лимфопролиферативных нарушений, таких, как смешанная криоглобулинемия, злокачественная не-Ходжкинская лимфома и появление органоспецифических и неспецифических аутоантител. Таким образом, хроническую ВГC-инфекцию следует рассматривать как мультисистемное заболевание.
Диагностика
Лабораторная диагностика гепатита С основана на выявлении специфических маркеров инфицирования ВГС (анти-ВГС-IgM/G, РНК ВГС) и должна проводиться разрешенными МЗ РФ к применению диагностическими препаратами отечественного или зарубежного производства в лабораториях, имеющих лицензию на проведение данного вида лабораторных исследований.
HCV RNA — самый ранний маркер репликации вируса, определяемый с помощью полимеразной цепной реакции (ПЦР) спустя несколько недель после заражения. Для выявления анти-ВГС применяют иммуноферментный анализ (ИФА). В настоящее время используют тест-системы третьего поколения ELISA-3. Подтверждающим методом является рекомбинантный иммуноблотинг (RIBA). У 60% больных анти-ВГС определяются в острой фазе, у 35% они появляются спустя 3-6 месяцев после инфицирования, у 5% инфицированных лиц анти-ВГС не определяются.
Болезнь может протекать бессимптомно. Наиболее распространенным симптомом является слабость. Целенаправленный опрос больных часто помогает выявить такие факторы риска, как переливание крови, внутривенное введение наркотиков, хронический гемодиализ и др. Кроме слабости больной может жаловаться на быструю утомляемость, тяжесть в правом подреберье, боли в правом верхнем квадранте живота, диспепсические явления.
Критериями постановки диагноза являются увеличение печени и селезенки, гиперферментемия и анти-ВГС в крови в течение не менее 6 месяцев.
Гепатоспленомегалия выявляется не более чем у 50% обратившихся за помощью больных, активность сывороточных трансаминаз редко превышает верхнюю границу нормы в 6 раз. Следует обратить внимание на то, что активность сывороточных трасаминаз не отражает степени изменений в печени: она может быть нормальной, несмотря на значительные морфологические изменения. Концентрация РНК ВГС в сыворотке имеет существенное значение для определения контагиозности и для мониторинга результатов лечения. При наличии в крови HCV-РНК биопсия печени, как правило, выявляет ряд изменений. Концентрация HCV-РНК в сыворотке, превышающая 105 молекулярных эквивалентов (копий) в 1 мл, наблюдается в активной фазе заболевания и совпадает с пиками активности трансаминаз.
Наличие или отсутствие РНК ВГС, как правило, не является диагностическим критерием хронического гепатита С и определяет фазу процесса (активный, неактивный).
Для раннего выявления ГЦК у больных циррозом печени, особенно у мужчин старше 40 лет, каждые 6 месяцев определяют уровень сывороточного α-фетопротеина и выполняют УЗИ печени.
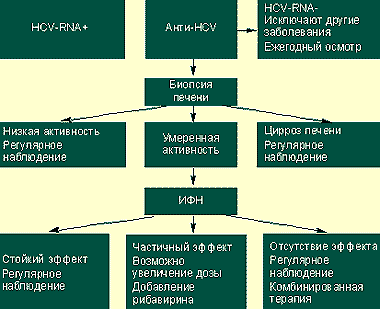 |
| Алгоритм ведения HCV-положительных больных |
Естественное течение и прогноз
Считается, что не более чем у 30% больных ВГС с минимальной морфологической активностью через 20 лет возможно развитие цирроза печени. Таким образом, больные, у которых при гистологическом исследовании биоптата печени выявляется наличие минимального воспаления и минимального фиброза, нуждаются в динамическом наблюдении.
Если персистенция РНК ВГС сохраняется более 6 месяцев, то спонтанное разрешение хронической HCV-инфекции маловероятно.
Клиническая картина
У большинства больных с хроническим гепатитом С заболевание протекает бессимптомно. Если жалобы существуют, то это чаще всего слабость, тупые боли в правом подреберье, тошнота, снижение аппетита, кожный зуд, артралгии и миалгии. Физикальный осмотр пациента помогает установить диагноз зачастую только на стадии цирроза печени.
Внепеченочные проявления HCV-инфекции
Ассоциация хронического гепатита С с различными внепеченочными проявлениями — хорошо известный врачам факт. Наиболее вероятным для большинства заболеваний и синдромов, наблюдаемых при HCV-инфекции, представляется иммунный патогенез, хотя конкретные механизмы во многом еще не выяснены. Доказанные и предполагаемые иммунные механизмы включают:
Частота иммуноопосредованных заболеваний и синдромов у больных хроническим гепатитом С достигает 23%. Наиболее характерны аутоиммунные проявления для больных с гаплотипом HLA DR4, который ассоциируется с внепеченочными проявлениями при аутоиммунном гепатите. Этот факт подтверждает гипотезу о триггерной роли вируса в инициации аутоиммунных процессов у генетически предрасположенного индивидуума.
Заболевания, ассоциированные с HCV-инфекцией
Ассоциированные с продукцией или отложением иммуноглобулинов:
Ассоциированные с неизвестным механизмом:
Выявление сывороточных аутоантител отражает наиболее частый феномен аутоиммунизации при HCV-инфекции, который диагностируют у 40-65% больных. Спектр аутоантител достаточно широк и включает ANA (до 28%), SMA (до 11%), анти-LKM-1 (до 7%), антифосфолипидные (до 25%), антитиреоидные (до 12,5%), ревматоидный фактор, анти-ASGP-R и др. Чаще всего титры этих антител не достигают диагностических значений, показательных для той или иной аутоиммунной патологии.
Анти-GOR являются антителами, специфичными для HCV-инфекции, и их выявляют не менее чем у 80% больных. Эпитоп, распознаваемый анти-GOR, локализуется на пока неидентифицированном ядерном белке, гиперэкспрессию которого наблюдают при гепатоцеллюлярной карциноме. Выработка анти-GOR ассоциирована только с HCV-инфекцией, но не с АИГ.
Аутоиммунные расстройства наблюдаются в среднем у 23% больных хроническим гепатитом С. Наиболее часто встречаются патология щитовидной железы.
Гистологическое исследование печени
Гистологическая картина не является патогномоничной, при этом достаточно часто выявляются характерные изменения. Отличительная особенность ее — лимфоидные агрегаты или фолликулы в портальных трактах, которые могут быть как изолированными, так и частью воспалительных изменений портальных трактов. По клеточному составу эти агрегаты напоминают первичные лимфоидные фолликулы в лимфатических узлах. Жировая дистрофия обнаруживается в 75% случаев. Кроме того, выявляются следующие характерные изменения: негнойный холангит с лимфоидной и плазмоклеточной инфильтрацией стенок протоков; лимфогистиоцитарная инфильтрация перипортальной зоны; слабовыраженные ступенчатые некрозы; мостовидные некрозы (обнаруживаются редко), пролиферация и активация сателлитных клеток печени, пролиферация эпителия желчных канальцев.
Отмечено, что индекс гистологической активности (ИГА) и индекс фиброза (ИФ) у больных хроническим гепатитом С с наличием жировой дистрофии достоверно выше, чем у пациентов без сопутствующей жировой дистрофии. У 93% больных с жировой дистрофией в гепатоцитах обнаруживался Core-протеин ВГС, при отсутствии жировой дистрофии — лишь у 39%. Этим фактом подчеркивается роль Core-протеина в развитии жировой дистрофии гепатоцитов.
Биопсия печени играет существенную роль в уточнении диагноза и оценке активности и стадии заболевания.
РНК ВГС можно определить в ткани печени методом ПЦР.
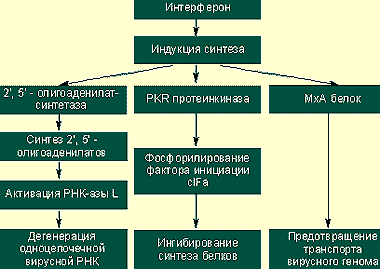 |
| Предотвращение вирусной транскрипции и трансляции |
Лечение
Основная цель лечения — предотвратить прогрессирование заболевания.
Режим отдыха, диета и прием витаминов не оказывают лечебного действия.
Отбор пациентов для лечения. Показанием к назначению терапии интерфероном служит умеренное (но не минимальное) либо тяжелое воспаление и/или фиброз. Решение о лечении пациентов с циррозом печени принимают индивидуально в каждом конкретном случае. Больные, у которых гистологическая активность минимальна, должны находиться под динамическим наблюдением, так как они имеют хороший жизненный прогноз без лечения и очень низкий риск развития цирроза печени через 10-20 лет.
Факторы, связанные с благоприятным эффектом противовирусной терапии при хронической HCV-инфекции:
Больным с нормальным уровнем АЛТ и положительным тестом на HCV RNA без результатов гистологического исследования противовирусное лечение проводить не рекомендуется.
Основной препарат, эффективность которого в лечении гепатита С доказана, — это интерферон альфа (ИФα).
В настоящее время принята оптимальная схема монотерапии ИФ: разовая доза составляет 3 млн МЕ, ее вводят подкожно или внутримышечно 3 раза в неделю в течение 3 месяцев. Через 3 месяца необходимо исследовать РНК ВГС. Если результаты ПЦР положительные схему лечения меняют. Если же РНК не выявляется, лечение продолжают до 12 месяцев. Стойкий положительный ответ в этом случае регистрируется у 15-20% больных.
Оптимальная схема лечения хронического гепатита С в настоящее время — это комбинация ИФa и рибавирина.
Согласно рекомендации согласительной конференции Европейской ассоциации по изучению печени (1999), больным с впервые установленным диагнозом «хронический гепатит С» и показаниями к лечению необходимо назначать ИФa в комбинации с рибавирином следующими курсами:
Стойкий положительный ответ при комбинированном лечении ИФa с рибавирином наблюдается в 40-60% случаев.
Суточная масса рибавирина составляет 1000-1200 мг в зависимости от массы тела.
В последние годы для повышения эффективности интерферона применяют пегилирование, которое заключается в присоединении к молекуле интерферона полиэтиленгликоля. В итоге образуется ПЭГ-интерферон, имеющий более длительный период полураспада. Предварительные данные свидетельствуют о большей эффективности такого лечения по сравнению с терапией интерфероном альфа.
Одним из наиболее перспективных пегилированных интерферонов является пегасис — ПЭГ-интерферон альфа-2а, соединенный с разветвленной молекулой полиэтиленгликоля, молекулярная масса которого составляет 40 kDa, общий вес молекулы — около 60 kDa. Особенности химической структуры данного препарата определяют его фармакокинетические свойства и клиническую эффективность. Молекула полиэтиленгликоля присоединена к альфа-интерферону посредством самой стабильной амидной связи, это делает молекулу пегасиса чрезвычайно устойчивой к действию петидаз и позволяет выпускать препарат в виде растворенной и готовой к употреблению лекарственной формы. Особенностью молекулы полиэтиленгликоля является способность активно связывать несколько молекул воды, что создает вокруг химически структурной единицы пегасиса эффект «водного облака», делая ее устойчивой во внутренней среде и сообщая препарату относительно небольшой объем распределения. Это, в свою очередь, способствует тому, что отпадает необходимость в коррекции дозы препарата в зависимости от массы тела пациента: пегасис вводится один раз в неделю в дозе 180 мкг. Существенными преимуществами препарата пегасис являются значительно лучшая переносимость и меньшая частота побочных реакций, ассоциированных с системным действием альфа-интерферона, что значительно улучшает качество жизни пациентов, получающих лечение по поводу хронического гепатита С. Кроме того, в отличие от других пегилированных интерферонов пегасис не требует существенной коррекции дозы в зависимости от функционального состояния почек, что делает препарат незаменимым у пациентов с сопутствующей хронической почечной недостаточностью.
Клиническая эффективность пегасиса оценена солидными широкомасштабными многоцентровыми рандомизированными исследованиями. Было показано, что частота доказанного ответа на лечение значительно превышает таковую по сравнению с «короткими» интерферонами как в схемах монотерапии, так и в сочетании с рибавирином. Особенно впечатляющими в этой связи являются результаты этиопатогенетической терапии с использованием пегасиса в сочетании с рибавирином у так называемой «трудной» категории пациентов, имеющих морфологические проявления цирроза печени, 1b-генотип вируса, высокую виремию: частота доказанного ответа на лечение у данной категории пациентов при использовании пегасиса в сочетании с рибавирином может составлять около 40%, у иных категорий пациентов этот показатель может превышать 75%, что ранее было практически немыслимым результатом.
Другие противовирусные препараты в лечении хронического гепатита С
Имеются данные, свидетельствующие о положительном действии таких препаратов, как ремантадин, урсодеоксихолевая кислота, пегилированные интерфероны, препараты глициризиновой кислоты, однако эта информация нуждается в дальнейшей проверке.
По вопросам литературы обращаться в редакцию
Лечение хронического гепатита
Хронический персистирующий гепатит
Лечение. Питание должно быть 4-разовое с полным исключением грибов, консервированных, копченых и вяленых продуктов, жареных блюд, изделий из шоколада, крема и сдобного теста, спиртного, ограничить употребление животных жиров (жирные сорта мяса, утка, гусь, свинина). 1-2 раза в год курсы витаминотерапии (группа В, аскорбиновая кислота, рутин). Не рекомендуется прием желчегонных препаратов. Один раз в 6-12 месяцев больному проводить исследование крови на печеночные пробы.
Хронический активный гепатит (ХАТ)
Эта форма развивается после вирусного (инфекционного) гепатита с выраженными воспалительно-некротическими изменениями.
Жалобы: общая слабость, утомляемость, значительное снижение трудоспособности, тошнота, ухудшение аппетита, тяжесть и боли в правом подреберье. Помимо указанных жалоб у больных в зависимости от тяжести заболевания развивается геморрагический синдром (кровотечения из десен и носа, подкожные кровоизлияния), повышение температуры от низких субфебрильных до высоких цифр, появляются на груди и плечах «сосудистые звездочки», присоединяются поражения других органов: боли в суставах, воспалительные процессы в легких, почках, сердце, плеврит (воспаление плевры с накоплением в плевральной полости жидкости). Печень увеличена, болезненная, плотная, в большинстве случаев увеличена и селезенка.
Противопоказан лечение хронических гепатитов прием желчегонных, печеночных экстрактов типа сирепара, анаболических гормонов (ретаболил), любых физиотерапевтических процедур. Назначение легалона, карсила, эссенциале не желательно, так как они могут вызвать нарастание воспаления. Лечение кортикостероидами (преднизолон), левамизолом (декарисом) только по назначению и под контролем врача. При ХАГ выраженной активности больные направляются на ВТЭК для определения группы инвалидности в связи со стойкой утратой трудоспособности.
Хронический холестатический гепатит
Заболевание печени диффузного характера в результате воспаления вдоль мелких желчных ходов, застоя желчи в ткани печени.
Гепатит С
Вирусный гепатит — инфекционное заболевание, вызываемое группой гепатотропных вирусов (размножающихся преимущественно в печеночных клетках — гепатоцитах). В настоящее время наиболее изучены распространенные вирусные гепатиты А, В, C, D (дельта) и Е.
Вирусный гепатит — инфекционное заболевание, вызываемое группой гепатотропных вирусов (размножающихся преимущественно в печеночных клетках — гепатоцитах). В настоящее время наиболее изучены распространенные вирусные гепатиты А, В, C, D (дельта) и Е.
Особое положение вирусного гепатита С (ГС) среди других гепатитов обусловлено катастрофическим ростом инфицированности вирусом ГС населения и особенно молодежи, что связывают с ростом шприцевой наркомании. Так, по материалам Всемирной организации здравоохранения, приблизительно около 1 миллиарда человек на планете инфицированы вирусом ГС. Вполне понятно, что при таких темпах увеличивается и абсолютное число неблагоприятных исходов.
Другая особенность проблемы ГС заключается в том, что вирусный гепатит С недостаточно изучен как с позиций вирусо- и иммуногенеза, так и с чисто клинической точки зрения. Именно при ГС наблюдаются парадоксальные ситуации, когда ставится диагноз хронического гепатита, а клинических, анамнестических, а порой и лабораторных данных (за исключением обнаружения одних только антител к HCV (Hepatitis C Virus)) нет.
Необходимо сразу же определиться, что ГС должен рассматриваться как одно из составляющих глобальной проблемы HCV-инфекции, включающей в себя не только собственно острый и хронический гепатиты, но и цирроз печени и внепеченочные поражения. Именно такой подход поможет правильно определить состояние конкретного больного и оценить лабораторные данные, предусмотреть перспективы развития инфекции, индивидуально и своевременно подобрать необходимую адекватную терапию и избежать категорических, поспешных прогнозов в отношении фатальности исходов острого и хронического ГС.
Клинические формы гепатита C
При попадании вируса ГС в организм человека возможно развитие двух вариантов инфекционного процесса:
Острые манифестные формы HCV-инфекции (желтушная и безжелтушная) протекают как острый ГС с различной степенью тяжести заболевания (легкой, среднетяжелой, тяжелой и злокачественной). В ряде случаев наблюдается затяжное течение: с длительной гиперферментемией и/или с затяжной желтухой (холестатический вариант).
В последующем заболевание заканчивается:
Бессимптомная (субклиническая) форма HCV-инфекции является наиболее распространенной (до 70% всех случаев инфицирования), однако практически не диагностируется в период острой фазы. В дальнейшем субклинические формы (как и острые манифестные) заканчиваются выздоровлением или формированием хронического гепатита с различной степенью активности. Следует подчеркнуть, что течение бессимптомной формы ГС (также как и манифестных форм) сопровождается качественными и количественными изменениями специфических (IgM и IgG) антител, а также определенной динамикой вирусемии, изучаемой по уровню РНК HCV в крови. Вместе с тем наблюдаются различные по выраженности изменения биохимических показателей цитолиза гепатоцитов (гиперферментемии аланиновой (АЛТ) и аспарагиновой (АСТ) аминотрансфераз и др.).
Острая желтушная форма. Инкубационный период варьирует от нескольких недель (при переливании крови и ее препаратов) до 3–6 и редко до 12 месяцев (при инфицировании посредством парентеральных манипуляций). Средняя продолжительность инкубационного периода составляет 6 месяцев.
Преджелтушный период. Заболевание чаще начинается постепенно, проявляясь, в основном, астено-диспептическим синдромом. Больные жалуются на общую слабость, снижение работоспособности, недомогание, повышенную утомляемость, ухудшение аппетита, возможна тошнота, 1–2-кратная рвота, чувство тяжести в эпигастрии, иногда ноющие боли в правом подреберье. Повышение температуры тела не относится к числу постоянных симптомов — только у 1/3 больных с ГС в преджелтушном периоде регистрируется повышение температуры тела, в основном в пределах субфебрильных величин. В этом же периоде можно пропальпировать увеличенную, нередко болезненную печень. Продолжительность начального (преджелтушного) периода колеблется от 4 до 7 дней, однако у отдельных больных он может достигать 3 недель. В конце преджелтушного периода изменяется цвет мочи и окраска стула.
Желтушный период. С появлением желтухи симптомы печеночной интоксикации могут сохраняться, но чаще уменьшаются или совсем исчезают. В этот период характерны вялость, слабость, сниженный аппетит вплоть до анорексии, тошнота, редко бывает рвота, боли в эпигастрии и правом подреберье. У всех больных выявляется гепатомегалия, иногда чувствительный при пальпации край печени и у части больных (до 30%) определяется увеличенная в размерах селезенка. Выраженность желтухи различная: от слабой иктеричности склер до высокой интенсивности окраски кожных покровов.
Одной из особенностей ГС является достаточно короткий, по сравнению с другими типами гепатитов, период максимальной выраженности симптомов интоксикации и желтухи. В сыворотке крови отмечается увеличение содержания билирубина и значительное повышение активности АЛТ и АСТ. Показатели тимоловой пробы умеренно повышаются, а сулемового титра — снижаются. Желтушный период длится от 1 до 3 недель. У отдельных больных может развиться холестатический вариант течения болезни с длительностью желтухи до двух-трех месяцев, зудом кожи (иногда изнурительным) и с типичными для длительной гипербилирубинемии биохимическими сдвигами в крови (высокий уровень общего и конъюгированного билирубина, повышенные показатели щелочной фосфатазы).
Период спада желтухи характеризуется нормализацией самочувствия больного, уменьшением размеров печени и селезенки, постепенным восстановлением цвета мочи и стула, значительным снижением активности ферментов и уровня билирубина.
Исходы острого гепатита С. Выздоровление наблюдается в 15–25% всех случаев острого ГС, а в остальных — переход в хронический гепатит, с постепенным (в течение многих лет) формированием цирроза печени и крайне редко с развитием первичного рака печени — гепатоцеллюлярной карциномы.
В большинстве случаев заболевание прогрессирует медленно. Около 15% лиц, инфицированных вирусом ГС, выздоравливают спонтанно (т. е. после перенесенного гепатита в течение двух лет в крови не обнаруживается РНК вируса гепатита С), у 25% заболевание протекает бессимптомно с нормальным уровнем сывороточных аминотрансфераз или с легким печеночным поражением, т. е. в среднем 40% больных выздоравливают клинически. Естественно, что при адекватной терапии процент благоприятных исходов возрастает.
Безусловно, такие факторы, как злоупотребление алкоголем, наркомания, токсикомания и неправильное питание во многом ускоряют и усиливают процесс поражения паренхимы печени, что в свою очередь предопределяет неблагоприятный исход как острой, так и хронической HCV-инфекции.
К группе риска развития вирусного цирроза печени также относятся пациенты, страдающие хроническими заболеваниями: сахарным диабетом, туберкулезом, коллагенозами, хроническими заболеваниями желудка, кишечника, почек и др.
Тревожным в плане прогноза является развитие ГС вместе с гепатитом В: одновременное заражение (коинфекция) или комбинации (суперинфекция): хронического гепатита В с присоединением острого ГС; хронического ГС и инфицирование вирусом гепатита В (ВГВ).
В связи с этим тактика и стратегия лечения таких пациентов требует дифференцированного, индивидуального подхода в каждом конкретном случае.
Хронический гепатит С. При HCV-инфекции чаще, чем при HBV (Hepatitis В Virus), наблюдается переход заболевания в хроническое течение.
Клинические проявления при хроническом ГС (ХГС), формирующемся после перенесенной желтушной формы или после бессимптомного течения заболевания, весьма незначительны и проявляются некоторыми астено-вегетативными симптомами: повышенная утомляемость, немотивированная слабость, плохое настроение, иногда снижение аппетита. Часто выраженность симптомов и жалоб бывает настолько невысокой, что только после тщательного и даже пристрастного выяснения анамнеза удается выстроить хронологию заболевания. Диспепсический синдром также выражен слабо или отсутствует — отмечается некоторое снижение аппетита, возможна тошнота после жирной, острой пищи, иногда беспокоит чувство тяжести в правом подреберье. Эти симптомы больные, как правило, связывают с нарушением режима питания и диеты. При осмотре определяется увеличение печени (печень на 1–1,5 см ниже реберного края с умеренно упругим, гладким, острым, чувствительным или безболезненным краем), у 30–40% пациентов пальпируется селезенка. При УЗИ отмечается гепатоспленомегалия, диффузные изменения в паренхиме печени и селезенки. Активность трансаминаз обычно в пределах нормальных значений или в 1,5–3 раза превышает их. Нарушение белкового обмена не наблюдается. При серологическом исследовании регистрируются антитела к HCV общего пула, при этом в крови определяется РНК вируса.
При хроническом ГС с высокой активностью процесса течение заболевания носит волнообразный характер и складывается из периодов обострения и ремиссии. Период обострения характеризуется полиморфизмом клинической картины, однако ведущим является астено-диспептический синдром, у 10–25% пациентов наблюдается желтуха. Отмечаются резкие сдвиги лабораторных показателей: активность трансаминаз превышает нормальные значения в 10 и более раз, изменяются показатели белкового и липидного обмена. В крови обнаруживается РНК HCV. На УЗИ определяется гепатоспленомегалия, обеднение сосудистого рисунка, эхогенная неоднородность паренхимы (зернистость) и утолщение капсулы печени.
В период ремиссии хронического ГС самочувствие больных улучшается, снижается активность ферментов, однако сохраняется гепатомегалия, тогда как спленомегалия регистрируется у 10–15% больных. В ряде случаев может исчезать виремия (с последующим появлением РНК вируса в период очередного обострения).
Частота периодов обострений и ремиссий и степень их выраженности достаточно вариабельны, однако определенная закономерность существует: чем чаще обострения, тем они продолжительнее и тем выше активность АЛТ и АСТ, что способствует более быстрому формированию цирроза печени. Именно при высокой активности ХГС наблюдаются такие внепеченочные проявления, как артралгии, субфебрильная температура, телеангиоэктазии, кожные высыпания и т. д., а также симптомы декомпенсированного дисбактериоза кишечника (более легкие формы дисбактериоза — компенсированная или латентная и субкомпенсированная наблюдаются практически при любой клинической форме ГС).
Многократно повторяющиеся обострения ХГС, протекающие с высокой степенью активности, в конечном итоге заканчиваются переходом в следующую клиническую форму HCV-инфекции — вирусный цирроз печени, симптомы которого достаточно известны. Однако обычно на это уходят многие годы.
Следует отдельно подчеркнуть, что при хроническом активном ГС внепеченочные проявления связаны с развитием аутоиммунных (иммунопатологических) процессов, в инициализации которых определенную роль играет вирус HCV-инфекции. Прогрессирующая аутоиммунная патология (полиартриты, синдром Шегрена, полиневриты, нефропатии, анемии и др.) усугубляет в свою очередь течение хронического поражения печени, что определяет необходимость подбора адекватной терапии.
Морфологическая характеристика. У большинства больных с хроническим течением инфекции имеется средняя или умеренная тяжесть некрозо-воспалительных повреждений в печени с минимальным уровнем фиброза. Прогрессирование HCV-инфекции сопровождается портальной и перипортальной воспалительной реакцией с мелкоочаговыми некрозами и массивной лимфоцитарной инфильтрацией. Процесс повреждения печени может усиливаться: в результате некротических изменений образуются соединительнотканные септы и развиваются мультилобулярные (сливные, т. н. «мостовидные») некрозы, что характеризует хронический активный гепатит с начальными признаками цирроза печени. Высокая активность хронического ГС морфологически характеризуется прогрессированием мультилобулярных некрозов и образованием множественных соединительнотканных септ, что в свою очередь нарушает кровоснабжение, вызывает беспорядочную узелковую регенерацию в оставшихся уцелевших островках паренхиматозных клеток, что способствует формированию «ложных» регенераторных печеночных долек с исходом в макронодулярный цирроз печени.
Исходы хронического гепатита С. Темпы перехода ХГС в цирроз печени различны: только у 10–20% больных отмечается выраженная активность воспалительного процесса и в течение 10–20 лет развивается клинически манифестный цирроз печени, большинство же больных ХГС просто не доживают до развития манифестного цирроза и тем более рака печени, умирая от других (общесоматических) заболеваний. Однако в ряде случаев отмечается быстрое прогрессирование ХГС в цирроз печени, что зависит от многих факторов, среди которых следует выделить злоупотребление алкоголем, токсическое действие наркотиков, сопутствующие соматические заболевания, одновременное заражение вирусами С и В (коинфекция) или суперинфекцию ВГВ, изначально неадекватную специфическую терапию HCV-инфекции. Поэтому знание хронологии и особенностей развития вирусного поражения печени должно учитываться при выборе тактики и стратегии лечения HCV-инфекции, особенно ее хронических форм.
Диагностика
Специфическая лабораторная диагностика HCV-инфекции основана на обнаружении специфических антител к основным антигенам вируса и определении РНК вируса, его количества и генотипа.
Иммуноферментные тест-системы третьего поколения для определения антител к HCV, где в качестве связывающего антигена на твердой фазе используются иммунореактивные синтетические пептиды, являются достаточно чувствительными и информативными, а их широкое использование повысило процент выявления лиц, инфицированных вирусом ГС.
Широко используется определение т. н. общих антител к HCV, однако интерпретация положительных результатов такого исследования весьма ограничена — наличие общих антител к HCV позволяет лишь констатировать факт контакта пациента с вирусом ГС и не позволяет судить ни о давности процесса, ни о его завершенности или прогрессировании. Также не отмечается и корреляции с выраженностью клинического течения HCV-инфекции.
Таким образом, обнаружение только общих антител к HCV имеет скрининговый (ориентировочный) смысл и дает основание для дальнейшего комплексного, в том числе специфического лабораторного обследования. Отметим, что общие антитела к вирусу гепатита С сохраняются в организме неограниченное время.
Антитела класса IgM к HCV, определяемые иммуноферментным методом, позволяют говорить не только об инфицировании вирусом ГС, но с определенной долей достоверности об острой фазе инфекции или обострении хронического гепатита, несмотря на отсутствие симптомов болезни и гиперферментемии АЛТ, АСТ.
Вирусная РНК выявляется в цитоплазме большинства гепатоцитов печени уже на первой-второй неделе заражения. В последующем количество вирусных частиц периодически может увеличиваться, но это не всегда коррелирует с наличием РНК в сыворотке крови или со степенью воспалительных изменений в печени. Максимально виремия наблюдается в начале острого периода болезни. Антитела появляются спустя 6–12 недель от начала развития гепатита. Прежде всего выявляются антитела к структурным (связанным с ядерным белком) протеинам, а затем — к неструктурным белкам — NS3, NS4 и NS5 регионов геномa.
Определение рибонуклеиновой кислоты вируса ГС (HCV-RNA) проводится с помощью ПЦР, которая с высокой степенью точности показывает присутствие или отсутствие вирусной РНК в крови.
Метод ПЦР позволяет определить вирусный генотип и его подтип, а также количество РНК (титр или количество генокопий в мл). Определение генотипа вируса и его титра (полуколичественное исследование) в крови пациента используется как для диагностики HCV-инфекции, так и для дополнительной оценки активности вирусного процесса и для контроля эффективности комплексного, в том числе противовирусного лечения. Интерпретация полученных результатов оценивается следующим образом: 1 + (1:1) и 2 + (1:10) — вирусная РНК определяется в низком титре, уровень виремии низкий, 3 + (1:100) — средний уровень виремии и наконец 4 + (1:1000) и 5 + (1:10000) — высокий уровень виремии. Недостатком метода является его технологическая сложность и достаточно высокие в настоящее время экономические затраты, что не позволяет широко внедрить его в массовое лабораторное обследование.
При положительном результате обследования на антитела к HCV и отсутствии клинической картины гепатита самым простым (и правильным) решением будет направление пациента к инфекционисту. Для получения более полной характеристики следует провести дополнительное обследование:
Результаты такого обследования в совокупности с данными эпиданамнеза и физикального обследования на первом этапе помогут выработать правильную тактику лечения и ведения конкретного пациента. Нередко встречаются ситуации, когда результаты комплексного обследования не выявляют никаких отклонений, кроме обнаружения антител к HCV. В этих случаях правомочно говорить о перенесенной ранее субклинической форме HCV-инфекции. Однако, учитывая существующую вероятность реактивации (репликации) вируса, следует поставить больного на диспансерный учет и 2–4 раза в год проводить выборочное лабораторное обследование. Подобные рекомендации даются и пациенту, перенесшему манифестную форму ГС.
Терапия гепатита C
Лечение ГС имеет ряд особенностей и зависит в первую очередь от того, острый или хронический гепатит диагностирован у пациента.
Острый гепатит С является типичным инфекционным заболеванием и в его терапии применяются традиционные принципы лечения вирусных гепатитов: характер терапии манифестных форм вирусного ГС (протекающих с симптомами интоксикации и желтухой) зависит от степени тяжести, однако при всех формах больные должны соблюдать режим с ограничением физической нагрузки и диету — стол № 5, а при обострении процесса — № 5а. Базисная терапия также включает в себя проведение пероральной дезинтоксикации, использование спазмолитиков, ферментных препаратов, витаминов, десенсибилизирующих средств. Наряду с общепринятой базисной терапией в современных условиях возможно назначение этиотропного лечения: назначение индукторов интерферонов и иммуномодуляторов (Амиксин, Неовир, Циклоферон, Иммунофан, Полиоксидоний и др.).
При среднетяжелых и тем более тяжелых формах ГС, сопровождающихся выраженными симптомами интоксикации (длительной тошнотой, многократной рвотой, резкой слабостью, усилением желтухи и другими признаками печеночной недостаточности), показано внутривенное введение глюкозо-электролитных растворов, препаратов поливинилпирролидона (Гемодеза и аналогов) в суточном объеме до 1,5–2 литров под контролем диуреза. В случаях же развития тяжелого и злокачественного течения к терапии добавляют глюкокортикоиды (преднизолон 60–90 мг per os в сутки или 240–300 мг внутривенно), белковые препараты (альбумин, плазма), аминокислотные смеси (Гепастерил А и В, Аминостерил Н-гепа и др.), противогеморрагические средства (Викасол, Дицинон, аминокапроновую кислоту), ингибиторы протеаз (Контрикал, Гордокс и аналоги), энтеросорбенты, среди которых наиболее предпочтительным является Дюфалак. Эффективным методом терапии тяжелых форм остается плазмаферез.
При развитии холестатического варианта течения назначают Усофальк (урсодеоксихолевая кислота) по 8–10 мг/кг тела в сутки один раз вечером в течение 15–30 дней, энтеросорбенты (Полифепам, Энтеросгель и т. п.). В ряде случаев наблюдается положительный эффект при проведении гипербарической оксигенации (ГБО), сеансов плазмафереза, ингаляционном введении гепарина в сочетании с лазерной терапией.
В патогенетическую терапию ГС могут быть включены также и другие препараты: Гептрал, Рибоксин, Тыквеол, Хофитол, Фосфоглив, Карсил, Легалон и аналоги. В последнее время применяются препарат «Глутоксим», избирательно действующий на вируспораженные и непораженные клетки и регулирующие процессы тиолового обмена.
Учитывая тот факт, что при патологии печени всегда имеются нарушения микрофлоры кишечника различной степени выраженности, рекомендуется назначение бактерийных препаратов, нормализующих микрофлору кишечника, — Бифидумбактерин и его комбинации, Лактобактерин, Хиллак-форте и пр. Рационально применение комплексного синбиотика Бифистим, содержащего помимо бактерий мультивитаминный комплекс и пищевые волокна, о необходимости включения которых говорилось ранее.
В настоящее время нет единого мнения о целесообразности применении противовирусных препаратов интерфероновой группы (или же других групп) в терапии острого ГС. Существует ряд исследований, демонстрирующих эффективность назначения 3-месячного курса интерферонов (или комбинации интерферонов с нуклеозидами) пациентам с острым ГС. По мнению авторов, раннее назначение противовирусных препаратов значительно снижает частоту перехода острого гепатита в затяжной и хронический.
Представляется также обоснованным назначение в начальном периоде острого ГС препаратов, обладающих противовирусной активностью (препараты глицирризиновой кислоты — Виусид, Фосфоглив).
Хронический гепатит С. Терапия пациентов с ХГС включает в себя ряд аспектов, среди которых следует выделить в первую очередь деонтологический. Так, больные ГС должны быть обязательно подробно информированы по определенному кругу вопросов, связанных с их заболеванием, в частности, касательно особенностей клинического течения, правил поведения больного в быту, санитарно-эпидемиологического характера, возможных исходов с акцентом на высокий процент хронизации, использования терапевтических мероприятий и средств, в том числе специфических противовирусных препаратов и связанных с этим сложностей и проблем (длительность и дороговизна терапии, нежелательные побочные проявления, ожидаемая эффективность лечения). Результатом такого собеседования врача с пациентом должно быть осознанное желание пациента лечиться, а также оптимистическое отношение к предстоящей длительной и упорной терапии.
В настоящее время в мировой практике используется целый ряд медикаментозных средств, противовирусная активность которых в той или иной степени доказана.
Первую и основную группу противовирусных препаратов составляют a-интерфероны (рекомбинантные и природные) — такие как: Реаферон, Роферон-А, Интрон-А, Интераль, Вэллферон, Реальдирон и др. Считается, что их противовирусное действие основано на торможении вирусной репродукции и стимуляции многих факторов иммунной системы организма.
Вторую группу противовирусных средств составляют ингибиторы обратной транскриптазы и, в частности, аналоги нуклеозидов (Рибавирин, Рибамидил, Ребетол, Рибавирин-вера, Видарабин, Лобукавир, Соривудин и др.), блокирующие синтез вирусных ДНК и РНК путем замены собой натуральных нуклеозидов и тем самым тормозящие репликацию вируса. Противовирусным эффектом обладают также Ремантадин и Амантадин.
Третья серия препаратов представлена интерфероногенами (Амиксин, Циклоферон, Неовир и др.), механизм действия которых заключается в индукции выработки макроорганизмом дополнительных количеств своих собственных интерферонов.
Лечение любого заболевания и особенно хронической формы ГС требует исключительно индивидуального подхода, поскольку характер патологического процесса у каждого конкретного больного определяется целым рядом имеющих большое значение составляющих, как то: возраст больного, характер сопутствующей патологии, длительность заболевания, генотип вируса и уровень вирусной нагрузки, переносимость препаратов, наличие и выраженность побочных нежелательных явлений, связанных с проводимой терапией и, в конце концов (а в ряде случаев и в начале), — с экономическими возможностями конкретного пациента.
Уместно отметить, что первоначально использовавшаяся у больных ХГС монотерапия препаратами интерферона по литературным данным (1999–2000 гг.) — Интрон-А по 3 млн МЕ 3 раза в неделю либо Вэллферона в том же режиме в течение 12 месяцев, давала положительный результат от 13 до 48% (имелись в виду нормализация уровня аминотрансфераз и исчезновение HCV-РНК в крови по данным ПЦР). Результаты зависели от генотипа возбудителя и включали т. н. положительные нестабильные ответы, т. е. новое появление РНК в крови у пациентов в процессе 6–12-месячного наблюдения за ними после завершения курса лечения.
В целях повышения эффективности лечения хронического вирусного ГС в последнее время применяется комплексная противовирусная терапия, как правило, сочетанное использование a-интерферонов с аналогами нуклеозидов. К примеру, комбинированное применение Интрона-А по 3 млн МЕ 3 раза в неделю с аналогами Рибавирина (Рибамидил, Ребетол, Видарабин, Лобукавир, Соривудин и др.), ежедневно в дозе 1000–1200 мг в течение 12 месяцев позволило получить стабильный, устойчивый ответ у 43% больных, т. е. отсутствие РНК вируса ГС в крови по данным ПЦР в динамике на протяжении 12 месяцев наблюдения за больными после прекращения такой терапии. Вместе с тем следует учитывать, что аналоги нуклеозидов сами по себе обладают целым спектром побочных реакций, проявляющихся чаще при длительном приеме препаратов. Об этих реакциях нуклеозидов также следует предупредить пациента.
Помимо прочих факторов, недостаточно высокий положительный стабильный эффект даже комбинированной терапии объяснялся тем, что применяемые схемы интерферонотерапии не создавали постоянства терапевтической концентрации активного вещества в крови и в тканях, поскольку период полураспада введенного в организм интерферона составляет 8 часов, в то время как вирусу достаточно в промежутках между инъекциями интерферона всего нескольких часов, чтобы достигнуть вновь своей исходной концентрации. Замена препарата Интрон-А в приведенной выше схеме лечения больных ХГС на ПЭГ-интерферон (ПЭГ-интрон, Пегасис) в дозе 180 мкг в виде 1 инъекции в неделю (присоединение к молекуле интерферона полиэтиленгликоля приводит к удлинению периода полураспада активного вещества в организме до 168 часов) позволила в итоге получить устойчивый терапевтический ответ в среднем у 72% всех таким образом пролеченных больных, из них у 94% с генотипом возбудителя 2 и 3.
Имеются сообщения, что подобная комплексная терапия, предпринятая в течение 6 месяцев у больных острым вирусным гепатитом С, давала полное излечение и исключала хронизацию процесса практически у всех больных (98%), независимо от генотипа возбудителя. Такие же впечатляющие данные получены и при лечении ХГС. Надо добавить, что оптимистические результаты, полученные при использовании ПЭГ-интерферона, омрачаются недопустимо высокой ценой препарата.
Лечение ГС является довольно сложным мероприятием, поэтому при назначении и проведении специфической терапии уместно руководствоваться следующими принципами: