гистологическая техника учебное пособие
Гистологическая техника учебное пособие
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ
ДАГЕСТАНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Предметом изучения цитологии, гистологии и эмбриологии являются клеточно-тканевые структуры организмов на микроскопическом уровне, а предметом изучения – микроскопический препарат. Поэтому для успешного освоения этих наук необходимо владеть гистологической техникой – приемами и методами изготовления микроскопических препаратов и способами их изучения. В настоящем руководстве изложены основные сведения по технике гистологических исследований, оно знакомит студентов с правилами работы и методами наблюдения под микроскопом, методикой приготовления препаратов. Особое внимание уделено методам окрашивания различных клеточно-тканевых структур и гистохимическим исследованиям. Методики применимы на растительных и животных объектах.
Методические указания рекомендованы для студентов, специализирующихся по кафедре физиологии человека и животных, могут быть использованы на лабораторных занятиях по цитологии, гистологии и эмбриологии, большом практикуме, при выполнении курсовых и дипломных работ.
Автор: Газимагомедова И.К. – доц. каф. зоологии и физиологии, канд. биол. наук
Приготовление постоянного микротомного препарата Взятие и фиксация материала …………………………….
Уплотнение (заливка в парафин) ………………………….
Окрашивание и заключение в бальзам ………………….
Методы окрашивания гистологических препаратов …
Методы окраски клеток и неклеточных структур соединительной ткани ……………………………………..
Выявление элементов нервной системы
Приготовления препаратов давленных объектов. Методы изучения митоза и мейоза ………………………
1. Световая Микроскопия
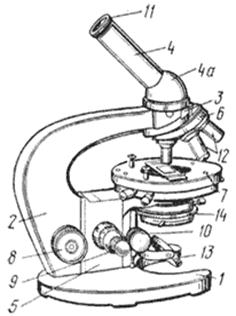
1.1. Устройство микроскопа
В микроскопе различают оптическую (объектив, окуляр), осветительную (источник света, зеркало, конденсор и диафрагма) и механическую (штатив, предметный столик, колонка с макро- и микровинтами, тубус) части (рис. 1).
Рис.1. Световой микроскоп.
Полное увеличение микроскопа оценивают как произведение увеличений объектива и окуляра, например, при объективе 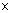
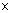
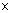
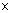
Разрешающая способность объектива, т.е. минимальное расстояние между двумя видимыми точками (минимальный размер объекта):
где: λ – длина волны света, используемого для освещения объекта; n – коэффициент преломления среды (воздух или масло); α – угол между оптической осью объектива и наиболее отклоняющимся лучом, попадающим в объектив (максимально 90°); n ∙ sin α – апертура линз.
Если использовать ультрафиолетовый свет (260 – 280 нм), то можно повысить разрешение до 130-140 нм (0,13 – 0,14 мкм). Это будет пределом теоретического разрешения светового микроскопа, определяемым волновой природой света. Таким образом, все, что может дать световой микроскоп как вспомогательный прибор к нашему глазу – это повысить разрешающую способность его примерно в 1000 – 2500 раз. Это и есть “полезное” увеличение микроскопа, выше которого мы будем только увеличивать контуры изображения, не открывая в нем новых деталей. Следовательно, при использовании видимой области света 0,2–0,3 мкм является конечным пределом разрешения светового микроскопа (минимальное расстояние на котором различимы два объекта).
Зеркало собирает лучи от источника света и направляет их на препарат снизу. При искусственном освещении используется вогнутая поверхность зеркала, а при дневном – плоская.
Конденсор состоит из линз, которые фокусируют лучи света на препарате. Поднимая и опуская конденсор (с помощью винта), можно настраивать фокусировку лучей. При подъеме конденсора попадающие на препарат лучи рассеиваются, при опускании концентрируются на препарате, но на более ограниченном участке. Обычно работают при конденсоре, поднятом до уровня столика.
В итоге, световые лучи проходят следующий путь: источник света → зеркало → конденсор → диафрагма → препарат → объектив → тубус → окуляр. Т.е. микроскопия ведётся в проходящем свете, для чего препарат должен быть достаточно тонким.
1.2. Техника микроскопирования
Изучить препарат при малом увеличении.
Перевести препарат на большое увеличение. Для этого сменяют объектив на 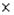
Для изучения очень мелких структур используют иммерсионный объектив ( 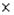
2. Приготовление постоянного микротомного препарата
Приготовление постоянных гистологических препаратов включает следующие этапы: 1) взятие и фиксация материала; 2) промывка и обезвоживание; 3) уплотнение (заливка в парафин); 4) приготовление срезов; 5) окрашивание; 6) обезвоживание и заключение препаратов в консервирующую среду (рис. 2).
2.1. Взятие и фиксация материала
Необходимое условие при взятии материала – сохранение прижизненной организации тканей. Для этого материал берут «живьем» и быстро убивают, обычно погружая в специальные фиксирующие жидкости, в целях сохранения витальной структуры, т.е. проводят фиксацию.
Рис. 2. Этапы приготовления гистологического препарата для световой микроскопии.
В зависимости от строения органа взятие материала осуществляется по-разному. Из однородных органов (печень, селезенка) кусочек можно вырезать из любого участка. Из неоднородных органов (почка, надпочечник) необходимо так вырезать кусочек, чтобы попали все слои. Величина кусочка зависит от структуры органа, целей исследования и способов дальнейшей обработки. Из соответствующего органа вырезают обычно небольшие кусочки (0,5 x 1 x 1 см ).
Способы фиксации – использование фиксирующих жидкостей, криофиксация (мгновенное замораживание в жидком азоте) и лиофилизация (замораживание с последующим высушиванием в вакууме). При лиофилизации выпадает необходимость проводить обезвоживание и уплотнение материала.
Фиксирующие средства бывают простые и сложные. К первым относятся спирты, ацетон, кислоты, формалин, сулема, пикриновая кислота, тетраоксид осмия. Сложными являются смеси различных веществ, например жидкость Ценкера, жидкость Карнуа, жидкость Буэна и т.д. Так, для лучшей фиксации ядер употребляют хромовые или хромосмиевые смеси, для фиксации цитоплазмы смеси Карнуа или Буэна. Фиксирующие свойства зависят от рН среды, температуры, продолжительности фиксации.
В последнее время, особенно для электронной микроскопии, широко используется глютаровый альдегид, который более эффективно сшивает молекулы и тем самым обладает сильным фиксирующим действием.
Требования, предъявляемые к фиксатору : 1) свежесть; 2) достаточное количество. Объем фиксатора должен в 20-40 раз превышать объем фиксируемого материала, объект со всех сторон должен быть окружен фиксатором. Если часть материала плавает на поверхности фиксатора, то сверху накладывают тонкий слой ваты. Как до, так и после фиксации объект не должен подсыхать на воздухе.
100% или 96% спирт……………………6 частей
Ледяная уксусная кислота…………… 1 часть
Фиксатор готовят перед употреблением. Фиксируют от 30 мин до 3 ч, затем кусочки можно хранить в 70% спирте.
100% или 96% этиловый спирт………. 3 части
Продолжительность фиксации – 2-12 ч. Иногда в нем хранят материал при 0-3 о С.
Двухромовокислый калий………………2,5 г
Сернокислый натрий…………………….1 г
Дистиллированная вода…………………100 мл
Ледяная уксусная кислота………………5 мл (добавляют перед употреблением)
Фиксируют 1-24 ч. Затем 24 ч промывают в водопроводной воде до обесцвечивания воды. Материал обесцвечивают в 70% спирте, где его можно хранить. Цвет фиксатора – насыщенно красно-бордовый. Как только сулема будет удалена, раствор перестанет обесцвечиваться.
100% или 96% спирт…………………….10 мл
Ледяная уксусная кислота………………2 мл
Фиксируют от 5 мин и более. Фиксатор пригоден для приготовления временных давленых препаратов.
5% формалин: 1 часть 40% формалина + 7 частей дистиллированной воды.
10% формалин: 1 часть 40% формалина + 3 части дистиллированной воды.
20% формалин: 1 часть 40% формалина + 1 часть дистиллированной воды.
Методика проведения фиксации. Берется чистая стеклянная посуда (пробирки, бюксы или стаканчики) с фиксатором, объем которого в 20-40 раз больше объема материала. На дно посуды кладут гигроскопическую или стеклянную вату для равномерного пропитывания объекта. Материал с помощью пинцета быстро помещается в фиксирующую смесь (фиксатор должен быстро проникать в ткани и не вызывать грубых нарушений тканевых структур) и посуда плотно закрывается. Вместе с материал в пробирку кладется фиксационная этикетка, сделанная из плотной бумаги, размером 1х1 см, на которой простым карандашом отмечаются название изучаемого материала, фиксатора и дата фиксации.
Если ткань богата водой или кровью, фиксатор следует дважды сменить.
После фиксации образцы промывают проточной водой (в некоторых случаях спиртом) от 1 до 3 ч, иногда дольше. Промывкой материала удаляется излишнее количество фиксатора. В зависимости от способа фиксации существуют разные способы промывки. После фиксации в смеси с пикриновой кислотой промывка производится 70-80% спиртом. При фиксации в смесях, содержащих сулему, трихлоруксусную кислоту, используют 90-96% спирт. При формалиновой фиксации и фиксации хромовыми смесями промывку производят проточной водой под краном, или неоднократной сменой воды (10-12 раз) в течение 24-48 ч. Материал, фиксированный в смесях с преобладанием спирта (фиксатор Карнуа) промывке не подвергается.
Существуют разные приспособления для промывки: 1) обычные стеклянные склянки с пробкой или завязанные марлей и резиновым шлангом, соединенные с краном; 2) для мелких объектов применяются специальные фарфоровые сита; 3) стеклянные трубочки, обвязанные с обеих сторон марлей.
Удобно провести промывку материала следующим образом: материал вместе с этикеткой переносят в марлевые узелки, перевязывают их ниткой и помещают в высокий стакан с водой. Сверху в стакан кладут воронку и все ставят под кран с проточной водой.
Далее необходимо получить срезы материала для их последующего окрашивания. Для этого образцы уплотняют, т.е. заливают в парафин или целлоидин, чтобы в последующем их можно было тонко резать. Предварительно образцы обезвоживают, чтобы гидрофобный уплотнитель смог проникнуть в ткань. Обезвоживание производится проведением материала по батарее спиртов возрастающей концентрации, что позволяет избежать разрывов и деформаций ткани.
Методика обезвоживания. Материал вынимают из марлевых узелков и вместе с этикеткой последовательно помещают в стаканчики или бюксы со спиртами (метанол или этанол) возрастающей концентрации – 70%, 80%, 96%, 100%. Чем нежнее материал, тем ниже первоначальная концентрация спирта (начинают с 20% спирта). Время выдерживания в каждом спирте зависит от толщины материала и строения органа: от 30 мин, 1-6 ч, и до 6-12 ч. В 96% и 100% спиртах выдерживают дважды. При перекладывании материала из слабого раствора спирта в спирт большей концентрации кусочки необходимо обсушить фильтровальной бумагой.
Схема и сроки выдерживания в спиртах растительного материала:
Основы гистологической техники
Государственное бюджетное образовательное учреждение
«Иркутский государственный медицинский университет»
Министерства здравоохранения Российской Федерации
Институт сестринского дела
ОСНОВЫ ГИСТОЛОГИЧЕСКОЙ ТЕХНИКИ
Рекомендовано методическим советом Института сестринского
образования ГБОУ ВПО ИГМУ Минздрава России
в качестве учебного пособия для студентов специальности
060604 «Лабораторная диагностика»
(протокол от 01.01.2001).
ИСО ГБОУ ВПО ИГМУ Минздрава России, канд. мед. наук,
– заведующая кафедрой лабораторной диагностики ИСО ГБОУ ВПО ИГМУ Минздрава России, канд. биол. наук, доцент.
– заведующий кафедрой патологической анатомии ГБОУ ВПО ИГМУ Минздрава России, заведующий патологоанатомическим отделением МАУЗ КБ № 1 г. Иркутска, канд. мед. наук,
– старший лаборант патологоанатомического отделения МАУЗ КБ №1 г. Иркутска, врач-патологоанатом.
Учебное пособие освещает вопросы организации рабочего места лаборанта-гистолога, описание особенностей забора гистологического материала, методов его проведения и основных методов окрашивания для приготовления гистологических микропрепаратов.
Предназначено для студентов, обучающихся по специальности «лабораторная диагностика».
© ГБОУ ВПО ИГМУ Минздрава России, 2013
1. Организация рабочего места лаборанта-гистолога
2. Документальное оформление поступившего материала
3. Техника приготовления гистологических препаратов
3.1 Взятие материала
3.2 Краткие замечания об артефактах при иссечении и фиксации материала
3.3 Фиксация материала
3.4 Промывка материала
3.5 Обезвоживание материала
3.6 Уплотнение материала
3.7 Нарезка препаратов
3.8 Правила окрашивания препаратов
3.9 Просветление и заключение срезов
4. Примерный перечень манипуляций в области гистологии
Задачи, которые выполняет в настоящее время патологическая анатомия, ставят её среди медицинских дисциплин в особое положение: с одной стороны – это теория медицины, которая, раскрывая материальный субстрат болезни, служит клинической практике, с другой стороны – это клиническая морфология для установления диагноза, служащая теории медицины.
Изучение структурных основ болезни происходит на разных уровнях: организменном, системном, органном, тканевом, клеточном, субклеточном и молекулярном. Изучение на тканевом и клеточном уровне осуществляется с помощью микроскопических методов исследования.
В патологоанатомических отделениях клинической морфологией занимаются врачи-патологоанатомы, качество работы которых напрямую зависит от умения среднего звена отделения – лаборантов-гистологов.
1. ОРГАНИЗАЦИЯ РАБОЧЕГО МЕСТА ЛАБОРАНТА-ГИСТОЛОГА
Организация рабочего места во многом определяет эффективность и качество работы лаборанта. Рациональная расстановка и размещение лабораторной посуды, инструментария, необходимых растворов и реактивов позволяют без суеты, с наименьшей затратой усилий выполнить за одно и то же время больший объем работы.
У лаборанта должно быть свое рабочее место, с площадью рабочей поверхности не менее 60 х 120 см. Участок стола, предназначенный для непосредственной работы, следует сделать из влагоустойчивого материала, накрыть стеклом и расположить под ним небольшие листы белой и черной бумаги. Это создает соответствующий фон, который облегчает работу с окрашенными (белый лист) и неокрашенными (черный лист) препаратами.
Достаточная освещенность рабочего места является одним из важнейших условий, так как изготовление гистологических препаратов требует значительного напряжения зрения. Необходимо максимально использовать дневной свет. Лучше ставить стол около окна. Однако даже при достаточном свете рабочее место должно быть оснащено специальным осветителем к микроскопу или настольной лампой (с наклоняющейся верхней частью) для обеспечения освещенности. Недостаток света неблагоприятно сказывается на восприятии цвета препарата и затрудняет оценку качества его окраски.
Лаборант должен содержать, свой стол в надлежащем порядке: не загромождать рабочую поверхность лишней посудой и предметами, не применяемыми в данный момент в работе. В любой гистологической лаборатории применяют большой набор разнообразной лабораторной посуды. Следует принять за правило не оставлять использованную посуду длительное время без промывания. Если нет возможности её тут же окончательно вымыть, то необходимо ополоснуть и залить водой. Для удаления засохших реактивов требуется значительно больше усилий, а иногда их вовсе невозможно отмыть.
В повседневной работе лаборанту необходимо иметь набор инструментов, за которым необходим тщательный уход. После применения его следует сразу же мыть (если нужно, очищать) и насухо вытирать (или высушивать в сушильном шкафу).
Хранить инструменты следует в определенном месте. Это облегчает их нахождение и экономит рабочее время.
По окончании рабочего дня лаборант обязан проверить, выключены ли электроприборы, с которыми он работал.
1. Банка на штативе с отводной трубкой для дистиллированной воды.
2. Широкогорлые банки с притертыми пробками для составления батарей для проводки материала, для хранения кусочков тканей в фиксирующих жидкостях и т. д.
3. Бюксы – круглые стеклянные стаканчики с притертыми крышками. Применяются для обработки гистологических срезов и маленьких кусочков тканей.
4. Биологические стаканчики – круглые, овальные или четырехугольные, снабжены крышечками. Наборы таких стаканчиков вставляются в специальные штативы и используются в качестве батарей для проводки гистологических срезов, монтированных на предметных стеклах.
5. Колбы (плоскодонные) – в зависимости от емкости используются для приготовления и хранения различных красителей, под дистиллированную воду и др.
6. Чашки Петри – широкие плоские стеклянные чашки с крышками, используются для окраски свободно плавающих срезов.
7. Кюветы – применяют для одновременной окраски нескольких срезов.
8. Кристаллизаторы – для мытья посуды.
9. Часовые стекла – для окрашивания свободно плавающих срезов, нуждающихся в контроле под микроскопом (серебрение нервной ткани).
10. Пипетки – используют для накапывания красителей на срезы.
11. Для хранения канадского бальзама может быть приспособлена любая баночка, в пробку которой воткнута стеклянная палочка.
12. Предметные стекла – прямоугольные стеклянные пластины размером 76*26 мм и толщиной 1 мм, предназначенные для размещения гистологических срезов.
13. Покровные стекла – тонкие (0,15-0,2 мм) пластинки для покрытия обработанных срезов, расположенных на предметном стекле.
2. ДОКУМЕНТАЛЬНОЕ ОФОРМЛЕНИЕ ПОСТУПИВШЕГО МАТЕРИАЛА
1. Весь материал для исследования из лечебных отделений доставляется в патологоанатомическое отделение после операции в фиксирующей жидкости (10% р-р формалина). Хранение материала без фиксации недопустимо. На банку, содержащую объект, наклеивается ярлык с указанием фамилии и инициалов больного, лечебного отделения и номера истории болезни. Помещать в одну посуду несколько объектов исследования от разных больных разрешается только при условии, если каждый из них завязывает в марлю вместе с биркой. На бирке пишутся Ф. И.О. и возраст больного.
2. Присланный объект, непригодный для исследования (подсохший, загнивший, замороженный), не принимается на исследование, о чем немедленно ставят в известность заведующего лечебным отделением.
3. На каждый подлежащий исследованию объект заполняется бланк направления. Он доставляется вместе с объектом в патологоанатомическое отделение. Все графы бланка должны быть заполнены таким образом, чтобы производящий исследование патологоанатом имел достаточно клинических сведений при оценке обнаруженных морфологических изменений.
Бланк заполняется врачом лечебного отделения немедленно после окончания операции. Объект, направленный на исследование, должен соответствовать данным сопроводительного бланка.
4. Если немедленная отправка объектов на исследование невозможна, оперировавший хирург обеспечивает правильную фиксацию и сохранность.
5. При доставке материала из других ЛПУ фиксированные объекты доставляются курьером.
6. Ткани и органы, полученные при биопсии с диагностической целью, категорически запрещается делить на части и посылать их в несколько патологоанатомических отделений, так как морфологические изменения, характерные для данного процесса (рак, туберкулез и т. д.), могут оказаться только в одной части объекта, и результаты исследования будут различными. Это может дезориентировать лечащих врачей и нанести вред больному.
Весь персонал патологоанатомического отделения несет ответственность за сохранения принятого и обработанного материала, что нередко решает вопрос о здоровье и жизни больного.
8. Исследование присланных кусочков тканей и органов для диагностических биопсий и послеоперационного материала рекомендуется проводить в течение 3-4 суток.
9. Поступившие в лабораторию объекты на исследование вместе с сопроводительным бланком принимаются лаборантом, при этом проверяется, соответствует ли поступивший объект указанному на бланке, все ли графы бланка заполнены.
10. В книге записи в порядке поступления регистрируются под очередным номером все объекты, поступившие на исследование. В целях правильного учета количество гистологических исследований при наличии нескольких объектов (органов) от одного больного (например: матка, труба, червеобразный отросток) следует каждый из объектов внести под отдельным очередным номером, который проставляется на всех материалах и документах, относящихся к данному исследованию: на бланке заключения, на гистологических препаратах, на банке, в котором сохраняется присланные на исследование объекты.
11. Нумерация исследований начинается каждый год заново, при этом номером исследования на предметных стеклах проставляются две последние цифры года исследования.
12. Макроскопическое описание присланных объектов с указанием количества и объёма кусочков и органов, а также вырезка кусочков для гистологического исследования производится врачом патологоанатомического отделения, в день получения материала.
13. После изучения сопроводительных документов и микропрепаратов врачом описывается гистологическая картина присланных для исследования объектов, устанавливается диагноз, ставить подпись (разборчиво) и дата.
14. Лаборант полностью переписывает в книгу регистрации все данные макроскопического и гистологического исследований, диагноз с указанием фамилии врача, производившего исследования и дату ответа.
15. Выдача ответов на руки больным воспрещается.
16. При запросе микропрепаратов из других лечебных учреждений, куда по характеру заболеваний направлен больной (например: онкологический диспансер и т. п.), патологоанатомическое отделение (ПАО), в котором производилось исследование биопсии и было дано заключение, обязано выдавать заключение и микропрепараты, официально запрашиваемые из других лечебных учреждений, сохраняя в отделении дубликаты препаратов. После изучения микропрепаратов лечебное учреждение, которому они выданы, обязано возвратить их обратно в то же отделение, из которого они получены.
17. Все книги записи исследования биопсий сохраняются и должны постоянно находиться в помещении ПАО и из него не выносятся.
18. Гистологические препараты хранятся в архиве ПАО таким образом, чтобы они не портились (в специальных шкафах).
19. Архивные гистологические препараты рекомендуется хранить на протяжении 5 лет, препараты с установленным диагнозом опухоли хранятся бессрочно.
3. ТЕХНИКА ПРИГОТОВЛЕНИЯ ГИСТОЛОГИЧЕСКИХ ПРЕПАРАТОВ
Приготовление гистологических препаратов включает в себя несколько этапов: взятие материала, фиксация, обезвоживание, промывка, уплотнение, нарезание препарата, окрашивание, просветление и заключение срезов.
3.1 Взятие материала
Хороший гистологический препарат должен отвечать таким требованиям:
— исследуемая ткань должна в максимальной степени сохранить свое прижизненное строение,
— срез должен быть тонким и прозрачным, чтобы через него проходил свет,
— изучаемые микроструктуры должны быть хорошо видны.
Для этого нужно обеспечить:
— своевременное взятие и надлежащую фиксацию исследуемого материала,
— качественное приготовление и обработку срезов,
— соответствующую окраску изучаемого препарата.
При микроскопическом исследовании тканей и органов большое значение имеет техника взятия материала. Поэтому при иссечении кусочков необходимо соблюдать следующие правила:
1. Объекты, подлежащие исследованию, должны быть свежими. Этому условию больше всего удовлетворяет материал, направленный прямо из операционной. Хуже обстоит дело с исследованием кусочков, взятых при вскрытии трупов, где приходится сталкиваться с посмертными изменениями.
2. Иссекая кусочки, нужно учитывать микроскопическое строение того или иного органа или ткани.
Например: кусочки из почки и надпочечника вырезают с таким расчетом, чтобы в них попали корковое, и мозговое вещество, для чего разрезы ведут перпендикулярно к поверхности указанных органов. Из органов, имеющих во всех своих частях одинаковое строение (печень, селезенка, щитовидная железа и др.) объекты можно иссекать как угодно, но желательно захватывать с капсулой. Стенки полых органов (мочевой пузырь, кишечник и др.) исследуют на поперечных сечениях.
4. Иссечение необходимо производить острыми инструментами, чтобы не травмировать ткани.
5. Недопустимо никакое сдавливание кусочков, а также очистка поверхности органа (например: слизистой оболочки, серозного покрова) пальцами, инструментами, тряпками.
6. Кусочки переносят в фиксирующую жидкость на лезвии ножа или пользуются анатомическими пинцетами.
3.2 Краткие замечания об артефактах при иссечении и
Хорошо известно, что плохая фиксация и механическая травматизация тканей (плохое качество режущих инструментов, раннее вскрытие, недостаточный опыт вскрывающего) постоянно сопровождаются появлением темных клеток в различных тканях и органах и особенно в нервной системе, где практически они имеют первостепенное значение. Важнейшими морфологическими формами такого рода искусственных образований являются: гиперхромные и сморщенные нейроны, пикнотические ядра, пузырьковидное превращение клеточного тела. Появление последних обычно связано с фиксацией ткани мозга в недостаточно крепких спиртах и обмыванием объектов водой.
Для возникновения артефактов весьма велико значение неудовлетворительной фиксации. Ещё в 1926 году ученые впервые установили, что фиксатор действует неодинаково на разной глубине объекта. Возникающие в процессе спиртовой фиксации диффузионные токи могут вести к смещению ядерного и клеточного содержимого и даже к разрывам. Общеизвестно, что позднее вскрытие, фиксация мозга в виде отдельных излишне толстых кусков, а также недостаточное количество фиксатора ведут к аутолитическим процессам в глубоких слоях объектов. При благоприятных условиях внешней среды (высокая температура, влажность) эти изменения в нервной системе развиваются очень быстро и морфологически ощутимы уже через несколько часов после смерти, проявляясь в картинах побледнения и распыления хроматофильного вещества.
Говоря об артефактах, нельзя не напомнить и о таком моменте, как необходимость соблюдения принципа стандартности при заборе и последующей обработке экспериментального и контрольного материала, ибо только так возможно гарантировать более или менее правильную оценку результатов микроскопического исследования. Впрочем, и при этих условиях нередко возникают серьезные трудности. Дело в том, что артефакты контрольного и экспериментального материала могут быть далеко не одинаковы, поскольку в одном случае механической травматизации и грубой фиксации подвергаются нормальные нервные элементы, а в другом – патологически измененные. Вот почему нельзя полностью согласиться с таким довольно распространенным представлением, что будто бы тщательное сопоставление опытного и контрольного материала позволяет не учитывать артефакты фиксации при экспериментальных и патологоанатомических исследованиях. В таких случаях, наряду с сопоставлением опытного и контрольного материала, может оказаться полезным и метод фиксации путем перфузии. Этот последний метод является существенным дополнением к методу фиксации в виде отдельных кусков, поскольку он в значительной мере защищает от возникновения артефактах по причине механической травматизации материала.
Постоянными артефактами в центральной нервной системе являются периваскулярные и перицеллюлярные щели. Наблюдаемые на любых срезах они нередко дают повод для ошибочной диагностики отека.
Могут быть и другие структурные нарушения искусственной природы, как, например, пустоты (округлой и неправильной формы) и щели в цитоплазме и ядрах нервных клеток.
Нельзя еще раз не напомнить о необходимости соблюдения очень большой осторожности при оценке картин хроматолиза со стороны отдельных ганглиозных клеток или их групп. Подобные картины могут быть выражением не только функционального состояния или каких-то вредных воздействий (экспериментального или спонтанного характера), но и возникать, как уже было отмечено выше, в результате неудовлетворительной фиксации материала.
В заключение следует упомянуть об агональных изменениях нейронов, поскольку они могут быть сходны с артефактами при неудовлетворительной фиксации. Речь идет о периваскулярных некробиозах с побледнением и исчезновением ганглиозных клеток и вакуольных изменениях их клеточных тел, возникающих при длительной агонии.
Первым этапом в обработке кусочков, вырезанных их различных органов и тканей для микроскопического исследования, является фиксация. Она имеет целью закрепление тканевых структур в том состоянии, в каком они находились в момент погружения кусочков в фиксирующую жидкость, и предохранение их от дальнейшего разрушения. Нужно остановить происходящие в ткани посмертные процессы (прежде всего ферментативные), сохранив при этом ее прижизненное строение. Извлеченные из организма ткани очень быстро подвергаются аутолизу. Необходимо остановить эти процессы, коагулировать белки и инактивировать ферменты. Для этого используется фиксация материала, а растворы, употребляемые с этой целью, называются фиксаторы.
При работе с фиксирующими жидкостями необходимо соблюдать некоторые правила. Общие правила фиксации:
— фиксацию проводят при комнатной температуре (18-20ОС).
— недопустимо обмывание кусочков водой перед погружением их в фиксирующую среду.
— если фиксирующая жидкость после погружения кусочков мутнеет или изменяет свой цвет (окрашивает кровью), то её немедленно меняют.
— объем фиксирующей жидкости должен не менее чем в 20 раз превышать объем фиксируемых кусочков ткани.
— фиксатор должен со всех сторон прилегать к кусочку ткани, поэтому на дно сосуда кладут вату или фильтровальную бумагу или кусочек ткани подвешивают на нитке.
— продолжительность фиксации зависит от свойств фиксатора, от скорости его проникновения в ткани.
— материал, взятый из трупа или иссеченный на операции, подлежит немедленному помещению в заранее приготовленную фиксирующую жидкость, так как промедление с фиксацией может отразиться на результатах микроскопического исследования.
Фиксаторы могут быть простыми (формальдегид, этиловый спирт, метанол) и сложные (жидкость Мюллера, жидкость Ценкера, жидкость Буэна, жидкость Карнуа).
Химические фиксаторы либо способствуют образованию в белках поперечных связей, либо вызывают денатурацию и осаждение белков, замещая связанную с ними воду. В результате ткани уплотняются и становятся тверже. Кроме того, большинство фиксаторов инактивирует содержащиеся в клетке ферменты. Большинство фиксаторов обладает также хорошими антисептическими свойствами, убивая бактерий и другие болезнетворные агенты, иногда содержащиеся в тканях и могущие представлять опасность для здоровья исследующих их людей.
Все фиксирующие средства делятся на простые и сложные в зависимости от того, входит ли в их состав одно какое-нибудь веществ или несколько.
Простые фиксирующие вещества
Формалин (формол) наиболее распространенная и универсальная жидкость с характерным резким запахом. Обычный продажный формалин представляет собой 40% водный раствор формальдегида.
Формалин – хорошее фиксирующее средство и незаменим в повседневной работе патологоанатомических отделений. Его применяют не только для простой гистологической работы (имеются в виду общие краски), но и при многих специальных методах исследования.
Благодаря своей универсальной фиксации в формалине может проводиться параллельная фиксация (имея в виду специальные задачи, применение одновременно с формалином других фиксирующих жидкостей).
Формалин хорошо проникает в ткани и потому может применяться для фиксации довольно крупных объектов. Кусочки органов толщиной 0,5-1 см. фиксируются в 10% растворе формалина в течение 24-48 часов. Критерием достаточной фиксации служит равномерное уплотнение объекта и одинаковый вид его как с поверхности, так и на контрольном разрезе. В кусочках, не полностью зафиксированных на контрольных разрезах можно видеть красные или розовые фокусы. Некоторые ткани после формалиновой фиксации принимают бурый цвет, что зависит от перехода оксигемоглобина в метгемоглобин.
Объекты после фиксации в формалине подвергают дальнейшей обработке для заливки в парафин.
Фиксированный в формалине материал перед той или иной обработкой желательно промывать в проточной воде (от нескольких часов до суток). Такое промывание ведет к удалению формалина и обеспечивает в дальнейшем более равномерную окраску срезов.
Большим достоинством формалина является возможность сохранять в нем кусочки довольно долгое время и после окончания фиксации. Необходимо заметить, что при длительных сроках хранения (месяцами) кусочков в растворах формалина образуются большие осадки, которые на срезах симулируют пигментные отложения и этим затрудняют микроскопическое исследование. Иногда такие осадки появляются очень скоро, например, при фиксации объектов с большим кровенаполнением или при фиксации в небольшом количестве жидкости. Впрочем, эти осадки сравнительно легко удаляются.
Наблюдаются явления полимеризации и выпадение осадков при хранении чистого (неразведенного) формалина в холодном помещении и на свету, поэтому рекомендуется хранить его в теплом помещении и в темноте.
Работая с растворами формалина нужно соблюдать осторожность, т. к. пары формалина вызывают раздражение слизистых оболочек глаз, носа, гортани и трахеи.
Для фиксации тканей и органов применяют как абсолютный, так и 96° этиловый спирт. По сравнению с формалином спирт обладает меньшей проникающей способностью, и поэтому кусочки для фиксации берут не толще 0,3-0,5 см.
Работая со спиртом как с фиксатором, далеко не всегда можно пользоваться им столь широко, как это рекомендуется с другими фиксирующими жидкостями. Спирт употребляется как фиксирующее средство редко (когда нет формалина) и притом только для плотных и тканей.
Положительной стороной фиксации в спирте является то, что помимо фиксации, он приводит одновременно к обезвоживанию объектов, чем значительно сокращается вся процедура по заливке кусочков в парафин.
Приготовление абсолютного спирта.
Для фиксации и обезвоживания применяется абсолютный спирт, однако его не всегда легко приобрести. В таком случае его приходится готовить в лабораторных условиях, пользуясь при этом прокаленным (безводным) медным купоросом (см. ниже).
Для приготовления абсолютного спирта прокаленный белый купорос насыпают в большую широкогорлую банку и заливают 96°-м спиртом из такого расчета, чтобы столб спирта над купоросом превышал толщину слоя последнего не больше чем в 4-5 раз. Содержимое банки ежедневно взбалтывают в течение 4-5 дней, добиваясь посинения всей толщины оседающего купороса. После этого в банку подсыпают еще порцию белого купороса, но уже в меньшем количестве, примерно в 2-3 раза, и оставляют на 1-2 дня. Подсыпания купороса повторяют до тех пор, пока последняя порция его не перестанет синеть; тогда абсолютный спирт считается готовым. Такой абсолютный спирт храниться постоянно на медном купоросе и используется по мере надобности для различных целей.
Приготовление безводного купороса.
Берут химически чистый синий купорос (если он крупнокристаллический, то его предварительно толкут в фарфоровой ступке) и прокаливают в фарфоровой чашке. В результате прокаливания происходит удаление кристаллизационной воды из молекулы медного купороса и получается безводный купорос белого цвета. При соприкосновении с водой он вновь жадно поглощает воду и дает первоначальное соединение синего цвета, на чем и основано его применение для обезвоживания спирта.
Прокаливание ведут с соблюдением известных предосторожностей, а именно: мелко размельченный купорос небольшими порциями прокаливают на малом огне через асбестовую сетку в фарфоровой чашке (или медной посуде, при постоянном помешивании фарфоровой или стеклянной лопаткой). Нельзя пользоваться металлическим шпателем и вести прокаливание в железной или никелированной посуде. Несоблюдение указанных правил может привести к пережиганию, точнее к разложению медного купороса с образованием окислов меди. Последнее обстоятельство весьма неблагоприятно сказывается на способности купороса поглощать воду.
При прокаливании медный купорос начинает отдавать кристаллизационную воду уже при температуре 600°, а при 1000° частично разлагается и становиться серым.
Прокаленный купорос хранят в банке с притертой крышкой.
Ацетон – жидкость с характерным запахом, смешивается с водой, хлороформом, ксилолом, им пользуются. В качестве быстрого фиксирующего средства в тех случаях, когда необходимо срочное исследование. Однако следует иметь в виду, что ацетон сильно сморщивает ткани, затрудняя этим микроскопическое исследование. Для фиксации берут маленькие кусочки. Фиксация кусочков толщиной 2-3 мм. Требует примерно около 2-3 часов. Фиксируют в двух порциях. Заливают в парафин. Лучшие результаты дает ацетон в комбинации с другими фиксирующими средствами. Пригоден только бесцветный и безводный ацетон, хорошо смешивающийся с водой.
Негоден желтый технический ацетон, который при смешивании с водой дает мутную смесь.
Сложные фиксирующие жидкости
Из числа сложных фиксирующих жидкостей наибольшее практическое значение в работе патологоанатомического отделения имеет жидкость Карнуа.
Состав жидкости: спирт абсолютный – 60 мл, хлороформ – 30 мл, уксусная ледяная кислота – 10 мл.
Очень хороший фиксатор. Имеет особые показания в тех случаях, когда надо спешить с исследованием. Кусочки, толщиной от 2 до 4 мм, фиксируют в ней от 2 до 3-4 часов. Нельзя задерживать объекты в этой жидкости больше, чем это необходимо для их полной фиксации, затем их переносят в 960 спирт и заливают.
Цель промывки – удаление фиксатора или его осадков. В зависимости от использованного фиксатора применяют или проточную воду или спирт. Водопроводной водой промывают в течение 24-48 часов. Воду из крана пускают тонкой струйкой в емкость, в которой находятся кусочки материала.
Если материал подлежит заливке в парафин, то следующим после фиксации моментом в его обработке является обезвоживание в спиртах восходящей концентрации.
Обезвоживание в спиртах имеет целью подготовить ткани к пропитыванию парафином.
Для пропитывания парафином такое обезвоживание носит лишь подготовительный характер. Это обстоятельство объясняется тем, что парафин не растворяется в спирте и обезвоженные спиртом кусочки требуют ещё дополнительной обработки, а именно: помещение в такую среду, которая с одной стороны, обладает способностью смешиваться со спиртом, а с другой – является хорошим растворителем парафина. К подобного рода средам относятся: хлороформ, ксилол, толуол, бензол.
Спирт как обезвоживающее средство наиболее удобен и потому больше всего распространен, но он не единственный в этом роде. Можно указать, например, на ацетон, который обладает способностью смешиваться с водой, хлороформом, ксилолом. Фиксированные кусочки могут быть сразу проведены через ацетон и залиты в парафин. Однако рекомендовать такую обработку объектов в повседневной работе нельзя, т. к. ацетон очень сильно деформирует ткани. В своей работе к ацетоновой методике прибегают для обезвоживания женских соскобов.
Помимо подготовки объектов к той или иной заливке, обезвоживание в спиртах сопровождается ещё и уплотнением тканей.
Классически вся процедура обезвоживания материала состоит в проведении его через целый ряд спиртов. Проводка кусочков через спирты совершается в широкогорлых банках емкостью мл с простыми или притертыми пробками. При перекладывании кусочков из одного спирта в другой их осторожно подсушивают между двумя листами фильтровальной бумаги или салфеткой. Такое подсушивание имеет целью экономное расходование спиртов и увеличение срока их обезвоживающей способности.
В банку №1 кусочки поступают после фиксации, а в последующие банки из предыдущих. Особенно тщательно надо следить за состоянием спирта в первой банке и своевременно его менять. Спирт во второй и следующей банках может быть ещё некоторое время использован в качестве предыдущего, Т. е. II перемещаем на место I, II на место II, и т. д.
Вообще надо заметить, что мощность обезвоживающей системы в смысле способности пропустить через себя то или иное количество кусочков зависит во многом от тщательности и аккуратности в работе, Т. е. насколько тонко и аккуратно иссекают кусочки, как подсушивают их перед помещением в спирты, и, наконец, насколько обрабатываемые ткани богаты жирами и жироподобными веществами.
Совершенно негодным считается спирт, в котором образуется облако мути вокруг кусочков на дне банке.
Проба с водой служит хорошим контролем степени насыщенности рабочих спиртов жирами. Если при смешивании (в пробирке) небольшого количества бывшего в употреблении спирта с водой получается сильная муть, то такой спирт подлежит немедленной замене. Для повторного использования допустимы спирты, дающие с водой очень слабое помутнение. Что касается последнего спирта, в котором заканчивается обезвоживание кусочков, то здесь, конечно, надо стремиться к тому, чтобы спирт совершенно не давал никакой мути.
Кости и патологические обызвествленные ткани фиксируют по общим правилам. После фиксации такие ткани нельзя сразу заливать в обволакивающую среду. Они должны быть предварительно подвергнуты специальной обработке, имеющей целью удаление извести. Процесс извлечения извести из тканей называется декальцинацией.
Декальцинация всегда применяется после фиксации.
Для извлечения известковых солей из тканей предложены различные минеральные (азотная, соляная) и органические (муравьиная, трихлоруксусная, пикриновая и др.) кислоты.
При проведении декальцинации необходимо соблюдать следующие правила:
1. Декальцинации подвергают по возможности небольшие и тонкие куски костной ткани (толщиной до 0,5-1 см.), аккуратно выпиленные из фиксированных объектов. Небольшие кусочки декальцинируются скорее, а это, помимо экономии времени, дает возможность лучше сохранить способность тканей воспринимать окраску, которая ухудшается под влиянием кислоты и тем больше, чем длительнее была обработка кислотой.
2. Объем декальцинирующей жидкости в 25-50 раз должен превосходить объем всех вместе взятых декальцинируемых кусочков.
3. Декальцинируемые объекты должны со всех сторон омываться раствором кислоты, для чего их подвешивают на нитке, закрепляя пробкой и, если кусочков много, завязывают в марлю.
4. Декальцинирующую жидкость меняют каждые 48 часов, и проверяют препаровальной иглой степень декальцинации объектов. Декальцинация идет тем скорее, чем чаще меняется жидкость. Когда кусочек становиться эластичным и мягким и игла легко проходит сквозь ткань, обработка считается законченной.
5. Материал тщательно промывают в проточной воде и подвергают дальнейшей обработке как и другой исследуемый материал.
Для декальцинации можно использовать смесь следующего состава: 50 мл муравьиной кислоты, 40 мл соляной кислоты, 410 мл Н20.
Это объясняется тем, что в чистом виде соляная кислота почти совсем не употребляется, т. к. она резко деформирует клеточные структуры и сильно ослабляет способность тканей воспринимать краску. Достоинством муравьиной кислоты является слабое влияние на окрашиваемость тканей, но применение её в значительной мере ограничено её относительно высокой стоимостью.
Декальцинация обычно ведется при комнатной температуре (около 18-220) и всегда в вытяжном шкафу, в котором следует сохранять и неразведенные кислоты.
Фиксированные кусочки после обезвоживания в спиртах (или декальцинации) переносят вначале в смесь спирта пополам с хлороформом и затем в чистый хлороформ при t = 370С.
Хлороформ хорошо смешивается со спиртами и в тоже время растворяет парафин, поэтому он и необходим как промежуточная среда между обезвоживанием и собственно заключением. Объекты, обработанные хлороформом, в дальнейшем легко пропитываются парафином.
Хлороформ, как и спирты, время от времени меняют во избежание излишнего насыщения его спиртом и жирами.
Для постепенного и лучшего пропитывания парафином кусочки из хлороформа переносят в расплавленную смесь хлороформа с парафином и оставляют в ней при t = 370С в термостате на 1 час. Смесь хлороформа с парафином готовят из равных объемных частей одного и другого, для чего парафин предварительно растапливают.
Из смеси хлороформа с парафином кусочки перекладывают в расплавленный парафин, который должен быть заранее приготовлен и стоять в термостате, установленным на 2-30 выше точки плавления парафина (примерно 54-550) во избежание излишнего охлаждения парафина при открывании дверцы термостата и перекладывании кусочков. Пропитывание в парафине идет в двух порциях, обозначаемых как первая и вторая. Кусочки вначале помещают в первую емкость на 1 час, затем перекладывают во вторую тоже на 1 час.
Работа в двух порциях парафина вызвана необходимостью как можно полнее освободить объект от хлороформа, примесь которого изменяет пластичность парафина, делая его крошкообразным. Хлороформ остается в первой порции парафина. Первый парафин можно использовать в течение длительного времени, при этом его лучше держать в расплавленном виде (в термостате).
После того, как кусочки пробыли во втором парафине достаточное время, берут специальные коробочки «кораблики» и перекладывают кусочки материала по одному на дно и заливают чистым запасным парафином, который специально держат в термостате в расплавленном состоянии. Оставляют при комнатной температуре.
Когда парафин достаточно затвердеет, его извлекают из формочки. Извлеченный парафин благодаря охлаждению должен быть совершенно однородным (гомогенным). Если в нем обнаруживаются беловатые участки (крошковатые на изломе), то это свидетельствует о наличии в нем остатков промежуточной среды. В таком случае кусочки необходимо залить в новую порцию парафина.
3.7 Нарезка препаратов
Если заливка произведена правильно и качественно, парафиновые блоки готовят для приготовления тонких срезов, необходимых для исследования под микроскопом, достигается это резкой кусочков на особых приборах, называемых микротомами (Рис. 1.). Подобные приборы обеспечивают получение срезов нужной толщины.
Микротом – это специальное механическое устройство, предназначенное для приготовления гистологических срезов определенной толщины.
Основные части микротома: станина, механизм микроподачи, механизм подъема, зажим для блоков (объектодержатель), ножевые салазки с ножедержателем.
Станина – массивная, чугунная основа, на которой монтируются все остальные узлы. В верхней части имеется паз для перемещения ножевых салазок, несущих ножедержатель. На боковой поверхности расположены наклонные направляющие для перемещения салазок с механизмом подъема.
Механизм подъема состоит из трехгранной призмы, вставленной в специальную оправу, снабженную винтом для подъема призмы и рукояткой для её закрепления в нужном положении. Оправа в свою очередь прочно прикреплена к салазкам, несущим механизм подъема.
Зажим для блоков (рамочный) состоит из внутренней (предназначенной для укрепления блока) и наружной рамок. Система рукояток и винтов позволяет изменять положение рамок в продольном и поперечном направлениях. От основания зажима отходит штифт, при помощи которого зажим для блоков вставляют в специальное гнездо, имеющееся в трехгранной призме. Фиксирование на нужном уровне производят специальной рукояткой.
Ножевые салазки – массивные устойчивые салазки, снабженные ручкой для передвижения и несущие на себе ножедержатель, которые укрепляют на салазках специальной рукояткой, позволяющей менять горизонтальный угол расположения ножа. Сам же зажим снабжен подвижной цилиндрической втулкой, перемещение которой с помощью рычажка меняет угол наклона ножа.
Механизм микроподачи – наиболее сложный узел микротома. Он состоит из стержня, соединенного жестко с тягой (несущей на своем конце собачку), храповика и микровинта.
Автоматическая микроподача блока осуществляется следующим образом:
при каждом обратном (холостом) ходе ножа ножевые салазки толкают стержень микроподачи и перемещают его. Это в свою очередь вызывает перемещение тяги, которая с помощью собачки поворачивает храповик. Вращение его через конические шестеренки передается микровинту, который через разъемную гайку перемещает по наклонным направляющим снизу вверх салазки с зажимом для блока.
Система тяга – стержень каждый раз с помощью специальных пружин возвращается в исходное положение. Следовательно, чем больше стержень микроподачи выдвинут навстречу ножевым салазкам, тем большим окажется его шаг (а соответственно, и поворот храповика), тем выше переместится блок и тем толще будет срез. Благодаря тому, что стержень имеет микрометрическую шкалу и специальный зажим, позволяющий менять его положение, можно точно регулировать степень подачи блока.
Так как с каждым срезом блок поднимается все выше, то периодически нужно отсоединять микровинт от разъемной гайки и опускать салазки с механизмом подачи в крайнее нижнее положение.
Уход за микротомом
Хорошее состояние скользящих поверхностей, их чистота и гладкость является основным условием для точной работы микротома, а, следовательно, и получения срезов одинаковой, заданной толщины. Поэтому уходу за ними необходимо уделять главное внимание.
Салазки и направляющие дорожки должны тщательно охраняться от запыления и загрязнения. Для этого, когда микротом не работает, его закрывают специальным футляром или чехлом. Скользящие поверхности должны быть постоянно смазаны тонким слоем нейтрального костного или вазелинового масла, что не только обеспечивает легкость скольжения, но и предупреждает появление ржавчины. Периодически (для удаления загрязненной смазки) скользящие поверхности микротома необходимо протирать тряпочкой, смоченной бензином или толуолом, после чего сразу смазать их.
Помимо чистки и смазки скользящих поверхностей, необходимо проверять правильность затяжки винтов, которыми укреплены направляющие пластины и другие части прибора.
Следует избегать частого перемещения микротома с одного места на другое, так как при этом может быть нарушена точность прибора.
Резку исследуемого объекта на микротоме производят с помощью специальных микротомных ножей.
Следует помнить, что получить хороший тонкий срез можно только при наличии правильно заточенного, очень острого микротомного ножа.
Правила резания на микротоме
Предпосылкой для получения хороших гистологических срезов служит правильный выбор угла наклона ножа и угла резания.
Резание на микротоме
Для того чтобы срез можно было исследовать в микроскоп, необходимо, чтобы структурные компоненты составляющих его тканей были хорошо различимы в проходящем свете и чтобы срез был защищен от возможного загрязнения и повреждения. Поэтому дальнейшая обработка среза предусматривает его окрашивание, просветление и заключение.
Блок подвергают обрезке, удаляя свободный чистый парафин (т. е. расположенный вне ткани). С боковых сторон блока оставляют лишь в виде площадки с материалом. Если не произвести такого удаления парафина, то срезы будут не гладкими, а морщинистыми (выпуклыми) в середине по той причине, что чистый парафин, остающийся с боков, сокращается во время резки в большей степени по сравнению с парафином, пропитывающим ткань.
Неприятный момент сморщивания срезов можно уменьшить, подвергая блок охлаждению (лед), Т. е. сообщая ему большую твердость.
Подготавливая парафиновый блок к резке при необходимости получения лент надо стремиться придавать ему правильную прямоугольную форму. Парафиновый блок прочно закрепляют в зажиме микротома, расположив параллельно длиннику микротома. Затем, установив необходимый угол резания и правильный угол наклона ножа, его прочно закрепляют винтами зажимами и располагают под блоком. При строго поперечном положение ножа очень плотный объект заставляет вибрировать его, что сопровождается характерным скрипом и образованием поперечных полос на поверхности блока.
После этого, регулируя винтами механизм подачи, блок устанавливают таким образом, чтобы верхняя его плоскость находилась до лезвия ножа на 0,5-1 мм. Когда предварительная подгонка блока к ножу закончена, устанавливают микрометрическую шкалу на получение толстых (25-30 мкм) срезов и движением ножевых салазок начинают подавать блок вверх до получения с него первых полных срезов. Затем производят моделирование блока: срезают скальпелем избыточный парафин, оставляя вокруг залитого объекта слой не более 2-3 мм, и придают блоку прямоугольную форму. После этого устанавливают микрометрическую шкалу на нужную толщину среза и приступают к окончательной резке материала.
Следует помнить, что перемещение ножевых салазок вдоль рельсового пути нужно производить плавно, без излишних усилий. Нельзя надавливать на рукоятку сверху, так как это проводит к вытеснению слоя масла, находящегося между скользящими поверхностями, и опусканию ножа, вследствие чего срезы получаются неравномерными. Движение микротомным ножом в момент прохождения над блоком надо производить быстро.
Так как парафин сильно тупит ножи, то для резки парафиновых блоков лучше применять ножи твердой закалки, с толстым клином.
Толщина парафиновых срезов колеблется от 3-5 до 15 мкм и зависит как от качества заливки материала, так и от ножа.
Нужно следить, чтобы срез не был прижат к ножу, так как при этом, происходит его приклеивание и повреждение. Готовый срез осторожно снимают с ножа влажной кисточкой (в направлении от спинки к лезвию) и переносят в чашку с теплой (350-400С) водой. Помещают срезы на воду обязательно поверхностью, прилежащей к ножу, определить которую можно по характерному блеску (верхняя сторона всегда матовая).
При резке надо следить, чтобы волоски от кисточки не попадали под режущий край ножа, так как это приводит к повреждению лезвия.
Для наклеивания расправленные срезы вылавливают из воды на заранее подготовленное предметное стекло; для этого стекло одним концом опускают в чашку с водой, проводят под срез и подхватывают его, удерживая препаровальной иглой на средней части стекла. Остатки воды вокруг среза тщательно удаляют тряпочкой и проглаживают пальцем через 2-3 слоя сухой и теплой тряпочкой.
Так как парафиновые срезы при наклейке вбирают воду, то во избежание недоразумений при дальнейшей обработке (т. е. окраске) необходимо их тщательно просушить, только после этого приступить к окраске.
Недостаточно высушенные срезы легко отклеиваются во время окраски, а главное, плохо освобождаются от парафина при обработке ксилолом. Критерием хорошо высушенных срезов являются приобретением ими большей прозрачности по сравнению с беловатыми плохо просушенными срезами.
Если приходится торопиться с окраской, то рекомендуется свежеприклеенные и немного подсохшие (в термостате или на воздухе) срезы слегка подогреветь на платформе электроплиты, осторожно доводя парафин до признаков начального оплавления, но не полного расплавления. Такая обработка способствует более прочной фиксации срезов на предметном стекле.
Для того чтобы срезы прочно пристали к предметному стеклу и не отклеились во время окраски, стекла специально обрабатывают с целью обезжиривания. Для этого их основательно моют в горячей мыльной воде или длительно кипятят в 2-3 % содовом растворе, затем хорошо ополаскивают в чистой горячей воде и промывают (несколько часов) в проточной.
Обработанные и промытые в воде предметные стекла протирают льняной тряпкой, держа стекла за края; и хранят в 960 спирте или в смеси спирта эфиром, откуда их по мере надобности вынимают пинцетом и высушивают. На хорошо обезжиренном предметном стекле вода должна растекаться тонким слоем, а не собираться в капли.
Хорошие предметные стекла должны быть из белого стекла и иметь совершенно ровную поверхность, толщина их не должна превышать 1,2 мм.
Перед самой наклейкой срезов высушенные стекла покрывают тонким слоем смеси белка с глицерином.
Приготовление белка с глицерином. Берут свежий яичный белок (без примеси желтка), взбивают вилкой или шпателем до состояния пены и выливают на большой широкопористый фильтр, предварительно смоченный дистиллированной водой. Фильтрация продолжается около 24 часов. К профильтрованному белку прибавляют равный объем глицерина, размешивают и добавляют кусочек тимола для предупреждения загнивания.
Приготовление предметного стекла с белком. На сухое предметное стекло стеклянной палочкой наносят маленькую капельку смеси белка с глицерином и пальцем тщательно размазывают тонким слоем. Руки должны быть предварительно вымыты, а палец, которым производят размазывание смеси, обработан спиртом. Нанесенный на стекло слой белка с глицерином свертывают при небольшом нагревании (50-600) для чего стекло проводят 2-3 раза над горячей электроплиткой. После такой обработки предметное стекло считается готовым и на него можно наклеивать срезы.
Возможные погрешности при изготовлении парафиновых срезов
Для того чтобы получить хорошие гистологические срезы, необходимо уметь своевременно распознать и устранить причину, ухудшающую качество срезов.
2) низкая температура окружающей среды
3) медленное охлаждение парафина при заливке
4) большой угол наклона ножа
1) залить материал в более мягкий парафин после предварительного растапливания блока в термостате
2) дышать на поверхность блока (согревание) перед каждым движением ножа или приспособить эл. плиту рядом с микротомом
3) изменить угол наклона ножа.
б) Залитый материал в процессе резки выпадает из окружающей массы парафина.
1) при переносе кусочка в формочку для заливки произошло его охлаждение.
1) необходимо блок растопить в термостате и залить заново, строго соблюдая правила заливки, после предварительного растапливания материал переносят в промежуточные срезы (для удаления спирта), затем вновь пропитывают и заливают
2) заливка произведена охлажденным парафином
3) недостаточное удаление спирта перед пропитыванием.
1) переутомление материала при проводке и фиксации.
Невозможно. Можно лишь несколько размягчить материал, если на поверхность резания перед каждым движением ножа наносить слой горячего парафина кисточкой (дав ему затем остыть) или дышать на поверхность блока.
г) Срезы закручиваются, прилипают к поверхности ножа, мнутся.
1) малый угол наклона ножа
3) высокая температура окружающей среды.
1) изменить угол наклона
2) залить материал в более твердый парафин и охладить блок путем помещения перед резкой в холодильник (можно также положить на поверхность резание кусочек льда)
3) приклеивание, сморщивание или разрыв срезов, особенно при резке органов, богатых костной, хрящевой или плотной соединительной ткани, могут быть следствием их электризации.
помещать на лезвие (в месте прохождения среза) каплю воды, дышать на лезвие и блок, натирать участок лезвия и прилежащую часть ножа куском твердого парафина.
е) Срезы разрываются или покрыты бороздами.
1) зазубрины на лезвии ножа
2) грязный парафин (плотные соринки царапают срез и портят лезвие);
3) материал плохо декальцинирован.
1) точка и правка ножа или перемещение в ножедержателе
2) перезаливка в чистый парафин
3) устранить нельзя.
ж) Плоскость среза не однородна (беловатая в средней части).
Расплавление блока и проведение материала через промежуточные срезы до абсолютного спирта. После обезвоживания проводят через промежуточную среду, пропитывают и заливают.
Приготовление серий парафиновых срезов
При серийном исследовании материала, залитого в парафин, удобнее всего пользоваться лентами из срезов. Однако добиваться получения таких лент всегда легко. Для достижения хороших результатов необходимо соблюдать следующие основные условия:
1. Парафин должен быть хорошего качества с температурой плавления 48-520С, достаточно пластичным, а заключение материала в него безукоризненным. Невозможно получение лент при слишком плотных и больших объектах.
3. Парафиновому блоку придают строго прямоугольную форму, длинник его устанавливают параллельно длиннику микротома. Одновременно следят за тем, чтобы узкая сторона блока, обращенная к лезвию ножа, была тоже параллельна последнему. Режущий край ножа, будучи подведен к блоку, должен прилегать ко всей его стороне.
4. Желательная толщина срезов 7-8 мкм. Слишком тонкие и толстые срезы малопригодны. Резку ведут толчкообразным движениями ножа.
5. В лабораторном помещении желательна температура около 18-220С. При более низкой температуре необходимо поставить около микротома (вблизи блока) включенную электроплиту. Наоборот, при слишком высокой температуре парафин становится мягким, срезы легко мнутся, в таком случае блок охлаждают льдом.
6. В процессе резания срезы накапливаются на верхней поверхности ножа, по мере накопления их отодвигают по ножу кверху, свешивая если нужно. По получении лент нужной длины их осторожно снимают, пользуясь препаровальной иглой, и кисточкой и опускают в воду. Затем срезы забирают и наклеивают на стекла.
7. Надписи на предметных стеклах делают ручкой с пером черной тушью.
Перед тем как приступить к окрашиванию срезов, их, как правило, подвергают специальной предварительной обработке. Парафиновые срезы требуют наиболее сложной подготовки. Так как парафин не обладает достаточной прозрачностью и затрудняет процесс окрашивания (гистологические красители – это водные или спиртовые растворы, плохо проникающие в парафинированные ткани), его необходимо удалить из среза. Для этого срез подвергают депарафинированию – процессу, обратному тому, который осуществляют при подготовке объекта к заливке парафин, Т. е. срезы последовательно проводят через растворитель парафина, спирты нисходящей концентрации и помещают в воду. Практически это осуществляют так: этикетируют высокие стаканчики, наливают в них соответствующие растворы и устанавливают в определенной последовательности, обеспечивающей проведение манипуляций по следующей схеме:
Ксилол (толуол, бензол) две смены по 2-4 мин.
Вода дистиллированная 2 мин. и больше.
3.8 Правила окрашивания препаратов
Краски и их приготовление
Все употребляемые в гистологии краски по сродству их к тем или иным тканевым элементам делятся на ядерные (основные) и диффузные (кислые). Каждая группа насчитывает значительное количество красящих средств. В условиях работы патологогистологического отделения нет надобности во всей массе имеющихся красок. Для подавляющей части диагностических исследований достаточны такие простые способы окраски, как гематоксилин-эозин и по Ван-Гизону, и несколько специальных методов (фосфорно-вольфрамовый гематоксилин, судан-III, конго-рот и т. д).
Основные, или ядерные краски. В этой группе наибольшее значение имеют красители, приготовленные из гематоксилина.
Гематоксилин является экстрактом кампешевого дерева, имеет вид бурого кристаллического порошка, хорошо растворимого в спирте и плохо в воде. Существует много способов приготовления гематоксилина, но суть их одна – его окисление.
Красящим веществом является не сам гематоксилин, а продукт его окисления – гематеин (C16H1406). В связи с этим часть гематоксилиновых красок пригодно для работы не сразу после приготовления, а только по истечении некоторого времени, в течение которого происходит окисление гематоксилина в гетеин, что обозначается как «созревание краски». По мере созревания краски возрастает её красящая способность. Созревания требуют только те гематоксилиновые краски, которые готовят без окислителей.
Из квасцовых гематоксилинов, приготовляемых с окислителями и потому сразу окрашивающих, используется гематоксилин Караци и железный гематоксилин Вейгерта.
Гематоксилин Караци имеет следующий состав:
Вода дистиллированная – 400мл
Квасцы алюмо-калиевые – 25 г
Гематоксилин кристаллический – 0,5 г
Йодноватокислый калий – 0,03 г
Смесь готовят при комнатной температуре. Вначале она представляет собой светло-фиолетовую прозрачную жидкость, которая через несколько часов становится темно-вишневой и непрозрачной; с этого момента она начинает окрашивать срезы, необходимое время окрашивания – 20-40 минут. В последующие дни красящая способность нарастает спустя 1-2 недели хорошие результаты будут уже через 10-15 минут. В дальнейшем, по мере созревания, краситель может и перекрашивать.
Красящий раствор обладает большой устойчивостью, сохраняется около 10 лет; в первые недели после приготовления можно не фильтровать. Для предупреждения плесени в краску добавляют несколько кристалликов тимола.
Железный гематоксилин Вейгерта (Ван-Гизон) приготавливают из двух основных растворов (Вейгерт 1 и Вейгерт 2) только по мере надобности.
Раствор Вейгерт 1 представляет собой 1 % раствор гематоксилина в 960 спирте (на 100 мл 1 г).
Раствор Вейгерт 2 имеет следующий состав: 4 мл крепкой хлористоводородной кислоты и добавляют 95 мл дистиллированной воды.
Этот раствор желательно готовить на срок не более 3-4 месяцев.
Перед употреблением смешивают точно поровну оба раствора в маленьком градуированном цилиндре; получается густая темно-фиолетовая смесь. Свежеприготовленная смесь обладает высокой красящей способностью, интенсивно окрашивает срезы в течение 3-5 минут. Правильно приготовленный раствор железного гематоксилина должен отличаться известной стойкостью и не изменять цвета около 40-60 минут. В последующие часы такая краска становиться тёмно-вишнёвой с коричневым оттенком, а со 2-3-го дня постепенно буреет, сохраняя этот цвет несколько недель. Лучше всего пользоваться смесью сразу после приготовления, однако если она была хорошо приготовлена, то, несмотря на бурение, её с большим успехом можно использовать повторно, не прибегая к фильтрованию еще 1-2 недели.
Краска, в которой появился хлопьевидный осадок, негодная для повторного употребления.
Если свежеприготовленная краска начинает буреть и приобретать зеленоватый оттенок сразу или вскоре после приготовления (в течение 5-10-20 минут), то она считается негодной, ибо приводит в дальнейшем и бурой и зеленоватой окраске ядер, в то время как нормально они должны быть черными. Такое преждевременное побурение и позеленение краски обычно связано с преобладанием в смеси второго раствора (Вейгерт 2).
Следует помнить, что при смешивании по каплям таких растворов, как Вейгерт 1 и 2, для получения равных объемных отношений необходимо брать первого раствора в 2 раза больше капель, чем второго. Например, на 2 капли второго – нужно взять 5 капель первого раствора. Это объясняется разницей поверхностных натяжений этих растворов (один – спиртовой, другой – водный), в силу чего капли их неодинаковы по объему. Понятно, что пипетки для них должны быть одинаковыми. Можно пользоваться и одной пипеткой, но тогда, перед тем как набирать краску, пипетку каждый раз надо тщательно промывать в дистиллированной воде.
Все гематоксилиновые красители окрашивают ядра в темно-синий (квацевые) или черный (железный гематоксилин) цвет.
Кислые краски. Из диффузных красок постоянное применение имеют эозин, кислый фуксин и пикриновая кислота. Последние две краски употребляются в специальной смеси друг с другом, называемой пикрофуксином или смесью Ван-Гизона.
Эозин – синтетический краситель, тетерабрампроизводное флуоресцина.
Выделяется в виде натриевой, калиевой или аммониевой соли. Различают много сортов эозина, из них наибольшее распространение имеют: эозин желтый (растворимый вводе), голубоватый (растворимый в спирте), эритрозин (растворимый только в спирте). Употребляются эозины в 0,25-0,5% водных или спиртовых растворах. Для приготовления спиртовых растворов можно пользоваться любыми сортами эозина и брать спирт различной крепости (от 40° до 70°); они окрашивают сильнее водных. Иногда пользуются растворами эозина, подкисленными уксусной кислотой, примерно из расчета 1 капля крепкой уксусной кислоты на 100 л раствора эозина. Подкислять лучше спиртовые растворы эозина, так как водные (подкисленные) с течением времени могут мутнеть и давать осадки. Такие подкисленные растворы показаны в том случае, когда ткани плохо воспринимают обычный (неподкисленный) краситель.
Растворы эозина розового цвета, в такой же цвет они окрашивают и ткани. Сроки окрашивания весьма различны (от 5-10 секунд до 3-5 минут) и зависят от сорта, способа приготовления и процентного содержания красителя.
Пикрофуксин. Готовят из насыщенного при комнатной температуре водного раствора пикриновой кислоты и 1 % водного раствора кислого (не основного) фуксина (при комнатной температуре в 100 мл дистиллированной воды растворяется около 12 г пикриновой кислоты).
Оба раствора смешивают из расчета 10 мл пикриновой кислоты на 1 мл фуксина. Получается жидкость гранатового цвета. Особенностью этой смеси является то, что разные ткани она окрашивает различно и этим значительно облегчает их исследование. Каждая ткань воспринимает из этой смеси только одну составную часть краски и именно ту, которая обладает наибольшим сродством к ней. Так, соединительная ткань лучше всего воспринимает кислый фуксин и потому окрашивается в ярко-красный цвет. Мышечная ткань (поперечнополосатая и гладкая), эластические волокна окрашиваются пикриновой кислотой в желтый цвет и цитоплазма различных клеток. Данное обстоятельство имеет весьма важное дифференциально-диагностическое значение, и в этом большое преимущество пикрофуксина перед эозином, одинаково закрашивающим все ткани.
Пикрофуксин требует тщательного приготовления. Помимо точного соблюдения соотношений указанных компонентов, краску иногда приходится подгонять по контрольным препаратам, добавляя в неё то одну, то другую составную часть. Так, если преобладает фуксин, то доливают пикриновую кислоту и наоборот. Правильно приготовленная краска отличается тем, что её составные части дают на тканях, к которым они обладают небольшим сродством, лишь свой совершенно чистый тон и не забивают друг друга.
Все краски для гистологических работ готовят обязательно на дистиллированной воде.
В гистологической технике в зависимости от числа применяемых красящих средств различают следующие виды окрасок:
– простую (применяется одна краска),
– двойную (две краски)
– тройную, или сложную (три краски).
Во всех этих окрасках главная роль принадлежит ядерной (основной) краске, которая употребляется либо одна, либо в комбинации с кислыми (одной или несколькими).
Наиболее распространены комбинированные окраски, здесь возможны самые разнообразные сочетания. В патологогистологической практике широко применяются гематоксилин в комбинации с эозином (двойная) и гематоксилин с пикрофуксином (тройная). Последняя окраска известна под именем Ван-Гизона.
Окрашивание препаратов в обоих случаях идет по одной и той же схеме и состоит в последовательном применении сначала ядерной, а затем кислой краски с промыванием в воде после каждой из них.
Также существуют и другие типы окрашивания:
Прогрессивное окрашивание – способ, при котором срезы находятся в красителе до тех пор, пока не достигнут требуемого уровня окрашиваемости.
Регрессивное – срезы вначале перекрашивают, а затем доводят до требуемой окраски путем отмывания в соответствующей жидкости, что позволяет более отчетливо выделить отдельные элементы тканей.
Следует постоянно помнить:
а) о тщательном удалении отмывающей жидкости (в противном случае она будет продолжать действовать и исказит результат окраски);
б) о предпочтительном применении тонких срезов;
в) о том, что разведенные красители дают лучшие результаты, чем крепкие растворы (толстые срезы и высокая концентрация красителя затрудняют дифференцировку и приводят к неравномерной окраске срезов);
г) окраску нужно проводить под контролем микроскопа.
Прямое окрашивание – окрашивание объекта непосредственно в растворе красителя;
Непрямое (протравная) – срез окрашивают нужным красителем лишь после предварительной обработки специальными протравными красителями.
Все методы гистологического окрашивания можно разделить на две основные группы:
а) обзорные, используемые для получения общего ориентировочного представления об изучаемом объекте (окрашиваются преимущественно ядра и цитоплазма клеток);
б) специальные, которые позволяют окрашивать именно те тканевые и клеточные элементы, которые интересуют исследователя.
Для того чтобы получить хорошие результаты при любом методе окраски гистологических препаратов, необходимо соблюдать определенные правила:
1. Красящие растворы должны быть чистыми, поэтому любой краситель необходимо перед употреблением отфильтровать, а водный раствор готовить только на дистиллированной воде;
2. Отдавать предпочтение: а) окрашиванию красителями низкой концентрации в течение длительного времени перед кратковременной окраской красителями высокой концентрации;
б) применению регрессивных методов.
Тщательно выполнять все процедуры при подготовке среза к окраске и последующей его обработке.
При окраске водными красителями срезы переносят из дистиллированной воды, а при окраске спиртовыми – из спирта соответствующей концентрации, непосредственно в красящий раствор (прямое окрашивание) или сначала в жидкость для протравки (непрямое окрашивание). Когда препарат приобретает
нужную интенсивность окраски, его промывают в воде (или спирте) для удаления избытка красителя, а затем, если нужно, дифференцируют в соответствующей жидкости. Излишний краситель отмывают до тех пор, пока он не перестает переходить из среза в отмывающую жидкость.
Окрашивание срезов, наклеенных на стекло, проводят путем помещения их в красящий раствор. Для этого специальные кюветы, позволяющие красить одновременно большое количество стекол, проводят по схеме в высоких стаканчиках с краской.
Для того чтобы окрашенный препарат можно было исследовать в проходящем свете и дольше хранить, он должен быть прозрачным и защищен от высыхания, загрязнения и повреждения.
Все эти условия обеспечивают просветлением и заключением препарата в специальные срезы.
3.9 Просветление н заключение срезов
Просветление делает препараты прозрачными, проходимыми для лучей света и потому удобными для исследования. Различают две группы просветляющих веществ в зависимости от того, способны ли они просветлять срезы после извлечения их из воды или только после обезвоживания спиртом.
Первую группу веществ, т. е. просветляющих срезы после воды, составляет глицерин, глицерин-желатина и т. д. и ряд сложных специально приготовленных сред, как то: фаррактова жидкость, масса Апатии. Подобные просветляющие вещества обычно употребляют при некоторых специальных методах исследования, например на липиды, амилоиды. В этом случае окрашенный срез извлекают из воды на предметное стекло, расправляют, удаляют избыток воды вокруг среза тряпкой, кладут каплю глицерина или другое просветляющее вещество из этой группы и покрывают покровным стеклом. Можно применять этот метод и для различных ориентировочных исследований.
Ко второй группе веществ (просветляющих срезы после спирта) относятся ксилол, толуол, эфирные масла, карболксилол, карболтолуол и т. д.
Для просветления срезов чаще всего пользуются веществами второй категории, так как они обладают более высоким просветляющим эффектом и дают прочные препараты. По этой последней причине срезы после окрашивания подвергают спиртовой обработке, то более, то менее тщательной смотря по тому, с каким просветляющим средством приходится работать.
Так, например, ксилол и толуол весьма чувствительны к качеству обезвоживания срезов и поэтому здесь показано применение абсолютного спирта. Креозот, эфирные масла, карболксилол в этом отношении менее чувствительны, они легко просветляют и после 960 спирта. Все просветляющие вещества обладают теми или иными неблагоприятными свойствами, проявляющимися иногда при длительном хранении препаратов. Один из них вызывает пожелтение препаратов (креозот), другие сильно морщат срезы (ксилол, толуол, карболксилол) и, наконец, почти все они, за исключением ксилола и толуола, в той или иной степени извлекают различные синтетические (анилиновые) красители и поэтому имеют ограничения.
На основании вышеизложенного, делаем вывод, что большим достоинством ксилола и толуола является их абсолютно индифферентность к любым красителям.
В практической работе при простых окрасках (гематоксилин-эозин, по Ван-Гизону) и многих специальных методах исследования для целей просветления удобнее всего пользоваться комбинацией просветляющих средств, т. е. просветлять срез вначале веществом, не требующим абсолютного спирта (эфирное масло, креозот, карболксилол), а затем быстро в течение 1 минуты, обрабатывать ксилолом, применяя его повторно. В просветляющем веществе срез держат до тех пор, пока он не станет совсем прозрачным. На черном фоне стола непросветленные участки среза представляют в виде беловатых пятен. Эта операция занимает от 15-20 секунд до нескольких минут. Быстрота просветления препарата зависит от крепости употреблявшегося спирта и тщательности обработки им. При неудовлетворительной спиртовой обработке, а также для более скорого просветления показано повторное применение просветляющего вещества, которое в этом случае часто комбинируют с быстрым просушиванием среза втрое или вчетверо сложенной фильтровальной бумагой.
Просветленные и обработанные ксилолом срезы заключают в специальные срезы.
Применение пластических масс для заключения гистологических срезов позволяет отказаться от всех перечисленных выше веществ и от покровных стекол, т. к. пластмасса пропитывает срез и одновременно покрывает его тонким слоем сверху, заменяя тем самым покровное стекло.
Дибутилсебацинат представляет собой бесцветную маслянистую жидкость, которая при обычной температуре практически не испаряется и придает эластичность и гибкость полистироловой пленке и очень долгое время. В готовый раствор полистирола следует добавить пластификатор в таком количестве, чтобы раствор последнего в полистироле был равен 6% (т. е. на 100 мл раствора полистирола добавляется 6 мл пластификатора). Скорость образования пленки при добавлении пластификатора почти не изменяется (она образуется через 40-60 минут), однако пленка получается эластичной, не трескается, не ломается и плотно прилегает к предметному стеклу.
Методика заключения срезов в полистирол: рез, извлеченный на предметное стекло из карболксилола, покрывается несколькими каплями раствора полистирола. Наносить раствор можно стеклянной палочкой из маленькой бутылочки, куда предварительно наливается небольшое количество полистирола из основного запаса раствора и равномерно распределяется по стеклу. Пока не образовалась прочная сухая пленка, срез следует предохранять от попадания пыли.
После данных процедур препарата можно исследовать под световым микроскопом. Помещенные под стекло срезы для светового микроскопа могут долго хранится и многократно использовать.
Гистологическое исследование аутопсийного, биопсийного материала, а также органов тканей, удаленных при хирургических операциях ставит перед собой цель определения характера патологического процесса. Значение этого метода исследования трудно переоценить, так как он позволяет уточнить диагноз, определить морфологические особенности патологического процесса. На основании полученных данных врач имеет возможность избрать наиболее правильную тактику лечения больного. Особенно важное значение имеет биопсия при определении опухолей, когда малейшая невнимательность и неточность могут послужить причиной роковой ошибки. При работе с биопсийным материалом от лаборанта-гистолога требуется предельная собранность и четкость.
Примерный перечень манипуляций в области гистологии
1. Знать правила приема и регистрации материала в патологоанатомическом отделении.
2. Уметь готовить рабочее место для проведеения лабораторных гистологических исследований.
3. Знать технику микроскопирования гистологических препаратов.
5. Знать технику безопасности при работе с электроприборами.
6. Знать приемы безопасности взятия материала для гистологического исследования.
7. Уметь готовить фиксирующие жидкости.
8. Уметь фиксировать гистологический материал.
9. Уметь готовить спиртовую батарею.
10. Уметь обезвоживать гистологический материал.
11. Уметь заливать гистологический материал.
12. Знать устройство микротома.
13. Уметь резать парафиновые срезы.
14. Уметь готовить клей для срезов: смесь белка и глицерина.
15. Уметь наклеивать срезы на предметные стекла.
16. Уметь готовить батарею для парафинирования срезов.
17. Уметь депарафинировать срезы.
18. Уметь просветлять гистологические срезы.
19. Уметь готовить красящие растворы.
20. Уметь обрабатывать биопсийный материал.
21. Уметь окрашивать срезы гематоксилин – эозином.
22. Уметь окрашивать гистологические срезы по Ван – Гизону.
23. Уметь окрашивать срезы по методике судан III.
24. Уметь окрашивать срезы по методу конго-рот.
25. Уметь окрашивать срезы по методу ФВГ.
26. Уметь проводить утилизацию отработанного материала, дезинфекцию и стерилизацию использованной лабораторной посуды, инструментария, средств защиты.
27. Уметь архивировать материал.
1. Основы гистологической техники – – Практическое руководство. – М : Медицина, 2010. – 234 с.
5. Гистология: Пер. с англ. – М.: Мир, 1983. – Т. 5. – 296 с.