глюкоза депонируется в печени в форме
Глюкоза депонируется в печени в форме
Углеводная недостаточность – болезненное состояние, связанное с недостаточным поступлением и усвоением углеводов либо с их интенсивным расходованием.
Так как углеводы играют роль быстрого источника энергии, относительный углеводный дефицит может сопровождать любое физическое перенапряжение и считается вариантом нормы. Уровень углеводов в этом случае быстро восполняется за счет резервов организма без негативных последствий. При длительном дефиците питания, а также при некоторых заболеваниях может развиваться хроническая углеводная недостаточность, последствия которой бывают необратимыми. Наиболее чувствительны к дефициту углеводов клетки нервной и мышечной ткани, которые являются основными потребителями энергии. При нехватке углеводов для восполнения энергии начинают использоваться жиры и даже белок, что может вызывать серьезные изменения в обмене веществ и влиять на работу печени и почек.
Дефицит углеводов, гипогликемия.
Синонимы английские
A Carbohydrate Deficiency, Deficiency Of Carbohydrates.
Симптомы углеводной недостаточности во многом зависят от ее длительности и степени выраженности. При кратковременном падении уровня сахара в крови в периоды физического или умственного перенапряжения могут отмечаться легкая слабость и усиленное чувство голода. Длительный дефицит углеводов, сопровождающийся истощением их запаса в печени, может приводить к нарушению ее функций и развитию дистрофии (нарушению питания тканей).
Основные проявления углеводной недостаточности:
Кто в группе риска?
Общая информация о заболевании
Наряду с жирами и белком углеводы относятся к основным компонентам пищевого рациона. Они удовлетворяют потребность организма в энергии, участвуют в расщеплении жиров и белка.
Многие люди, пытаясь сбросить вес, ошибочно урезают количество углеводов в рационе до минимума, однако полноценная утилизация жиров возможна только при достаточном количестве углеводов.
Основные функции углеводов
Разнообразие выполняемых функций обеспечивается за счет особенностей химического строения углеводов. Принято различать следующие их виды.
Таким образом, для обеспечения потребностей организма в первую очередь расходуются простые углеводы (глюкоза), уровень которых восполняется либо за счет поступления с пищей, либо за счет собственных запасов при расщеплении гликогена. Если же собственный углеводный резерв исчерпан, организм начинает использовать имеющийся жир и белки, поэтому длительная нехватка углеводов приводит к серьезным нарушениям обмена и образованию целого ряда вредных веществ, постепенно накапливающихся в крови. К числу таких веществ относятся продукты неполного расщепления жира: кетоновые тела и ацетон. Этот процесс представляет серьезную опасность и даже может привести к коме. Избыточный расход белка вызывает уменьшение мышечной массы, нарушение целого ряда жизненно важных процессов, таких как продукция гормонов, основных белков крови, пищеварительных ферментов, что чревато тяжелыми формами дистрофии, снижением работоспособности и интеллекта.
Главное проявление углеводного дефицита – это гипогликемия – низкий уровень глюкозы в крови.
Основные причины углеводной недостаточности
а) Приобретенные нарушения чаще всего носят временный характер и устраняются лечением. Наиболее распространенными являются:
б) Врождённые ферментопатии характеризуются отсутствием или низким уровнем отдельных ферментов, отвечающих за расщепление сложных углеводов. Наиболее известным примером является врождённая недостаточность лактазы – фермента, отвечающего за усвоение молочного сахара. Заболевание выявляется у новорождённых и характеризуется вздутием живота, жидким стулом, потерей веса. В качестве лечения предлагается переход на смеси, не содержащие лактозу.
Углеводная недостаточность может быть заподозрена у пациентов с дефицитом массы тела, а также у лиц, входящих в группу риска: страдающих сахарным диабетом, заболеваниями печени, почек, поджелудочной железы. Для подтверждения диагноза назначаются следующие исследования.
Дополнительные (инструментальные) методы исследования
Объем диагностических исследований зависит от предполагаемой причины углеводной недостаточности и должен определяться лечащим врачом.
Лечение углеводной недостаточности направлено на восстановление уровня углеводов, а в более тяжелых случаях на нормализацию белкового и жирового обмена.
Рекомендуемые анализы
Глюкоза депонируется в печени в форме
Одним из интегральных показателей внутренней среды, отражающим обмен в организме углеводов, белков и жиров, является концентрация в крови глюкозы. Она является не только источником энергии для синтеза жиров и белков, но и субстратом для их синтеза. В печени происходит новообразование углеводов из жирных кислот и аминокислот.
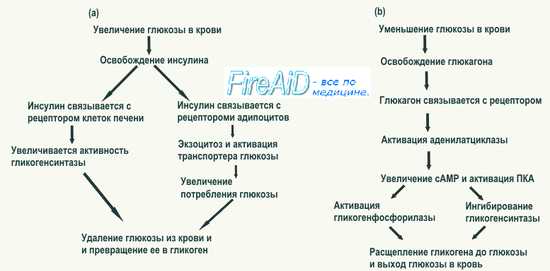
Нормальное функционирование клеток нервной системы, поперечнополосатых и гладких мышц, для которых глюкоза является важнейшим энергосубстратом, возможно при условии, что приток к ним глюкозы обеспечит их энергетические потребности. Это достигается при содержании в литре крови у человека в среднем 1 г (0,8—1,2 г) глюкозы (рис. 12.2). Из схемы на этом рисунке следует, что при нормальном уровне содержания глюкозы в крови происходит образование гликогена в печени и мышцах, синтез жиров, ее потребление клетками мозга, мышцами и другими тканями. В условиях гипергликемии избыточное количество глюкозы удаляется из крови через почки, увеличивается синтез гликогена. При гипогликемии усиливается гликогенолиз под влиянием адреналина и глюкагона.
Сдвиги в концентрации глюкозы в крови от «заданного» (константного) значения воспринимаются глюкорецепторами гипоталамуса, который реализует свои регулирующие влияния на клетки через симпатический и парасимпатические отделы вегетативной нервной системы. Эти влияния обусловливают срочное повышение или снижение выработки инсулина, глюкагона и адреналина эндокринным аппаратом поджелудочной железы и надпочечников. Более медленный эффект гипоталамических влияний осуществляется через гормоны гипофиза. Для поддержания константного уровня концентрации глюкозы существует и более короткая петля обратной связи — влияние глюкозы, циркулирующей в крови, непосредственно на бета-клетки островков Лангерганса поджелудочной железы, вырабатывающих гормон инсулин.
При снижении содержания глюкозы в литре крови до уровня менее 0,5 г, вызванном голоданием, передозировкой инсулина, имеет место недостаточность снабжения энергией клеток мозга. Нарушение их функций проявляется учащением сердцебиения, слабостью и тремором мышц, головокружением, усилением потоотделения, ощущением голода. При дальнейшем снижении концентрации глюкозы в крови указанное состояние, именуемое гипогликемией, может перейти в гипогликемическую кому, характеризующуюся угнетением функций мозга вплоть до потери сознания. Введение в кровь глюкозы, прием сахарозы, инъекция глюкагона предупреждают или ослабляют эти проявления гипогликемии. Кратковременное повышение уровня глюкозы в крови (гипергликемия) не представляет угрозы для здоровья человека.
В крови организма человека обычно содержится около 5 г глюкозы. При среднесуточном потреблении с пищей взрослым человеком, занимающимся физическим трудом, 430 г углеводов в условиях относительного покоя, тканями ежеминутно потребляется около 0,3 г глюкозы. При этом запасов глюкозы в циркулирующей крови достаточно для питания тканей на 3—5 мин и без ее восполнения неминуема гипогликемия. Потребление глюкозы возрастает при физической и психоэмоциональной нагрузках. Так как периодический (несколько раз в день) прием углеводов с пищей не обеспечивает постоянного и равномерного притока глюкозы из кишечника в кровь, в организме существуют механизмы, восполняющие убыль глюкозы из крови в количествах, эквивалентных ее потреблению тканями. При достаточном уровне концентрации глюкозы в крови она частично превращается в запасаемую форму — гликоген. При уровне более 1,8 г в литре крови происходит выведение ее из организма с мочой.
Избыток глюкозы, поступившей из кишечника в кровь воротной вены, поглощается гепатоцитами. При повышении в них концентрации глюкозы активируются ферменты углеводного обмена печени, превращающие глюкозу в гликоген. В ответ на повышение уровня сахара в крови, протекающей через поджелудочную железу, возрастает секреторная активность бета-клеток островков Лангерганса. В кровь выделяется большее количество инсулина — единственного гормона, обладающего резким понижающим концентрацию сахара в крови действием. Под влиянием инсулина повышается проницаемость для глюкозы плазматических мембран клеток мышечной и жировой тканей. Инсулин активирует в печени и мышцах процессы превращения глюкозы в гликоген, улучшает ее поглощение и усвоение скелетными, гладкими и сердечной мышцами. Под влиянием инсулина в клетках жировой ткани из глюкозы синтезируются жиры. Одновременно выделяющийся в больших количествах инсулин тормозит распад гликогена печени и глюконеогенез.
Содержание глюкозы в крови оценивается глюкорецепторами переднего гипоталамуса, а также его полисенсорными нейронами. В ответ на повышение уровня глюкозы в крови выше «заданного значения» (>1,2 г/л) возрастает активность нейронов гипоталамуса, которые посредством влияния парасимпатической нервной системы на поджелудочную железу усиливают секрецию инсулина.
При понижении уровня глюкозы в крови уменьшается ее поглощение гепатоцитами. В поджелудочной железе снижается секреторная активность бета-клеток, уменьшается секреция инсулина. Тормозятся процессы превращения глюкозы в гликоген в печени и мышцах, уменьшается поглощение и усвоение глюкозы скелетными и гладкими мышцами, жировыми клетками. При участии этих механизмов замедляется или предотвращается дальнейшее понижение уровня глюкозы в крови, которое могло бы привести к развитию гипогликемии.
При уменьшении концентрации глюкозы в крови имеет место повышение тонуса симпатической нервной системы. Под ее влиянием усиливается секреция в мозговом веществе надпочечников адреналина и норадреналина. Адреналин, стимулируя распад гликогена в печени и мышцах, вызывает повышение концентрации сахара в крови. Норадреналин обладает слабовыраженной способностью повышать уровень глюкозы в крови.
Под влиянием симпатической нервной системы стимулируется выработка альфа-клетками поджелудочной железы глюкагона, который активирует распад гликогена печени, стимулирует глюконеогенез и приводит к повышению уровня глюкозы в крови.
Понижение в крови концентрации глюкозы, являющейся для организма одним из наиболее важных энергетических субстратов, вызывает развитие стресса. В ответ на снижение уровня сахара крови глюкорецепторные нейроны гипоталамуса через рилизинг-гормоны стимулируют секрецию гипофизом в кровь гормона роста и адренокортикотропного гормона.
Под влиянием гормона роста уменьшается проницаемость клеточных мембран для глюкозы, усиливается глюконеогенез, активируется секреция глюкагона, в результате чего уровень сахара в крови увеличивается.
Секретируемые под действием адренокортикотропного гормона в коре надпочечников глюкокортикоиды активируют ферменты глюконеогенеза и этим способствуют увеличению содержания сахара в крови.
Регуляция обмена веществ и энергии в организме находится под контролем нервной системы и ее высших отделов. Об этом свидетельствуют факты условно-рефлекторного изменения интенсивности метаболизма у спортсменов в предстартовом состоянии, у рабочих перед началом выполнения тяжелой физической работы, у водолазов перед их погружением в воду. В этих случаях увеличивается скорость потребления организмом кислорода, возрастает минутный объем дыхания, минутный объем кровотока, усиливается энергообмен.
Развивающееся при снижении в крови содержания глюкозы, свободных жирных кислот, аминокислот чувство голода обусловливает поведенческую реакцию, направленную на поиск и прием пищи и восполнение в организме питательных веществ.
Глюкоза депонируется в печени в форме
Недостаточность углеводного обмена в печени, нарушение ее глюкостатической функции может носить первичный наследственный и вторичный приобретенный характер. Причем приобретенные формы печеночной недостаточности в поддержании углеводного гомеостаза могут возникать как следствие прямого цитотоксического действия на паренхиму печени патогенных факторов бактериально-токсической, иммунноаллергической, онкогенной природы экзогенного или эндогенного происхождения. В ряде случаев расстройства углеводного обмена в печени возникают в результате нарушений оксигенации паренхимы печени или развития холестаза [1–5].
Следует отметить важное значение нарушений гормонального баланса, в частности изменений соотношения в организме инсулина и контринсулярных гормонов в расстройствах процессов гликолиза, гликогенолиза, гликогенеза, гликонеогенеза, окисления субстратов в цикле Кребса и других реакциях.
Характер и механизмы нарушений углеводного обмена в печени при наследственных формах патологии
Наследственные нарушения метаболизма углеводов в печени именуют гликогенозами (болезни накопления) и агликогенозами (отсутствие гликогена в печени).
Следует отметить, что гликогенозы могут быть не только печеночного происхождения, но и мышечного, а также носить смешанный и даже генерализованный характер.
Первая идентификация гликогенозов и их классификация была предложена супругами Cori (1957). В последующем было установлено XI различных энзиматических дефектов метаболизма углеводов, приводящих к качественным и количественным нарушениям содержания гликогена в органах и тканях. Наиболее часто встречающимися гликогенозами являются гепаторенальный гликогеноз Iа типа (болезнь Гирке), описанный впервые von Girke в 1929 г. [2, 5].
Заболевание выявляется в раннем детском возрасте, характеризуется резким снижением содержания глюкозы в крови (иногда до 0,55–1,1 ммоль/л) и сопровождается развитием судорог, рвоты, коллапса.
Основной генетический дефект, лежащий в основе данного заболевания – это недостаточность фермента глюкозо-6-фосфатазы, наследуемая аутосомно-рецессивно. При этом в ткани печени накапливается глюкозо-6-фосфат, активирующий Д-форму гликогенсинтетазы. Последнее приводит к прогрессирующему возрастанию содержания гликогена в печени. Одновременно выявляется избыточное отложение гликогена в канальцах почек.
Снижение содержания глюкозы в крови подавляет продукцию инсулина, что приводит к активации липолиза, развитию гиперлипидемии, нарушению утилизации субстратов в цикле Кребса. Одновременно возникает накопление промежуточных продуктов распада углеводов и жиров: молочной, пировиноградной кислоты, жирных и кетокислот, а также холестерина, триглециридов, мочевой кислоты.
Достаточно быстро формируется метаболический ацидоз. Формирование гепаторенального гликогеноза нередко приводит к развитию таких осложнений, как подагра, уролитиаз.
Касаясь нарушений клеточного состава периферической крови при гликогенозе Iа типа, следует отметить развитие анемии и лейкопении, при этом в лейкоцитах резко увеличивается содержание гликогена.
Прогноз заболевания неблагоприятен вплоть до развития летальных исходов (в 50 % наблюдений) в раннем детском возрасте. Однако в других случаях возможно относительно благоприятное течение патологии и рождение здоровых детей в потомстве.
Гликогеноз Ib типа
Гликогеноз Ib типа характеризуется наследственной недостаточностью транслоказы глюкозо-6-фосфатазы в эндоплазматическом ретикулюме гепатоцитов, в то время как активность фермента глюкозо-6-фосфатазы достаточно велика.
Гликогеноз III типа
Гликогеноз III типа (болезнь Форбса) связан с недостаточностью фермента амило-1-6-глюкозидазы, является наиболее частой формой гликогеноза, характеризуется выраженной гепатомегалией гипокликемией, умеренным ацидозом и кетонурией. У детей отмечается умеренная задержка роста. Тем не менее течение этой формы патологии более благоприятное, чем при болезни Гирке.
Гликогеноз IV типа
Гликогеноз IV типа (болезнь Андерсена) – крайне редкое аутосомно-рецессивное заболевание связано с наследственным дефектом ветвящего фермента гликогена не только в печени, но в лейкоцитах, фибробластах и мышцах. Содержание гликогена в печени при указанной патологии чаще нормальное, однако структура его аномальна, сходна с амилопектином, включает редкие длинные наружные ветви.
Гипогликемический синдром не выражен, однако прогноз заболевания неблагоприятен в связи с ранним развитием цирроза печени.
Гликогеноз VIа типа
Гликогеноз VIа типа (болезнь Хёрса) – редкая форма аутосомно-рецессивного наследования нарушения активности фосфорилазы печени и лейкоцитов. Заболевание характеризуется развитием гипогликемии и умеренного ацидоза. Прогноз болезни благоприятен в связи с восполнением дефекта фермента фосфорилазы за счет активации реакций глюконеогенеза.
Этиология и патогенез агликогеноза
Агликогеноз – заболевание с аутосомно-рецессивной недостаточностью УДФ-глюкозо-гликогентрансферазы (гликогенсинтетазы) характеризуется отсутствием запасов гликогена в печени, развитием гипогликемии, особенно натощак, в связи с чем возникает необходимость частого приема пищи. В ряде случаев формируется жировая инфильтрация печени, возрастает уровень кетоновых тел в крови. Одновременно снижается содержание аминокислот в крови, участвующих в глюконеогенезе.
Характер и механизмы нарушений углеводного обмена в печени при приобретенных формах патологии
Как указывалось выше, печень играет ведущую роль в поддержании постоянства содержания глюкозы в крови за счет динамического равновесия процессов гликогенеза, глюконеогенеза, гликолиза и гликогенолиза. При повреждении паренхимы печени прежде всего нарушается глюкостатическая функция. Это обусловлено тем фактом, что гликогенез является энергозависимым процессом. Удлинение цепи гликогена на одну молекулу глюкозы требует расхода одной молекулы АТФ и УДФ. В то же время развитие деструктивно-воспалительных процессов гепатоцитов, нарушение оксигенации и трофики печени при различных формах патологии инфекционной и неинфекционной природы, нарушения гормонального баланса, кислотно-основного состояния сопровождаются развитием типовой реакции митохондрий – набуханием [5–8].
При набухании митохондрий нарушается пространственная ориентация дыхательных ферментативных ансамблей на внутренней мембране митохондрий, разобщаются процессы окислительного фосфорилирования и дыхания, возникает дефицит АТФ и, соответственно, подавление всех энергозависимых реакций, в том числе и гликогенеза. В этих случаях нагрузка глюкозой приводит к появлению длительной диабетоидной гипергликемической кривой, а вне нагрузки глюкозой или при редком приеме пищи в связи с истощением запасов гликогена возможна гипогликемия.
Пораженная печень теряет способность трансформировать в гликоген и другие субстраты в реакциях гликонеогенеза, что приводит к избыточному накоплению в крови, тканях и паренхиме печени молочной, пировиноградной, жирных кислот, кетокислот, аминокислот. Последнее в свою очередь является одним из патогенетических факторов развития метаболического ацидоза. Для печеночной недостаточности характерно также нарушение окисления глюкозы в пентозном цикле и соответственно развитие дефицита рибозофосфатов, а также НАДФН2, что приводит к недостаточности антиоксидантных систем и активации свободнорадикальной деструкции гепатоцитов. Нарушения трансформации пировиноградной кислоты в гликоген и окисления ее в цикле трикарбоновых кислот при печеночной недостаточности сопровождается активацией альтернативных механизмов ее метаболизма с образованием токсических соединений – ацетона и бутиленгликоля.
Нарушения углеводного обмена в печени при гормональном дисбалансе
Основными гормональными регуляторами углеводного обмена в печени являются инсулин и контринсулярные гормоны (глюкогон, адреналин, норадреналин, тираксин, трийодтиранин, соматотропный гормон и адренокортикотопный гормоны).
В то же время следует отметить, что гепатоциты занимают промежуточное положение между клетками высокоинсулинзависимых органов и тканей (жировой, соединительной, мышечной, кроветворной и др.) и инсулиннезависимых (центральной нервной системы, надпочечников, гонад, глаза) [2, 3, 5].
Как известно, плазматическая мембрана гепатоцита, в отличие от мио- и липоцита, свободно проницаема для глюкозы без участия инсулина. В то же время в условиях нормы под влиянием инсулина возникает активация гексокиназы (глюкокиназы) в гепатоцитах, миоцитах и липоцитах, а также усиливается синтез жирных кислот из глюкозы, активируются пентозные и гликолитические пути метаболизма глюкозы, повышается активность ферментов цикла Кребса. Активация указанных реакций обеспечивает усиление синтеза АТФ. Дефицит инсулина, как известно, может носить наследственный и приобретенный характер, быть абсолютным или относительным, иметь панкреатическое или внепанкреатическое происхождение. В настоящее время очевидна возможность развития сахарного диабета I и II типов как самостоятельных нозологических форм патологии наследственного генеза, а также формирование вторичного сахарного диабета симптоматического характера при различных эндокринопатиях, сопровождающихся гиперпродукцией контринсулярных гормонов, а также при воспалительно-деструктивных процессах в поджелудочной железе неаутоиммунного характера (при несбалансированном питании, недостаточности незаменимых аминокислот, витаминов, микроэлементов и т.д.) [6, 9, 10].
В условиях дефицита инсулина, абсолютного или относительного преобладания контринсулярных гормонов при различных эндокринопатиях подавляются процессы гликогенеза, снижается активность ферментов пентозного цикла окисления глюкозы, а также окисление субстратов в цикле Кребса. Гликонеогенез активируется лишь под влиянием гормонов АКТГ и глюкокортикоидов при стрессорных ситуациях, болезни и синдроме Иценко – Кушинга, стероидной терапии. Между тем усиление продукции контринсулярных гормонов (глюкагона, катехоламинов, тираксина, трийодтиранина) приводит к активации ферментов фосфорилазы и глюкозо-6-фосфатазы в гепатоцитах и соответственно к усилению мобилизации гликогена из депо.
Таким образом, при нарушених гормонального баланса, в частности при различных формах сахарного диабета (первичного и вторичного), возникает несостоятельность глюкостатической функции печени. При этом глюкоза не утилизируется в инсулинзависимых органах и тканях, а также в печени, несмотря на то, что проницаемость мембран гепатоцитов при вышеуказанных гормональных нарушениях для глюкозы не меняется. Однако в условиях дефицита инсулина блокируются все последующие метаболические пути ее превращения. Последнее приводит к развитию гипергликемии, глюкозурии, лактат- и/или кетоацидоза жировой инфильтрации печени и к тяжелым морфофункциональными изменениям со стороны различных органов и систем.