ифт периферической крови что это
Ифт периферической крови что это
Исследование включает в себя определение абсолютных и относительных значений субпопуляционного состава лимфоцитов (CD3, CD4, CD8, CD19, CD56). Рекомендуется к назначению для контроля показателей клеточного звена иммунной системы в динамике после комплексного иммунологического обследования.
Иммунофенотипирование, клеточный иммунитет, многоцветный клеточный анализ методом проточной цитометрии, субпопуляции лимфоцитов.
Human Immune System, Immunophenotyping, Multicolor Flow Cytometry Cell Analysis, Human Leukocyte Differentiation Antigens.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Общая информация об исследовании
В основе проточной цитофлуориметрии лежит проведение фотометрических и флюоресцентных измерений отдельных клеток, пересекающих одна за другой вместе с потоком жидкости луч монохроматического света, обычно света лазера.
Метод позволяет не только определить количественное соотношение основных популяций лимфоцитов:
— но и оценить малые клеточные популяции, а также изучить их функциональную активность:
Когда назначается исследование?
Рекомендовано для комплексного обследования пациентов, входящих в группу риска по четырем основным иммунопатологическим синдромам.
С инфекционным синдромом:
С аллергическим (атопическим) синдромом:
С аутоиммунным синдромом:
С иммунопролиферативным синдромом:
Что означают результаты?
Изменения различных клеточных популяций лимфоцитов в сторону повышения или понижения развиваются при различных патологических процессах в организме, таких как инфекции, аутоиммунные и онкологические заболевания, иммунодефициты, в постоперационном периоде, при трансплантации органов.
Ниже представлена таблица с клиническими ситуациями, которые могут приводить к изменениям в субпопуляционном составе лимфоцитов.
Субпопуляция лимфоцитов
Повышение показателя
Снижение показателя
Т-цитотоксические лимфоциты (CD3 + CD8 + CD45 + )
Т-«натуральные киллеры», НК-Т
Не имеет диагностического значения.
В совокупности с клиническими данными, симптоматикой, другими методами лабораторных исследований вышеуказанные изменения являются диагностическим признаком возникновения этих патологических процессов в организме человека.
Анализ клеток крови и головного мозга на иммунофенотипирование (ИФТ)
Исследование крови и костного мозга на иммунофенотипирование – один из наиболее точных методов диагностики, с помощью которого обнаруживают и квалифицируют различные заболевания, подтверждают диагноз. Также данный способ позволяет определить наиболее удачную схему лечения.
Прайс
| № | Услуга | Описание | Срок | Цена (руб) |
|---|---|---|---|---|
| 1 | Антитела к хеликобактеру (Helicobacter pylori), IgG | Диагностика хеликобактериоза | 1 р.д. | 400 |
| 2 | Антитела к хеликобактеру (Helicobacter pylori), IgA | Диагностика хеликобактериоза | 1 р.д. | 480 |
| 3 | Антитела к хеликобактеру (Helicobacter pylori), IgМ | Диагностика хеликобактериоза | 1 р.д. | 480 |
| 4 | Антитела к лямблиям (Lamblia intestinalis), суммарные | Диагностика лямблиоза | 1 р.д. | 560 |
| 5 | Антитела к уреаплазме (Ureaplasma urealyticum), IgG | Диагностика уреаплазмоза | 1 р.д. | 420 |
| 6 | Антитела к уреаплазме (Ureaplasma urealyticum), IgА | Диагностика уреаплазмоза | 1 р.д. | 450 |
| 7 | Антитела к микоплазме (Mycoplasma pneumoniae), IgG | Диагностика микоплазмоза | 1 р.д. | 450 |
| 8 | Антитела к микоплазме (Mycoplasma pneumoniae), IgА | Диагностика микоплазмоза | 1 р.д. | 450 |
| 9 | Антитела к микоплазме (Mycoplasma pneumoniae), IgM | Диагностика микоплазмоза | 1 р.д. | 450 |
| 10 | Антитела к микоплазме (Mycoplasma hominis), IgG | Диагностика микоплазмоза | 1 р.д. | 420 |
| 11 | Антитела к микоплазме (Mycoplasma hominis), IgА | Диагностика микоплазмоза | 1 р.д. | 420 |
| 12 | Антитела к хламидофиле (Chlamydophila pneumoniae), IgG | Диагностика хламидиоза | 1 р.д. | 420 |
| 13 | Антитела к хламидофиле (Chlamydophila pneumoniae), IgА | Диагностика хламидиоза | 1 р.д. | 420 |
| 14 | Антитела к хламидофиле (Chlamydophila pneumoniae), IgM | Диагностика хламидиоза | 1 р.д. | 420 |
| 15 | Антитела к хламидии (Chlamydia trachomatis), IgG | Диагностика хламидиоза | 1 р.д. | 420 |
| 16 | Антитела к хламидии (Chlamydia trachomatis), IgA | Диагностика хламидиоза | 1 р.д. | 420 |
| 17 | Антитела к хламидии (Chlamydia trachomatis), IgM | Диагностика хламидиоза | 1 р.д. | 420 |
| 18 | Антитела к парвовирусу (Parvovirus) B19, IgG | Диагностика парвовируса | 1 р.д. | 560 |
| 19 | Антитела к парвовирусу (Parvovirus) B19, IgM | Диагностика парвовируса | 1 р.д. | 560 |
| 20 | Антитела к токсоплазме (Toxoplasma gondii), IgG | Диагностика токсоплазмоза | 1 р.д. | 430 |
| 21 | Антитела к токсоплазме (Toxoplasma gondii), IgM | Диагностика токсоплазмоза | 1 р.д. | 430 |
| 22 | Антитела к вирусу краснухи, IgG | Диагностика вируса краснухи | 1 р.д. | 420 |
| 23 | Антитела к вирусу краснухи, IgM | Диагностика вируса краснухи | 1 р.д. | 420 |
| 24 | Авидность IgG к цитомегаловирусу (Cytomegalovirus) (включает определение антител к цитомегаловирусу, IgG) | Цитомегаловирусная инфекция | 1 р.д. | 1000 |
| 25 | Антитела к цитомегаловирусу (Cytomegalovirus), IgG | Цитомегаловирусная инфекция | 1 р.д. | 350 |
| 26 | Антитела к цитомегаловирусу (Cytomegalovirus), IgA | Цитомегаловирусная инфекция | 1 р.д. | 400 |
| 27 | Антитела к цитомегаловирусу (Cytomegalovirus), IgM | Цитомегаловирусная инфекция | 1 р.д. | 350 |
| 28 | Авидность IgG к вирусу Эпштейна-Барр (Epstein-Barr virus) (включает определение антител к капсидному антигену вируса Эпштейна-Барр, IgG) | Вирус Эпштейна-Барр (инфекционный мононуклеоз) | 1 р.д. | 640 |
| 29 | Антитела к капсидному антигену вируса Эпштейна-Барр (Epstein-Barr virus VCA), IgG | Вирус Эпштейна-Барр (инфекционный мононуклеоз) | 1 р.д. | 550 |
| 30 | Антитела к капсидному антигену вируса Эпштейна-Барр (Epstein-Barr virus VCA), IgM | Вирус Эпштейна-Барр (инфекционный мононуклеоз) | 1 р.д. | 500 |
| 31 | Антитела к вирусу простого герпеса II типа (Herpes simplex virus II), IgG | Вирус простого герпеса | 1 р.д. | 550 |
| 32 | Антитела к вирусу простого герпеса II типа (Herpes simplex virus II), IgM | Вирус простого герпеса | 1 р.д. | 550 |
| 33 | Антитела к вирусу простого герпеса I типа (Herpes simplex virus I), IgG | Вирус простого герпеса | 1 р.д. | 550 |
| 34 | Антитела к вирусу простого герпеса I типа (Herpes simplex virus I), IgM | Вирус простого герпеса | 1 р.д. | 550 |
| 35 | Авидность IgG к вирусу простого герпеса I, II типов (Herpes simplex virus I, II) (включает определение антител к вирусу простого герпеса I, II типов, IgG) | Вирус простого герпеса | 1 р.д. | 680 |
| 36 | Антитела к вирусу простого герпеса I, II типов (Herpes simplex virus I, II), IgG | Вирус простого герпеса | 1 р.д. | 650 |
| 37 | Антитела к вирусу простого герпеса I, II типов (Herpes simplex virus I, II), IgM | Вирус простого герпеса | 1 р.д. | 550 |
| 38 | Антитела к бледной трепонеме (Treponema palidum), IgG | Диагностика сифилиса | 1 р.д. | 300 |
| 39 | Антитела к бледной трепонеме (Treponema pallidum), IgM | Диагностика сифилиса | 1 р.д. | 350 |
| 40 | Антитела к бледной трепонеме (Treponema pallidum), суммарные | Диагностика сифилиса | 1 р.д. | 350 |
| 41 | Микрореакция на сифилис, полуколичественно (RPR) | Диагностика сифилиса | 1 р.д. | 200 |
| 42 | Микрореакция на сифилис качественно (RPR) | Диагностика сифилиса | 1 р.д. | 200 |
| 43 | ВИЧ (антитела и антигены) | Диагностика ВИЧ-инфекции | 1 р.д. | 350 |
| 44 | Антитела к вирусу гепатита E, IgM (Anti-HEV IgM) | Диагностика гепатита Е | 1 р.д. | 500 |
| 45 | Антитела к вирусу гепатита D, IgM (Anti-HDV IgM) | Диагностика гепатита D | 1 р.д. | 500 |
| 46 | Антитела к вирусу гепатита D, суммарные (Anti-HDV) | Диагностика гепатита D | 1 р.д. | 500 |
| 47 | Антитела к вирусу гепатита C, IgM (Anti-HCV IgM) | Диагностика гепатита С | 1 р.д. | 350 |
| 48 | Антитела к вирусу гепатита С, суммарные (Anti-HCV) | Диагностика гепатита С | 1 р.д. | 330 |
| 49 | Антитела к ядерному (cor) антигену вируса гепатита В, суммарные (Anti-HBcor) | Диагностика гепатита В | 1 р.д. | 380 |
| 50 | Антитела к поверхностному антигену вируса гепатита В (Anti-HBs) | Диагностика гепатита В | 1 р.д. | 380 |
| 51 | Поверхностный антиген вируса гепатита В (австралийский антиген, HbsAg) | Диагностика гепатита В | 1 р.д. | 330 |
| 52 | Антитела к вирусу гепатита А, IgG (Anti-HAV IgG) | Диагностика гепатита А | 1 р.д. | 350 |
| 53 | Антитела к вирусу гепатита А, IgM (Anti-HAV IgM) | Диагностика гепатита А | 1 р.д. | 350 |
Иммунофенотипирование костного мозга и лимфоцитов периферической крови проводится в Москве по доступной цене высококвалифицированными сотрудниками ООО «ВЫМПЕЛ-МЕДЦЕНТР»: профессором, доктором медицинских наук Луговским С. А., доцентом, кандидатом медицинских наук Почтарь М. Е., доцентом, кандидатом медицинских наук Наумовой Е. В.
Какой биоматериал используется для анализа ИФТ?
В зависимости от задач исследования, материалом для анализа может служить:
Суть исследования заключается в том, что при его проведении определяются типы клеток. С помощью особого оборудования или люминесцентных микроскопов, легко распознать принадлежность каждой из этих клеток к тому или иному виду и выявить возможные поражения.
Как подготовиться к процедуре?
Забор биоматериала производится в утренние часы натощак. Перед проведением исследования необходим период голодания, желательно, более 8 часов. Можно выпить небольшое количество воды. За несколько дней до процедуры недопустимо употребление алкоголя, курение сигарет, активные занятия спортом. На искажение результатов анализа крови ИФТ влияют тяжелые психоэмоциональные состояния.
Показания для проведения исследования
Как и любой анализ крови, фенотипирование проводится по ряду причин.
Обратите внимание, что интерпретировать результаты ИФТ костного мозга и лимфоцитов периферической крови нельзя самостоятельно и тем более, заниматься самолечением. Поставить точный диагноз может только врач-иммунолог, используя также результаты других анализов и обследований. Нормы показателей отличаются в зависимости от пола и возраста пациента.
В нашем медицинском центре в Москве есть все необходимые условия для качественной диагностики – врачи с многолетним опытом, современное оборудование, дружелюбный сервис и доступные цены на услуги. С помощью анализа на ИФТ легко предотвратить серьезную болезнь или обнаружить едва начавшиеся патологические процессы. Позаботьтесь о своем здоровье уже сегодня!
Оценка показателей клеточного иммунитета
Первым исследованием всегда является подсчет лейкоцитарной формулы (см. главу «Гематологические исследования»). Оцениваются как относительные, так и абсолютные значения количества клеток периферической крови.
Определение основных популяций (Т-клетки, В-клетки, натуральные киллеры) и субпопуляций Т-лимфоцитов (Т-хелперы, Т-ЦТЛ). Для первичного исследования иммунного статуса и выявления выраженных нарушений иммунной системы ВОЗ рекомендовано определение CD3, CD4, CD8, CD19, CD16+56, соотношение CD4/CD8. Исследование позволяет определить относительное и абсолютное количество основных популяций лимфоцитов: Т-клетки – CD3, В-клетки – CD19, натуральные киллеры (NK) – CD3- CD16++56+, субпопуляции Т лимфоцитов (Т-хелперы CD3+ CD4+, Т-цитотоксические CD3+ CD8+ и их соотношение).
Иммунофенотипирование лимфоцитов проводится c использованием моноклональных антител к поверхностным дифференцировочным ангинам на клетках иммунной системы, методом проточной лазерной цитофлуорометрии на проточных цитофлуориметрах.
Выбор зоны анализа лимфоцитов производится по дополнительному маркеру CD45, который представлен на поверхности всех лейкоцитов.
Условия взятия и хранения образцов
Венозная кровь, взятая из локтевой вены, утром, строго натощак, в вакуумную систему до указанной на пробирке метки. В качестве антикоагулянта используется К2ЭДТА. После взятия пробирку с образцом медленно переворачивают 8-10 раз для перемешивония крови с антикоагулянтом. Хранение и транспортировка строго при 18–23°С в вертикальном положении не более 24 ч.
Невыполнение этих условий приводит к некорректным результатам.
Т-лимфоциты (CD3+ клетки). Повышенное количество свидетельствует о гиперактивности иммунитета, наблюдается при острых и хронических лимфолейкозах. Увеличение относительного показателя встречается при некоторых вырусных и бактериальных инфекциях в начале заболевания, обострениях хронических заболеваний.
Снижение абсолютного количества Т-лимфоцитов свидетельствует о недостаточности клеточного иммунитета, а именно о недостаточности клеточно-эффекторного звена иммунитета. Выявляется при воспалениях разнообразной этиологии, злокачественных новообразованиях, после травмы, операций, инфаркта, при курении, приеме цитостатиков. Повышение их числа в динамике заболевания – клинически благоприятный признак.
В-лимфоциты (CD19+ клетки) Снижение наблюдается при физиологических и врожденных гипогаммаглобулинемиях и агаммаглобулинемиях, при новообразованиях иммунной системы, лечении иммунодепрессантами, острой вирусной и хронической бактериальной инфекциях, состоянии после удаления селезенки.
Увеличение отмечается при аутоиммунных заболеваниях, хронических заболеваниях печени, циррозе, муковисцедозе, бронхиальной астме, паразитарных и грибковых инфекциях. Характерно в период реконвалесценции после перенесенных острых и хронических вирусных и бактериальных инфекций. Выраженное увеличение наблюдается при хроническом В-лимфолейкозе.
NK-лимфоциты с фенотипом CD3-CD16++56+ Натуральные киллеры (NK-клетки) – популяция больших гранулярных лимфоцитов. Они способны лизировать клетки-мишени, инфицированные вирусами и другими внутриклеточными антигенами, опухолевые клетки, а также другие клетки аллогенного и ксеногенного происхождения.
Увеличение количества NK-клеток связано с активацией антитрансплантационного иммунитета, в некоторых случаях отмечается при бронхиальной астме, встречается при вирусных заболеваниях, повышается при злокачественных новообразованиях и лейкозах, в периоде реконвалесценции.
Снижение наблюдается при врожденных иммунодефицитах, паразитарных инфекциях, аутоиммунных заболеваниях, облучении, лечении цитостатиками и кортикостероидами, стрессе, дефиците цинка.
Т-лимфоциты хелперы с фенотипом CD3+CD4+ Увеличение абсолютного и относительного количества наблюдается при аутоиммунных заболеваниях, может быть при аллергических реакциях, некоторых инфекционных заболеваниях. Это увеличение свидетельствует о стимуляции иммунной системы на антиген и служит подтверждением гиперреактивных синдромов.
Снижение абсолютного и относительного количества Т-клеток свидетельствует о гипореактивном синдроме с нарушением регуляторного звена иммунитета, является патогномичным признаком для ВИЧ-инфекции; встречается при хронических заболеваниях (бронхитах, пневмониях и т.д.), солидных опухолях.
Т-цитотоксические лимфоциты с фенотипом CD3+ CD8+ Повышение выявляется практически при всех хронических инфекциях, вирусных, бактериальных, протозойных инфекциях. Является характерным для ВИЧ-инфекции. Снижение наблюдается при вирусных гепатитах, герпесе, аутоиммунных заболеваниях.
Соотношение CD4+/CD8+ Исследование соотношения CD4+/CD8+ (CD3, CD4, CD8, CD4/CD8) рекомендовано только для мониторинга ВИЧ-инфекции и контроля эффективности АРВ терапии. Позволяет определить абсолютное и относительное количество Т-лимфоцитов, субпопуляций Т-хелперов, ЦТЛ и их соотношение.
Диапазон значений – 1,2–2,6. Снижение наблюдается при врожденных иммунодефицитах (синдром Ди-Джоржи, Незелофа, Вискотта-Олдрича), при вирусных и бактериальных инфекциях, хронических процессах, воздействии радиации и токсических химических веществ, множественной миеломе, стрессе, снижается с возрастом, при эндокринных заболеваниях, солидных опухолях. Является патогномичным признаком для ВИЧ-инфекции (менее 0,7).
Увеличение значения более 3 – при аутоиммунных заболеваниях, остром Т-лимфобластном лейкозе, тимоме, хроническом Т-лейкозе.
Изменение соотношения может быть связано с количеством хелперов и ЦТЛ у данного пациента. Например, снижение количества CD4+ Т-клеток при острой пневмонии в начале заболевания ведет к снижению индекса, а ЦТЛ при этом могут не измениться.
Для дополнительного исследования и выявления изменений иммунной системы при патологиях требующих оценки наличия острого или хронического воспалительного процесса и степени его активности, рекомендуется включать подсчет количества активированных Т-лимфоцитов с фенотипом CD3+HLA-DR+ и ТNK–клеток с фенотипом CD3+CD16++56+.
Т-активированные лимфоциты с фенотипом CD3+HLA-DR+ Маркер поздней активации, показатель гиперреактивности иммунитета. По экспрессии данного маркера можно судить о выраженности и силе иммунного ответа. Появляется на Т-лимфоцитах после 3-го дня острого заболевания. При благоприятном течении заболевания снижается до нормы. Увеличение экспрессии на Т-лимфоцитах может быть при многих заболеваниях, связанных с хроническим воспалением. Отмечено его повышение у пациентов с гепатитом С, пневмониями, ВИЧ-инфекцией, солидными опухолями, аутоиммунными заболеваниями.
ТNK-лимфоциты с фенотипом CD3+CD16++CD56+ Т-лимфоциты, несущие на своей поверхности маркеры CD16++ CD 56+. Эти клетки имеют свойства как Т-, так и NK-клеток. Исследование рекомендовано как дополнительный маркер при острых и хронических заболеваниях.
Снижение их в периферической крови может наблюдаться при различных органоспецифических заболеваниях и системных аутоиммунных процессах. Увеличение отмечено при воспалительных заболеваниях разной этиологии, опухолевых процессах.
Исследование ранних и поздних маркеров активации Т-лимфоцитов (CD3+CD25+, CD3-CD56+, CD95, CD8+CD38+) дополнительно назначают для оценки изменений ИС при острых и хронических заболеваниях, для диагностики, прогноза, мониторинга течения заболевания и проводимой терапии.
Т-активированные лимфоциты с фенотипом CD3+CD25+, рецeптор к ИЛ2 CD25+ – маркер ранней активации. О функциональном состоянии Т-лимфоцитов (CD3+) свидетельствует количество экспрессирующих рецепторов к ИЛ2 (CD25+). При гиперактивных синдромах количество этих клеток возрастает (острые и хронические лимфолейкозы, тимома, отторжение трансплантата), кроме того, повышение их может свидетельствовать о ранней стадии воспалительного процесса. В периферической крови их можно выявить в первые три дня болезни. Снижение числа этих клеток может наблюдаться при врожденных иммунодефицитах, аутоиммунных процессах, ВИЧ-инфекции, грибковых и бактериальных инфекциях, ионизирующей радиации, старении, отравлении тяжелыми металлами.
Т-цитотоксические лимфоциты с фенотипом CD8+CD38+ Присутствие CD38+ на ЦТЛ лимфоцитах отмечено у пациентов с разными заболеваниями. Информативный показатель при ВИЧ-инфекции, ожоговой болезни. Увеличение числа ЦТЛ с фенотипом CD8+CD38+ наблюдается при хронических воспалительных процессах, онкологических и некоторых эндокринных заболеваниях. При проведении терапии показатель снижается.
Субпопуляция натуральных киллеров с фенотипом CD3- CD56+ Молекула CD56 – адгезивная молекула, широко представленная в нервной ткани. Кроме натуральных киллеров, экспрессируется на многих типах клеток, в том число на Т-лимфоцитах.
Увеличение данного показателя свидетельствуют о расширении активности специфического клона клеток киллеров, которые имеют меньшую цитолитическую активность, чем NK-клетки с фенотипом CD3- CD16+. Количество этой популяции возрастает при гематологических опухолях (ЕК-клеточная или Т-клеточная лимфома, плазмоклеточная миелома, апластическая крупноклеточная лимфома), хронических заболеваниях, некоторых вырусных инфекциях.
Снижение отмечается при первичных иммунодефицитах, вирусных инфекциях, системных хронических заболеваниях, стрессе, лечении цитостатиками и кортикостероидами.
Рецептор CD95+ – один из рецепторов апоптоза. Апоптоз – сложный биологический процесс, необходимый для удаления из организма поврежденных, старых и инфицированных клеток. Рецептор CD95 экспрессируется на всех клетках иммунной системы. Он играет важную роль в контроле функционирования иммунной системы, так как является одним из рецепторов апоптоза. Его экспрессия на клетках определяет готовность клеток к апоптозу.
Снижение доли CD95+-лимфоцитов в крови пациентов свидетельствует о нарушении эффективности последнего этапа выбраковки дефектных и инфицированных собственных клеток, что может привести к рецидиву заболевания, хронизации патологического процесса, развитию аутоиммунных заболеваний и повышению вероятности опухолевой трансформации (к примеру, рака шейки матки при папилломотозной инфекции). Определение экспрессии CD95 имеет прогностическое значение при миело- и лимфопролифератиных заболеваниях.
Повышение интенсивности апоптоза наблюдается при вирусных заболеваниях, септических состояниях, при употреблении наркотических средств.
Активированные лимфоциты CD3+CDHLA-DR+, CD8+CD38+, CD3+CD25+, CD95. Тест отражает функциональное состояние Т-лимфоцитов и рекомендован для контроля за течением заболевания и контроля иммунотерапии при воспалительных заболеваниях разной этиологии.
Ифт периферической крови что это
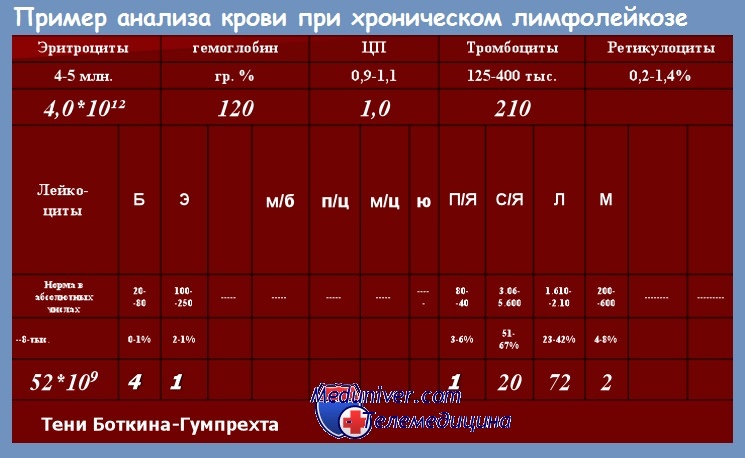
Диагноз хронического лимфолейкоза (ХЛЛ) может быть установлен при абсолютном количестве лимфоцитов в крови более 5•10 9 /л, наличии в костно-мозговом пунктате не менее 30 % лимфоцитов и иммунологическом подтверждении клонового В-клеточного характера лимфоцитоза.
В подавляющем большинстве случаев предположение о наличии у больного хроническим лимфолейкозом (ХЛЛ) возникает в связи с изменениями картины крови: обнаружение абсолютного и относительного лимфоцитоза. Международное рабочее совещание в 1989 г. установило среди критериев для постановки диагноза хронического лимфолейкоза наличие абсолютного лимфоцитоза в крови не менее 10 • 109/л, однако позже это положение было пересмотрено. В настоящее время для предположения о заболевании ХЛЛ считается достаточным наличие абсолютного лимфоцитоза 5•10 9 /л.
Иногда на протяжении 2—3 лет при числе лейкоцитов, лишь незначительно превышающем норму или даже соответствующем нормальному показателю, наблюдается постепенно нарастающий лимфоцитоз — 50—60—70 %. Эти изменения лейкоцитарной формулы еще не являются оснаванием для постановки диагноза хронического лимфолейкоза без дополнительных исследований: пункции костного мозга и иммунологического исследования крови и костно-мозгового пунктата. Тем не менее такой пациент должен быть под пристальным наблюдением врача: обязательны осмотр и анализы крови каждые 3—4 мес, поскольку, как правило, такие изменения крови являются проявлением начала хронического лимфолейкоза.
В крови среди ядерных элементов обнаруживается преобладание зрелых лимфоцитов — клеток малого размера, округлых, с плотным ядром и узким ободком светлой или слегка базофильной цитоплазмы. В мазках крови обычно определяется то или иное количество клеток Гумпрехта—Боткина — полуразрушенных размытых ядер лимфоцитов. Их появление связано с повышенной ломкостью мембраны лимфоцитов при хроническом лимфолейкозе.
Количество клеток Гумпрехта — Боткина, как правило, больше у больных с высоким лейкоцитозом. Клетки, или, как их нередко называют, тени Гумпрехта — Боткина, образуются при приготовлении мазка, их наличие и количество не имеют прогностического значения.
Количество лейкоцитов при хроническом лимфолейкозе может быть различным, в большинстве случаев при установлении диагноза хронического лимфолейкоза оно составляет 20—50•10 9 /л, но нередко при первом обращении к врачу уже имеется гиперлейкоцитоз (100—500 • 10 9 /л), свидетельствующий о длительном недиагностированном периоде заболевания. Мы наблюдали больного, у которого при первом обращении к врачу по поводу длительно существующих увеличенных лимфатических узлов количество лейкоцитов оказалось 1200•10 9 /л.
При подсчете лейкоцитарной формулы содержание лимфоцитов обычно составляет 50—70 %, при высоком лейкоцитозе иногда достигает 95—99 %. Наряду со зрелыми лимфоцитами в крови обычно в очень небольшом количестве (как правило, не более 1—3 %) удается обнаружить пролимфоциты — более крупные клетки с отчетливой нуклеолой в ядре. Постепенное увеличение содержания пролимфоцитов в течение болезни, так же как их постоянное присутствие в количестве 10 % и более, является плохим прогностическим признаком.
Е. Matutes и соавт. на большом клиническом материале показали, что выживаемость больных хроническим лимфолейкозом прямо коррелирует с числом циркулирующих пролимфоцитов и значительно снижается уже при числе пролимфоцитов более 5 %.
На основании изучения морфологической картины крови почти 550 больных ХЛЛ Е. Matutes и соавт. выделили примерно 15 % больных с необычной морфологией клеток. Они предложили считать таких больных страдающими атипичным ХЛЛ, отметив два его подтипа: один с повышенным более 10 % количеством пролимфоцитов и второй — с лимфоплазмоцитоидной дифференцировкой лимфоцитов и/или наличием лимфоцитов с расщепленным (cleaved) ядром. Во втором случае одновременно имеются обычные лимфоциты, характерные для хронического лимфолейкоза, и переходные формы — более крупные лимфоциты с выраженной базофилией цитоплазмы или с намечающейся расщелиной ядра.
Течение болезни в этом случае обычно не отличается от характерного для типичного хронического лимфолейкоза, однако нередко при обоих указанных вариантах имеется трисомия хромосомы 12. При обоих подтипах: повышенном количестве пролимфоцитов и лимфоплазмоцитоидной морфологии лимфоцитов — течение болезни у больных с трисомией хромосомы 12 более агрессивное.
Костно-мозговой пунктат при хроническом лимфолейкозе обычно гиперклеточный, инфильтрация лимфоцитами чаще всего имеет диффузный характер, хотя иногда встречаются случаи нодулярной инфильтрации. В большинстве случаев процентное содержание лимфоцитов значительно превышает необходимые для установления диагноза 30 %, нередко достигая 90—95 %.
Лимфоциты в костном мозге морфологически не отличаются от лимфоцитов крови, но обычно имеется 3—5 % пролимфоцитов даже в тех случаях, когда они не обнаруживаются в крови.
При морфологическом исследовании лимфатического узла обнаруживают стирание нормального рисунка и мономорфную инфильтрацию лимфоцитами, морфологически сходными с лимфоцитами крови и костного мозга, иногда имеющими несколько большие размеры. В небольшом количестве встречаются пролимфоциты и клетки, названные параиммунобластами: клетки среднего размера с дисперсным хроматином и круглыми или овальными ядрышками. В селезенке преобладает инфильтрация белой пульпы, хотя красная пульпа обычно тоже оказывается в той или иной степени инфильтрированной малыми лимфоцитами.
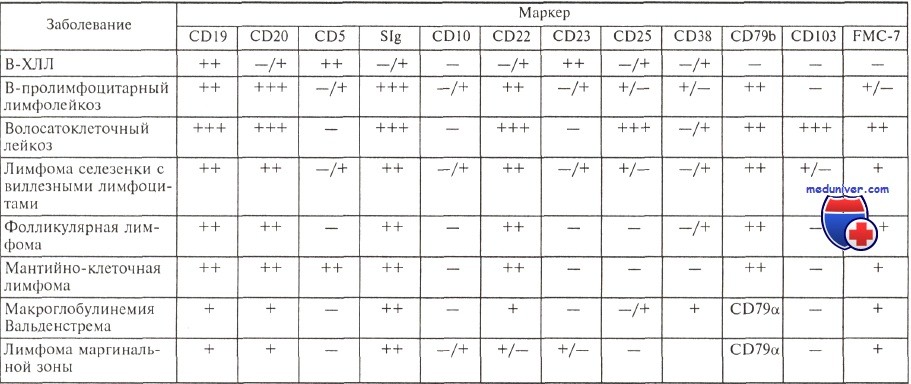
Несмотря на характерную картину, результаты морфологического исследования не могут считаться достаточными для установления диагноза хронического лимфолейкоза (ХЛЛ), поскольку аналогичная морфологическая картина крови и костного мозга нередко наблюдается при фолликулярной и мантийно-клеточной лимфомах с поражением костного мозга. Согласно современным критериям, диагноз хронического лимфолейкоза может считаться установленным только после иммунологического исследования, подтверждающего диагноз. Патологические лимфоциты при хроническом лимфолейкозе имеют абсолютно характерный иммунофенотип.
Они экспрессируют антигены CD19, CD5, CD23, отмечается слабая экспрессия на поверхности клеток иммуноглобулинов (экспрессируются IgM, нередко одновременно с IgD) с одной L-цепью, определяется слабая экспрессия антигенов CD20 и CD22, у ряда больных экспрессируется молекула FMC-7. Антиген CD79b, или Igb, являющийся частью В-клеточного рецептора, либо не экспрессируется, либо экспрессируется очень слабо в подавляющем большинстве случаев.
Характерный иммунофенотип опухолевых клеток позволяет отличить В-ХЛЛ от других лимфопролиферативных заболеваний.
Е. Matutes и соавт. предложили числовую систему, помогающую при дифференциальной диагностике В-ХЛЛ и других лимфопролиферативных заболеваний. По этой системе каждый иммунологический признак, характерный для В-ХЛЛ, расценивается как 1 балл, его противоположное значение — как 0.
Иммунофенотип опухолевых клеток при различных лимфопролиферативных заболеваниях
Иногда возникают трудности в дифференциальной диагностике хронического лимфолейкоза и так называемого монокло-нового В-лимфоцитоза неопределенного значения (MLUS — monoclonal lymphocytosis of undetermined significance), названного так по аналогии с моноклоновыми гаммапатиями неопределенного значения (MGUS). Термин был впервые введен еще в конце 80-х годов прошлого века для отличия непрогрессирующего моноклонового лимфоцитоза без признаков ХЛЛ от индолентного ХЛЛ с признаками заболевания. В настоящее время чаще употребляется термин CLUS (clonal lymphocytosis of undetermined significance).
При CLUS обычно на протяжении многих лет сохраняются умеренный и стабильный лейкоцитоз и лимфоцитоз (меньше необходимых для диагноза ХЛЛ 5•10 9 /л), нормальные показатели эритро- и тромбоцитопоэза, отсутствует увеличение лимфатических узлов и селезенки.
В наблюдениях С. Wang и соавт. клиническая картина и лабораторные показатели при CLUS оставались неизменными на протяжении 3—10 лет. Клоновая природа лимфоцитоза была подтверждена рестрикцией L-цепи экспрессируемых на поверхности лимфоцитов иммуноглобулинов. Никаких хромосомных аберраций на протяжении всего времени наблюдения выявлено не было. У всех пациентов исследование иммунофенотипа на протяжении всего времени наблюдения обнаруживало экспрессию лимфоцитами антигенов CD19, CD20 и слабую экспрессию поверхностных иммуноглобулинов, однако неизменно выявляло отсутствие экспрессии CD5 и CD23. Таким образом, данные наблюдения не отвечают всем признакам В-ХЛЛ. Однако в большинстве случаев иммунофенотип при CLUS не отличается от типичного иммунофенотипа В-ХЛЛ. A. Rowstron на основании анализа нескольких сотен наблюдений раннего стабильного хронического лимфолейкоза и сравнения их с CLUS указывает, что частота прогрессирования в этих случаях одинакова и не превышает 10 %.
Известно, что истинный хронический лимфолейкоз, имеющий все необходимые для установления диагноза черты, также может годами не проявлять признаков прогрессирования. В подобных случаях имеется характерный для данного заболевания иммунофенотип, а при длительном наблюдении (в одном нашем наблюдении спустя 22 года со времени постановки диагноза) во многих случаях появляются черты прогрессирующего хронического лимфолейкоза. В других наблюдениях клиническая картина сохраняется неизменной на протяжении всей жизни больного.
Мы наблюдали больную в течение 29 лет, которая не получала никакого лечения, поскольку все это время у нее была стабильная гематологическая и клиническая картина: отсутствие увеличенных лимфатических узлов и селезенки, количество лейкоцитов 15—20•10 9 /л, лимфоцитов 65—70 %. Это наблюдение похоже на наблюдения Т. Han и соавт., описавших 10 больных с лейкоцитозом более 10 • 109/л и моноклоновым В-клеточным лимфоцитозом, у которых в течение 6—24 лет не было признаков прогрессирования и которые не нуждались в терапии.
Возможно, эти наблюдения являются отражением возрастного изменения В-клеточного репертуара. Почти 10 лет назад было обнаружено, что у мышей с возрастом постепенно суживается разнообразие клонов В-клеток (В-клеточный репертуар) и одновременно происходит увеличение размеров (амплификация) отдельных клонов. N. Chiorazzi и М. Ferrarini указывают, что у здоровых людей старше 50 лет наличие таких клонов В-лимфоцитов является обычным. Возможно, отдельные клоны, возникшие под влиянием длительной стимуляции определенным антигеном, могут приобретать значительные размеры и определяться при рутинном иммунологическом исследовании.
Обнаруженная недавно в половине исследованных методом FISH случаев CLUS делеция 13ql4, являющаяся самой частой генетической аберрацией при ХЛЛ, подтверждает мнение о том, что CLUS следует расценивать как раннюю стадию хронического лимфолейкоза доброкачественного течения. В то же время P. Ghia и соавт., обследовав 500 здоровых людей старше 65 лет, обнаружили у части из них клоны клеток с иммунофенотипом, характерным для различных лимфопролиферативных заболеваний, иногда у одного и того же больного. Авторы полагают, что это, скорее всего, является не ранней стадией болезни, а отражением постепенно суживающегося с возрастом В-клеточного репертуара.
В 1982 г. описан постоянный поликлоновый В-лимфоцитоз у курящих женщин средних лет. У некоторых из них были частые респираторные заболевания. Это редкий феномен, и со времени первой публикации появилось не более 90 подобных описаний. Исследования с помощью ПЦР показали, что во всех изученных случаях имеется реаранжировка BCL-2/IgH, которая, однако, не всегда сопровождалась повышенной экспрессией BCL-2.
У некоторых курящих женщин с поликлоновым В-лимфоцитозом обнаружены незначительное увеличение размеров селезенки и поликлоновая гамма-патия, которые, как и лимфоцитоз, иногда исчезали после прекращения курения.
Несколько случаев поликлонового В-лимфоцитоза описаны у некурящих. С помощью ПЦР у некоторых пациентов в крови был обнаружен вирус Эпштейна—Барр. Неясно, играет ли этот вирус роль в развитии синдрома поликлонового В-лимфоцитоза.
Очевидно, в настоящее время подобные случаи не являются трудными для дифференциальной диагностики с хроническим лимфолейкозом (ХЛЛ), поскольку поликлоновый характер лимфоцитоза обнаруживается при иммунофенотипировании. Трудности для трактовки представляет описанный недавно случай поликлонового В-клеточного лимфоцитоза с комплексными хромосомными аберрациями — трисомией хромосом 3, 15 и 18, инверсией хромосомы 18, t(13;14) в отдельных клетках у длительно курящей женщины. Гематологическая картина остается стабильной на протяжении нескольких лет наблюдения, но отмечаются часто повторяющиеся инфекции верхних дыхательных путей. Необходимо длительное наблюдение для выяснения вопроса о том, не являются ли имеющиеся хромосомные аберрации отражением начала лимфопролиферативного заболевания.
При некоторых хронических инфекциях (туберкулез, сифилис), иногда при неинфекционных заболеваниях (тиреотоксикоз, болезнь Аддисона) наблюдается постоянный Т-клеточный лимфоцитоз, чаще всего при нормальном количестве лейкоцитов. Его также нетрудно дифференцировать от хронического лимфолейкоза (ХЛЛ) на основании данных иммунологического исследования.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021