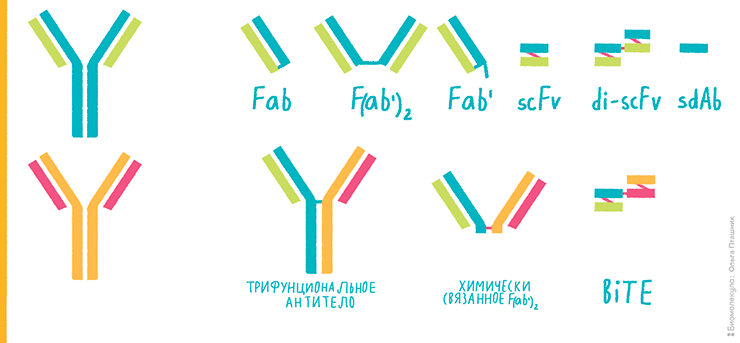иммуноанализ крови что это
Что такое ИФА и для чего он применяется?

Иммуно ферментная диагностика поступила в арсенал медицинских специалистов в 60 — х годах прошлого столетия. На тот момент это был очень сложный, но перспективный анализ. С высоты прошедших десятилетий можно уверенно сказать, что предполагаемый потенциал ИФА раскрылся в полной мере.
Какова область применения ИФА?
Область применения рассматриваемого метода диагностики в современной медицине достаточно широка, при этом основными направлениями являются:
Как работает рассматриваемый метод диагностики?
Метод ИФА использует два основных инструмента: иммунная реакция и ферментная реакция, на практике оба инструмента взаимодействуют, обеспечивая желаемый результат и высокую информативность. Иммунная реакция широко применяется для поиска причин возникновения болезни, болезнетворных бактерий и микробов. В вою очередь, ферментная реакция используется для того, чтобы перевести полученные результаты в форму, доступную для исследований и измерений.
Для диагностики каких заболеваний применяется рассматриваемый метод?
С помощью ИФА можно подтвердить или опровергнуть наличие у человека большого количества заболеваний, наиболее распространенными на сегодняшний день являются:
Как осуществляется подготовка к проведению такого анализа?
Для того, чтобы результаты рассматриваемого метода диагностики оказались достаточно достоверными, «разговорчивыми» и информативными, пациенту следует помнить о правилах забора крови для проведения анализа. Наиболее значимыми, обязательными к соблюдению, являются:
Каковы сроки выполнения такого анализа?

Подводя итог, хочется сказать следующее: иммуно — ферментный анализ — достаточно эффективное, высокоточное исследование, отличающееся высокой информативностью при высокой оперативности проведения.
Сдать кровь на ИФА вы можете в нашей клинике
Врач объяснил, как расшифровать свои анализы на антитела к COVID-19
С результатами подобных анализов корреспондент «Российской газеты» обратилась к сертифицированному специалисту по физической реабилитации, члену Европейской ассоциации амбулаторной реабилитации Леониду Дьякову.
Антитела: иммунный ответ
Леонид Леонидович, в лаборатории люди получают результаты исследования, естественно, безо всяких комментариев. Их отправляют к врачам. Но к ним сейчас пробиться нелегко, да и не каждый рискует сидеть в очередях. В итоге человек мучительно вглядывается в непонятные обозначения, думает, плохо это или хорошо. Расскажите, что значит: «Антитела обнаружены».
Тест на антитела может показать, сталкивался ли человек с коронавирусом, даже если симптомов COVID-19 у него не было. Если антитела обнаружены, значит, организм среагировал на встреченный вирус. Они могут сохраняться, даже если самого вируса в организме уже нет. Этот тест говорит только о том, что произошел некий иммунный ответ.
Таким образом, выявление антител в крови является информативным свидетельством текущего или прошлого инфекционного процесса и помогает выявить стадию развития инфекции.
Обнаружение IgM указывает на недавнее инфицирование SARS-CoV-2. Они появляются непосредственно после контакта с носителем вируса, на третий-четвертый день. Через семь-десять дней они уже точно присутствуют в крови.
Потом они «стареют»?
Леонид Дьяков: Общий период вероятного выявления антител класса M не превышает двух месяцев. В течение этого времени IgM антитела постепенно полностью сменяются на IgG. Последние начинают формироваться в среднем на 21-й день.
Если еще есть IgM, и уже появились иммуноглобулины класса G, то это означает позднюю инфекцию. Просто IgM еще не сошли на нет.
Получается, наличие IgM не обязательно говорит об активной инфекции?
Леонид Дьяков: Да. Эти антитела могут выявляться и на стадии выздоровления.
Когда в крови выявляются только IgG, это говорит о том, что пациент выздоровел, и у него сформировался иммунитет к SARS-CoV-2. Если уровень IgG достаточно высок, то можно стать донором иммунокомпетентной плазмы. Например, IgG больше 40, а IgM больше 1,5, либо IgG больше 80, а IgM равно нулю.
То есть, если в крови выявлены обе группы антител, это означает, что человек уже выздоравливает?
Леонид Дьяков: Совершенно верно. Еще раз повторю: иммуноглобулины М говорят о том, что человек в данный момент болеет коронавирусом. Это не обязательно тяжелые формы, состояние может быть и бессимптомным. А иммуноглобулины G говорят о том, перенес ли он коронавирусную инфекцию в прошлом.
Далее, в графе «Дополнительная информация», вообще непонятная шифровка. А чем непонятнее, тем ведь страшнее. К примеру, вот передо мной результаты, переданные одним пациентом: «ОПсыв 0,0338; КП 1,45». Что кроется за этим?
От чего зависит количество антител в организме?
Лучше не болеть
Заразен ли человек, чей анализ мы расшифровываем?
Леонид Дьяков: По данному тесту нельзя определить, заразен ли еще человек. В принципе, с такими показателями, которые вы предоставили, пациент не заразен.
Но чтобы достоверно знать это, следует все же сдать еще мазок. Именно он покажет, выделяется ли вирус во внешнюю среду. Если он будет отрицательный, то человек стопроцентно не заразен. Без этой уверенности я бы рекомендовал соблюдение мер социальной дистанции и индивидуальной защиты даже в случае обнаружения только антител класса IgG.
А вы верите в то, что все должны переболеть, и тогда с эпидемией будет покончено?
Леонид Дьяков: В этом, конечно, есть логика. Но проблема в том, что вирус дает достаточно серьезные осложнения. И не все болеют в легкой или бессимптомной форме.
Люди, узнавшие что у них обнаружены антитела, начинают думать, когда же, где подхватили заразу. Вспоминают, когда болели. Может ли данный тест показывать антитела не только на COVID-19, но и на перенесенные другие ОРЗ или ОРВИ?
Леонид Дьяков: Исключено. Это специфичный тест именно на антитела к коронавирусной инфекции.
Человек припомнил, что сильно болел в феврале, ему было очень плохо. Мог тогда быть коронавирус?
Леонид Дьяков: Иммуноглобулин G с тех пор не сохранился бы.
То есть, носители антител могут, в принципе, радоваться, что переболели коронавирусом, практически не заметив этого?
Леонид Дьяков: Те, кто переболел легко или бессимптомно, вырабатывают низкий уровень иммуноглобулина G и могут заболеть повторно.
Чем тяжелее протекает заболевание, тем больше антител произведет иммунная система, и тем дольше они проживут в крови после болезни.
Однако есть информация, что сохраняются так называемые клетки памяти. Организм запоминает, как вырабатывать эти антитела, при каких условиях и в каком количестве. И в случае повторного контакта с вирусом организм начинает синтезировать IgG-антитела значительно быстрее, не за 21 день, а за три. И они способны «смягчать» течение заболевания, препятствовать развитию тяжелых осложнений.
Дышите глубже
Получается, что в принципе сдавать тест на антитела и не совсем нужно. Какая разница, болел человек или нет, если этого особо и не заметил, а никаких таких преимуществ наличие антител не дает. Все так же нужно предохраняться от заражения…
Леонид Дьяков: Мое личное мнение, если человек чувствует себя хорошо, особой надобности в тестировании нет. Ведь с тем же успехом можно поискать у себя вирус герпеса и другие.
Однако тестирование поможет решить проблему в более глобальном масштабе, выработать стратегию борьбы с коронавирусом, поскольку по количеству иммунных людей можно спрогнозировать, когда случится спад эпидемии.
Что делать тем, у кого обнаружены антитела класса IgM?
Леонид Дьяков: Если нет явных признаков заболевания, нужно побольше двигаться, гулять на свежем воздухе, дышать полной грудью, чтобы работали легкие, а кислород циркулировал в крови.
Все материалы сюжета «COVID-19. Мы справимся!» читайте здесь.
ИФА и ПЦР: просто о сложных лабораторных методах диагностики инфекций
Опубликовано 29 ноября 2014 пользователем a.ultanbay
В лабораторной диагностике существует множество методов выявления необходимого элемента в биоматериале. Для диагностики инфекционных заболеваний чаще всего используют два принципиально разных метода: ИФА и ПЦР. Мы предлагаем Вам ознакомиться с данными методами, чтоб понять плюсы и минусы каждого из них.
ПЦР – один из самых наукоемких методов. Он обнаруживает ДНК микроорганизма. Генетический материал индивидуален для любого микроба, а это значит, что метод обладает самой высокой специфичностью и не может «обознаться». Принцип ПЦР заключается в том, что в пробирке происходит многократное удвоение искомого генетического кода. В случае присутствия даже незначительного количества этого кода, произойдет увеличение его количества, и анализатор сможет «уловить» его наличие. Таким образом, ПЦР – «золотой стандарт» выявления инфекционных агентов. Однако, у этого метода есть и свои минусы. Во-первых, в отличие от ИФА, ПЦР может сказать о наличии возбудителя только в месте взятия биоматериала, которое ограничено мазком (например, с уретры или из носа). Во-вторых, за счет своей высокой чувствительности, ПЦР может обнаружить даже мертвые частицы микробов, что наблюдается сразу после лечения. В таком случае, результат будет ложноположительный.
Резюмируя вышесказанное, приведем таблицу сравнения этих двух методов друг с другом:
Антитела к коронавирусу. Что важно знать.
Коронавирусная инфекция изменила жизнь почти всей планеты в целом и каждого из нас в частности. Инфекция часто протекает без симптомов или в лёгкой форме. Как узнать, переболел я или нет (ведь кашлял же зимой)? Являюсь ли безопасным для окружающих? Могу без страха навещать бабушку, маму, друзей? Эти и другие вопросы волнуют многих людей. Прошло достаточно времени чтобы появилась возможность ответить на них. Для оценки возможного иммунитета есть скрининговое исследование на антитела к коронавирусу (IgM и IgG).
Коронавирусная инфекция
Что такое антитела к коронавирусу?
Антитела, или иммуноглобулины – специальные белки, которые вырабатывает иммунная система в ответ на попадание любого инфекционного агента, в том числе CoV-2 в организм человека, даже если не было ярких признаков болезни. Антитела распознают коронавирус, обезвреживают и сохраняют информацию об инфекции на случай новой встречи с инфекцией.
Как образуются антитела?
На первой неделе заболевания начинают синтезироваться иммуноглобулины М (IgM). Они первыми встречаются с инфекцией, поэтому считаются маркерами острой первичной инфекции. Однако, тест на определение антител класса М может давать неспецифическую реакцию, что в ряде случаев приводит к ложноположительному результату. Поскольку на антитела класса М возложена ответственность первыми начать отражать инфекцию и сделать максимально быстро, то эти белки не очень специфичны и могут не очень точно улавливать вирус. К неспецифической реакции с тест- системой могут привести процессы, связанные с воспалением в организме: острые и хронические воспалительные процессы, аутоиммунные заболевания, проблемы с щитовидной железой, беременность и так далее. Это называется «ложноположительный» результат.
При стандартном инфекционном заболевании (в том числе и при коронавирусной инфекции) обычно антитела IgM через месяц исчезают, заменяясь на более специфичные антитела IgG. Однако учёные выяснили, что при коронавирусе IgM могут сохраняться длительное время (до 1,5-3 месяцев от появления симптомов, когда уже сам вирус давно не обнаруживается).
Иммуноглобулины А (IgA) также вырабатываются в острый период инфекции. Их основная цель – защитить слизистые оболочки от коронавируса. IgA более избирательны (специфичны), вырабатываются строго на коронавирус. Их уровень снижается после выздоровления, примерно к 1,5- 2 месяцам после инфицирования.
Иммуноглобулины G (IgG) синтезируются последними, через 5-6 недель с момента попадания вируса в организм, и сохраняют информацию о коронавирусе. Обычно IgG являются архивом памяти перенесеных инфекций, в большинстве случаев пожизненно, либо на несколько лет. Механизмы развития иммунной реакции на коронавирус пока изучаются. Неясно, стойкий иммунитет формируется или нет. Это предстоит узнать. Но в любом случае, выявление IgG свидетельствует о факте попадания коронавируса в организм и иммунном ответе организма.
Лаборатория KDL представляет линейку тестов на определение антител к новой коронавирусной инфекции.
Кому они показаны?
Также возможно анонимное выполнение исследование на антитела к коронавирусу с указанием возраста и пола.
Давайте о каждом исследовании по порядку.
Это комплексный тест, скрининговый. Одновременно определяет иммуноглобулины классов М и G, результат по каждому антителу. Выполняется иммунохроматографическим методом (ИХГА). Ответ выдаётся в формате «обнаружено/не обнаружено».
Как понимать результат исследования?
Если Ig M (+) обнаружены, IgG (-)не обнаружены:
Поэтому целесообразно провести исследование мазка из зева методом ПЦР. Если результат ПЦР отрицательный или нет признаков болезни, повторить тест на антитела через 2-3 недели.
Если IgM (+) обнаружены, IgG (+) обнаружены:
Если IgM (-) не обнаружены, IgG (+) обнаружены:
Если IgM (-) не обнаружены, IgG (-) не обнаружены:
Тест выполняется методом ИФА на анализаторе, производитель Евроиммун, Германия. Результат выдается в виде цифрового значения (коэффициент позитивности = КП).
IgA – показатели ранней инфекции, являются более точными в отличие от IgM, поскольку более специфичны.
Как правильно прочитать результат?
Положительный результат – более 1,1. Говорит об обнаружении IgA и может означать:
Пограничный результат – в интервале 0,8 – 1,1. Требует повторного исследования через 2 недели, поскольку может означать:
Отрицательный результат –менее 0,8. Означает отсутствие антител IgA, что возможно, если:
Исследование выполняется на анализаторе методом ИФА, производитель Евроиммун, Германия. Результат в виде цифрового значения (коэффициент позитивности = КП).
Расшифровка результатов:
Положительный результат –более 1,1. IgG выявлены, а это может быть в следующих случаях:
Пограничный результат –в интервале 0,8 – 1,1.
Возможно, IgG ещё немного, что требует повторить исследование через 2 недели и возможно, когда:
Отрицательный результат –менее 0,8.
IgG не обнаружены, что может быть, если:
Выполняется методом ИФА, методика автоматизированная, тест-системы российского производства. Заключение в виде цифры (коэффициент позитивности)
Выявление антител класса IgG говорит о наличии иммунного ответа на встречу с инфекцией в прошлом и является признаком перенесенного заболевания
Нужна ли специальная подготовка для определения антител к коронавирусу?
Подготовка не нужна. Для исследования сдаётся венозная кровь утром натощак или днём в часы работы медицинских офисов через 3 часа после еды. Чистую воду без газа пить можно.
Обращаю Ваше внимание, что все результаты исследований должен интерпретировать врач! Ведь полноценная картина складывается из данных истории болезни, осмотра, лабораторных и инструментальных данных. Будьте здоровы с лабораторией KDL, берегите себя и близких!
12 методов в картинках: иммунологические технологии
Авторы
Редакторы
За сотни тысяч лет эволюции иммунная система выработала множество инструментов для сражений с патогенами. Один из главных — антитело: белок, способный необычайно избирательно связываться с характерными кусочками молекул — антигенами. Несколько десятилетий назад биологам удалось «приручить» антитела: научиться производить их к нужным антигенам в любом количестве. И это открыло новую страницу в молекулярной биологии: появились иммунологические методики. Благодаря им мы можем «поймать» в растворе, клетке или срезе ткани почти любые молекулы и понять, сколько их, где именно они находятся и как взаимодействуют с другими молекулами.
12 биологических методов в картинках
Генеральный партнер цикла — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Партнер этой статьи — GE Healthcare
GE Healthcare Life Sciences — производитель высокотехнологичного оборудования, предоставляющий опыт, инновационные решения и широкий спектр услуг для создания крупносерийного биофармацевтического производства, разработки новых лекарств и вакцин, исследования клеток и белков. Обладая всеми биотехнологическими, инженерными и производственными возможностями, мы помогаем нашим заказчикам по всему миру занимать лидирующие позиции на рынке. Глубокая экспертиза, ресурсы, международное присутствие и инновационные разработки GE Healthcare Life Sciences дают возможность нашим клиентам создавать гибкое и экономически эффективное производство биофармпрепаратов.
Одна из главных миссий «Биомолекулы» — докопаться до самых корней. Мы не просто рассказываем, какие новые факты обнаружили исследователи — мы говорим о том, как они их обнаружили, стараемся объяснить принципы биологических методик. Как вытащить ген из одного организма и вставить в другой? Как проследить в огромной клетке за судьбой нескольких крошечных молекул? Как возбудить одну крохотную группу нейронов в огромном мозге?
И вот мы решили рассказать о лабораторных методах более системно, собрать воедино в одной рубрике самые главные, самые современные биологические методики. Чтоб было интереснее и нагляднее, мы густо проиллюстрировали статьи и даже кое-где добавили анимации. Мы хотим, чтобы статьи новой рубрики были интересны и понятны даже случайному прохожему. И с другой стороны — чтобы они были так подробны, что даже профессионал мог бы обнаружить в них что-то новое. Мы собрали методики в 12 больших групп и собираемся сделать на их основе биометодический календарь. Ждите обновлений!
Что такое иммунные методы и почему они имеют к иммунитету самое отдаленное отношение
Распознавать молекулы — это значит связываться с ними куда прочнее, чем с другими молекулами; для измерения прочности связывания существует специальная величина — сродство, или константа диссоциации.
Если говорить совсем точно, то антиген — это не всегда целая молекула, а иногда просто характерный кусочек молекулы.
В какой-то момент ученые поняли, что если антитела умеют специфично узнавать различные антигены, то можно это их свойство использовать в собственных, научных интересах. Так исследователи в своих лабораториях стали получать антитела с заданной специфичностью — очень избирательно узнающие один, определенный, нужный исследователям антиген, и ничего больше. И это стало огромным прорывом.
Представьте, например, что нам нужно исследовать опасный белок, который вырабатывают только раковые клетки и не вырабатывают здоровые. Антитело к этому белку — своеобразная «удочка», которая ловит только его и никого больше. Выловив на антительный «крючок» нехорошую молекулу, мы можем внимательно ее изучить, сделать какие-то важные выводы о ее функционировании, определить концентрацию, попытаться найти слабые места, чтобы в дальнейшем сделать против нее лекарство. Можем обнаружить все производящие ее клетки (в нашем случае — раковые!) — их распространение, количество и так далее.
Можно антитела использовать и для других, более сложных, целей. Например, к ним можно «пришивать» разноцветные флуоресцентные молекулы, а потом «сажать» на соответствующие антигены. В результате эти антигены станут светиться, и мы сможем изучать взаимодействия важных молекул даже в живой клетке. Также использование антител позволяет изучать и такие белки, которые связаны с ДНК и оказывают непосредственное влияние на процесс транскрипции.
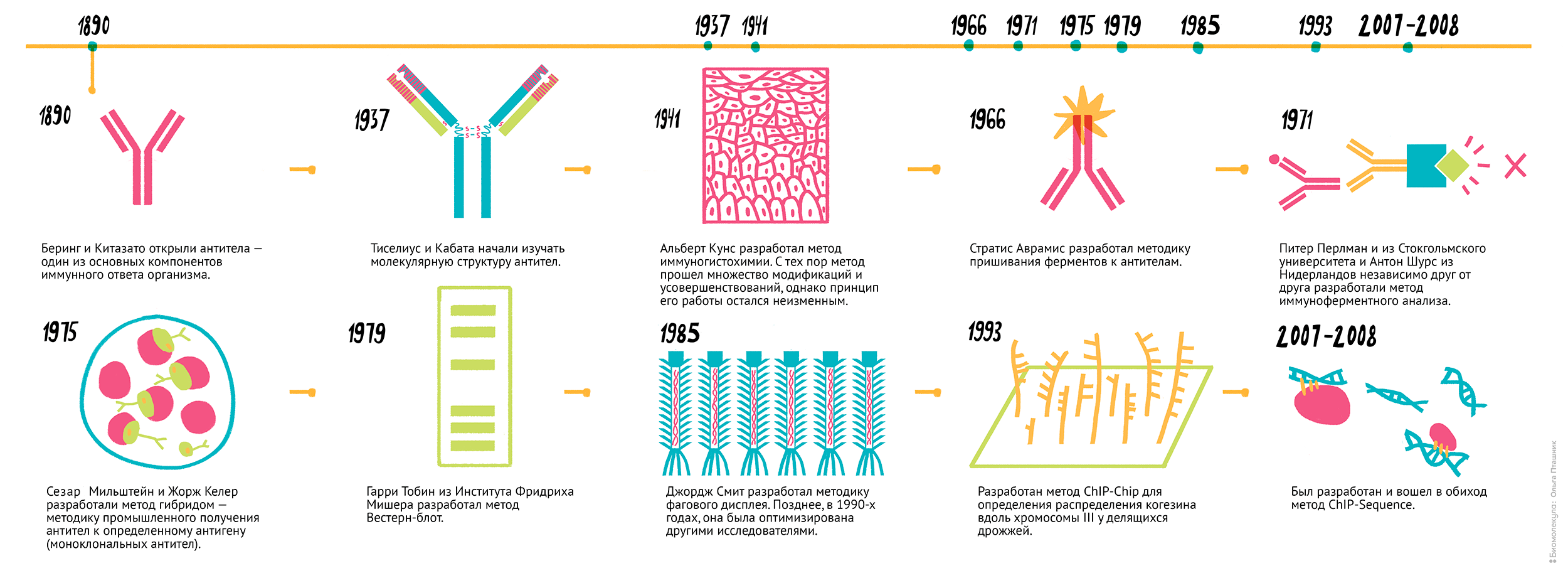
Как правило, методы, которые в качестве инструментов используют антитела, несут в своем названии приставку «иммуно-»: иммунопреципитация, иммунохроматография, иммуноферментный анализ (рис. 1). Именно о таких методах мы и расскажем в этой статье.
Рисунок 1. Несколько вех на пути развития иммунологических технологий. 1890 г. — Беринг и Китазато открыли антитела — один из основных компонентов иммунного ответа организма. 1937 г. — Тиселиус и Кабата начали изучать молекулярную структуру антител. 1941 г. — Альберт Кунс разработал метод иммуногистохимии [1]. С тех пор метод прошел множество модификаций и усовершенствований, однако принцип его работы остался неизменным. 1966–1969 г. — Стратис Аврамис разработал методику пришивания ферментов к антителам (чуть позже вы поймете, насколько это важно) [2]. 1971 г. — Питер Перлман из Стокгольмского университета и Антон Шурс из Нидерландов независимо друг от друга разработали метод иммуноферментного анализа [3], [4]. 1975 г. — Сезар Мильштейн и Жорж Келер разработали метод гибридом — методику промышленного получения антител к определенному антигену (моноклональных антител). 1979 г. — Гарри Тобин из Института Фридриха Мишера разработал метод вестерн-блоттинг [5]. 1985 г. — Джордж Смит разработал методику фагового дисплея [6]. Позднее, в 1990-х годах, ее оптимизировали другие исследователи. 1999 г. — Разработали метод ChIP-chip для определения распределения когезина вдоль хромосомы III у делящихся дрожжей [7]. 2007–2008 г. — Появился и вошел в обиход метод ChIP-sequence [8].
Чтобы увидеть рисунок в полном размере, нажмите на него.
Действующие лица
В этом разделе мы представляем вам главные молекулы-инструменты, используемые в иммунологических методах.
Антитела
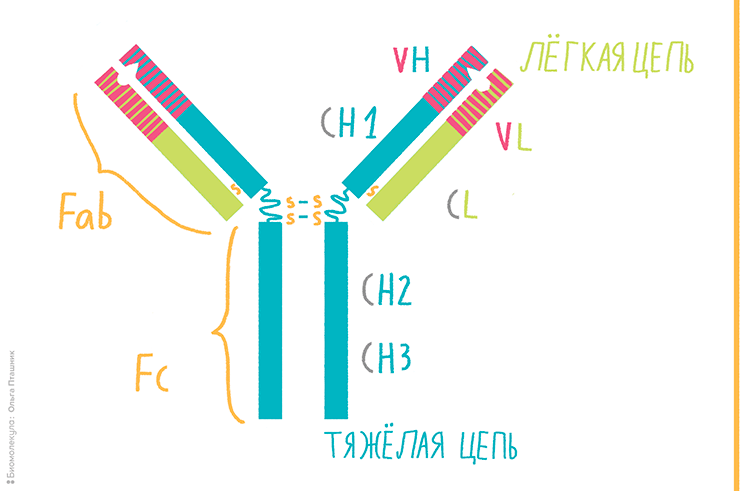
Антитело, или иммуноглобулин, — это крупный белок, состоящий, как правило, из двух тяжелых и двух легких цепей. Тяжелые и легкие цепи, в свою очередь, состоят из вариабельных (V) и константных (С) доменов. Тяжелые цепи содержат один вариабельный (VH) и три константных домена (СH1, СH2, СH3), легкие цепи — один вариабельный (VL) и один константный (СL) домены (рис. 2) [9]. Именно такое строение обеспечивает способность антител узнавать конкретные антигены (это называется вариабельностью антител и осуществляется V-доменами) и взаимодействовать с клетками собственной иммунной системы (эффекторная функция антител; за нее ответственны C-домены).
Рисунок 2. Строение антитела. Вариабельные домены легкой и тяжелой цепей (VH и VL) вместе с ближайшими к ним константными доменами (CH1 и CL1) образуют Fab-фрагменты антител (fragment antigen binding). Именно этими фрагментами антитело «цепляется» за свой антиген. Остальную часть, представленную C-концевыми константными доменами тяжелых цепей, обозначают как Fc-фрагмент (fragment crystallizable), которым антитело может цепляться за Fc-рецепторы, расположенные на некоторых иммунных клетках. На границе Fab и Fc фрагментов располагается гибкая «шарнирная область», благодаря которой фрагменты антитела могут двигаться друг относительно друга; эта область содержит дисульфидные связи, соединяющие тяжелые цепи между собой [9].
Каждое антитело распознает свой антиген и только его. А вот на каждый антиген может быть множество разных антител, которые распознают разные его участки (эпитопы). Разные антитела на один антиген называются поликлональными, то есть, состоящими из множества клонов — популяций антител. А идентичные друг другу, одинаковые молекулы антител называют моноклональными [10]. Поликлональные антитела куда дешевле и проще в производстве, чем моноклональные, но в иммунологических методиках чаще используют моноклональные, потому что они — абсолютно одинаковые молекулы, они гарантированно распознают один и тот же участок одного и того же антигена и потому гораздо стабильнее ведут себя в иммунологических методиках.
Антитело по своей структуре — эдакий Тянитолкай. С одной стороны у него находится связывающая антиген область (Fab-фрагмент), с другой стороны — «хвосты» тяжелых цепей — Fc-фрагмент. И для некоторых задач исследователю выгодно использовать не всё антитело, а лишь какую-то его часть. Так, можно взять Fc-фрагмент и пришить к нему какую-то другую молекулу (например, главный комплекс гистосовместимости (MHC)). Это увеличит время жизни молекулы в сыворотке крови и позволит связываться с рецепторами для антител (Fc-рецепторами). А можно использовать лишь Fab-фрагмент или комбинировать Fab-фрагменты различной специфичности, создавая так называемые биспецифические антитела. Кроме того, можно использовать не весь Fab-фрагмент, а лишь пару вариабельных доменов антитела и также комбинировать их. На рисунке 3 представлены различные варианты таких конструкций.
Рисунок 3. Конструкции на основе комбинаций фрагментов антител. Исходные антитела нарисованы слева сине-зеленым и оранжево-розовым. Пояснения — в тексте.
Их фрагменты и комбинации представляют собой:
Ловушки для антител
Для многих иммунных методик важно надежно закрепить молекулы антител на каком-то твердом носителе. Этих носителей есть несколько типов (рис. 4):
Рисунок 4. Ловушки для антител — носители, на которых можно надежно закрепить антитела. Пояснения — в тексте.
Как увидеть антитела
Антитела — это бесцветные белки, и сами по себе увидеть их в реакционной смеси невозможно. Поэтому если мы что-то пометили антителами, то эти самые антитела нам потом нужно как-то визуализировать, сделать видимыми. Для этого есть несколько остроумных способов (рис. 5).
Фермент и субстрат
Можно пришить к антителу какой-нибудь фермент, катализирующий «цветную» химическую реакцию. Обычно это пероксидаза хрена или щелочная фосфатаза. Теперь, когда мы добавляем в реакционную смесь субстрат используемого фермента (DAB или BCIP/NBT соответственно), то, если там есть антитело с пришитым к нему ферментом, субстрат расщепится, произойдет «цветная» реакция, и по изменению цвета реакционной смеси мы сможем понять, есть ли в этой смеси фермент и сколько его — а значит, и сколько там антител.
Флуоресцентная метка
Можно не заморачиваться с двухэтапной системой «фермент—субстрат» и сразу пришить к антителу цветную флуоресцентную метку [11]. Правда, в этом случае, чтобы увидеть результат, нам придется использовать флуоресцентный микроскоп [12].
Рисунок 5. Визуализация антител. Слева: к антителу пришит фермент, катализирующий «цветную» реакцию (то есть, такую, в которой субстрат меняет цвет). И чтобы узнать, есть ли в смеси эти антитела, достаточно добавить в эту смесь субстрат для данного фермента. Если смесь поменяла цвет — значит, антитела есть. Измерив с помощью спектрофотометра, насколько смесь поменяла цвет, можно определить и количество антител. Справа: антитела с пришитыми к ним флуоресцентными метками можно увидеть с помощью флуоресцентного микроскопа и определить, где эти антитела находятся и в каких количествах. К тому же, это очень красиво.
Иммунологические методы
А теперь, когда мы овладели всей подготовительной информацией, пришло время перейти собственно к иммунологическим методикам.
Иммунопреципитация и коиммунопреципитация
Уникальное свойство антител — возможность налипать только на соответствующие антигены — делает их своего рода «волшебными магнитами» в руках биотехнолога. С помощью антител можно обнаруживать нужные молекулы (как правило, белки) среди ненужных; выделять эти нужные молекулы, очищать их, определять их количество и так далее. Методы, основанные на использовании антител, можно применять и для изучения сложной белковой смеси, или, говоря научным языком, протеома. Рассмотрение иммунных методов мы начнем с одного из самых простых — иммунопреципитации.
Иммунопреципитация — способ, с помощью которого можно выделить из смеси и осадить (precipitate) ту молекулу, которая нас интересует (как правило, это белок; назовем его «Белок Х»).
Рисунок 6. Анимированная схема иммунопреципитации. Пояснения — в тексте.
Последовательность действия при иммунопреципитации такова (рис. 6):
Коиммунопреципитация похожа на иммунопреципитацию, только немного сложней. Она предназначена для выделения антигена вместе с белками, которые с ним связаны. В таких случаях известный антиген называют белком-приманкой (bait protein), а белки, с которыми он взаимодействует, белками-жертвами (prey protein(s)). Жертвами могут быть структурные белки, сигнальные молекулы, кофакторы и т. д.
Анализ белок-белковых взаимодействий со скоростью света!
Метод иммунопреципитации используют также при проведении анализа белков с использованием технологии интерферометрии слоя биомолекул (bio-layer interferometry, BLI), позволяющей не только определять количество целевых макромолекул в растворе, но и анализировать взаимодействие лигандных молекул с молекулами-рецепторами в динамике.
Системы Blitz и Octet, производимые компанией ForteBio (Pall) используют специальный биосенсор, который представляет собой светопроводящую иглу, чей конец покрыт биосовместимым матриксом.
На матриксе иммобилизованы структуры, которые способны специфически связываться с определенными биомолекулами, например, с Fab- или Fc-фрагментами антител человека или мыши, аффинными концевыми структурами белков (GST или олигогистидиновыми), биотинилированными молекулами.
При взаимодействии анализируемых молекул с биосенсором происходит изменение преломления светового пучка внутри биосенсора, которое регистрируется прибором и отображается на мониторе компьютера в виде кривых ассоциации/диссоциации.
Приборы Blitz и Octet применяют как для измерения концентрации специфических белков в диапазоне от 25 нг/мкл до 2 мг/мл, так и для изучения констант ассоциации/диссоциации при изучении межмолекулярных взаимодействий. При этом измерение констант происходит в режиме реального времени, не требуется специфического мечения анализируемых молекул, а образец остается интактным.
Материал предоставлен партнёром — компанией «Диаэм»
Анализ белок-белковых взаимодействий с помощью прибора Biacore TM T200 от компании GE Healthcare
Biacore* T200 — это универсальная система для изучения взаимодействий биомолекул как на ранних этапах исследований, так и во время поиска и разработки новых лекарств. Принцип действия прибора — плазмонный резонанс.
Система Biacore T200 позволяет получить надежные данные о кинетике, сродстве, концентрации, специфичности, селективности и термодинамических свойствах исследуемых взаимодействий в режиме реального времени.
Производительность и универсальность Biacore T200 позволяют использовать ее для широкого спектра приложений:
Компания GE Healthcare поддерживает проведение ежегодной школы по плазмонному резонансу в Москве: «В Москве прошла научная школа „Применение SPR-биосенсоров Biacore в разработках лекарств“» [13].
Материал предоставлен партнёром — компанией «GE Healthcare»
Иммуноферментный анализ
Иммуноферментный анализ (ИФА, по-английски ELISA — enzyme-linked immunosorbent assay) используется для определения, присутствует ли в растворе искомый Белок Х, и если да, то в каких количествах. Этот метод, как и иммунопреципитация, похож на сказку «Репка», но цепочка «тянущих репку» немного длиннее. Схема ИФА показана на рисунке 7:
Рисунок 7. Анимированная схема иммуноферментного анализа. Пояснения — в тексте.
В принципе, можно избавиться от шагов 8 и 9, если сразу к антителам к Белку Х пришить фермент. Но вторичные антитела прекрасны тем, что «размножают» сигнал: на одно первичное антитело может налипнуть сразу несколько вторичных, и тогда можно будет «поймать» даже ничтожно маленькую концентрацию Белка Х. Кроме того, вторичные антитела можно использовать в экспериментах с любыми Белками Х, потому что они специфичны не к ним, а к антителам, «поймавшим» белок.
Другие варианты ИФА
Это был классический вариант ИФА, а теперь рассмотрим его модификации.
Например, для детекции малых количеств антигена в пробе используют так называемый сэндвич-ИФА. В лунки планшета изначально вносят антитела, специфичные к детектируемому антигену, которые прилипают к поверхности пластика. Дальше повторяются уже известные нам шаги: добавляется антиген, а следом за ним еще одни антитела, специфичные к нему. Получается структура, действительно напоминающая сэндвич: антиген оказывается между двумя антителами и «не теряется»: удается определить даже крохотные его количества.
Конкурирующий ИФА — еще одна модификация метода, в которой исследуют концентрацию не антигена, а наоборот, антител. Если вы когда-нибудь сдавали кровь на антитела, то анализ проводили именно этим способом. В этом случае в лунки планшета, в которые нанесен антиген, добавляют исследуемые антитела (например, сыворотка крови) — назовем их «антителами А» — и антитела, помеченные ферментом, специфичным к антигену («антитела Б»). Между антителами разгорается нешуточная борьба за право связаться с антигеном. Соответственно, чем меньше в пробе «антител А», тем больше «антител Б» свяжется с антигеном и тем ярче будет сигнал.
Мультиплексная ИФА, технология xMAP: море информации в капле образца
Многие процессы, происходящие в живых организмах, динамичны и многокомпонентны. Иногда требуется проводить иммуноферментный анализ нескольких десятков белков, дабы определить общую картину. Учитывая количество аналитов и длительность ИФА, такой подход не очень удобен и совсем не быстр.
Для решения таких комплексных задач применяют мультиплексный анализ на основе технологий микрочастиц. Компания Merсk (Millipore) предлагает оборудование и реактивы для мультиплексного анализа с использованием технологии Luminex xMAP, позволяющей одновременно определять до нескольких сотен аналитов в одном образце.
В основе технологии — использование полимерных микросфер, несущих на поверхности зонды к определенным молекулам. Микросферы содержат два флуорофора в различных концентрациях, соотношение которых позволяет создавать разные спектральные характеристики у разных микросфер. Каждый тип частиц несет уникальный вид зонда и обладает уникальным спектром. Этот спектр распознается анализатором Luminex — MAGPIX, Luminex 200, Bio-Plex 3D.
Материал предоставлен партнёром — компанией «Диаэм»
Вестерн-блоттинг
Вестерн-блоттинг (англ. western blot) — еще один метод, в котором с помощью антител ученый может поймать нужный ему белок среди множества других. Последовательность этой «молекулярной рыбалки» очень похожа на ИФА, только «ловля» происходит не в лунке планшета, а на нитроцеллюлозной мембране (см. раздел «Ловушки для антител»). Схема вестерн-блоттинга показана на рисунке 8:
Рисунок 8. Анимированная схема вестерн-блоттинга. Пояснения — в тексте.
При проведении вестерн-блоттинга можно, конечно, использовать все те же ферменты и субстраты, что и в ИФА. Однако чаще удобнее получить сигнал в виде «светящейся» реакции — хемилюминесценции, которую легко детектировать при помощи рентгеновской пленки. Так у исследователя есть возможность попробовать разное время экспозиции пленки и, соответственно, получить серию снимков, из которых позже выбрать нужный с оптимальным соотношением сигнал—фон. К тому же, после проведения эксперимента вторичные антитела можно легко отмыть и использовать мембрану еще раз. Наиболее часто в качестве фермента при вестерн-блоттинге используется пероксидаза хрена, окисляющая люминол в присутствии пероксида водорода.
«Компас-блоттинг»
Любопытна история происхождения названия «вестерн-блоттинг». В середине 70-х годов XX века исследователь Эдвин Саузерн опубликовал новый метод детекции определенных последовательностей ДНК, позже названный в его честь, — саузерн-блоттинг (southern blot, то есть буквально — южный блоттинг). Двумя годами позже придумали похожий метод для детекции РНК, который по аналогии назвали нозерн-блоттингом (northern blot — северный блоттинг). Вестерн-блоттинг (western blot — западный блоттинг; см. видео) как метод детекции белков и истерн-блоттинг (eastern blot — восточный блоттинг) для изучения посттрансляционных модификаций белков появились вслед за ними. Волна увлечения «географическими» названиями на этом не закончилась, и сейчас в биохимии и молекулярной биологии можно найти такие экзотические методы, как саусвестерн-блоттинг (southwestern blot — юго-западный блоттинг) — метод идентификации ДНК-связывающих белков, и другие.
Видео. Производственная драма из лабораторной жизни. Увы! Не всегда миллион сделанных вами вестерн-блотов приведет к всемирной славе и публикации в Cell.
Оборудование «Диаэм» для иммуноблоттинга
Компания «Диаэм» предлагает широкий спектр оборудования и справочных материалов по методике иммуноблоттинга:
Материал предоставлен партнёром — компанией «Диаэм»
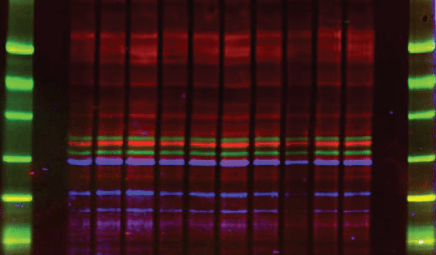
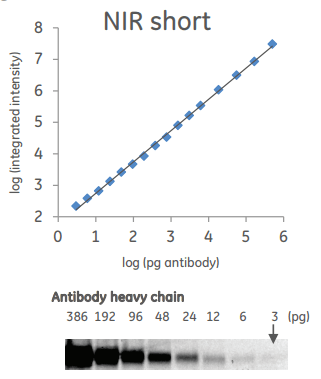
Сократите время эксперимента посредством регистрации трех белков на одном блоте с помощью прибора Amersham TM Typhoon TM NIR Plus от GE Healthcare
Один из возможных методов визуализации белков при вестерн-блот-анализе — использование специального прибора-сканера, считывающего флуоресцентный сигнал от меток, пришитых к вторичным антителам. Компания GE Healthcare представляет сканер нового поколения Amersham TM Typhoon TM * NIR Plus, позволяющий визуализировать и делать количественную оценку целых трех сигналов на одном блоте. Такой подход существенно уменьшает время эксперимента, позволяет избежать вариабельности между различными блотами и экономит количество исследуемого образца.
Визуализация двух исследуемых белков и нормализация по общему количеству белка в пробе на приборе Amersham TM Typhoon TM NIR Plus с использованием реагентов Amersham TM QuickStain Reagents.
Количественная оценка содержания детектируемого белка в пробах, анализируемых методом вестерн-блоттинг
Amersham TM Typhoon TM NIR Plus обладает большой площадью сканирования (40×46 см 2 ) и разрешением в 10 мкм, что позволяет использовать его не только для проявки вестерн-блота, но и для сканирования 96-луночных планшетов при считывании результатов иммуноферментного анализа. Таким образом, этот прибор можно использовать при проведении широкого спектра экспериментов.
Типы проб, которые можно анализировать при помощи Amersham TM Typhoon TM NIR Plus:
Базовая комплектация прибора Amersham TM Typhoon TM NIR Plus включает в себя три лазера, однако она может быть доукомплектована еще двумя лазерными модулями, что существенно расширяет ее функциональность. Простой и понятный интерфейс программного обеспечения сделает работу на приборе максимально комфортной и продуктивной.
Материал предоставлен партнёром — компанией «GE Healthcare»
Иммунохроматография
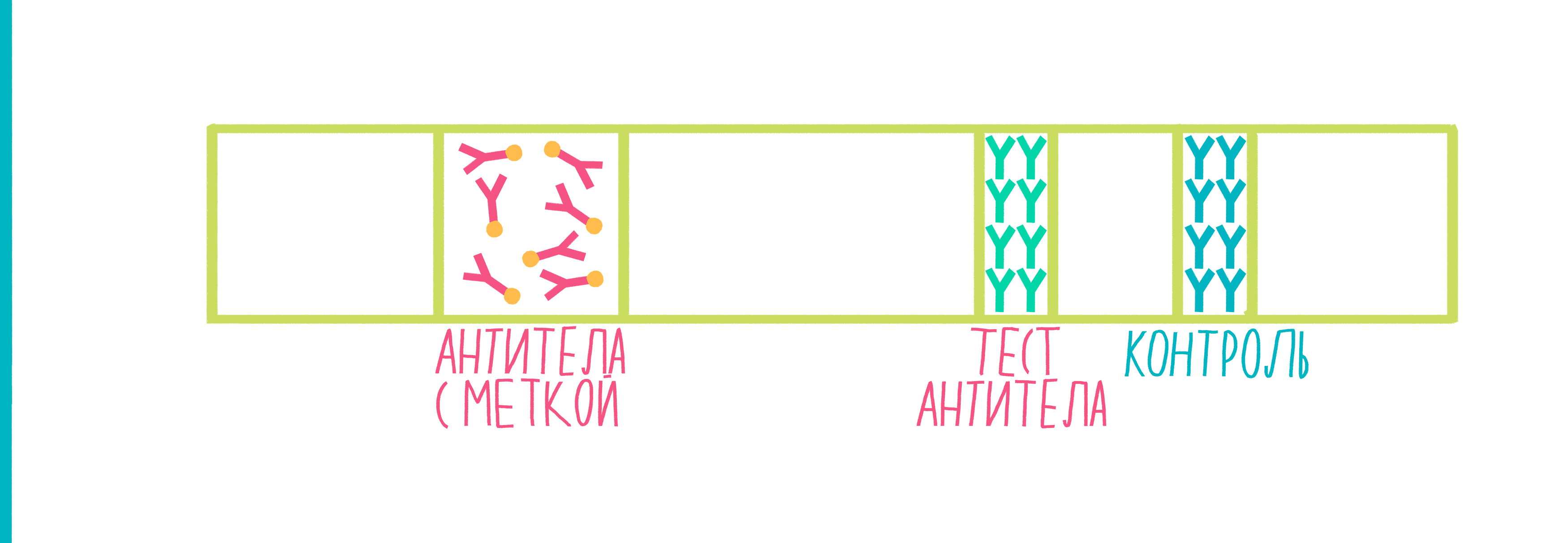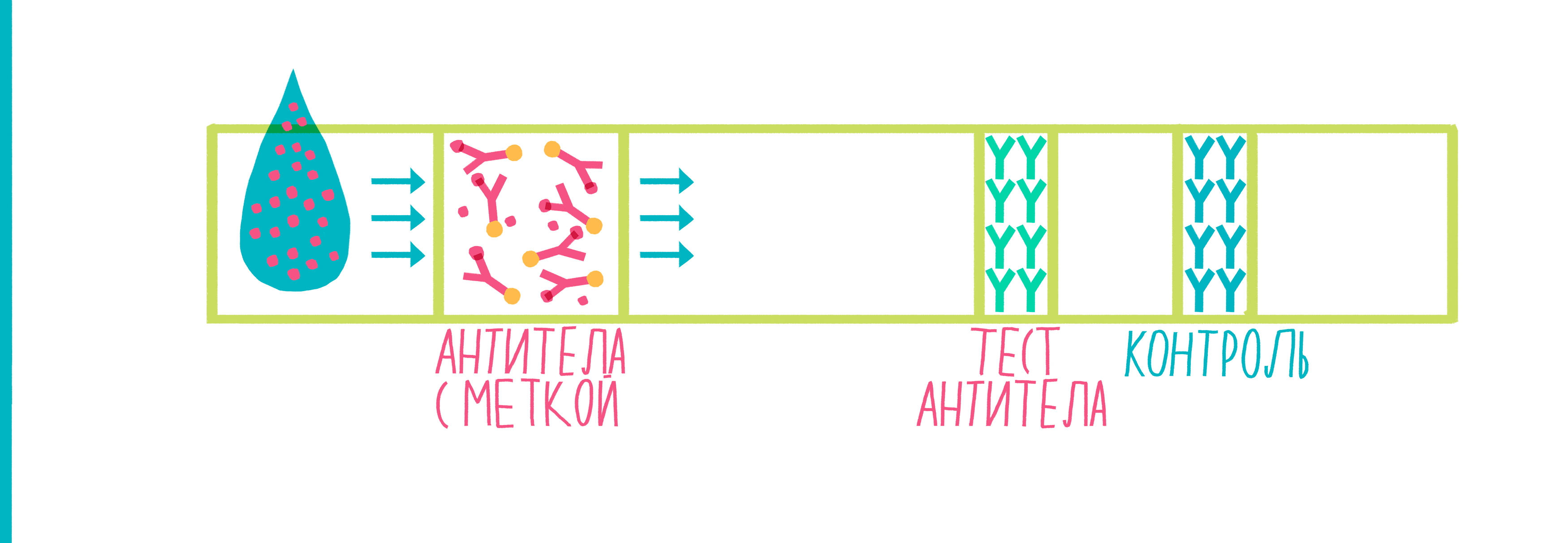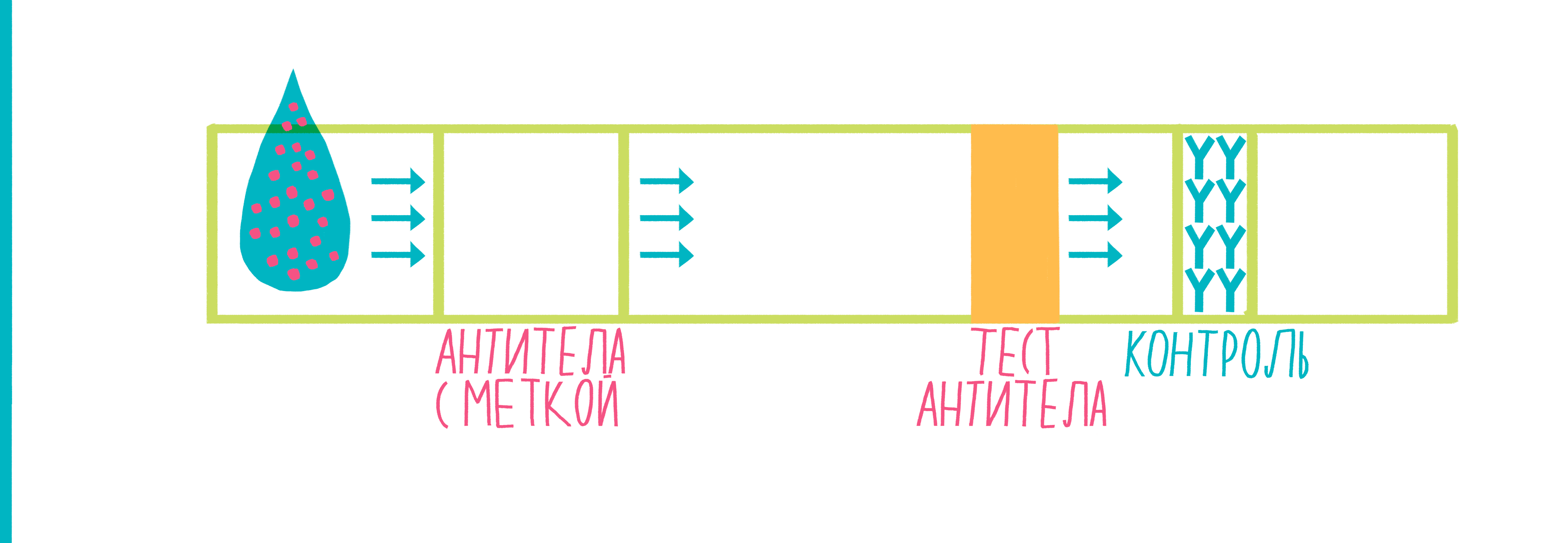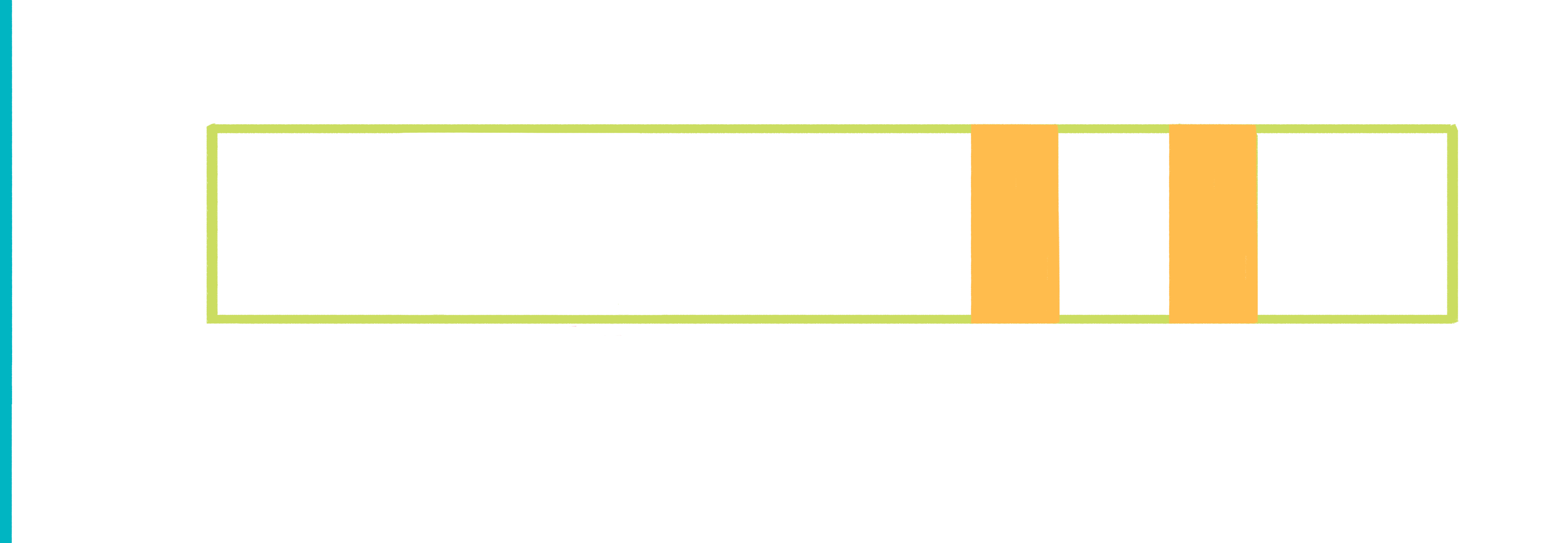
Иммунохроматография — очень остроумный метод обнаружения белка в анализируемой жидкости, в котором сам факт наличия жидкости используется для проведения реакции [15].
Рисунок 9. Анимированная схема иммунохроматографии. Пояснения — в тексте.
Широко распространенный пример использования иммунохроматографии — тесты для определения беременности. Исследуемой жидкостью в них выступает моча женщины, в которой присутствует белок хорионический гонадотропин человека (ХГЧ) — гормон, вырабатывающийся тканью хориона после имплантации эмбриона в стенку матки. ХГЧ движется по тест-полоске, в результате чего на ней появляются две полосы — это означает, что тест положителен, и женщина беременна.
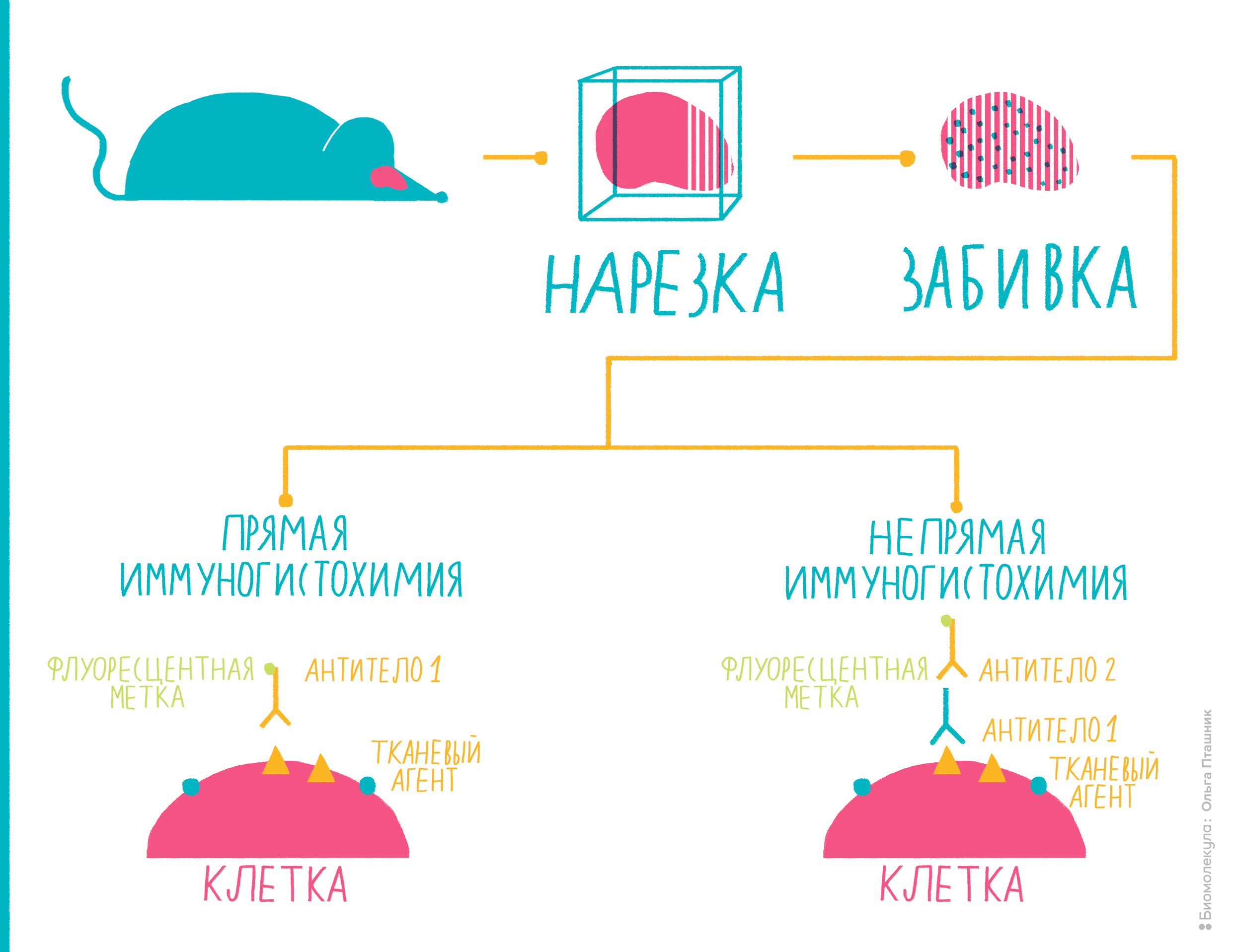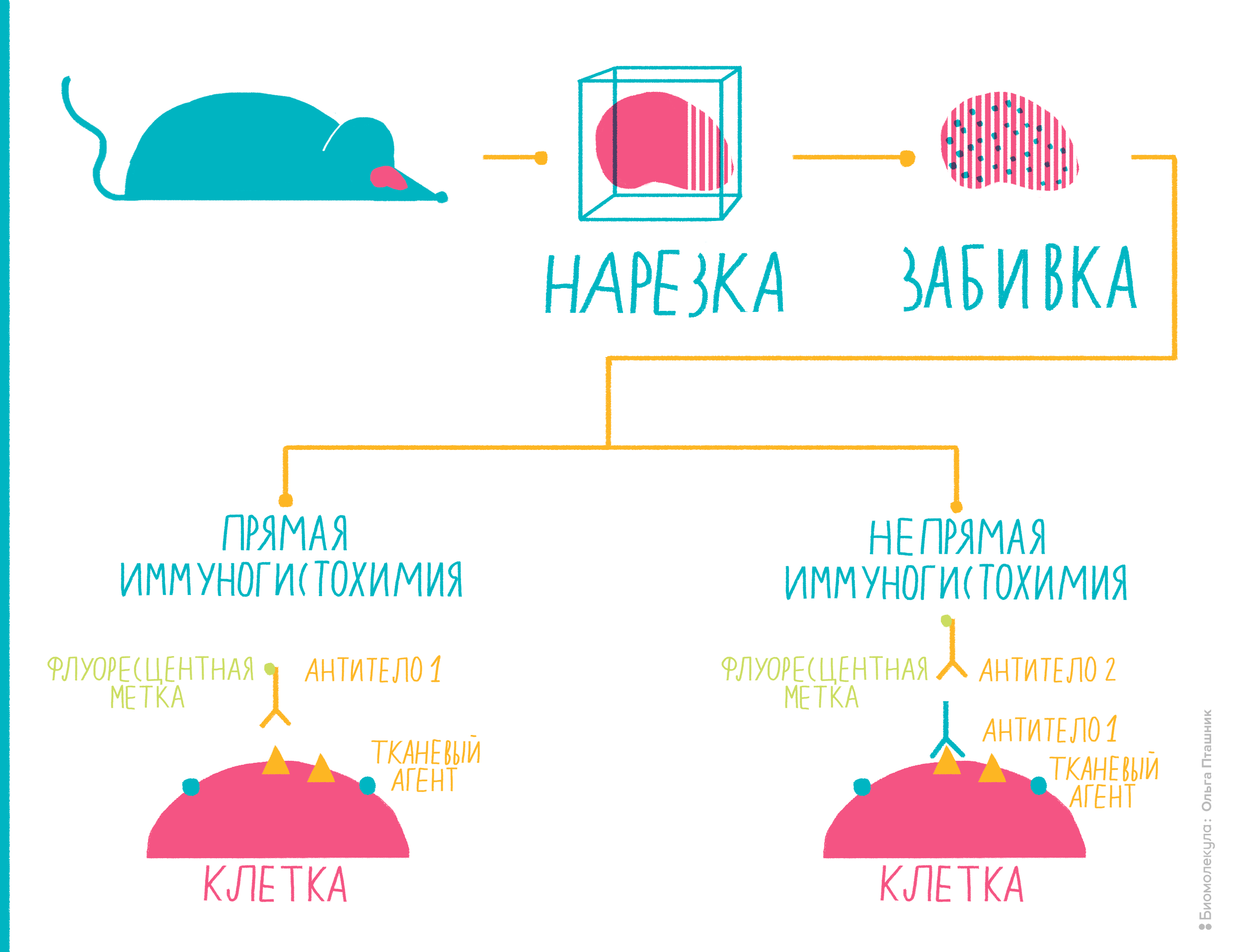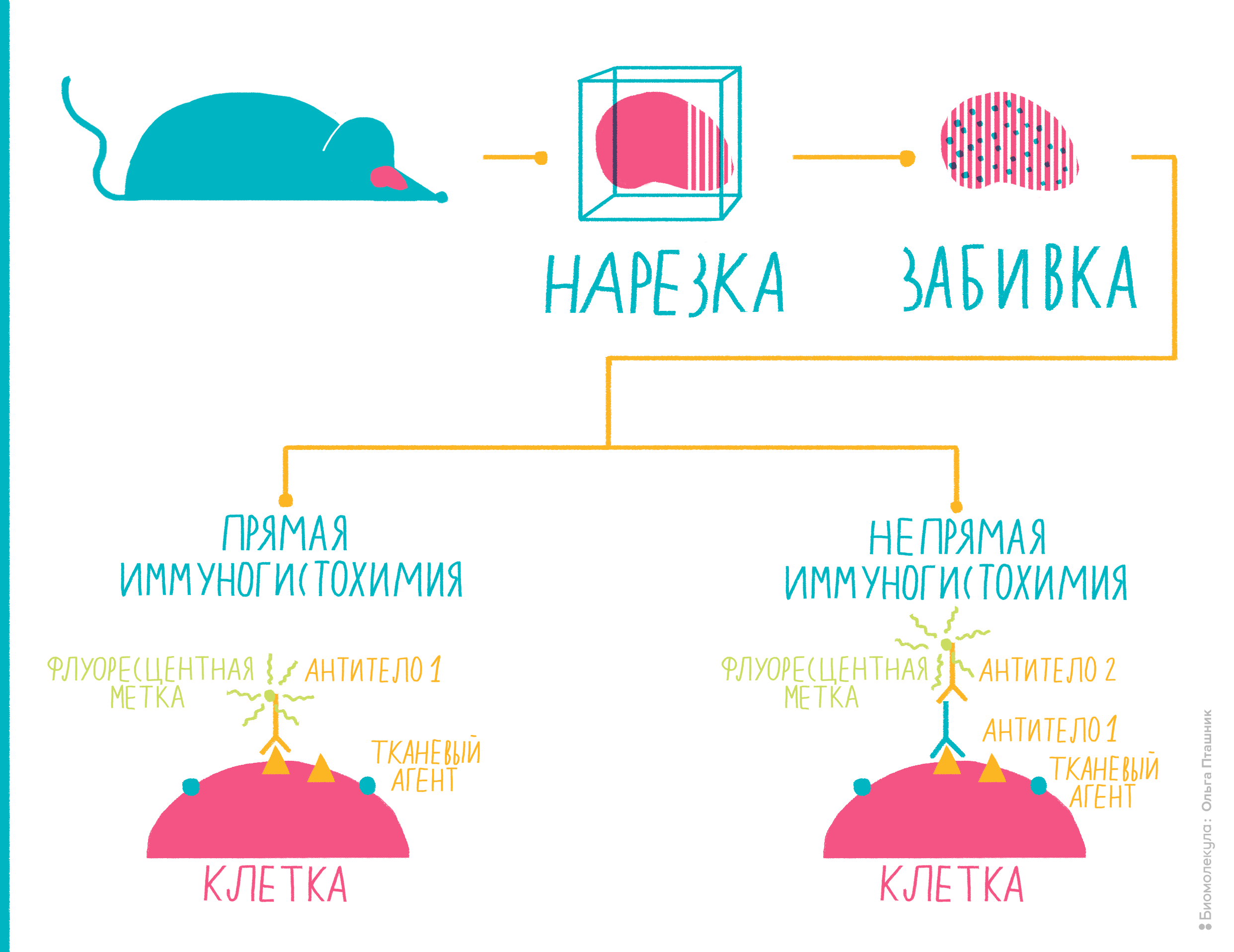
Иммуногистохимия
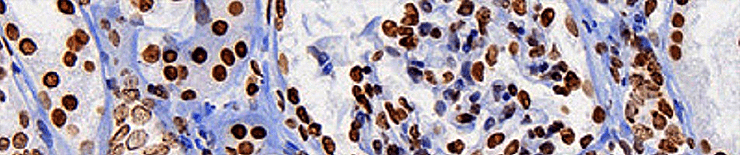
Многие антигены ученым и врачам хотелось бы определять не в сыворотке крови или в других жидкостях, а прямо на исследуемых тканях. Например, на опухолях. Ведь важно знать, экспрессируется ли на онкологической ткани тот или иной антиген: таким образом можно определить тип опухоли, предположить характер ее метастазирования и так далее. Способ, с помощью которого можно «увидеть» антигены на целой ткани, называется иммуногистохимией.
Она очень часто используется в медицинской диагностике, помогая врачам определить принадлежность опухоли к тому или иному типу и подобрать необходимое лечение [16]. Еще ее часто используют, чтобы диагностировать онкологические и иммунологические заболевания. Ученые иммуногистохимией тоже не пренебрегают. Например, с ее помощью можно определить, начался ли в ткани апоптоз, или исследовать нейродегенеративные заболевания [16].
Рисунок 10. Иммуногистохимия представляет собой комбинацию иммунологических, анатомических и биохимических техник исследования. Пояснения — в тексте.
Вот как проводят иммуногистохимию (рис. 10):
Помимо иммуногистохимии существует еще один метод с похожим принципом действия — иммуноцитохимия. Как можно заключить из названия, разница в том, что антигены определяют не на ткани, не на поверхности ее клеток, а непосредственно внутри клеток, то есть, отыскиваются внутриклеточные антигены. Для этого исследуемые клетки надо пермеабилизировать — то есть продырявить им мембрану, — а в остальном методика похожа на иммуногистохимию.
Иммуногисто- и иммуноцитохимия — это очень удобные методы для медицинской диагностики и научных исследований, при помощи которых можно отличать друг от друга ткани по внутри- и внеклеточным антигенам.
Реагенты для иммуно-гистохимического окрашивания:
Справочники, видеолекции, протоколы:
Материал предоставлен партнёром — компанией «Диаэм»
ChIP-сhip и ChIP-seq
Эти методы нужны для выяснения, с какими последовательностями ДНК в клетке связываются исследуемые белки (например, гистоны) [17]. Методы очень похожи, и отличаются только последним этапом. ChIP расшифровывается как chromatin immunoprecipitation, то есть иммунопреципитация хроматина.
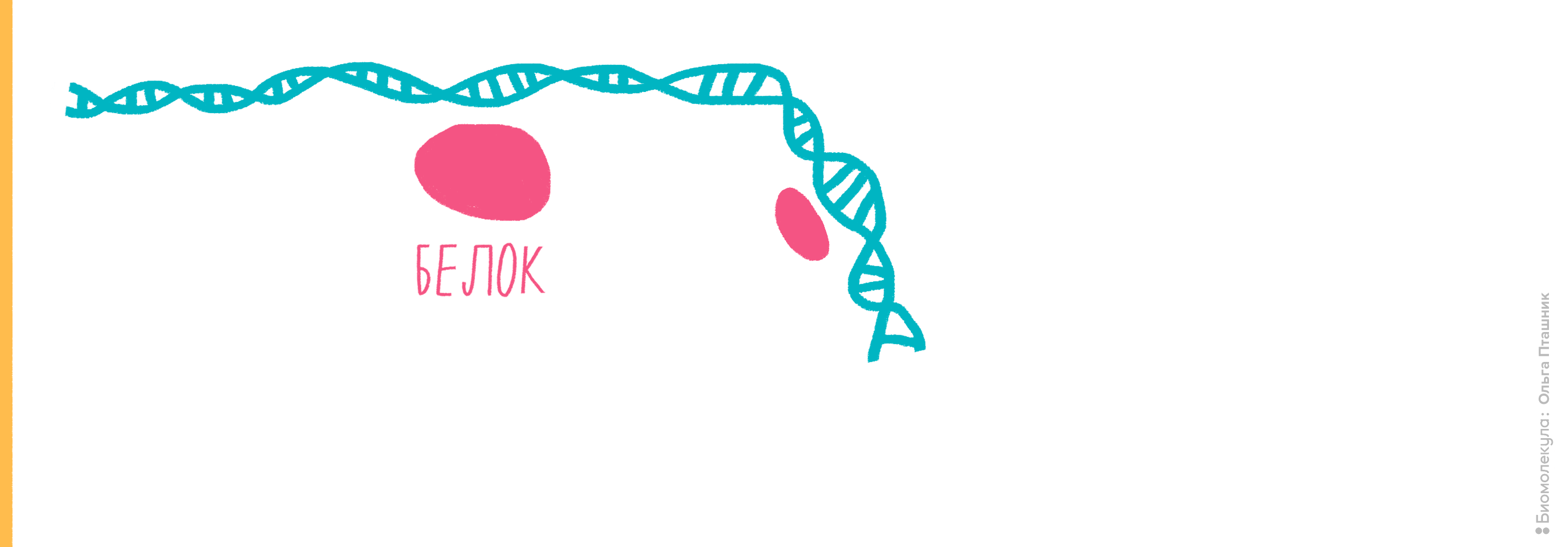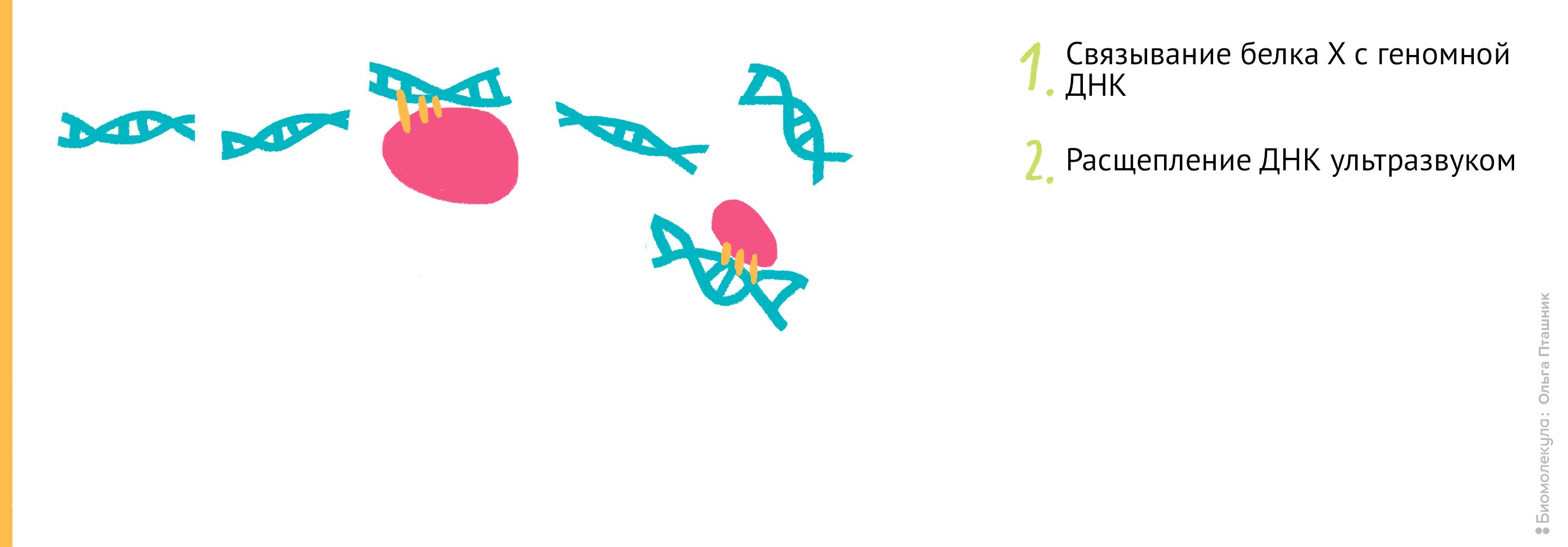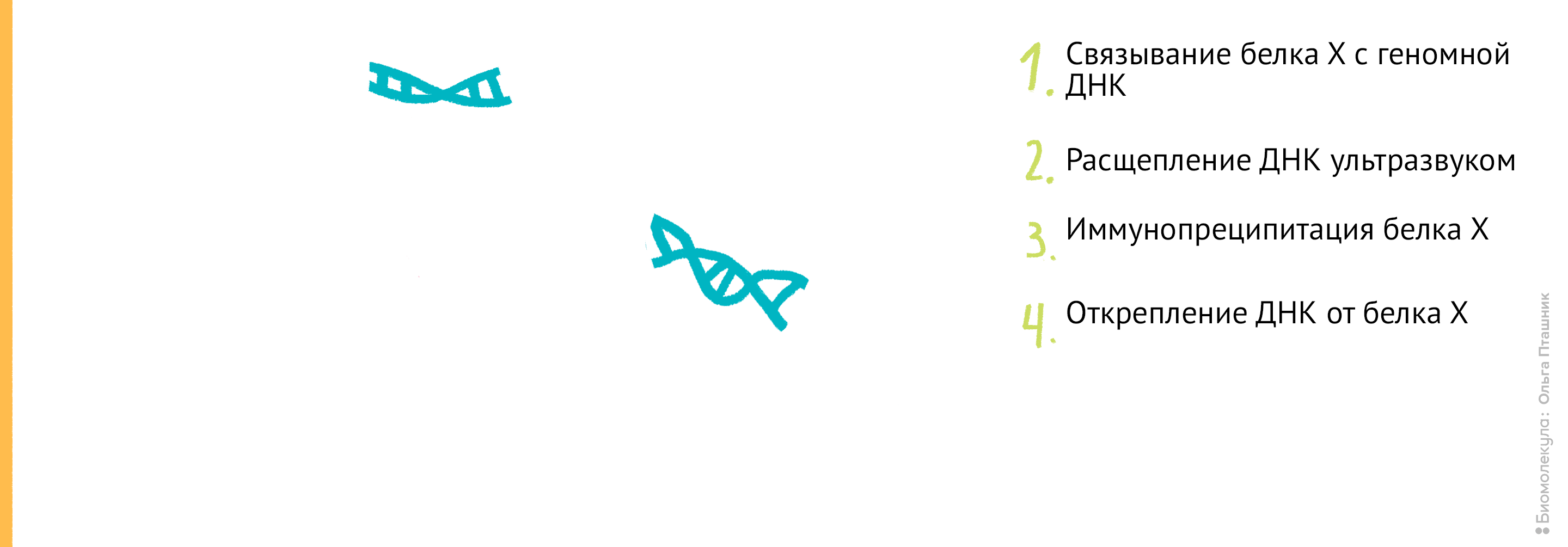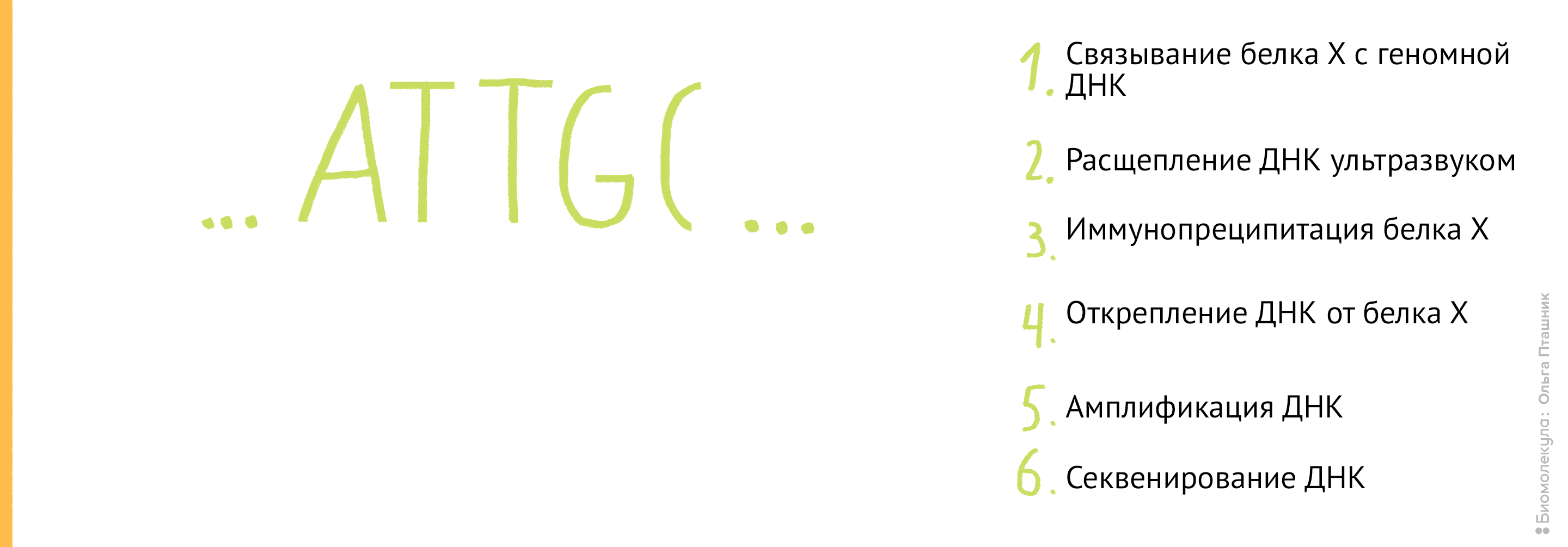
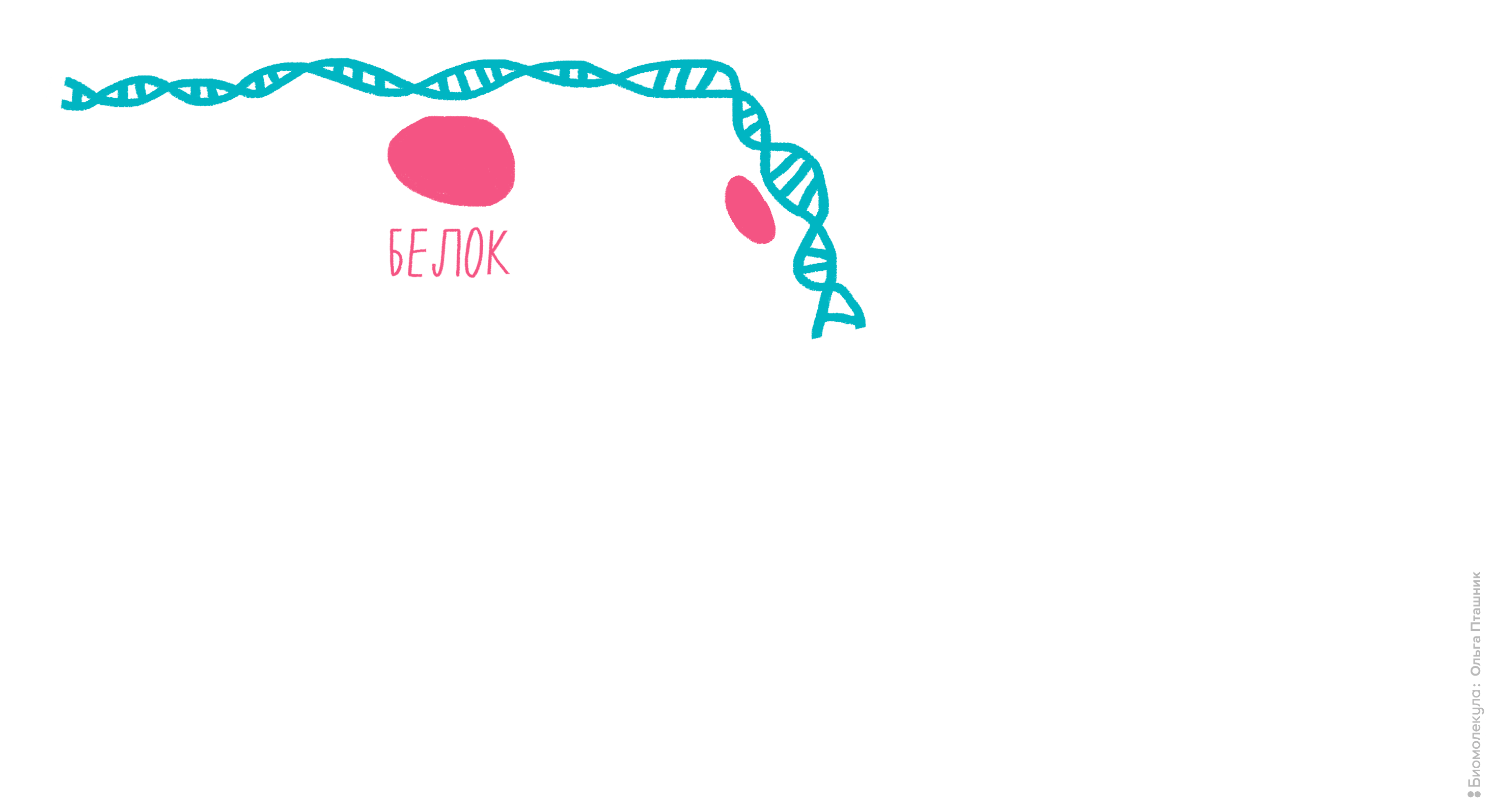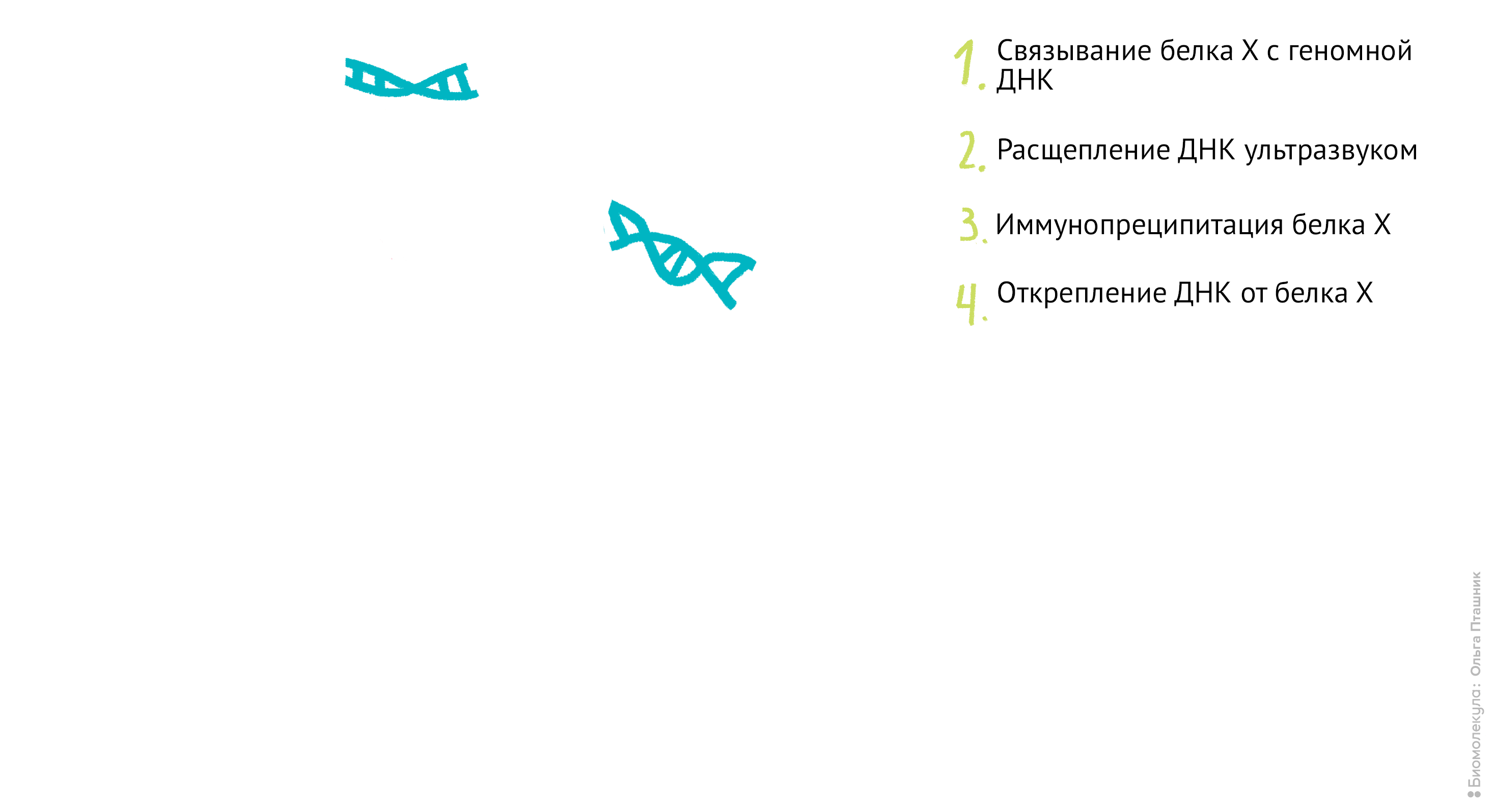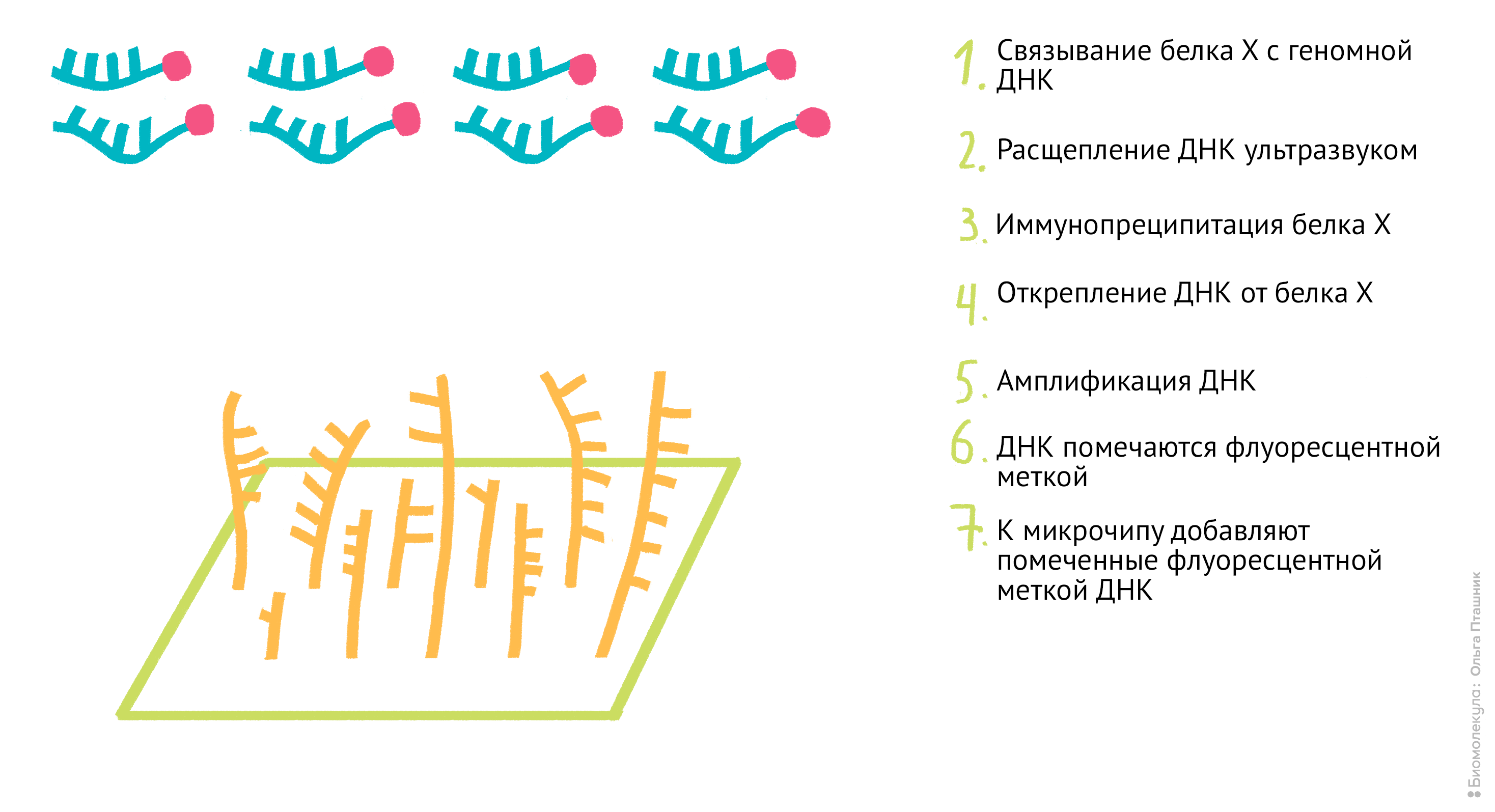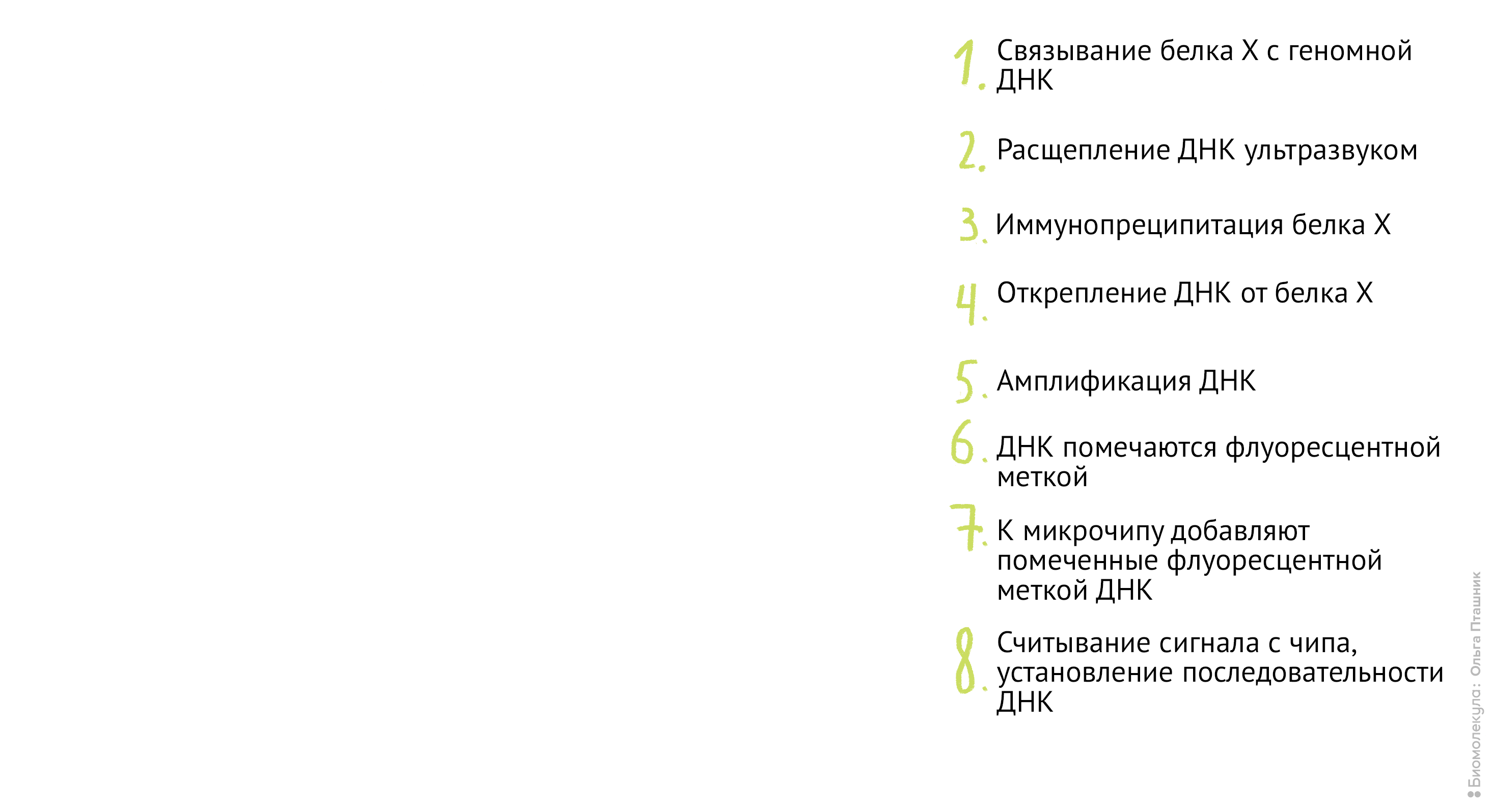
Рисунок 11. Проведение анализа ChIP-seq. Первым делом Белок Х связывается с геномной ДНК, после чего ДНК во всей клетке расщепляется при помощи ультразвука. Для иммунопреципитации искомого белка добавляются полимерные шарики с антителами к нему. После нескольких стадий отмывки белок отсоединяется от ДНК, и ее анализируют при помощи секвенирования для определения нуклеотидной последовательности, которая связывается с Белком Х.
Начнем с методики ChIP-sequencing (СhIP-seq) (рис. 11).
Если же мы используем метод ChIP-chip (иммунопреципитация хроматина на чипе), то последние шаги будут немного другие: анализом последовательности ДНК будут заниматься биоинформатики, а не «мокрые» биологи. А именно (рис. 12):
Рисунок 12. Методика ChiP-chip. Белок Х связывается с геномной ДНК в местах специфического связывания при помощи обратимой реакции с формальдегидом. Затем, по методике коиммунопреципитации (о которой мы уже говорили) геномная ДНК разрезается на кусочки и Белки Х связываются с антителами к ним. После этого геномная ДНК отделяется от Белка Х, амплифицируется, очищается и метится флуоресцентной меткой. Помеченные меткой олигонуклеотиды связываются с олигонуклеотидами на специальном чипе (к нему прикреплены различные олигонуклеотиды и связывание происходит между комплементарными последовательностями). Там, где произошло связывание, возникает флуоресцентный сигнал, который потом анализируется в биоинформатической лаборатории. В результате мы узнаем, с какими именно участками ДНК связывается наш белок.
Фабрика инструментов
А теперь, когда мы узнали, какие волшебные перспективы открывают перед учеными иммунологические методики, поговорим немного о том, как же можно получить главные молекулы для этих методик — антитела.
Гибридомная технология
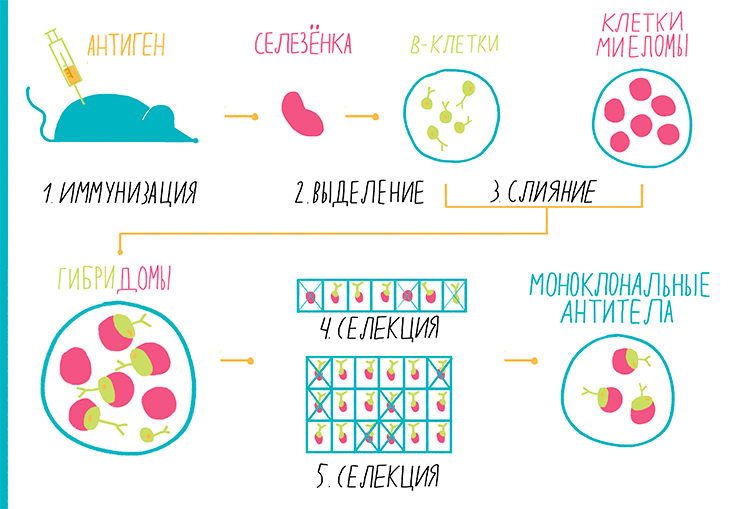
Как мы уже говорили выше, технологичность иммунным методикам обеспечивает применение моноклональных антител (то есть, тех, молекулы которых абсолютно идентичны друг другу). Впервые этого удалось достичь с помощью гибридомной технологии, разработанной Жоржем Келером и Сезаром Мильштейном в 1975 году. За это изобретение в 1984 году они получили Нобелевскую премию по физиологии. Методика заключается в создании бессмертной линии гибридных клеток, производящих нужные антитела: такая линия называется гибридомой. Подробности можно прочесть в статье «Моноклональные антитела» [10]. Производство гибридомы состоит из нескольких этапов (рис. 13):
Рисунок 13. Гибридомная технология. Пояснения — в тексте.
Антитела Abcam — идеальное решение для высокочувствительных иммунных методов анализа
Недостаток поликлональных антител, полученных из животных, в том, что фактически это смесь иммуноглобулинов G (IgG) с различными идиотопами, которые садятся на несколько фрагментов (эпитопов) введенного антигена. В итоге при использовании таких поликлональных антител есть риск получить ложноположительный результат, если в образце присутствует молекула другого белка с аналогичными эпитопами.
Кроме того, животные-продуценты смертны, и есть риск, что, получив хорошие результаты с антителами от одной особи, вы не получите такие же с антителами, полученными от другой.
Преимущество моноклональных (гибридомных) антител в том, что они позволяют получать антитела, которые связываются только с одним эпитопом, и продуценты их практически бессмертны. Наиболее специфичными являются моноклональные антитела, полученные из лимфоцитов кролика.
Антитела RabMAb от Abcam — это годами проверенная технология производства кроличьих моноклональных антител. Преимущества антител RabMAb от Abcam:
Материал предоставлен партнёром — компанией «Диаэм»
Биотехнологическое производство в эукариотических рекомбинантных системах
Этот метод постепенно оттесняет гибридому в деле производства промышленных количеств антител. «Биотехнологическое производство белков», как уже говорилось в соответствующей главе статьи «Методы в картинках: клеточные технологии» [21], это производство белков в «неродной» клетке с помощью специальных генетических инструментов — векторов со вставленными в них участками с генами необходимых антител (о том, как получают эти участки, рассказано ниже, в разделе «Фаговый дисплей»).
Антитела — чрезвычайно капризный материал для биотехнологического производства. Во-первых, они состоят из двух типов цепей, а, во-вторых, содержат в своей структуре несколько дисульфидных связей, которые могут быть построены только специальными ферментами. Поэтому производство полноразмерных антител — дело не из легких, и с ним справится далеко не каждая система экспрессии рекомбинантных белков [22].
95% применяемых в клинике антител производится в клеточных линиях млекопитающих. Это дорого и долго, но другого выхода нет — только клетка млекопитающего хорошо понимает, как именно провести посттрансляционную модификацию полноценного антитела. Есть несколько клеточных линий, которые могут продуцировать антитела. Самые известные из них — клетки яичника китайского хомячка (chinese hamster ovary, CHO) и линия человеческой эмбриональной почки (human embryonic kidney, HEK293). Они пригодны как для получения линии, стабильно экспрессирующей нужное антитело, так и для производящей продукт лишь некоторое время (транзиентная экспрессия).
Для получения антител можно использовать и целые организмы — так называемые трансгенные растения и животные. Растения немного отличаются от животных по паттернам гликозилирования, поэтому для того, чтобы синтезированные растительной клеткой белки тяжелой и легкой цепи антитела правильно соединились между собой, ученым приходится применять множество сложных уловок. Тем не менее использование трансгенных растений существенно снижает себестоимость получения антител, и хотя сейчас на рынок еще не вышло ни одно антитело, произведенное таким образом, несколько из них уже проходят клинические испытания.
Еще одна заманчивая перспектива для производства антител — использование трансгенных животных, ведь в этом случае нужные нам белки можно будет получать, например, в молоке мышей, кроликов, коров и овец или даже в яйцах кур. В настоящее время такой способ получения антител активно исследуется, однако пока он далек от реального использования в медицине [23], [24].
Фаговый дисплей
Фаговый дисплей (рис. 14) — это, строго говоря, не метод наработки антител, а лишь подготовительная методика для их промышленной наработки, а именно, получения векторных вставок для последующего биотехнологического производства (о котором мы только что рассказали).
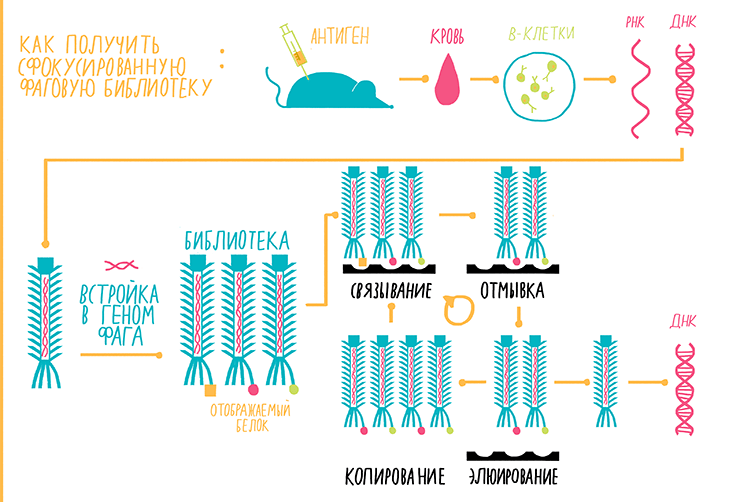
Метод основан на работе бактериальных вирусов — бактериофагов. Суть метода заключается в следующем факте: если в ген, который отвечает за синтез оболочки бактериофага, встроить ген какого-либо другого белка, то фаг будет «отображать» (display) этот другой белок на своей поверхности. Если фагов с разными генами много, мы получаем фаговую библиотеку. Фаговая библиотека антител представляет собой популяцию бактериофагов, каждый из которых несет на себе либо Fab-фрагмент антитела, либо sdAb. Существует несколько типов фаговых библиотек. Библиотеки на основе ДНК иммунных клеток здоровых людей называются наивными. Сфокусированные библиотеки создают из клеток иммунизированного животного. В этом случае происходит увеличение числа вариантов антител к антигену, которым иммунизируют животных. Синтетические библиотеки состоят из генов, синтезированных искусственно [25].
Рисунок 14. Схема фагового дисплея (на примере сфокусированной библиотеки). Пояснения — в тексте.
Разберем схему фагового дисплея на примере сфокусированной библиотеки (рис. 14).
Несколько слов об аптамерах
Как ни парадоксально это звучит, но иммунные методики не ограничиваются исключительно использованием иммунных молекул — антител. «Ловить» белковые молекулы можно и с помощью особым образом подобранных нуклеиновых кислот — аптамеров.
Открытие структуры и механизмов биосинтеза основных полимеров живых клеток, а вместе с тем — регуляции генной активности, например, в формате оперонов, донесло до людей полезную мысль, что белки могут со значительным сродством связываться с определенными последовательностями нуклеиновых кислот, так называемыми мотивами [26]. Многие белковые факторы транскрипции имеют свою характерную последовательность ДНК, с которой они связываются наиболее прочно, сохраняя слабое сродство к остальным участкам нуклеиновой кислоты. Разумеется, на выяснение того, с какими последовательностями связываются разные регуляторные белки, брошены существенные усилия исследователей, и здесь достигнуты значительные успехи [27].
Наблюдения за механизмами специфичного связывания белками нуклеиновых кислот породили обратную постановку задачи: а нельзя ли подобрать особую последовательность, связывающую произвольный белок? Было бы удобно использовать такую последовательность ДНК или РНК (особенно первую из-за более высокой химической стабильности), которую можно легко амплифицировать путем полимеразной цепной реакции [18] для связывания интересующих нас белковых молекул. Если удастся достичь достаточно избирательного и прочного связывания, то такие последовательности нуклеиновой кислоты, наподобие антител, способны сослужить хорошую службу в методах качественного и количественного анализа белков.
Так разработали метод отбора связующих нуклеиновых молекул, которые назвали аптамерами. Метод назвали SELEX (от английского systematic evolution of ligands by exponential enrichment, то есть систематическая эволюция путем экспоненциального обогащения), или просто селекцией in vitro [28], [29]. Вначале осуществляют синтез фрагментов нуклеиновой кислоты, которые представляют собой набор случайных последовательностей, но каждая по краям содержит постоянные элементы, необходимые впоследствии для амплификации. Интересующий нас белок-мишень укрепляют на твердом носителе и дают получившейся смеси полинуклеотидов связываться с этой мишенью. Носитель тщательно промывают, а то, что осталось связанным на белке, амплифицируют путем ПЦР. По идее, ненужное мы отмыли, а оставшееся — это именно то, что хорошо связывается с нашим белком. Но для хороших аналитических характеристик связующего вещества ему еще нужно эволюционировать в пробирке. Циклы SELEX повторяют много раз, в ходе чего смесь обогащается наиболее прочно связывающейся последовательностью нуклеиновой кислоты. Ее можно отсеквенировать и затем синтезировать в любых нужных количествах.
Все здорово, правда? Насколько лучше по сравнению с трудностями получения антител! Однако в разработке аптамеров, конечно, имеется значительное количество подводных камней. Один из самых главных — химические свойства нуклеиновой кислоты. Поскольку это кислота, связываться она может только со щелочными белками. Если белок кислый или даже нейтральный, аптамер к нему подобрать, скорее всего, не удастся. Однако изощренный научный подход частично решает и эту проблему. Созданы аптамеры из нуклеиновой кислоты, содержащей не естественные азотистые основания, а химически модифицированные. Так одному из биотехнологических стартапов удалось получить хорошие аптамеры к более чем тысяче белков человека. Эти агенты назвали специальным словом — somamer. На основе сомамеров созданы чипы для полуколичественного анализа примерно тысячи белков плазмы крови [30]. Их в последние годы часто используют в исследованиях для поиска биомаркеров. Чипы на основе сомамеров — хорошая альтернатива протеомике, использующей масс-спектрометрию.
Итак, аптамеры могут в ряде случаев заменять антитела. Их легче синтезировать, а детектирование связанных белков или даже других молекул осуществляется за счет амплификации связавшегося материала. Аптамеры, как и антитела, рассматривают в качестве лекарственных средств. Дошло до того, что одно из лекарств на основе аптамера, пегаптаниб, уже вышло на рынок и используется для лечения атрофии сетчатки глаза.
Заключение
Иммунные методы — это незаменимая в современном мире группа методик, которая позволяет «поймать» практически любую сложную молекулу, определить ее количество, местоположение в клетке или ткани и даже иногда «поймать» те молекулы, с которыми наша молекула связывается. Кроме того, эти методики очень широко представлены в повседневной жизни: от анализа крови на антитела до теста на беременность.
Календарь
На основе статей спецпроекта мы решили сделать календарь «12 методов биологии» на 2019 год. Эта статья представляет ноябрь.