индекс тромбодинамического потенциала повышен при беременности чем грозит
Тромбоэластограмма
Стоимость анализа
стоимость указана без учета стоимости забора биологического материала
Добавить в корзину
Готовность результатов анализа
Обычные*: 1 день
Дата сдачи анализа:
Дата готовности:
*не считая дня сдачи.
Где и когда можно сдать
Подготовка к анализу
Натощак, не менее 3-4 часов после последнего приема пищи
Забор биоматериала
Файлы
Скачать образец результата анализа
Для чего это нужно
Тромбоэластограмма – глобальный тест гемостаза, который представляет собой запись процесса свертывания крови в специальной кювете.
Существуют различные варианты тромбоэластограммы, но наиболее распространенный – с использованием цельной крови, то есть с клетками крови (тромбоцитами, лейкоцитами, эритроцитами). В таком случае мы видим, как ведет себя кровь в условиях, близким к условиям в организме.
Тромбоэластограф ТЭГ-5000 в ЦИР
В лаборатории гемостаза нашего Центра иммунологии и репродукции тромбоэластограмма выполняется на тромбоэластографе ТЭГ-5000. Методика, которую использует этот прибор, традиционно называется тромбоэластография.
Анализ выполняется в лаборатории гемостаза ЦИР непосредственно в центре, где сдаётся кровь.
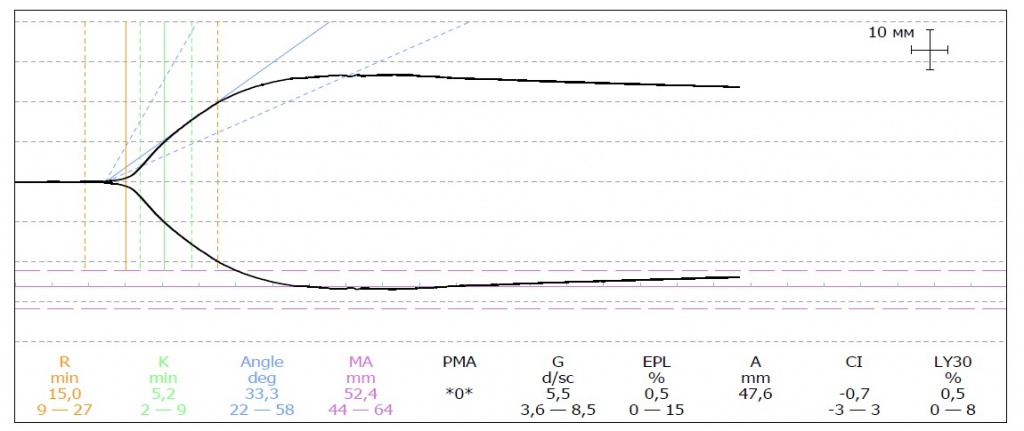
Показатели тромбоэластограммы
График тромбоэластограммы показывает процесс свертывания крови (образования сгустка) и фибринолиза (разрушения сгустка). При свертывании крови на графике начинается расхождение кривых. Затем расхождение достигает максимума и начинается уменьшение амплитуды (фибринолиз).
Каждый из этих процессов характеризуется рядом показателей, а сам график имеет различную форму при разных состояниях.
Тромбообразование
R (reaction time) – латентное время до достижения расхождения нити в 2 миллиметра, характеризует фазу инициации. Увеличение времени может свидетельствовать о недостатке факторов свертывания крови или использовании препаратов, влияющих на свертывание крови.
Угол альфа – угол наклона кривой, характеризует функцию фибриногена.
G – это так называемая сила сгустка, вычисляемая на основе максимальной амплитуды.
Фибринолиз
После достижения максимума сгусток начинает лизироваться (растворяться), площадь под кривой начинает уменьшаться. Эта часть кривой характеризует процесс фибринолиза. Если идет значительный фибринолиз, то кривые могут даже сойтись в одну точку.
LY30 – очень важный для оценки лизиса показатель. Этот показатель показывает процентное уменьшение амплитуды через 30 минут после МА. Повышенное значение LY указывает на активированный фибринолиз.
Индекс тромбодинамического потенциала
Формула 1: ИТП = МA*100/(100-МA)/K
Формула 2 (TEG5000, TEG6S): ИТП= TPI = MA*100/(100-MA)/(K*2)
Формула 3 (устаревшая): ИТП=MA/(R+К).
Тромбоэластограмма и беременность
Рассказывает главный врач ЦИР Игорь Иванович Гузов:
«Когда мы оцениваем сложную ситуацию во время беременности, мы получаем задачу зафиксировать и понять, что было сейчас, и что будет дальше. И самое главное, оценить ситуацию, что будет происходить, когда мы назначаем те или иные виды лечения.
Случайность может быть. Но, к сожалению, в очень большом проценте случаев это не случайность, которую можно увидеть. И, что самое страшное, во всех таких ситуациях, это то, что лечение должно быть назначено на ранних сроках беременности. Если ты опоздал с назначением лечения, ты в гораздо большей степени рискуешь получить проблему, чем если бы ты заранее все спланировал и заранее всё отслеживаешь и наблюдаешь.
В числе всех этих параметров анализов, которые позволяют рассмотреть все эти вещи, безусловно, является тромбоэластограмма. Поэтому здесь я бы рекомендовал прислушиваться к назначению врачей, когда они назначают тромбоэластограмму.
Когда мы дополняем экспертную программу лабораторной диагностики, связанную с рисками нарушения беременности, этим очень информативным исследованием, мы получаем исключительно важную информацию, которая может быть использована для того, чтобы вы родили здорового ребенка».
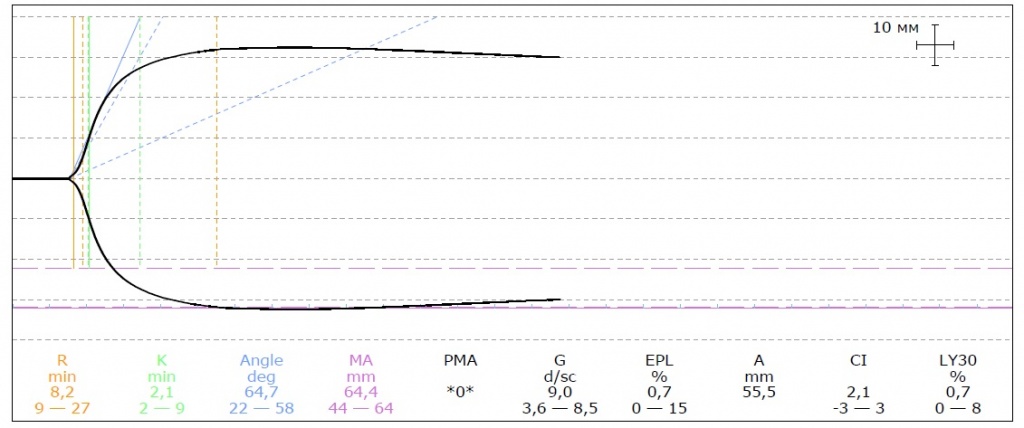
Показатели тромбоэластограммы на приборе ROTEM
Как сдать анализы в Лабораториях ЦИР?
Для экономии времени оформите заказ на анализ в Интернет-магазине! Оплачивая заказ онлайн, Вы получаете скидку 10% на весь оформленный заказ!
У Вас есть вопросы? Напишите нам или позвоните +7 (495) 514-00-11. По анализам Вы можете задать вопрос на нашем форуме и обратиться на консультацию к специалисту.
Обследование и ведение беременных пациенток с наследственной предрасположенностью к тромбофилическим осложнениям и тромбофилиями различного генеза
Тромбофилия не является заболеванием, ее стоит рассматривать скорее как патологическое состояние или синдром, возникающие под воздействием комбинации постоянных или временных факторов риска, вызывающих тромбозы [3].
Показанием к обследованию пациенток является возникновение идиопатических тромбозов, инсультов, инфарктов, наличие выкидышей, тяжелого гестоза, преждевременной отслойки нормально расположенной плаценты, преждевременных родов на сроках до 34 недель, синдрома задержки роста плода при предыдущих беременностях, тромбозов, возникших на фоне приема контрацептивных препаратов или заместительной гормональной терапии (ЗГТ) [2]. Показаниями к лабораторной диагностике тромбофилии у пациентки является наличие следующих общих признаков патологии:
первая манифестация тромбоза в возрасте 13–20–30 лет;
артериальные и венозные тромбозы (от тромбоза поверхностных вен до ТЭЛА);
тромбоз на фоне применения непрямых антикоа- гулянтов (варфарин – снижение витамина К);
у новорожденных: неонатальная коагулопатия, фульминантная пурпура как причина смерти. Сведения о патологических состояниях получают прежде всего из анамнеза.
КОМПЛЕКСНОЕ ОБСЛЕДОВАНИЕ
Таким образом, обследование беременной в I триместре при постановке на учет либо пациентки, планирующей беременность, начинают именно со сбора подробного анамнеза, который включает в себя семейный анамнез: семейный акушерский, семейный тромботический (в том числе сведения о заболеваниях матери и отца в трудоспособном возрасте, такие как гипертония (ГБ), ишемическая болезнь сердца (ИБС), острое нарушение мозгового кровообращения (ОНМК) и др. Также важны анамнез экстрагенитальных заболеваний пациентки, диагностированных до или во время беременности (ГБ, СД, СКВ и др.), и оценка репродуктивной функции пациентки.
При привычном невынашивании беременности рекомендуются дополнительные виды исследований, такие как Д-димер, растворимый фибрин-мономерный комплекс (РФМК), тромбоэластография, уровень ингибитора активатора плазминогена, исследование на антифосфолипидный синдром (АФС) с интервалом 6 недель:
IgM и IgG кардиолипину, фосфолипидам, гликопротеиду;
Высокоинформативным является анализ на полиморфизм генов тромбофилии. Причем приказом МЗ РФ № 572-Н предусмотрены исследования на определение уровня протромбина, протеинов С и S. Дополнительно к приказу рекомендуется назначить исследование на гомоцистеин.
Оценить вероятность предтромботического состояния и развития тромбоза, а также эффективность и безопасность терапии в тромбоцитарном звене позволит определение количества тромбоцитов (PLT). В норме PLT составляет 180 – 320 х 109 /л, при тромбоцитозе более 350 х 109 /л и тромбоцитопении менее 100 х 109 /л.
СРЕДНИЙ ОБЪЕМ ТРОМБОЦИТОВ (MPV) СОСТАВЛЯЕТ 3,6–9,4 МКМ. ОТ РАЗМЕРА ТРОМБОЦИТА ЗАВИСЯТ СОДЕРЖАНИЕ В НЕМ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ И ЕГО СКЛОННОСТЬ КЛЕТОК К АДГЕЗИИ. СЛЕДУЕТ ПОМНИТЬ, ЧТО ОБЪЕМ ТРОМБОЦИТОВ ИЗМЕНЯЕТСЯ ПЕРЕД АГРЕГАЦИЕЙ, И ЧЕМ БОЛЬШЕ ОБЪЕМ ТРОМБОЦИТОВ, ТЕМ ОНИ «МОЛОЖЕ» [1]. ПРЕОБЛАДАНИЕ В КРОВИ МОЛОДЫХ ФОРМ ТРОМБОЦИТОВ НАБЛЮДАЕТСЯ ПРИ КРОВОПОТЕРЕ И СВИДЕТЕЛЬСТВУЕТ ОБ УСИЛЕННОЙ РЕГЕНЕРАЦИИ. УВЕЛИЧЕНИЕ УРОВНЯ СТАРЫХ И УМЕНЬШЕНИЕ СОДЕРЖАНИЯ ЗРЕЛЫХ ТРОМБОЦИТОВ ХАРАКТЕРНЫ ДЛЯ РАЗЛИЧНЫХ ВОСПАЛИТЕЛЬНЫХ ПРОЦЕССОВ, ИНТОКСИКАЦИЙ, ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ.
ОЦЕНКА ФУНКЦИОНИРОВАНИЯ СИСТЕМЫ КОАГУЛЯЦИИ
Агрегация тромбоцитов. Для определения исходной функции тромбоцитов, эффективности антиагрегантной терапии назначается исследование спонтанной агрегации тромбоцитов или исследование с применением индукторов: аденозиндифосфатом (АДФ), адреналином, коллагеном ристоцетином.
ОПРЕДЕЛЕНИЕ ДЛИТЕЛЬНОСТИ КРОВОТЕЧЕНИЯ – ВАЖНЫЙ И ИНФОРМАТИВНЫЙ ТЕСТ, КОТОРЫЙ ПОЗВОЛЯЕТ ОДНОВРЕМЕННО КАЧЕСТВЕННО ОЦЕНИТЬ КОЛИЧЕСТВО ТРОМБОЦИТОВ В КРОВИ, ИХ АДГЕЗИВНЫЕ И АГРЕГАЦИОННЫЕ СВОЙСТВА, ФУНКЦИОНАЛЬНЫЕ ХАРАКТЕРИСТИКИ СТЕНКИ КРОВЕНОСНЫХ СОСУДОВ, А ТАКЖЕ ВЫРАЖЕННЫЙ ДЕФИЦИТ ПЛАЗМЕННЫХ ФАКТОРОВ СВЕРТЫВАНИЯ. В НОРМЕ ДЛИТЕЛЬНОСТЬ КРОВОТЕЧЕНИЯ СОСТАВЛЯЕТ 4–8 МИНУТ.
Агрегация тромбоцитов с АДФ показывает количество высвобождающихся собственных агонистов, содержащихся в гранулах тромбоцитов. Определение агрегации тромбоцитов с ристоцетином показано для диагностики болезни фон Виллебранда (увеличение времени кровотечения при нормальном количестве тромбоцитов и отсутствие явных причин для дисфункции тромбоцитов).
Удлинение времени кровотечения отражает на- рушение гемостаза вследствие тромбоцитопений, тромбоцитопатий врожденного и приобретенного генеза (нарушения функций тромбоцитов – адгезии и агрегации), нарушений сосудистой стенки или сочетания этих факторов. Время кровотечения мо- жет увеличиться при применении антиагрегантной терапии, синдроме диссеминированного внутрисосудистого свертывания (ДВС), синдроме «массивных» трансфузий. Увеличение длительности кровотечения при нормальном количестве тромбоцитов в крови позволяет предположить нарушение их функций.
Укорочение времени кровотечения характерно для гиперагрегации тромбоцитов.
Информативным для лечащего врача является также определение активированного частичного тромбопластинового времени (АЧТВ), которое при беременности в норме колеблется от 25 до 40 секунд. Удлинение АЧТВ свидетельствует о дефиците плазменных факторов коагуляции ниже 10–25 %, применении антикоагулянтов. Укорочение АЧТВ говорит о гиперкоагуляции, характерной для ДВС, а значит, необходимо решить вопрос о назначении антикоагулянтной терапии. При проведении терапии гепаринами осуществляется обязательный контроль АЧТВ: удлинение АЧТВ более чем в 2,5 раза от нормы перед очередным введением гепарина свидетельствует о высокой чувствительности к гепаринотерапии и требует снижения дозы.
ПРОТРОМБИНОВОЕ ВРЕМЯ (ПТВ) ПОЗВОЛЯЕТ ПРОИЗВЕСТИ ОЦЕНКУ ВНЕШНЕГО ПУТИ СВЕРТЫВАНИЯ КРОВИ 1 ФАЗЫ. В НОРМЕ ПТВ СОСТАВЛЯЕТ 12–16 СЕК. ЕГО УКОРОЧЕНИЕ ПОКАЗЫВАЕТ АКТИВАЦИЮ ВНЕШНЕГО ПУТИ КОАГУЛЯЦИОННОГО ГЕМОСТАЗА, А УДЛИНЕНИЕ – ДЕФИЦИТ, ЧТО ОЗНАЧАЕТ НЕОБХОДИМОСТЬ НАЗНАЧЕНИЯ ЛЕЧЕНИЯ ФАКТОРАМИ ПРОТРОМБИНОВОГО КОМПЛЕКСА (ПРОТРОМПЛЕКС, НОВОСЕВЕН И ДР).
Удлинение ПТВ наблюдается при заболеваниях печени и желчного пузыря, нарушениях эвакуации желчи, циркуляции ВА, дефиците или аномалии факторов протромбинового комплекса [5].
В процессе коагуляции важна концентрация фибриногена, которая в норме составляет 2–4 г/л. Ее повышение может наблюдаться в последние месяцы беременности, после родов и хирургических операций, в период воспалительных и неопластических заболеваний, при легких формах гепатитов, в I-й фазе ДВС.
СНИЖЕНИЕ КОНЦЕНТРАЦИИ ФИБРИНОГЕНА ХАРАКТЕРНО ДЛЯ ТЯЖЕЛЫХ ЗАБОЛЕВАНИЙ ПЕЧЕНИ, НАСЛЕДСТВЕННЫХ ГИПО-, АФИБРИНОГЕНЕМЙ, ПЕРВИЧНОГО ФИБРИНОЛИЗА, II И III СТАДИЙ ДВС, ПРИЧЕМ В ПОСЛЕДНЕМ СЛУЧАЕ ВАЖНЫ НЕ СТОЛЬКО ПОКАЗАТЕЛИ, СКОЛЬКО ДИНАМИКА, СКОРОСТЬ ИЗМЕНЕНИЯ КОНЦЕНТРАЦИИ.
При активации системы фибринолиза (взаимо- действие плазмина с фибриногеном и фибрином) образуются растворимые комплексы мономеров фибрина (РФМК), которые не должны превышать 10 мг/л. РФМК расценивается как ранний признак ДВС. О хроническом ДВС свидетельствует постоянная циркуляция мономерных комплексов в крови.
Исследование на Д-димеры используется для диагностики ДВС. При добавлении специфической сыворотки определяется количество Д-димеров, по которым судят о фибринолизе. Д-димер не повышается у пациентов с дефицитом тканевого активатора плазминогена или высокой активностью ингибитора активатора плазминогена часто даже при тромбозе глубоких вен (ТГВ) и тромбозе легочной артерии (ТЭЛА).
Информативно исследование на определение процента активности белка-антикоагулянта антитромбина III, нормальный показатель – 80–120 %. Любое изменение концентрации (как снижение, так и повышение) может указывать на наличие генетических мутаций в гене антитромбина III. Уменьшение характеризует заболевания печени, причем в этом случае снижение концентрации АТ III пропорционально тяжести заболевания. Кроме того, более низкие значения возможны при введении пациенту нефракционированного гепарина (НФГ), который при низкой концентрации АТ III не дает ожидаемого эффекта. Снижение концентрации также может наблюдаться при шоковых состояниях (например, при острой почечной недостаточности (ОПН) и активации ингибиторов АТ III в крови).
Следует помнить, что показатели содержания АТ III снижаются в середине менструального цикла, в послеоперационном периоде, при синдроме ДВС, приеме оральных контрацептивов, эстрогенов.
Повышение концентрации АТ III характерно для вирусного гепатита, холестаза, может наблюдаться при дефиците витамина К, приеме антикоагулянтов непрямого действия (например, варфарина) или во время менструации.
ЗАКЛЮЧЕНИЕ
Для получения точной информации о состоянии пациентки лабораторные методы исследований дополняются инструментальными: УЗИ, ЭКГ и УЗДГ сосудов нижних конечностей. В соответствии с приказом Министерства здравоохранения Российской федерации УЗИ рекомендуется проводить:
при постановке на учет;
на сроке 11–14 недель;
на сроке 18–21 неделя;
на сроке 30–34 недели;
планово с 33 недель КТГ;
Желательно получить информацию максимально рано, чтобы принять решение для назначения лечения: при пренатальном обследовании, обследовании в I триместре беременности, при возникновении осложнений во время настоящей беременности.
1. Агаркова Т. А., Трифонова Е. А., Габитова Н. А. Анализ генетических маркеров наследственной тромбофилии и эндотелиальной дисфункции при осложненном течении беременности. Всероссийский научный форум «Мать и дитя», 11-й. Материалы. М 2010; 6–7.
2.Баркаган З. С. Руководство по гематологии. М: Ньюдиамед, 2005; 3: 416.
4. Ройтберг Г. Е., Струтынский А. В. Лабораторная и инструментальная диагностика заболеваний внутренних органов – М.: ЗАО «Издательство БИНОМ», 1999 г. – 622 с.
6.Clark P., Brennand J., Conkie J. at al. Activated protein C sensitivity, protein C, protein S and coagulation in normal pregnancy // Thromb Haemost.. – 1998. – Вып. 79. – С. 1166–1170.
Наталия Рубина; консультанты: Седа Баймурадова, д. м. н., доцент кафедры акушерства и гинекологии Первого Московского Государственного медицинского университета (ПМГМУ); Нона Овсепян, врач-консультант Независимой лаборатории ИНВИТРО
Кто в «группе риска»?
За неделю до сдачи анализа крови на гемостаз нельзя пить алкоголь и принимать аспириносодержащие препараты, так как и то, и другое разжижает кровь. В итоге, анализ может дать неверные результаты.
Когда это необходимо?
Седа Беймурадова, гинеколог: «Однажды ко мне на приём пришла женщина, у которой последовательно случилось уже 8 выкидышей. После 4-го участковый врач направил её на гемостазиограмму, а затем назначил лечение. Однако оно оказалось неэффективным, и после ещё 4 случаев невынашивания она обратилась к нам в центр. Мы дообследовали её и выяснили, что доза лекарства, назначенная ей ранее, была слишком мала для неё и потому не сработала. Мы порекомендовали ей использовать другой препарат в более высоких дозах, и она спокойно доносила новую беременность и родила здорового ребёнка».
Бесплодие
Если у вас есть генетическая предрасположенность к нарушениям гемостаза, то на фоне гормональной нагрузки при лечении бесплодия (в том числе в программах ЭКО) резко возрастает риск тромбозов и инсультов.
Методы лечения
Если своевременно диагностировать нарушения в свёртывающей системе крови, то большого количества осложнений беременности удаётся избежать. Современные врачи применяют для лечения ДВС-синдрома препараты под названием низкомолекулярные гепарины (Фраксипарин, Клексан, Фрагмин). Они не проникают через плацентарный барьер, а потому совершенно безопасны для плода. Лечение проводится амбулаторно, вам нужно лишь приезжать на контрольный анализ раз в 2 недели. Одновременно могут назначаться антиоксиданты, содержащиеся в Омега 3 (рыбий жир), аспирин в малых дозах для разжижения крови, фолиевая кислота и витамины группы В.
Помните: с нарушениями гемостаза можно справиться, если вовремя применить соответствующее лечение. В этом случае у вас есть все шансы родить здорового ребёнка и избавиться от проблем со здоровьем в будущем.
СКОЛЬКО СТОИТ АНАЛИЗ?
Общая стоимость анализа складывается из тех показателей, которые назначены пациенту для обследования (на усмотрение лечащего врача назначаются либо все показатели, либо избирательно).
Как сдавать: утром и строго натощак, не пить воды и не чистить зубы.
Где сдать анализы на гемостаз
Гемостаз при беременности: особенности и нарушения
Нормальная беременность сопровождается множеством изменений, направленных на обеспечение роста плода. Перемены происходят и в системе гемостаза, при этом любые отклонения от нормы могут быть чреваты серьезными осложнениями как для матери, так и для ребенка.
Изменения гемостаза при беременности
Перемены в системе гемостаза у беременных женщин в первую очередь связаны с появлением нового круга кровообращения — маточно-плацентарного, необходимого для полноценного обеспечения плода кислородом и питательными веществами.
Изменения уровня тромбоцитов
В большинстве случаев содержание в крови тромбоцитов остается неизменным, однако примерно у 10% женщин 1 концентрация этих клеток снижается — развивается тромбоцитопения. Обычно она связана с тремя состояниями 2 :
Изменения свертывающей системы крови
С увеличением коагуляционного потенциала и связано значительное повышение уровня почти всех факторов свертывания крови, кроме факторов XI и XIII. Кроме того, увеличивается и концентрация в плазме фибриногена.
Изменения в показателях гемостаза у беременных женщин, общая картина 1 :
Из важных изменений, происходящих в системе гемостаза у здоровых женщин, необходимо отметить рост концентрации D-димера по мере увеличения сроков беременности.
Таким образом, при беременности наблюдаются физиологические изменения системы гемостаза в сторону гиперкоагуляци.
Какие лабораторные параметры позволяют оценить систему гемостаза при беременности?
Большинство специалистов сходится во мнении, что оценку гемостаза обязательно проводить на разных сроках беременности, начиная с момента первичного обследования.
Для оценки гемостаза исследуется уровень нескольких показателей, каждый из которых играет важное значение в функционировании системы свертывания крови.
Минимальное обследование гемостаза включает в себя определение следующих параметров:
АЧТВ — активированное частичное тромбопластиновое время. В некоторых лабораториях этот показатель называют АПТВ (активированное парциальное тромбопластиновое время). АЧТВ — это время, необходимое для сворачивания плазмы крови после добавления к ней кальция, фосфолипидов и каолина.
Укорочение АЧТВ говорит об ускорении свертывания и увеличении вероятности развития ДВС-синдрома, а также о возможном наличии антифосфолипидного синдрома или недостаточности факторов свертывания.
Удлинение АЧТВ характерно для недостаточной коагуляционной способности крови и риске кровотечений во время родов или в послеродовой период.
Протромбиновое время — показатель гемостаза, показывающий, сколько времени нужно для свертывания плазмы крови при добавлении к ней кальция и тканевого фактора. Отражает внешний путь свертывания.
Укорочение протромбинового времени характерно для ДВС-синдрома.
Удлинение может говорить об увеличении вероятности послеродового кровотечения вследствие дефицита ряда факторов свертывания, заболеваний печени, недостаточности витамина К и некоторых других состояний и заболеваний.
В различных лабораториях протромбиновое время может быть представлено тремя способами:
Фибриноген — белок, из которого образуется фибрин, участвующий в формировании красного тромба.
Снижение содержания этого белка наблюдается при ДВС-синдроме, патологии печени.
Повышение уровня фибриногена во время беременности — вариант нормы. Также следует определять количество тромбоцитов в крови для исключения тромбоцитопатий.
D-димер — это продукт распада фибрина, небольшой фрагмент белка, присутствующий в крови после разрушения тромба. То есть его повышение говорит об активном процессе тромбообразования. В то же время этот показатель физиологически повышается при беременности.
Однако для того, чтобы подтвердить, что у пациента развился тромбоз, только измерения уровня D-димера недостаточно. Для подтверждения диагноза следует провести дополнительные инструментальные методы исследования (ультразвуковое дуплексное ангиосканирование, КТангиография) и оценить наличие клинических признаков заболевания.
Также в некоторых случаях врачи могут предполагать наличие наследственной тромбофилии (генетически обусловленной способности организма к формированию тромбов). С более подробной информацией о наследственных тромбофилиях вы можете ознакомиться в соответствующем разделе.
Опыт применения терапевтического афереза у беременных с тяжелой гиперлипидемией
Т.А. Федорова, Е.В. Стрельникова, Н.Е. Кан, М.В. Мельников, Р.М. Eсаян
ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова» МЗ РФ, г. Москва
Трансфузиология №1, 2015
Резюме
В статье представлена оценка эффективности методов терапевтического афереза (плазмафереза и каскадной плазмофильтрации) у беременных с тяжелыми метаболическими нарушениями в виде гиперлипидемии и гипертриглицеридемии. Наблюдались две беременных женщины в сроках гестации 33–34 недели с хронической плацентарной недостаточностью, с гиперлипидемией, гипертриглицеридемией. У второй беременной при поступлении диагностирован острый жировой панкреатит. До и после родоразрешения путем операции кесарева сечения (второй пациентке произведено также вскрытие и дренирование сальниковой сумки, декапсуляция поджелудочной железы, дренирование брюшной полости) проводились процедуры плаз- мафереза на аппарате РСS-2 («Гемонетикс» США) и процедуры каскадной плазмофильтрации на аппарате «CobeSpectra» («Фрезениус» Германия) с фильтром Evaflux 5a («Курарэй», Япония). Обе пациентки выписаны в удовлетворительном состоянии с новорожденными детьми. Показано значительное улучшение клинической картины заболевания, быстрое значимое снижение уровней показателей липидного спектра: холестерина, триглицеридов, липопротеидов низкой плотности, амилазы, ЛДГ, снижение тромботического потенциала крови. Методы гемафереза следует считать методами выбора в своевременном лечении беременных с выраженными метаболическими на- рушениями для предотвращения фатального панкреатита и профилактики тяжелых акушерских осложнений.
Ключевые слова: беременность, гиперлипидемия, гипертриглицеридемия, сахарный диабет, панкреатит, плазмаферез, каскадная плазмофильтрация, новорожденный.
Введение
В последние годы в клинической практике все шире используются методы экстракорпоральной гемокоррекции или терапевтического афереза, сущность которых заключается в перфузии крови или плазмы через сорбенты, мембраны или фильтры, в удалении части плазмы, что позволяет вывести из организма экзо- и эндотоксины, повышенные уровни холестерина, липидов, триглицеридов, аутоантител и циркулирующих иммунных комплексов улучшить функции почек, печени, дыхательной, иммунной, эндокринной систем, гемостаза, повысить чувствительность к эндогенным и медикаментозным веществам [1–3].
Известно много различных технологий терапевтического афереза, включая плазмаферез, каскадную плазмофильтрацию, разнообразные виды осаждения компонентов плазмы и сорбционные технологии. Самым широко используемым является плазмаферез (ПА), который применяется в лечении многих заболеваний в клинической практике, в том числе и в акушерстве и гинекологии, так как способствует улучшению реологии крови, иммунокоррекции, детоксикации. Но вместе с тем данный метод отличается несе- лективностью и имеет ограничения из-за необходимости при определенных ситуациях замещения удаляемой плазмы донорской плазмой, раствором альбумина с возможностью иммунизации к чужеродным белкам. Возможность селективного удаления из плазмы крови веществ, вызывающих или поддерживающих различные заболевания, а также возможность воздействовать на различные клетки с нарушенными функциями – это новая концепция в медицине, в том числе и в акушерско-гинекологической практике.
В отделении гравитационной хирургии крови НЦ ГиП им. акад. В.И. Кулакова имеется опыт использования сочетания терапевтического плазмафереза и каскадной плазмофильтрации (КПФ) у беременных с метаболическим синдромом, сахарным диабетом, сопровождающимися выраженной гиперлипидемией, гипертриглицеридемией, гиперхолестеринемией, высокой вязкостью крови и плазмы. При этом макроскопически плазма больных имеет вид «сливок». Приводим наш опыт применения сочетания методик терапевтического афереза (плазмаферез и КПФ) в лечении двух беременных с выраженной гиперлипидемией, гиперхолестеринемией, гипертриглицеридемией.
Цель: оценка эффективности методов терапевтического афереза (плазмафереза и каскадной плазмофильтрации) у беременных с тяжелыми метаболическими нарушениями в виде гиперлипидемии и гипертриглицеридемии.
Материалы и методы
Представлены клинические случаи ведения беременных в сроках 32–34 недели с гиперхолестеринемией, гипертриглицеридемией в сочетании с фетоплацентарной недостаточностью. Беременным до и после родоразрешения проводились процедуры плазмафереза (ПА) с использованием аппаратов РСS-2 («Гемонетикс», США) с удалением 30% объема циркулирующей плазмы за каждую процедуру, плазмовозмещение – 0,9% раствор натрия хлорида, 6% раствор гидроксиэтилированного крахмала, и 20% раствор альбумина (объемы плазмозамещения в соотношении к удаленной плазме 1,5:1,0), и процедуры каскадной плазмофильтрации (КПФ) на аппарате «Cobe Spectra» («Фрезениус» Германия) с фильтром Evaflux 5a («Курарэй» Япония) с удалением 400 мл фильтрата. Для оценки эффективности использовались клинические, биохимические, гемостазиологические, ультразвуковые, допплерометрические кардиотокографические методы исследования.
Результаты и обсуждение
Пациентка Л., 19 лет, поступила в Центр из областной больницы с диагнозом: «Беременность 33–34 недели. Угрожающие преждевременные роды. Хроническая плацентарная недостаточность. Сахарный диабет I типа, тяжелое течение, декомпенсация. Диабетическая микро- и макроангиопатия. Стеатоз печени. Гиперлипидемия. Хронический пиелонефрит, обострение. Гидронефроз обеих почек». Наследственность: сахарный диабет 2-го типа у бабушки. Перенесенные заболевания: ветряная оспа, ОРВИ. Больная Л. страдает сахарным диабетом с 2001 г., с октября 2008 г. находилась на ин- сулинотерапии, которую отменила самостоятельно, узнав о беременности. Диету не соблюдала, самоконтроль гликемии проводила нерегулярно.
Данная беременность первая, наступила самостоятельно. Течение беременности: I триместр – без особенностей, II триместр – с угрозой прерывания беременности. III триместр – в сроке беременности 31 неделя в связи гипергликемией 17 ммоль/л больная была срочно госпитализирована, возобновлена инсулинотерапия. В 32 недели выявлен очень высокий уровень холестерина – общий холестерин сыворотки 21 ммоль/л. В 33 недели с приступом удушья, диабетическим кетоацидозом и полинейропатией доставлена на реанимобиле в НЦ АГиП им. Кулакова.
При поступлении – уровень холестерина сыворотки составил 21 ммоль/л, уровень триглицеридов – 18,3 ммоль/л, липопротеидов низкой плотности (ЛПНП) – 7,2 ммоль/л. Пороговым уровнем триглицеридов сыворотки для начала плазмафереза решено считать 11,3 ммоль/л (1000 мг/дл), поскольку именно при таком уровне резко возрастает риск фатального панкреатита [4]. Был срочно начат курс лечебного плазмафереза. Контролировались показатели биохимического анализа крови, гемостазиограммы беременной, ультразвукового, допплерометрического кардиотокографического исследований плода.
Всего было проведено 3 процедуры терапевтического плазмафереза с удалением 30% объема циркулирующей плазмы за каждую процедуру (вес беременной – 65 кг, ОЦП – 2520 мл), плазмовозмещение – 0,9% раствор натрия хлорида, 6% раствор гидроксиэтилированного крахмала, и 20% раствор альбумина, объемы плазмозамещения в соотношении к удаленной плазме – 1,5:1,0. По окончании 3 процедур плазмафереза уровень холестерина снизился до 17,15 ммоль/л, триглицеридов – до 9,17 ммоль/л, ЛПНП – до 5,4 ммоль/л. Учитывая положительную динамику уровней триглицеридов на фоне выраженной гипопротеинемии у больной, было решено провести процедуру каскадной плазмофильтрации с удалением 400 мл фильтрата. После первой процедуры уровень холестерина составил 13,2 ммоль/л, триглицеридов – 7,3 ммоль/л, ЛПНП – 5,2 ммоль/л.
Показатели ультразвукового и кардиотокографического исследований плода – без ухудшения. Показатели гемостазиограммы: концентрация фибриногена снизилась с 7,9 г/л до с 5,6 г/л, протромбиновый индекс – с 140 до 118%. АЧТВ удлинилось с 28 до 36 с; r + k – с 15 до 28 мм, ma укоротилось с 55 до 44 мм. Индекс тромбодинамического потенциала составил до про цедур 20,0 у. е., после курса лечения – 16,3 у. е., что свидетельствовало о снижении тромбодинамического потенциала крови, улучшении реологических свойств крови.
В сроке 36 недель беременности пациентка родоразрешена путем операции кесарева сечения в связи с развитием регулярной родовой деятельности. Родился живой мальчик массой 2359 г, длиной 47 см с оценкой по шкале Апгар на 7/8 балла.
С целью стабилизации показателей липидного спектра на 5-е сутки после родоразрешения проведена вторая процедура каскадной плазмофильтрации с удалением 300 мл фильтрата. После второй КПФ показатели липидного спектра практически нормализовались: холестерин – 4 ммоль/л, триглицериды – 2,1 ммоль/л, ЛПНП – 1,7 ммоль/л. Динамика показателей липидного спектра и снижение индекса атерогенности при проведении плазмафереза и КПФ представлены на рис. 1 и 2.
Больная перенесла все процедуры без осложнений, выписана на 7-е сутки после родов с ребенком под наблюдение врача.
Пациентка А., 20 лет, ист. 2569/14 АК, поступила в Центр с диагнозом: «Беременность 34 недели. Угрожающие преждевременные роды. Хроническая плацентарная недостаточность. Гиперлипидемия. Острый панкреатит».
Из анамнеза известно, что беременная из сельской местности, росла и развивалась нормально. Наследственность не отягощена. Из перенесенных заболеваний – детские инфекции. Данная беременность первая, наступила самостоятельно. Протекала без особенностей до 14 недель беременности. В 14 недель при заборе крови на анализы впервые был отмечен выраженный хилез плазмы, лечения не проводилось, дополнительного обследования также не проводилось. В 20 недель плазма была сливкообразная, уровни холестерина и триглицеридов были повышены. В 22 недели была госпитализирована в республиканскую больницу по месту жительства, где было проведено пять процедур плазмафереза с незначительным снижением уровней холестерина и триглицеридов. При УЗ-исследовании плод соответствовал сроку беременности. Беременная была выписана домой и до 32 недель никакого лечения не получала. Повторно госпитализирована в сроке 32 недели в республиканскую больницу. При сдаче анализов – сливкообразная кровь, получить какие-либо анализы не представлялось возможным. Плод соответствовал сроку беременности.
Произведена хирургическая операция: срединная нижняя лапаротомия, кесарево сечение в нижнем маточном сегменте поперечным разрезом. Вскрытие и дренирование сальниковой сумки, декапсуляция панкреас, дренирование брюшной полости.
Операция прошла без осложнений. Родился живой мальчик массой 2360 г, длиной 47 см с оценкой по шкале Апгар на 7/8 балла. В послеоперационном периоде: лечение соматостатином, парентеральное питание, промывание железы, ферментолечение. Через 12 часов после операции начато проведение процедур терапевтического афереза: всего проведено 2 процедуры лечебного плазмафереза с удалением 30% ОЦП за процедуру; далее 2 процедуры каскадной плазмофильтрации на фильтре 5А с удалением 400 мл фильтрата и в последующем еще 2 процедуры лечебного плазмафереза.
При поступлении уровень триглицеридов – 14,68 ммоль/л, холестерина – 20,3 ммоль/л, липопротеидов низкой плотности – 5,8 ммоль/л, общего белка – 205,9 г/л при выраженном хилезе сыворотки, амилазы – 313 ед./л,
ЛДГ – 998 ед./л.
По окончании курса лечения уровень холестерина снизился до 3,54 ммоль/л; триглицеридов – до 3,3 ммоль/л; липопротеидов низкой плотности – до1,5 ммоль/л; амилазы – до 57 ед./л; ЛДГ – до 500 ед./л, КА снизился с 21,4 до 7,7 ед. Динамика показателей липидного спектра у больной А. представлена на рис. 3.
При исследовании системы гемостаза выявлено, что при поступлении у пациентки – выраженная гиперкоагуляция, о чем свидетельствовали: высокий уровень фибриногена – 7,9 г/л, АЧТВ – 28 с, протромбиновый индекс (ПТИ) составлял 140%. Индекс тромбодинамического потенциала (ИТП) был высокий и составлял 55–52 у. е. После курса лечения с использованием методов терапевтического афереза уровень фибриногена составил 4,8 г/л, АЧТВ – 36 с, ПТИ снизился до 118%. ИТП снизился до 7,9–8,8 у. е., что свидетельствовало о нормокоагуляции. Тромботических осложнений у больной не было. Пациентка выписана в удовлетворительном состоянии с ребенком.
В акушерстве и гинекологии все более широкое применение находит такой селективный метод, как КПФ с использованием различных волоконных фильтров, при которой возможно удаление из крови липопротеинов низкой плотности (ЛПНП), ЛП(а), триглицеридов, фибриногена, холестерина, аутоантител, циркулирующих иммунных комплексов. Так, КПФ позволяет снизить концентрацию холестерина на 67%, ЛПНП – на 72%, ЛП(а) – на 70%, триглицеридов – на 54%, фибриногена – на 63%, вязкость плазмы – на 16%, за счет чего улучшаются гемореологические показатели крови [5–7]. В настоящее время российскими специалистами разработаны клинические протоколы использования экстракорпоральных методов лечения многих заболеваний [8]. Американским обществом по аферезу (American Society for Apheresis) также опубликованы рекомендации по использованию терапевтического афереза в различных областях медицины и представлена классификация процедур афереза [9]. Использование данных методик с применением разнообразных фильтров показано при тяжелых метаболических нарушениях (гиперлипидемии, гипертриглицеридемии и др.), при аутоиммунных заболеваниях (антифосфолипидный синдром, тиреоидит, нефротический синдром), резус-конфликте, остром поражении печени и многих других [10–12].
В акушерской и гинекологической практике методы терапевтического афереза используются у пациенток с тяжелыми метаболическими нарушениями, которые развиваются при беременности, у пациенток с аутоиммунными заболеваниями, осложняющими течение гестационного периода, нередко приводящими к репродуктивным потерям [13, 14]. Известно, что у пациенток с выраженными метаболическими нарушениями, включая гиперлипидемию, гипертриглицеридемию, нарушения пуринового обмена, углеводного обмена, сопровождающиеся повреждением эндотелия сосудов, имеются повышение вязкости крови, нарушения реологии крови, микроциркуляции, что нередко приводит к тромботическим осложнениям [15]. Коррекции гипервязкости крови у беременных особенно важна, так как вышеуказанные нарушения лежат в основе многих акушерских осложнений (преэклампсия, преждевременная отслойка нормально расположенной плаценты, плацентарная недостаточность, тромбозы, внутриутробная гибель плода и др.) [16]. Кроме того, одним из основных осложнений выраженной гиперлипидемии является тяжелый жировой панкреатит у больной. Известно, что гормональные изменения во время беременности в норме предрасполагают к повышению уровня холестерина, липидов, триглицеридов, но у пациенток с генетическими нарушениями метаболизма липопротеинов, с сахарным диабетом, заболеваниями гепатобилиарной системы нередко развивается выраженная, тяжелая гиперлипидемия, гипертриглицеридемия, усугубляющаяся по мере прогрессирования беременности. Помимо резко возрастающего риска панкреатита, для беременных с гиперлипидемией характерно преждевременное начало родовой деятельности в 32–36 недель [17]. Стандартная терапия этого заболевания вне беременности включает низкожировую диету, прием препаратов групп фибратов или статинов, а в случае развития панкреатита – инфузионную терапию и полный переход на парентеральное питание. Учитывая, что прием фибратов и статинов противопоказан при беременности ввиду их выраженной тератогенности, а риск развития панкреатита воз- растает в несколько раз, единственным решением проблемы лечения данной категории больных является применение методов гемафереза.
Заключение
Представленный анализ клинических наблюдений, при которых использовались методы терапевтического афереза у беременных с гиперлипидемией, позволяет заключить, что данные методы гемокоррекции следует рассматривать как методы выбора в лечении беременных с выраженными метаболическими нарушениями для профилактики панкреатита, тромботических осложнений и тяжелых акушерских осложнений. Своевременное, раннее их использование у беременных с гиперлипидемией исключает развитие фатального жирового панкреонекроза. Отсутствие адекватного обследования и лечения беременных с гиперлипидемией чревато тяжелыми последствиями, такими как развитие тяжелого панкреатита, жирового панкреанекроза, фетоплацентарной недостаточности, которые могут привести к летальному исходу, как со стороны матери, так и плода. Кроме этого, методы терапевтического афереза, обладая многокомпонентным воздействием, в лечении пациенток с выраженной гиперлипидемией позволяют избежать использования препаратов, обладающих токсическим воздействием на плод, в также пролонгировать беременность до сроков рождения жизнеспособного ребенка. Hакопленный нами опыт позволяет говорить о том, что показаниями для проведения КПФ с использованием волоконных фильтров типа 5А в акушерстве и гинекологии являются: метаболический синдром в
сочетании с гиперлипидемией, гиперхолестеринемией, триглицеридемией, сахарный диабет, сопровождающиеся высокой вязкостью крови и плазмы, нарушением микроциркуляции (в качестве подготовки к беременности и во время беременности); гомозиготная форма семейной гиперхолестеринемии; гетерозиготная форма семейной гиперхолестеринемии при тяжелом течении и отсутствии необходимого эффекта от медикаментозной терапии и/или непереносимости гиполипидемических препаратов; комбинированная гиперлипидемия. Противопоказания для КПФ в акушерстве и гинекологии: гипокоагуляция; выраженные нарушения гемодинамики (сердечная недостаточность, пороки сердца с декомпенсацией, аневризма аорты и пр.) у пациентки; тяжелое (декомпенсированное) состояние плода по данным УЗИ, допплерометрии, кардиотокографии; непереносимость экстракорпорального контура; аллергия на компоненты процедуры. Следует отметить, что многие методологические аспекты проведения терапевтического афереза у беременных с метаболическими нарушениями во время беременности остаются неразработанными. Требуются дальнейшие исследования по оптимизации применения методов экстракорпоральной гемокоррекции для больных акушерского стационара.
Литература
1. Кулаков В.И., Серов В.Н., Абубакирова А.М., Федорова Т.А. Интенсивная терапия в акушерстве и гинекологии (эфферентные методы). – М.: МИА, 1998. – 205 с.
2. Von Baeyer H. Plasmapheresis in immune hematology: review of clinical outcome data with respect to evidence based medicine and clinical experience // Ther. Apher. Dial. – 2003. – Vol. 1, № 7. – P. 127–140.
3. Winters J.L. Plasma exchange: concepts, mechanisms, and an overview of the American Society for Apheresis guidelines // Hematology. – 2012. – № 1. – Р. 7–12.
4. Morelli F., Carlier P., Giannini G. et al. Hypercholesterolemia and LDL apheresis // Int. J. Artif. Organs. – 2005. – № 28. – Р. 1025–1031.
5. Коновалов Г.А., Кухарчук В.В., Покровский С.Н. Экстракорпоральные методы лечения дислипидемий // Вестник «Медси». – 2009. – № 3. – С. 13–24.
6. Хаютина Т.Л., Балаболкин М.И., Коновалов Г.А. и др. Пути коррекции липидного обмена у больных сахарным диабетом 2-го типа // Вестник «Медси». – 2008. – № 2. – С. 28–43.
7. Mabuchi H., Higashikata T., Kawashiri M.A. Clinical applications of long-term LDL – apheresis on and beyond refractory hypercholesterolemia // Transfus. Apher. – 2004. – № 30. – Р. 233–243.
8. Калинин Н.Н. Клиническое применение экстракорпоральных методов лечения. – М.: МИА, 2007. – 165 с.
9. Szczepiorkowski Z.M., Winters J.L., Bоndarenko N. et al. Guide-lines on the use of therapeutic apheresis in clinical practice: evidence-based approach from the Apheresis Applications Committee of the American Society for Apheresis // J Clin Apher. – 2010. – № 25. – Р. 83–177.
10. El-Haieg D.O., Zanati M.F., El-Foual. Plasmapheresis and pregnancy outcome in patients with antiphosphlipid syndrome // Int. J. Gyn. & Obstet. – 2007. – № 99. – Р. 236–241.
11. Соколов А.А. Эфферентные методы интенсивной терапии аутоиммунных и метаболических заболеваний (экспериментально-клиническое исследование): автореф. дис. … док. мед. наук. – СПб., 2007. – 505 с.
12. Nakanishi T., Suzuki N., Kuragano T. et al. Current topics in the rapeutic plasmapheresis // Clin. Exp. Nephrol. – 2014. – Vol. 1, № 18. – Р. 41–49.
13. Sivakumaran P., Tabak S.W., Gregory K. et al. Management of familial hypertriglyceridemia during pregnancy with plasma exchange // J. Clin. Apher. – 2009. – № 24. – Р. 42–46.
14. Макацария А.Д., Пшеничникова Е.Б., Пшеничникова Т.Б., Бицадзе В.О. Метаболический синдром и тромбофилия в акушерстве и гинекологии. – М.: МИА, 2006. – 476 с.
15. Amundsen A.L., Khoury J., Sandset P.M. et al. Altered Нemostatic balance and endothelial activation in pregnant women with familial hypercholesterolemia // Thromb. Res. – 2007. – № 120. – Р. 21–27.
16. Herrera E., Amusquivar E., Lopez-Soldado I., Ortega H. Maternal lipid metabolism and placental lipid transfer // Horm. Res. – 2006. – № 65. – Р. 59–64.