инфекции мрса что это
Стафилококк золотистый. Микробиологические аспекты
Прошло много лет после написания первой статьи, посвященной лечению инфекций, вызванных золотистым стафилококком. За это время автор, будем надеяться, немного помудрела и приобрела кое-какой опыт в более детальной диагностике вышеупомянутых состояний, чем и хотела бы поделиться с многоуважаемой аудиторией в надежде, что, возможно, поможет каждому из вас в рутинной ежедневной работе, так как с этой зверюшкой сталкивается буквально каждый, кто надел белый халат и уж тем более хирургический костюм.
Автор: Трубачева Е.С., врач – клинический фармаколог
Прошло много лет после написания первой статьи, посвященной лечению инфекций, вызванных золотистым стафилококком. За это время автор, будем надеяться, немного помудрела и приобрела кое-какой опыт в более детальной диагностике вышеупомянутых состояний, чем и хотела бы поделиться с многоуважаемой аудиторией в надежде, что, возможно, поможет каждому из вас в рутинной ежедневной работе, так как с этой зверюшкой сталкивается буквально каждый, кто надел белый халат и уж тем более хирургический костюм.
Сначала повторим общеизвестные факты: S.aureus относится к грамположительным коккам и являются чуть ли не основной причиной большого количества инфекций кожи и мягких тканей, а так же ведущей причиной послеоперационных раневых инфекций.
Выделяют следующие разновидности золотистого стафилококка:
И сейчас обсудим первые три более подробно, так как именно они являются той причиной, ради которой повторно поднята данная тема, в том числе и по просьбам читателей (за что выражаем отдельную признательность).
Первое, что необходимо не просто запомнить, а буквально зазубрить наизусть — золотистый стафилококк, он же S.aureus, является нормальным жителем на неповрежденной коже и слизистых оболочках. Еще раз — нормальным, но только на неповрежденной коже и вне зависимости от антибиотикочувствительности пойманных экземпляров. Если кожа по тем или иным причинам поражается (например, сахарным диабетом) или повреждается, стафилококк тут же из милого соседа превращается в злейшего врага. Все как у людей — стоит дать слабину, и ближайшие соседи начнут добивать с ласковой улыбкой.
Таким образом, когда вы получаете результат микробиологического исследования образца, взятого с кожи (или из носоглотки), и видите там золотистого стафа, то должны понимать, кто перед вами, и насколько этот кто-то имеет отношение к текущему процессу.
Второе: если клиника отсутствует, а стафилококк посеялся, надо сделать что? Правильно, повторить посев еще раз. Золотистый стафилококк — это один из немногих микробов, чье наличие в отделяемом материале надо проверять дважды. Единственное исключение — это кровь, взятая непосредственно из сосудистого русла, чаще всего из вены. Наличие стафилококка в крови является поводом к немедленному назначению антибактериальной терапии, так как прямо указывает на наличие инфекции кровотока, а уж какого она генеза, спонтанного или ятрогенного, разбираться будете позже. Во всех остальных ситуациях проводится пересев с тщательным соблюдением техники забора материала (со стенок раны, а не гной, состоящий из дохлых нейтрофилов и нападавших сверху стафилококков) и правил асептики и антисептики, чтобы собственными стафилококками с кожи вновь забранный материал не контаминировать.
Чтобы понять, друг перед нами или враг, познакомимся со стафилококками более подробно.
И нет, автор не сошла с ума — резистентность к ванкомицину у природных диких золотистых стафилококков — совершенно нормальное явление. Более того, попытка лечить такого возбудителя ванкомицином считается грубейшей ошибкой и закончится полным провалом в силу природной устойчивости к данному препарату. Это третье, о чем помнить необходимо.
Где мы встречаем таких S.aureus чаще всего? В носоглотках грудных младенцев или в их же кале, если придумали посеять. Почему? Потому что это представитель нормальной микрофлоры кожи, и ребенок сглатывает то, что живет в его носоглотке или слизывает с кожи матери. Надо лечить? В данной ситуации — ни в коем случае, иначе побьете нормальную микрофлору кожи и слизистых, и если очень повезет, то для ребенка это пройдет без последствий, но, скорее всего, получим стафилококка, вооруженного пенициллиназами, или MSSA. Повторимся еще раз — только в случае отсутствия клинической картины можно принимать такого рода решения. Во всех иных случаях необходима антибактериальная терапия, причем на длительный (до 28 суток) период времени.
Обратите внимание на строку с бензилпенициллином, указывающую на наличие пенициллиназ. Мы обязаны упомянуть, что точно такая же картинка может наблюдаться и у пациентов, давно или никогда не применявших антибиотики, так как пенициллиназы еще в середине прошлого века «ушли» в дикую природу.
Почему MSSA? Обратите внимание на строку с оксациллином, который в данной панели поставлен вместо метициллина. Таким же ориентиром может быть цефазолин. Оба этих препарата до сих пор являются самыми эффективными в клиническом плане антибиотиками для эрадикации дикого и MSSA стафилококков, если к этому имеются показания
При каких состояниях мы можем увидеть подобных возбудителей?
Типичным для клинической картины будет довольно агрессивное течение заболевания с яркими клиническими проявлениями ввиду того, что именно такой вид стафилококка обладает определенным набором ферментов, очень быстро расплавляющим окружающие ткани с образованием полостей и большим количеством гнойного отделяемого.
на антибиотикограмме будет выглядеть приблизительно так, оксациллин-резистентный, но ванкомицин-чувствительный (хотя при таком значении МПК уже возможны варианты)
Когда встречается? Все многообразие ятрогенных ВБИ к вашим услугам — почти все раневые инфекции и послеоперационные гнойные осложнения вне зависимости от их локализации. Повторимся в очередной раз — руки надо мыть, и мыть правильно. А еще закрывать маской не только рот, но и нос всем, кто хоть как-то касается открытых ран вне зависимости от причин их образования, так как стоит ране появиться, как стафилококк мгновенно превращается в зверя, осложняющего течение любого послеоперационного периода, особенно после операций, связанных с установками импланта. Более подробно о лечении предлагаем почитать в первой статье.
А теперь, тихо-тихо прошепчем, что иногда так может выглядеть приболевший микробиологический анализатор, который все, что в него не поставят, может определять как подобную страшную зверюгу. Хотя у вашего анализатора может быть какая-то своя болячка, и эти болячки лучше все-таки знать. Именно такого рода антибиотикограммы, как ничто другое наглядно показывают необходимость развития клинического мышления для умения отличать истинного возбудителя от контаминанта или нормального жителя человеческого организма, а также необходимости понимания, как работают методы микробиологической диагностики и варианты их ограничения.
Подведем краткие итоги нынешнего разговора:
В заключение хотелось бы отметить следующее. Уважаемые коллеги, золотистый стафилококк, при отсутствии клинической картины и на неповрежденной коже и слизистых является нормой — не надо его там «лечить». И брызгать ничем туда не надо. А в случаях наличия клинической картины (исключение — инфекции кровотока), необходимо провести повторный посев, с тщательным соблюдением правил асептики и антисептики, чтобы быть уверенными, что именно этот микроб является возбудителем, а не кто-то прячется за его спиной.
Метициллин-резистентный золотистый стафилококк (МРЗС)
Эта информация позволит вам узнать, что представляет собой метициллин-резистентный золотистый стафилококк (МРЗС), как он распространяется и как лечатся вызываемые МРЗС инфекции.
Что представляет собой метициллин-резистентный золотистый стафилококк?
Стафилококк (Staphylococcus) — это вид бактерий, обитающих в окружающей среде, в том числе и на поверхности кожи человека. Метициллин-резистентный золотистый стафилококк (МРЗС) — это стойкий к определенным антибиотикам вид стафилококка. Это означает, что некоторые методы лечения не справятся с ним или будут менее эффективными.
МРЗС может вызывать различные заболевания, например:
В чем состоит разница между колонизацией и инфицированием МРЗС?
Человек может быть либо колонизирован, либо инфицирован МРЗС. Колонизация означает наличие бактерий на коже или в организме человека при отсутствии каких-либо симптомов. Инфицирование означает наличие бактерий на коже или в организме, приводящее к появлению симптомов.
Как распространяется МРЗС?
Большинство инфекций, вызываемых МРЗС, распространяется через прямой контакт с физиологическими жидкостями инфицированного человека, такими как кровь, выделения из раны, моча, стул или мокрота (флегма). Также они могут распространяться через контакт с оборудованием или поверхностями, на которых могут находиться эти бактерии. МРЗС не распространяются при простом контакте, например через прикосновение или объятие.
Кто подвержен риску инфицирования МРЗС?
Заразиться инфекцией, вызываемой МРЗС, с большей вероятностью могут лица:
Каковы симптомы инфекции МРЗС?
Ваши симптомы будут зависеть от места возникновения инфекции и от типа инфекции.
Каковы методы лечения инфекции, вызываемой МРЗС?
Инфекции, вызываемые МРЗС, лечатся антибиотиками, к которым у вызвавших их бактерий нет устойчивости.
Какие меры по изоляции принимаются в больнице, если у меня обнаружена инфекция, вызываемая МРЗС?
Врач скажет вам, когда можно будет прекратить соблюдать эти меры предосторожности. Это произойдет после того, как вы пройдете курс лечения и у вас исчезнут все симптомы.
Какие меры по изоляции мне следует принять дома, если у меня обнаружится инфекция, вызываемая МРЗС?
Дома обязательно делайте следующее:
Где я могу получить дополнительную информацию о МРЗС?
Если у вас есть вопросы, обратитесь к своему врачу или медсестре/медбрату. Кроме того, для получения дополнительной информации вы можете посетить веб-сайты:
Инфекции мрса что это
Лиза Ко. 24 мая 2011 года.
В докладе, опубликованном в мае 2011 года Центрами по контролю и профилактике заболеваний (США) сообщалось, что из почти 300 образцов сырого мяса, приобретенного в 30 супермаркетах Детройта, шесть образцов дали положительный результат на бактерии MRSA.
Это не первый раз, когда MRSA был найден в мясе, которое мы едим, еще чаще находят этот штамм стафилококка в спортивных залах, больницах и пригородных поездах. Устойчивость к антибиотикам усиливается с каждым годом, и MRSA был разрекламирован как супермикроб конца света, который отвечает за 19 000 смертей в США каждый год. Является ли его распространение истинным бедствием в области общественного здравоохранения или причины для тревоги гипертрофированы?
Вот что вы должны знать.
Они не обязательно плотоядные
Золотистый стафилококк, хоть и характеризуется как плотоядная супербактерия, инфицирование MRSA может начаться с такой простой вещи, как фурункул или прыщ, причиной заражения может стать нарыв, волдырь или язва.
Больные заболевают в больницах
Инфекции MRSA происходят с нарастающей частотой в больницах, где стафилококковые бактерии засевают раны пациентов, которые уже ослаблены. Внутрибольничные инфекции являются причиной более чем 98 000 смертей в США каждый год. Шестьдесят три процента от общего числа случаев стафилококковой инфекции были вызваны MRSA в 2004 году, по сравнению с 22 процентами в 1995 году и 2 процентами в 1974 году.
MRSA грозит не только пожилым и слабым
Сегодня новые и более сильные штаммы MRSA не только угрожает старым и немощным. Так называемые микробные ассоциированные инфекции, вызванные MRSA, поражают здоровых и молодых людей, которые не были госпитализированы. Оборудование тренажерных залов, салонов татуировки, общие полотенца или бритвенные лезвия являются общими путями распространения инфекций. Вспышки чаще происходят там, где люди находятся в непосредственной близости друг от друга, например, в школах, спортзалах и тюрьмах.
Широкое использование антибиотиков привело к появлению более вирулентных штаммов бактерий, которые труднее уничтожить. Микробные ассоциированные инфекции вызваны штаммом MRSA, поэтому чем штамм MRSA сильнее, тем труднее лечить ассоциированную с ним инфекцию.
Виноваты животные
В 2004 году была была найдена связь MRSA у свиней и у людей в Нидерландах, когда несколько членов семей, работающих на одной из свиноферм и одновременно свиньи на этой ферме, все дали положительный результат на бактерии. Свиноводы в Нидерландах были в 760 раз чаще подвержены инфекции, чем в целом в популяции. В США у 45% фермеров, ухаживающих за свиньями и у 49% проверенных свиней был также обнаружен MRSA (носители инфекции не обязательно имеют симптомы заболевания).
Какая здесь связь? В промышленном животноводстве животные находятся в очень тесном помещении, что требует кормления этих животных антибиотиками, чтобы они не заражались в антисанитарных условиях содержания. В одном исследовании 2001 года сделан вывод, что здоровый скот потребляет 70% всех антибиотиков в США. Результатом является более быстрый рост животных, но также вырабатывается и большая устойчивость бактерий к антибиотикам. Затем бактерии MRSA от животных могут передаваться людям, которые работают с животными или пьют грунтовую воду, которая была загрязнена свинофермой.
Будущее темно и неясно
MRSA в вашем мясо не смертный приговор. Штамм стафилококка, обнаруженный в Детройте в продуктовых магазинах, может вызывать заболевания у человека. Возможно, он передается через переработчиков пищи или через оборудование при переработке. Инфекция может быть передана потребителям, если они, например, работают с сырым мясом, имея порезы на руках (надевайте перчатки для защиты в этом случае). Если тщательно готовить мясо и мыть все кухонные принадлежности, бактерии вам не страшны.
Устойчивость к антибиотикам у MRSA усиливается, что может сделать ее неизлечимой. Инфекции, вызванные новыми бактериальными штаммами Acinetobacter baumannii, оказывается еще более сложными для лечения. Общество инфекционных болезней Америки утверждает, что растущая устойчивость к антибиотикам является “надвигающимся кризисом” и “существенной угрозой для общественного здравоохранения и национальной безопасности США ”.
Инфекции мрса что это
Грамположительные кокки составляют значительную долю возбудителей инспекционных осложнений у онкологических больших в хирургических отделениях. Лидирующая роль в структуре грамположительных возбудителей у онкологических больных с послеоперационными РИ принадлежит S. aureus. По данным CDC, у здоровых людей S. aureus колонизирует слизистую оболочку носа в 20% случаев. Но-сительство МRSA регистрируется у 0,8-1% больных при госпитализации. В онкологии с S. aureus связано 20,8% НКИ. Более 30% послеоперационных РИ обусловлено S. aureus, 14 % — S. epidermidis.
Посев крови редко может помочь клиницистам в диагностике послеоперационных раневых инфекций в области брюшной полости. Интраабдоминальные инфекции это распространенная проблема, стоящая на 2-м месте среди наиболее частых причин летальности от инфекции. По зарубежным данным, рост из крови микроорганизма, идентичного микроорганизму из инфицированной послеоперационной раны, регистрируется в 0% случаев при аппендэктомии и достигает 5% при наличии чрескожных дренажных устройств. При инфицированных послеоперационных ранах наиболее целесообразно назначать посев крови больным отделения реанимации, где летальность от инфекции высока.
В отношении метициллин-чувствительных стафилококков (MSSA, MSSE), следует упомянуть группу фторхинолонов, применяемых для лечения стафилококковых инфекций (особенно кожи и мягких тканей), например левофлоксацин (Таваник) и моксифлоксацин (Авелокс), которые обладают более высокой активностью при стафилококковых инфекциях в сравнении с традиционными препаратами данной группы. Между этими антибиотиками нет полной перекрестной резистентности. По нашим данным, для трех наиболее часто выделяемых видов стафилококков (S. aureus, S. epidermidis, S. haemolylicus) моксифлоксацин статистически значимо более эффективен in vitro по сравнению с левофлоксацином.
Как правило, препаратами выбора для лечения стафилококковых инфекций служат b-лактамные антибиотики. Существует два основных механизма устойчивости стафилококков к этой группе препаратов: продукция b-лактамаз или наличие дополнительного пенициллинсвязывающего белка (ПСБ2а). Выявление этих механизмов и четкое их разграничение у конкретных штаммов стафилококков позволяют точно прогнозировать эффективность всей группы b-лактамных антимикробных препаратов без необходимости определения чувствительности к каждому препарату в отдельности.
В связи с этим следует руководствоваться следующими правилами при анализе антибиотикограммы стафилококков:
• чувствительность к бензилпенициллину/ампициллииу: штамм не имеет механизмов резистентности. Можно прогнозировать чувствительность ко всем остальным b-лактамным антибиотикам (например, к цефазолипу, цефотаксиму и др.). Препараты выбора: природные пенициллины (например, бензилпенициллин — пенициллин G);
• устойчивость к бензилпенициллину/ампициллину, но чувствительность к оксациллину/метициллину: штамм продуцирует ферменты b-лактамазы (пенициллиназы), способные разрушать природные и полусинтетические пенициллины.
• устойчивость и к бензилпенициллину/ампициллину, и к оксациллину/метициллину: штамм имеет ПСБ2а, следовательно, все b-лактамные антибиотики клинически будут неэффективны, даже если в антибиотикограмме будет указана чувствительность к ним.
Для штаммов с истинной оксациллин/метициллин-резистентностью характерна ассоциированная резистентность к антибиотикам и других групп (например, к гентамицину, клиндамицину, ципрофлоксацину и др.). Препараты выбора: гликопептиды (ванкомицин), вторая линия — оксазолидиноны (линезолид). Таким образом, определение чувствительности стафилококков к антибиотикам в рутинной работе при определенных обстоятельствах можно ограничить двумя тестами: определение чувствительности к бензилпенициллипу и оксациллипу (выявление истинной резистентности к оксациллипу подразумевает выявление гена тесА, кодирующего синтез ПСБ2а).
По нашим данным, при послеоперационных раневых инфекциях штаммы S. aureus, обладающие истинной резистентностью к оксациллину (MRSA), составляют всего 9,5% (39 из 410), что статистически значимо ниже в сравнении с коагулазонегативными стафилококками (КНС). Так, 66,9% (204 из 305) штаммов S. epidermidis и 100% (191 из 191) штаммов S. haemolyticus были расценены как метициллин-резистентные коагулазонегативные стафилококки (КНС).
MRSA важный нозокомиальный патоген, составляющий более 50% НКИ в США, один из основных возбудителей послеоперационных раневых инфекций (РИ). Доля MRSA в структуре послеоперационных раневых инфекций (РИ) в США выросла С 9% в 1995 г. до 30% в 2000 г. с атрибутивной летальностью 21 %.
J.J. Engemann и соавт. изучили влияние MRSA на исход при послеоперационных инфекциях у 479 больных и пришли к выводу, что летальность у больных без инфекции составила всего 2,1%, при инфекции, обусловленной метициллин-чувствительными S. aureus (MSSA), — 6,7%, что статистически значимо выше, чем в случае без инфекции. Для MRSA летальность была статистически значимо выше, чем в каждом из предыдущих случаев, — 20,7%. Кроме того, стоимость лечения возрастала с 29 455 долларов США в случае без инфекции до 52 791 долларов при MSSA и достигала 92 363 долларов при MRSA.
Таким образом, экономические потери и увеличение летальности при хирургических инфекциях, обусловленных MRSA и MR-КНС, очевидны.
Пациенты больниц и медицинские работники по сути представляют собой потенциальный резервуар для штаммов MRSA, любые меры по уменьшению значимости этих резервуаров могут способствовать снижению НКИ, обусловленных MRSA. Весьма эффективным может быть выявление носителей штаммов MRSA среди медработников, а также обследование больных перед госпитализацией путем исследования слизистой оболочки полости носа с последующей санацией выявленных носителей или их изоляцией. Выделение специальных помещений для больных, колонизированных или инфицированных штаммами MRSA, с ограничением их передвижения в пределах больницы уже не только признано целесообразным, по и имеет место на практике во многих зарубежных клиниках.
Для лечения взрослых больных с послеоперационными раневыми инфекциями, обусловленными MRSA, рекомендован ряд препаратов: ванкомицин, линезолид, даптомицин, тигециклин, телеванцин. В недалеком будущем будет доступен новый антибиотик цефтаролин (цефалоспорин, Зинфоро). Хотя новые антибиотики с эффективностью против MRSA по сравнению с вапкомицином не демонстрируют особых преимуществ. Следует обращать внимание на то, какие штаммы циркулируют в конкретном стационаре: если МПК ванкомицина в отношении S. aureus не более 2 мкг/мл, назначать ванкомицин можно при его клинической эффективности, по в случае МПК > 2 мкг/мл (VISA штамм со сниженной чувствительностью ванкомицину, VRSA — ванкомицин резистентный штамм) следует переходить на альтернативные препараты.
В последнее время стали поступать сообщения о так называемой «MIC creep» — «плавающая, скрытая МПК». Штаммы с такой МПК ванкомицина, по критериям CLSI, считаются к нему чувствительными. В настоящее время появилась точка зрения, что понятие «MIC creep» следует считать спорным, т. к. возможным объяснением этого феномена может быть различие в методах определения МПК.
По данным отечественных стационаров чувствительность к ванкомицину всех исследованных в ходе мониторинга штаммов стафилококков высока, но статистически значимо ниже для S. epidermidis по сравнению с S. aureus и S. haemolyticus. Эффективность линезолида (Зивокс) и тигециклина in vitro составляет 100% в отношении всех видов стафилококков.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Инфекции мрса что это
ФГБУ «НИИ детских инфекций ФМБА», Санкт-Петербург
Введение
Золотистый стафилококк (Staphy-lococcus aureus) – наиболее частый патоген человека, вызывающий различные гнойные процессы: инфекции кожи и мягких тканей (ИКМТ), остеомиелиты, пневмонии, бактериемии. Кроме того, S. aureus является представителем нормальной микробиоты человека, считается, что он встречается у 30–60% человеческой популяции и бессимптомно колонизирует слизистые крыльев носа, крылья носа, подмышечные впадины, пах, подколенную область. Как известно, внедрение первых β-лактамов почти полностью решало проблему стафилококковых инфекций, связанных с хирургическим вмешательством. Однако у стафилококков достаточно быстро появилась устойчивость к пенициллину за счет приобретения плазмидной β-лактамазы.
В 1960-х гг. вскоре после внедрения в практику пенициллиназостабильных β-лактамов (метициллин) были описаны первые S. aureus, устойчивые к этим антибиотикам (Methicillin-resistant Staphylococcus aureus, MRSA) [1]. Достаточно быстро было установлено, что устойчивость к метициллину является маркером устойчивости ко всем β-лактамам, известным в то время. Впервые появившись в Англии, MRSA теперь циркулируют на всей планете. По количеству летальных исходов MRSA лидируют среди других мультирезистентных бактерий; так, в последнем (2013) опубликованном отчете CDC morrigan сообщается, что в США от инфекций, обусловленных мультирезистентными бактериями, погибают около 23 тыс. американцев в год, из них 11 тыс. приходится на MRSA [2]. Долгое время MRSA считался исключительно госпитальной инфекцией, но с 1990-х гг. стали описывать случаи тяжелых инфекций среди людей, не связанных с учреждениями здравоохранения (внебольничные MRSA) [3]. Позже, в середине 2000-х, появились MRSA, ассоциированные с инфекциями у животных, которые могут передаваться и человеку. Основным препаратом для лечения MRSA-инфекций длительное время оставались гликопептиды, однако в середине 1990-х впервые были описаны изоляты со сниженной чувствительностью к ванкомицину [4], а с 2002 г. – абсолютно резистентные фенотипы [5]. Появление изолятов, устойчивых к гликопептидам, послужило стимулом для разработки и внедрения новых антибиотиков и даже принципиально новых классов препаратов: оксазолидинонов, глицилциклинов, липопептидов, цефалоспоринов с анти-MRSA-активностью. Однако уже описаны клинические изоляты, проявляющие устойчивость и к этим антибиотикам. Биологические особенности основных генотипов MRSA кратко представлены в табл. 1.
Распространение и молекулярная эпидемиология MRSA в мире
Для MRSA характерна высокая степень клональности популяции; так, можно выделить всего несколько групп клонов, распространных на обширных географических территориях и наиболее клинически значимых. На сегодняшний день мультилокусное сиквенс-типирование (MLST – Multi-Locus Sequence Typing) рассматривается как основной метод оценки генетического родства бактерий и стафилококков в частности. Идентифицированный клон называется сиквенс-типом (ST, sequence type) [8]. Например, первый клон MRSA – ST250 «archaic clone», был изначально распространен на территории Западной Европы. Наиболее успешные клоны, пандемично распространенные по всему миру, относятся к ST8 и ST239. Клон ST8, вариант USA300, был впервые описан как внебольничный MRSA, появившийся на территории США.
В 1970–1980 гг. MRSA стали абсолютным лидером в структуре внутригоспитальных инфекций. Тем не менее частота регистрации случаев таких инфекций в разных странах колеблется в очень широком диапазоне. На рисунке представлены данные Европейской системы по надзору за распространением резистентности (European Antimicrobial Resistance Surveillance Network – EARS-Net), где показана доля выявляемых MRSA в разных странах за 2013 г. [9]. В таких странах, как Румыния, Италия, Греция, Португалия, Мальта, частота выявления MRSA очень высока (35–65%), напротив, в скандинавских странах эта доля не превышает 5%.
В Африке доля MRSA колеблется в пределах 25–50%, а в некоторых странах не достигает 20%. Можно выделить три доминирующих клона – ST88 «African clone» (превалирует), ST80 и ST239, все они отличаются высокой долей устойчивости к ко-тримоксазолу и тетрациклинам [10].
Азия – один из неблагоприятных регионов, где соотношение CA-MRSA и HA-MRSA составляет 25 и 75%. Особенно неблагоприятна ситуация в Корее, Шри-Ланке и Вьетнаме. Вместе с тем в некоторых странах отмечается появление и распространение клонов со сниженной чувствительностью к гликопептидам. На территории всего азиатского региона циркулирует ST239, который является ведущим нозокомиальным патогеном. Среди CA-MRSA преобладают клоны ST8, ST30, ST59, ST22, ST772 и ST72 [11].
Лидерами по распространению MRSA являются страны Латинской и Южной Америки, где частота выделения HA-MRSA колеблется от 30 до 90% и CA-MRSA – от 15 до 80%. Первая вспышка CA-MRSA-инфекции произошла в 2002 г. среди заключенных в тюрьмах Уругвая. Было госпитализировано более 1000 человек, из них 12 погибли. Среди HA-MRSA превалируют клоны ST239 (вариант «Brazilian»), ST247, ST5 (вариант «New-York/Japan») и ST8; среди внебольничных – ST5 (вариант «Pediatric»), ST100 («Argentinian pediatric clone»), ST8 («USA300») [12].
В Австралии инфекции, вызванные MRSA, не превышают 30%, но остро стоит проблема CA-MRSA, с 2000-х гг. периодически описываются вспышки в местах повышенной скученности людей. К числу основных клонов CA-MRSA относятся ST93, ST75, ST30, ST1, ST45, ST78 и ST5 [13].
С 1979 по 2000 г. сообщения о выделении MRSA от животных были скорее исключением, чем обычным явлением. В 2005 г. был описан тяжелый случай развития MRSA-инфекции у 6-месячного ребенка, жившего на ферме в Нидерландах. Проведенные генетические исследования показали, что выделенный от пациентки изолят принадлежал к новому на тот момент клону, ST398, более того, у животных, обитающих на той ферме также был выявлен этот клон. Так, появился новый эпидемиологический кластер – MRSA ветеринарной линии (LA-MRSA), проявляющий устойчивость к многим группам препаратов (тетрациклины, макролиды, ко-тримоксазол, фторхинолоны). Некоторыми исследователями высказывается предположение, согласно которому клон ST398 в большей степени ассоциирован с поражениями верхних дыхательных путей [14].
В связи с крайне высокой значимостью негативных клинических факторов, ассоциированных с MRSA, в США, Австралии и ряде стран Европы были приняты жесткие противоэпидемические меры по сдерживанию этой инфекции, что способствовало существенному снижению распространения MRSA [15]. В частности, в Европе удалось снизить частоту выделения c 24% в 2005 г. до 16% в 2013-м (см. рисунок).
Проблема снижения чувствительности к гликопептидам
В 1997 г. в Японии был выделен первый VISA-изолят (Mu50), имеющий МПК ванкомицина 8 мкг/мл [4]. Mu50 был выделен из инфицированной кардиохирургической раны 4-месячного пациента, при этом терапия ванкомицином не давала положительных результатов. Другой изолят, Mu3, выделенный через год в том же госпитале также на фоне неудачи лечения имел МПК ванкомицина 4 мкг/мл, отличался нестабильностью свойств, вследствие чего он был отнесен к категории hVISA. За прошедшее десятилетие сообщения о изолятах со сниженной чувствительностью появлялись по всему миру. За последнее время в ряде регионов в популяции MRSA наблюдают сдвиг МПК в сторону больших значений («MIC creep» – «сползание МПК»): с этим феноменом, возможно, связано возрастание числа случаев клинических неудач ванкомицина [16, 17]. Однако такой сдвиг МПК наблюдается не во всех регионах мира, в некоторых работах МПК ванкомицина на протяжении длительного периода времени в одном стационаре или географическом регионе сохраняется на одном уровне [18–20]. Экстраполируя данные о чувствительности к ванкомицину с клинической точки зрения, стоит сказать, что уже при МПК=2 мкг/мл вероятность неудачной терапии ванкомицином резко возрастает [21, 22]. Несколько позже были описаны изоляты MRSA, проявляющие высокую степень устойчивости к гликопептидам.
В 2002 г. в Мичигане (США) был описан первый клинический изолят ванкомицинустойчивого S. aureus (VRSA-1). У этого изолята был обнаружен мобильный генетический элемент, полученный от ванкомицинрезистентного энтерококка [23]. С 2002 по 2009 г. в США было выявлено 11 изолятов VRSA: 7 – из Мичигана (VRSA-1, VRSA-5-10), изоляты из Пенсильвании (VRSA-2), Нью-Йорка (VRSA-3), а также из Индии и Ирана. По всему миру к 2013 г. всего было описано 33 клинических изолята VRSA [24–26]. Очевидно, что подобные фенотипы не распространяются и элиминируют из стафилококковой популяции.
Проблема MRSA в России
В России ситуацию с распространением MRSA, c одной стороны, нельзя оценить в силу отсутствия централизованной системы по сбору данных о циркуляции госпитальных и внегоспитальных патогенов, с другой – имеющиеся исследования показывают крайнюю неравномерность их распространения. Так, частота встречаемости MRSA может колебаться от 0 до 80% в зависимости от стационара и географического региона. Анализ популяционной структуры MRSA еще раз подчеркивает ее высокую клональность. Другая особенность – в России циркулируют только HA-MRSA. Изолят CA-MRSA, несущий токсин PVL, был обнаружен только в одном случае во Владивостоке [27]. Среди HA-MRSA доминируют два клона – ST8 и ST239, при этом первый превалирует [28, 29]. Проведенные авторами исследования показывают, что среди изолятов ST239 преобладают фенотипы с устойчивостью более чем к трем не-β-лактамным антибиотикам. Кроме того, ST239 встречается только среди больных инвазивными формами стафилококковых инфекций. Клон ST8, напротив, более гетерогенен по спектру антибиотикоустойчивости, а также может встречаться среди носителей. В работах О.А. Дмитренко было показано, что эти клоны циркулируют на территории России с 1990-х гг. [30]. По нашим данным, в Санкт-Петербурге и Москве с 2011 г. стал регистрироваться не характерный для России клон ST228, который характеризуется множеством различных детерминант устойчивости к не-β-лактамам, а также сниженной чувствительностью к новому цефалоспорину – цефтаролину. Помимо вышеперечисленных клонов гораздо реже, но встречаются ST1, ST5 и ST22.
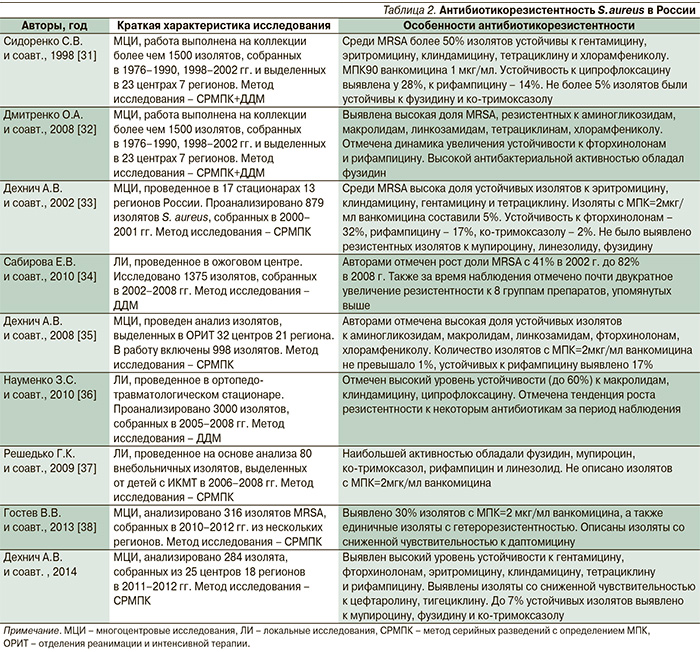
В табл. 2 представлены результаты проведенных в России многоцентровых и локальных исследований по изучению антибиотикорезистентности S. aureus. Отдельного внимания заслуживает чувствительность к ванкомицину. Во многих исследованиях с применением дискодиффузионного метода (ДДМ) оценки чувствительности, проведенных в России, не было описано ни одного случая выявления VRSA-фенотипа. Другой вопрос – это изоляты MRSA со сниженной чувствительностью к ванкомицину (hVISA и VISA). К сожалению, определение МПК в России проводят лишь единичные лаборатории, а поскольку определение снижения чувствительности и выявление hVISA/VISA изолятов возможно только этими методами (хотя и не всегда точно), данных о рассматриваемых фенотипах практически нет. Как уже отмечено ранее, в некоторых странах наблюдается «MIC creep»-эффект для ванкомицина, в какой-то степени на основе анализа имеющихся исследований можно заключить, что такой процесс происходит и в России. Например, в работах начала 2000-х гг. доля изолятов с МПК ванкомицина 2 мкг/мл составляла не боле 5%, а к 2013 г. возросла до 30% (табл. 2). Раннее исследование, проведенное авторами, также показало, что единичные изоляты проявляют hVISA-фенотип. Все эти факты свидетельствуют о том, что использование ванкомицина в клинической практике для лечения MRSA-инфекций необходимо проводить под строгим наблюдением и постоянным мониторингом чувствительности исследуемой культуры только методами количественной оценки.
Диагностика инфекций, вызываемых MRSA, детекция метициллинрезистентности
В современную диагностику инфекций, вызываемых MRSA, как и в другие области микробиологической диагностики, происходит постепенное внедрение молекулярных методов. На сегодняшний день существуют коммерческие тест-системы, основанные в основном на ПЦР, позволяющие выявлять MRSA непосредственно в биологических образцах, не выделяя чистую культуру возбудителя. Шире всего молекулярные методы применяются при диагностике бактериемии (сепсиса) и при скрининге на носительство MRSA, т.е. в тех ситуациях, когда скорость ответа имеет существенное значение. В случае бактериемии (сепсиса) быстрый ответ необходим для принятия решения об антибактериальной терапии, а в случае скрининга – для принятия решения о необходимости изоляции пациента. Скрининг на носительство широко распространен в Европе и США, где это исследование применяется в системе инфекционного контроля для предотвращения импорта MRSA в стационары.
При всей перспективности молекулярной диагностики классические методы вряд ли утратят свое значение в обозримом будущем. Если классическая микробиологическая диагностика инфекций, вызываемых MRSA, ничем не отличается от диагностики других стафилококковых инфекций, то детекция метициллинрезистентности имеет некоторые особенности. Прежде всего метициллин уже давно не применяется не только в клинической медицине, но и в лабораторной диагностике. На протяжении многих лет метициллинрезистентность выявляли ДДМ-использованием диска с оксациллином. Однако сравнительно недавно было показано, что использование диска с цефокситином обеспечивает большую чувствительность и специфичность детекции метициллинрезистентности. На основании этих данных CLSI и EUCAST рекомендуют использовать для детекции метициллинрезистентности только диски с цефокситином. Здесь же уместно еще раз напомнить, что, согласно рекомендациям CLSI и EUCAST, оценивать чувствительность стафилококков к другим β-лактамам, кроме цефтаролина и цефтобипрола, нецелесообразно из-за высокой вероятности получения ложной чувствительности. Для прогноза чувствительности к β-лактамам необходимо использовать результаты, получаемые при оценке чувствительности культуры к цефокситину.
Гораздо более серьезную проблему из-за невозможности использовать ДДМ представляет определение чувствительности стафилококков к ванкомицину (выявление фенотипов VISA и hVISA). Молекулярные тесты также отсутствуют, поскольку точный механизм формирования устойчивости не известен. Для выявления снижения чувствительности необходимо использовать фенотипические методы определения МПК в серийных разведениях или разные варианты эпсилометрических тестов. Однако перечисленные методы недостаточно стандартизованы и не обладают необходимой специфичностью и чувствительностью. Наиболее достоверным методом служит популяционный анализ (PAP), требующий для своей постановки специальной аппаратуры [39]. Естественно, что такой метод достаточно трудоемок и может быть выполнен только в специализированных референс-лабораториях. В отличие от детекции hVISA/VISA фенотип VRSA легко можно определять даже ДДМ.
Лечение инфекций, вызываемых MRSA
Наиболее детальные рекомендации по тактике терапии MRSA-инфекций изложены в двух обновляемых протоколах: Американского общества инфекционистов – IDSA (Infectious Diseases Society of America) [40] и Британского общества по микробной химиотерапии BSAC (British Society for Antimicrobial Chemotherapy) [41]. Описываемые ниже возможности лечения MRSA-инфекций основаны на этих протоколах.
Традиционными средствами лечения MRSA-инфекций считаются гликопептиды, из них в настоящее время в Российской Федерации доступен только ванкомицин. Применение ванкомицина разрешено при MRSA-инфекциях практически любой локализации, несмотря на то что его эффективность далеко не во всех случаях подтверждена контролируемыми клиническими испытаниями. Столь широкий спектр показаний к применению ванкомицина связан с тем, что препарат зарегистрирован в годы, когда требования к доказательности эффективности были минимальными. В связи с появлением штаммов MRSA со сниженной чувствительностью к ванкомицину роль этого антибиотика в этиотропной терапии пересматривается.
Прежде всего это касается режимов дозирования антибиотика, наиболее современные рекомендации по этому вопросу приведены в консенсусном документе, принятом рядом профессиональных сообществ [42]. Основу этих рекомендаций составляют клинические наблюдения, а также анализ фармакокинетических и фармакодинамических закономерностей. Показано, что предиктором эффективности ванкомицина является отношение площади под фармакокинетической кривой ванкомицина (area under the curve – AUC) к минимальной подавляющей концентрации (minimal inhibitory concentration – MIC) антибиотика в отношении возбудителя. Высокая вероятность клинического и бактериологического эффекта отмечается при значении AUC/MIC≥400. Обеспечить эту величину удается в отношении бактерий с МПК ванкомицина 1,0 мкг/мл при разовой дозе антибиотика 5–20 мг/кг, вводимой с интервалом 8–12 часов. При МПК ванкомицина в отношении возбудителя более 1,0 мкг/мл для лечения рекомендуется использовать альтернативные препараты.
Важным моментом правильного клинического применения ванкомицина служит учет того факта, что при лечении инфекций, вызванных метициллинчувствительными стафилококками, антибиотик по эффективности существенно уступает β-лактамам. Этот факт исключает возможность эмпирического применения ванкомицина при стафилококковых инфекциях без подтверждения метициллинрезистентности.
Перечень разрешенных показаний к ванкомицину и анти-MRSA-препаратам, альтернативным ванкомицину, приведен в табл. 3. Очевидно, что для альтернативных препаратов перечень показаний весьма ограничен, т.к. по современным требованиям разрешение на применение по каждому показанию может быть получено только при наличии положительных результатов контролируемых клинических испытаний. Однако на практике эти препараты применяются гораздо шире (назначение «off label»), что имеет крайне важное значение для накопления новых клинических данных и последующего расширения официальных показаний. Следует также указать, что возможности применения этих антибиотиков при MSSA-инфекциях гораздо шире. В некоторых ситуациях для лечения MRSA-инфекций применяют ко-тримоксазол, рифампицин и клиндамицин.
Бактериемии делят на осложненные и осложненные, последние определяют как развившиеся на фоне эндокардита или при наличии имплантированных устройств. Основу терапии составляют ванкомицин и даптомицин, при неосложненных формах достаточной считается 2-недельная длительность применения, при осложненных – 4–6 недель. Обсуждается вопрос о дозах даптомицина. Разрешенная доза составляет 6,0 мг/кг/сут, высказывается предположения о необходимости использовать при эндокардите дозы до 10,0 мг/кг/сут. Целесообразность использования комбинаций ванкомицина с аминогликозидами или рифампицином не доказана.
Наиболее широкие возможности существуют для лечения ИКМТ, по этому показанию можно применять все анти-MRSA-антибиотики. Оборотная сторона медали доступности многих препаратов – это сложность выбора наиболее эффективного. В клинических испытаниях при ИКМТ эффективность новых антибиотиков, как правило, сравнивают с ванкомицином (проверка гипотезы не меньшей эффективности – «non-inferiority»). Результат подавляющего большинства таких испытаний – это отсутствие достоверных различий между ванкомицином и новыми препаратами. Исключение составляет демонстрация определенных преимуществ цефтаролина перед комбинацией ванкомицина и азтреонама при оценке результата на ранних стадиях инфекции [43]. При выборе терапии ИКМТ важно помнить, что адекватный дренаж при легких формах вполне достаточен для получения максимального эффекта, а при средне-тяжелых формах эффективны доксициклин, ко-тримоксазол или клиндамицин. Среди MRSA, циркулирующих в Российской Федерации, отмечают низкую частоту ассоциированной устойчивости к ко-тримоксазолу (2% по критериям EUCAST); частота устойчивости к тетрациклинам и клиндамицину существенно выше – 52 и 45% соответственно. Для лечения поверхностных инфекций кожи и мягких тканей возможно также использование топических препаратов – мупироцина, фузидина [44].
Ни один из новых препаратов не рекомендован для лечения интраабдоминальных MRSA-инфекций. Тигециклин, разрешенный по этому показанию при MSSA-инфекциях, на практике применяют и при MRSA- инфекциях.
Лечение нозокомиальной пневмонии, в т.ч. и вентиляторассоциированной, – один из немногих случаев, в котором показано достоверное преимущество линезолида перед ванкомицином. Даптомицин при легочных инфекциях практически неэффективен, поскольку ингибируется легочным сурфактантом [45].
При инфекциях мочевыводящих путей ни один из новых антибиотиков не показан, рекомендуется использовать нитрофурантоин или ко-тримоксазол, при осложненных формах – ванкомицин и даптомицин. Концентрации линезолида и тигециклина не достигают терапевтических значений в моче, соответственно, их использование нецелесообразно [46].
Новые антибиотики также не рекомендованы для лечения инфекций ЦНС; базовым препаратом считается ванкомицин, некоторые эксперты рекомендуют его комбинацию с рифампицином. Несмотря на отсутствие официальных показаний, имеется положительный опыт применения при менингитах и других инфекциях ЦНС линезолида и даптомицина.
Помимо существующих высокоэффективных антибиотиков в настоящее время в клиническую практику внедряются новые препараты, активные в отношении MRSA, VISA, VRSA. К их числу относятся тедизолид (Tedizolid), далбаванцин (Dalbavancin) и телаванцин (Telavancin). Тедизолид – бактериостатический антибиотик группы оксазолидинонов второго поколения, механизм его действия – нарушение сборки бактериального рибосомального комплекса, что приводит к нарушению биосинтеза белка клетки. Основной особенностью тедизолида считается преодоление резистентности к линезолиду. Препарат ориентирован на терапию ИКМТ у взрослых (FDA, 2014), также ведутся клинические испытания по поводу возможности использования тедизолида для лечения нозокомиальных пневмоний [47, 48]. Далбаванцин – дериват гликопептидов, относится ко второму поколению липогликопептидов, одобрен FDA в 2014 г. для лечения ИКМТ. Этот антибиотик, аналогичный ванкомицину, нарушает биосинтез клеточной стенки бактерии [49]. Телаванцин – парентеральный липогликопептид, нарушает биосинтез клеточной стенки, одобрен в 2009 г. для лечения стафилококковых ИКМТ, внутрибольничных пневмоний и вентиляторассоциированных пневмоний [50].
Еще два препарата с анти-MRSA-активностью, рекомендованные для лечения ИКМТ, которые заслуживают внимания, – это оритаванцин (Oritavancin) группы гликопептидов [51] и хинупристин/дальфопристин (Quinupristin/dalfopristin) группы стрептограминов [52]. Проведенные клинические испытания, а также исследования чувствительности in vitro показывают высокую эффективность этих антибиотиков в отношении MRSA. К сожалению, все вышеописанные препараты пока не зарегистрированы на территории России, а стоимость лечения ими крайне высока даже в Европе и США.
Заключение
До сих пор MRSA по количеству летальных исходов и экономических затрат на лечение входит в одну тройку с такими инфекционными заболеваниями человека, как туберкулез и СПИД. Однако понимание механизмов распространения и соблюдения крайне жестких превентивных мер (по принципу «search and destroy» – «найти и уничтожить») по сдерживанию MRSA привели к значительному снижению уровня этой инфекции в Европе и США. Такой опыт, безусловно, необходимо внедрять и в нашей стране. Если в первой половине 2000-х гг. практически не было препаратов (кроме, ванкомицина) для лечения MRSA, то в настоящее время существует много альтернатив, и при условии проведения рациональной антимикробной химиотерапии можно добиться высокой эффективности лечения и свести проблему MRSA к минимуму. Более того, уже не одно десятилетие ведутся разработки по созданию стафилококковой вакцины, внедрение которой, возможно, способствовало бы снижению риска развития внутрибольничных MRSA-инфекций.
Литература
Об авторах / Для корреспонденции
В.В. Гостев – ФГБУ «НИИ детских инфекций ФМБА», Санкт-Петербург
С.В. Сидоренко – ФГБУ «НИИ детских инфекций ФМБА», Санкт-Петербург
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)