ингибирует репликацию что значит
Репликация вирусов
Репликация вирусов
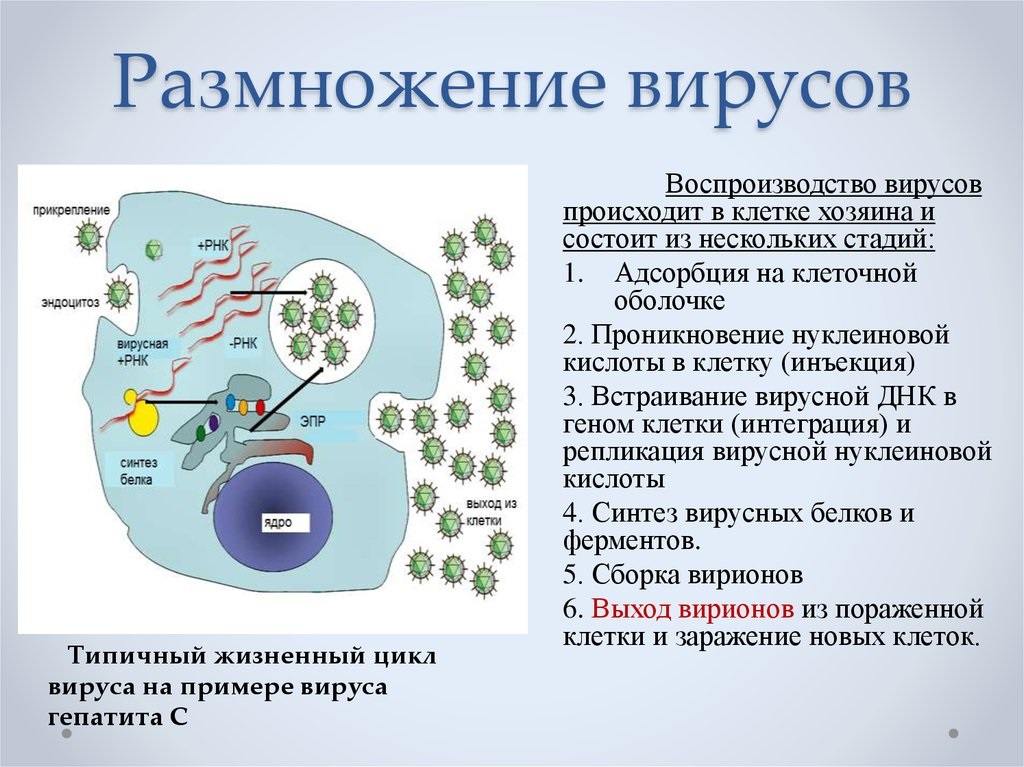
Размножение вируса, или репликация, является весьма характерным процессом, свойственным только обитателям этого особого мира природы. Как известно, рост организмов растительного и животного мира природы невозможен без деления клеток. Вирус же вообще не увеличивается в размерах. Вирусные частицы появляются сразу «взрослыми» в результате своеобразного процесса, названного репликацией. Но самое поразительное — то, что в продуцировании новых вирусных частиц участвует только одна нить: одинарная цепочка нуклеиновой кислоты.
Проследим за нуклеиновой кислотой бактериофага, проникшей в клетку бактерии. Первым делом ДНК выключает жизненно важные для клетки хозяина процессы. Затем начинают образовываться специфические вещества ферменты, идущие на строительство молекул ДНК, точно таких же, какие были и у бактериофага. Примерно через 8 мин образование ферментов замедляется и начинают образовываться белки капсидов. На строительство цепочек нуклеиновых кислот потомства кроме ферментов идет часть родительской ДНК бактериофага и разбитая ДНК хозяина. Капсиды новых бактериофагов строятся из вновь образованных белков; сюда же идет часть белков разрушенной клетки и старого бактериофага.
Примерно через 15 мин после инфицирования в клетке бактерий образуется столько вирусных частиц, что им становится тесно. Они разрывают оболочку хозяина и вырываются наружу, заражают новые клетки бактерий и т. д.
Репликация вирусов как сборочный конвейер
Часто процесс репликации вирусов сравнивают с заводским сборочным конвейером, действующим по заранее разработанному технологическому процессу. Сначала под руководством ДНК идет изготовление строго определенных элементов деталей. Далее ДНК вырабатывает белки своей сферы и ядрышко, вокруг которого белки под влиянием электростатических сил собираются в сферу. Ядрышко уничтожается, после того как образовалась головка-сфера. Один из ответственейших моментов сборки — заполнение сферы цепочкой ДНК. К этому моменту из отдельных участков «цеха сборки» к «главному конвейеру» подаются недостающие детали бактериофага: стержень, сократительные кольца, пластинки, нити. Эти детали друг за другом прикрепляются к сфере.
Интересно, что «рабочие» операции по сборке вирусов сходны с процессами зарождения и развития более сложных организмов. Не заимствованы ли эти приемы из мира вирусов?
Кстати, технические приемы репликации различных видов вирусов не только состоят из общих операций, но имеют и некоторые особенные черты. Так, вирусы оспы размножаются в цитоплазме, а вирусы группы герпеса и аденовирусы — в ядре. В процессе построения нуклеиновых кислот участвуют разрушенные системы клетки хозяина. Следовательно, вирусам оспы и аденовирусам придется использовать различный строительный материал. Эти вирусы относятся к группе крупных вирусов. Например, в молекуле ДНК вируса осповакцины закодировано около 500 белков. Цикл размножения длится более 20 ч. Можно представить, как сложно контролировать процесс репликации вируса! И если системы, отвечающие за последовательность сборки, хоть раз ошибутся, вирусу не удастся «самособраться». Запомните это уязвимое место в процессе репликации.
Отряд самоубийц в медицине
Отряд самоубийц в медицине
Необратимый ингибитор (оранжевый), подобно диверсанту, подрывает работу фермента (синий). Это потенциальное лекарство против трипаносомы крузи — главной причины болезни сердца в Латинской Америке.
Авторы
Редакторы
Статья на конкурс «био/мол/текст»: Многие лекарства конкурируют с природными молекулами за связывание со своей мишенью. Большинство таких препаратов связывается с белками за счет слабых взаимодействий, но некоторые способны образовывать прочные связи, «выключая» свою мишень до конца ее «жизни», пусть и ценой собственной. Такие лекарства относятся к классу необратимых ковалентных ингибиторов, получивших образное название суицидных ингибиторов (англ. suicide inhibitors). О них и пойдет речь в нашей статье. Как работают и насколько опасны одни из самых эффективных лекарств? Чья болезнь помогла открыть аспирин? Что общего между никотином и грейпфрутовым соком? Ответы на эти и многие другие вопросы вы найдете далее.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2017.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».
Из чего же, из чего же сделаны эти лекарства?
Сегодня сложно представить себе человека, который ни разу в жизни не принял ни одной таблетки. Каждый год прилавки аптек пополняются все новыми и новыми лекарствами. Независимо от цвета упаковки препарата и его лекарственной формы (будь то таблетка, мазь, капсула, раствор для инъекций и т.д.) внутри всегда содержится главный компонент лекарства — действующее вещество. Именно оно и обеспечивает терапевтический эффект.
Большинство действующих веществ является ингибиторами, то есть они блокируют функцию того или иного белка (чаще фермента, но иногда и рецептора) в нашем или чужеродном организме. Многие из них связываются со своей мишенью обратимо, то есть после встраивания в мишень молекула может выйти обратно, так что их возможности сильно ограничены. Но необратимые ковалентные ингибиторы «намертво» связываются со своей мишенью. В результате фермент больше не способен функционировать до тех пор, пока клетка не синтезирует его новые копии.
Низкомолекулярные «взломщики»
«В чем же секрет столь сильного связывания этих ваших необратимых ингибиторов?» — спросите вы. В ковалентной связи. Существует несколько механизмов связывания лекарств с их молекулярными мишенями. Обычно связывание происходит при помощи слабых взаимодействий [4]. Ковалентная же связь является сильнейшим из возможных взаимодействий и превосходит любые другие в десятки, а то и сотни раз (табл.1) [5]!
| Тип связи | Энергия, ккал/моль |
|---|---|
| Ковалентная | 50–150 |
| Электростатическая | 5–10 |
| Водородная | 2–5 |
| Гидрофобная | 0,5–1 |
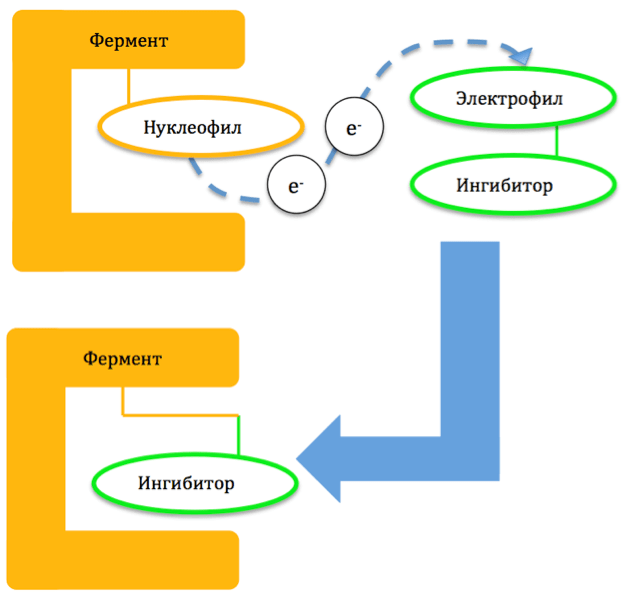
Механизм образования ковалентной связи строится на том, что пара электронов одного из атомов молекулярной мишени (нуклеофила) распределяется между ним и одним из атомов ингибитора (электрофилом) (рис. 1). Из-за высокой прочности связи ингибитор оказывается необратимо присоединен к ферменту и приводит к разрушению последнего. Восстановление функции фермента наступает только после синтеза его новых копий [5].
Рисунок 1. Общий механизм действия необратимых ингибиторов.
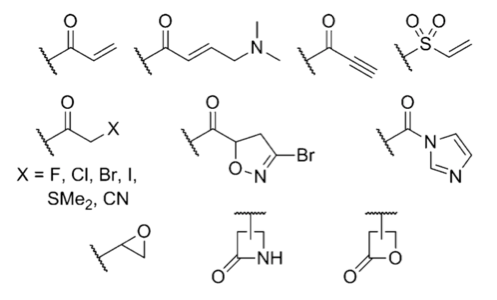
Как же выглядят эти электрофильные группы, которые используются для создания ковалентных необратимых ингибиторов? Найти ответ вы сможете, посмотрев на рисунок 2. Наличие одного из этих фрагментов в структуре лекарства может говорить о том, что оно действует по уже известному вам механизму [6].
Рисунок 2. Примеры электрофильных групп, встречающихся в необратимых ингибиторах.
Несмотря на то, что связывание необратимых ингибиторов приводит к гибели фермента, не следует думать, что одна доза такого лекарства может полностью уничтожить фермент в организме. Наличие и работа генов позволит создать его новые копии, пусть на это и понадобится от нескольких часов до пары дней [2].
Как и все в мире, ковалентные необратимые ингибиторы имеют свои преимущества и недостатки, которые мы представили в формате таблицы 2 [6].
| Преимущества | Недостатки |
|---|---|
| Высокие эффективность и избирательность позволяют использовать меньшие дозы и уменьшить риск побочных эффектов | Высокая активность некоторых представителей может приводить к некрозу печени, мутациям и даже раку! |
| Связывание с важными остатками фермента предотвращает развитие устойчивости микробов, что важно при лечении инфекций | Потенциальная иммуногенность, так как полученный продукт реакции может вызывать аллергический ответ |
| Длительное действие, так как активность фермента вновь появляется только при синтезе его новых копий |
Тернистые пути разработки эффективных лекарств
Если вы думаете, что разработка необратимых ковалентных ингибиторов — легкое дело, то вы глубоко заблуждаетесь. Даже если закрыть глаза на то, что разработка любого лекарства является крайне трудоемким и времязатратным процессом [7], задача не сильно упростится — ведь необратимые ингибиторы требуют особого подхода к своей персоне. Сегодня не так много одобренных препаратов действуют именно таким образом. А механизм действия многих из них открыли только спустя годы после разработки! Ученые на этом пути сталкиваются с большим количеством порой неразрешимых проблем.
Одна из них — участие одного фермента сразу в нескольких метаболических каскадах. Обсуждаемые лекарства необратимо связываются с ферментом-мишенью, уничтожая его на то время, которое требуется на синтез новых копий фермента. Этот процесс может занимать до нескольких суток! В том случае, если фермент-мишень выполнял несколько функций, это чревато серьезными побочными эффектами. Чтобы обойти проблему, необратимо связывающиеся ингибиторы чаще всего применяют для блокирования одного из ферментов потенциально опасных для человека вирусов, бактерий и т. д. [3].
Вторая проблема заключается в том, что при низкой избирательности необратимые ингибиторы могут связываться с нежелательными мишенями, похожими на выбранную нами для ингибирования. Это тоже может приводить к серьезным побочным эффектам. Поэтому важная задача при оптимизации структуры ингибиторов — повышение избирательности к своей мишени [3].
Опасения в отношении побочных эффектов необратимых ингибиторов не лишены оснований. Бум гонений на эту группу препаратов вызвали исследования 1970-х годов. Тогда выяснили, что два из наиболее широко известных представителей этой группы — парацетамол и фуросемид — обладают высокой токсичностью в связи с тем, что, метаболизируясь в печени, они образовывают активные производные, формирующие ковалентные связи с ее белками [2], [8]. Как выяснилось позже, эти единичные случаи не имеют отношения ко многим препаратам из группы необратимых ингибиторов, а парацетамол и фуросемид до сих пор активно используются в клинической практике.
Другим распространенным примером нежелательного необратимого ингибирования является цитохром P450. Цитохромы — группа ферментов в нашем организме, главной задачей которых является обезвреживание потенциально опасных веществ. Первыми необратимыми ингибиторами цитохрома стали алкены и алкины. В результате ингибирования этого фермента процессы детоксикации становятся невозможными. Неполный список препаратов, способных вступать в подобную реакцию, включает 17α-алкенил-стероиды, левомицетин, циклофосфамид, спиронолактон, фурокумарины, никотин, изониазид и барбитураты. Звучит опасно, не правда ли? Не многим опаснее, чем пить грейпфрутовый сок! Его компоненты способны необратимо связываться с цитохромом кишечника и лишать этот фермент активности на 24 часа! К чему это может привести? К тому, что принимаемые в это время лекарства будут более эффективно поступать в наш организм, а рост их концентрации повышает риск развития нежелательных эффектов [5]. Именно поэтому врачи рекомендуют запивать таблетки только водой.
Но всегда ли можно считать необратимые ингибиторы безопасными лекарствами? Конечно же, нет. Поиск необратимых ингибиторов, и правда, не всегда оборачивается успехом для исследователей. В частности, полным провалом завершились исследования мышьяк-содержащих органических соединений для лечения трипаносомоза [9]. Эти соединения необратимо ингибировали жизненно необходимые ферменты трипаносомы за счет образования связей между атомом мышьяка в составе исследуемых веществ и серосодержащими остатками фермента. Но они оказались токсичными не только для трипаносомы, но и для организма человека [5].
К счастью, несмотря на все перипетии судьбы, ученые вновь сфокусировали свои пристальные взгляды на необратимых ковалентных ингибиторах. Лучшее понимание реально существующих рисков и знание механизма химических преобразований открыли множество возможностей для разработки более эффективных лекарств и привели к резкому росту встречаемости необратимых ингибиторов в различных исследованиях [10].
«Ветераны» борьбы за здоровье человечества
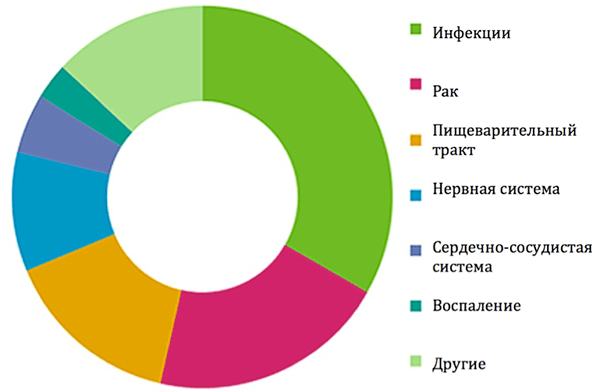
Многие из широко применяемых успешных препаратов — необратимые ковалентные ингибиторы [6]. Например, в 2009 году три необратимо связывающихся ингибитора попали в топ-10 наиболее продаваемых лекарств [2]. В 2011 году из 39 ковалентных лекарств, одобренных в США, 33% являлись противоинфекционными, 20% нашли применение в лечении рака, 15% применялись при болезнях пищеварительного тракта, 10% — при нарушении работы центральной нервной системы, 5% использовались при лечении сердечно-сосудистых заболеваний и один препарат обладал противовоспалительными свойствами (рис. 3) [6], [11].
Рисунок 3. Области применения одобренных в США необратимо связывающихся ингибиторов (данные за 2011 год).
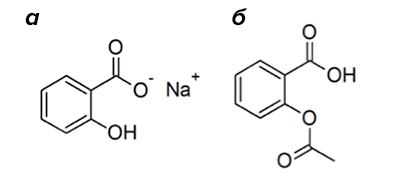
Рисунок 4. Структура салицилата натрия (а) и аспирина (б).
Давайте же поговорим о нескольких наиболее успешных примерах необратимых ковалентных ингибиторов.
Натрия салицилат впервые применили в качестве противовоспалительного лекарства в 1875 году (рис. 4а). Препарат обладал ужасным вкусом и вызывал язвы ротовой полости и желудка. В конце XIX века отец одного из химиков компании Bayer Company, страдающий от тяжелого ревматоидного артрита, упросил своего сына, Феликса Хоффмана, заняться поиском менее опасного аналога салицилата натрия. Феликс синтезировал различные производные и обнаружил, что ацетилсалициловая кислота обладает лучшими свойствами. Так был обнаружен аспирин (рис. 4б). В 1899 году Bayer выпустила аспирин как противовоспалительное, обезболивающее и жаропонижающее средство [2]. Как и в случае многих других препаратов, механизм его действия открыли только спустя 70 лет после коммерциализации препарата [6], за что в 1982 году была вручена Нобелевская премия [2], [12]. Аспирин оказался необратимым ингибитором ферментов, участвующих в реакции воспаления — циклооксигеназ [6].
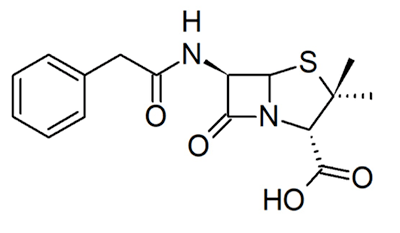
Рисунок 5. Структура пенициллина.
Другие примеры необратимых ковалентных ингибиторов — пенициллины [6]. Их родоначальника, пенициллин (рис. 5), открыл в 1928 году Александр Флеминг [13]. Ученым понадобилось еще 15 лет, чтобы достаточно изучить и начать использовать этот препарат в качестве антибактериального лекарственного средства, что спасло миллионы жизней во время Второй мировой войны [12]. Пенициллин нарушает синтез клеточной стенки бактерий. Он связывается с транспептидазой — ферментом, обеспечивающим первый этап сшивки пептидогликана, который является основным компонентом бактериальной клеточной стенки. Когда пенициллин связывается с транспептидазой, синтез бактериальной клеточной стенки блокируется, и многие бактерии погибают от разрыва клеточной мембраны под воздействием осмотического давления [1].
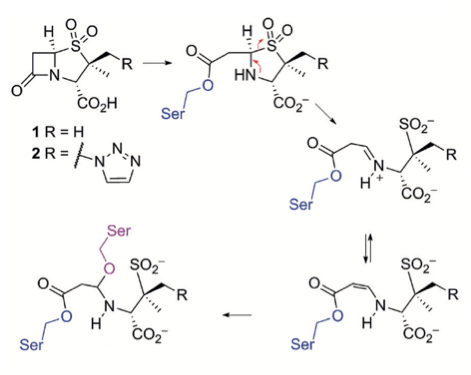
Однако все оказалось не так радужно — у бактерий обнаружились механизмы устойчивости [14]. В частности, резистентность к пенициллинам обеспечивается за счет наличия β-лактамаз — ферментов, расщепляющих пенициллины. Ученые не остановились на достигнутом и разработали ингибиторы этого фермента — сульбактам, тазобактам и клавулановую кислоту. Подобно пенициллинам, в результате нуклеофильной атаки эти соединения претерпевают открытие β-лактамного кольца. Отличие в том, что ингибиторы β-лактамаз подвергаются раскрытию и второго цикла, содержащегося в их структуре. При этом появляется возможность образования дополнительных связей, в том числе и ковалентных (рис. 6) [6], [15].
Рисунок 6. Механизм действия ингибиторов β-лактамаз
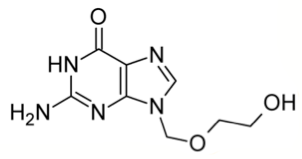
Рисунок 7. Структура ацикловира.
Ацикловир — один из самых эффективных препаратов с противовирусной активностью (рис. 7). Он был открыт в 1974 году крупной ныне фармацевтической компанией — GlaxoSmithKline (тогда она называлась Burroughs Wellcome) — в ходе широкомасштабного поиска противовирусного средства, начавшегося еще в 1960-е годы. А в 1988 году за изучение механизмов действия ацикловира и других препаратов вручили Нобелевскую премию [16].
В клинической практике ацикловир применяют для лечения вируса герпеса. Важно, что здоровые клетки человека не подвергаются действию препарата. Ведь ацикловир попадает в клетку благодаря одному из ферментов вируса — тимидинкиназе! Способность ацикловира связываться с этим ферментом в 200 раз выше, чем с любым ферментом нашего организма. Оказавшись в зараженных клетках, ацикловир преобразуется в ацикловир трифосфат, который связывается с вирусной ДНК и в таком виде необратимо ингибирует вирусные ДНК-полимеразы, необходимые для размножения вируса [17].
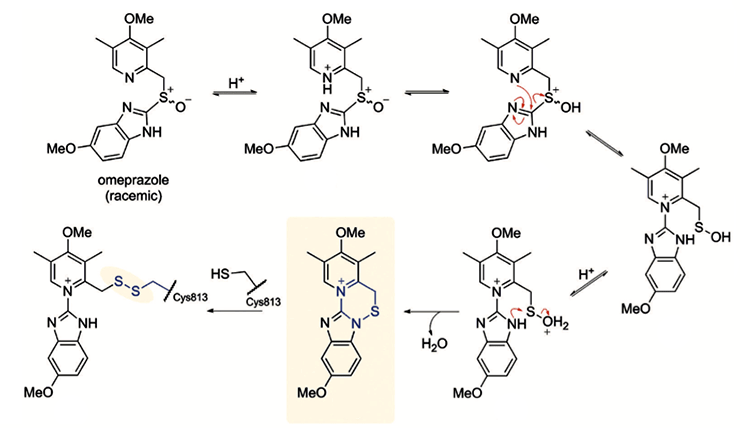
Другим широко известным примером необратимых ингибиторов является омепразол, одобренный к применению в 1980-х. Его применяют при заболеваниях пищеварительной системы, сопровождающихся усиленным выделением желудочной кислоты, таких как изжога или язва желудка. В нейтральной среде омепразол не оказывает действия на наш организм, но при ее закислении желудочным соком необратимо связывается с протонной помпой, ответственной за образование кислоты в желудке. Это происходит потому, что благодаря кислой среде омепразол претерпевает ряд внутримолекулярных перестроек и становится способным принять на себя нуклеофильную атаку каталитического цистеина протонной помпы, тем самым образуя прочную ковалентную связь и выключая этот белок (рис. 8) [6], [18], [19].
Рисунок 8. Механизм действия омепразола.
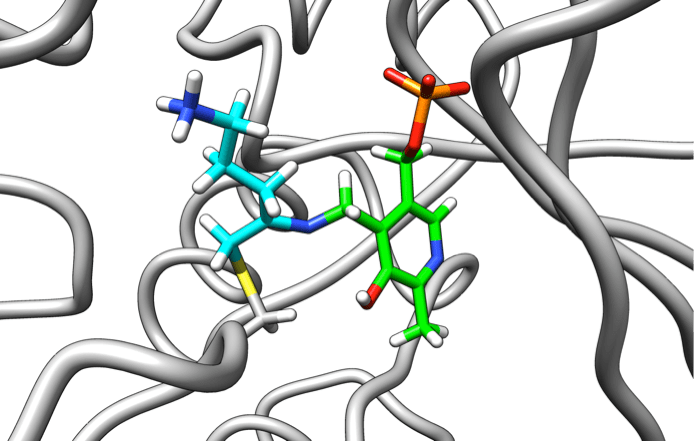
Африканская сонная болезнь, или африканский трипаносомоз, вызывается простейшими рода трипаносома. До конца XX века эта болезнь была практически неизлечима. Вакцины оказались неэффективны против трипаносом из-за того, что последние имеют механизмы обхода иммунной системы человека. Поэтому, основываясь на знаниях о жизненно необходимых ферментах этих простейших, ученые прибегли к разработке механизм-опосредованно связывающихся ингибиторов. Ахиллесовой пятой в метаболизме трипаносом оказался путь биосинтеза полиаминов, вовлеченных в процессы упаковки ДНК и в больших количествах необходимых при делении клеток. Первый этап их синтеза обеспечивает фермент орнитиндекарбоксилаза при участии вспомогательной молекулы — витамина В6. В клетках млекопитающих фермент синтезируется быстро, а у трипаносом этот процесс занимает гораздо больше времени. Именно поэтому необратимые ингибиторы орнитиндекарбоксилазы мало влияют на человеческие клетки, но крайне губительно действуют на паразита [1]. На базе этого механизма был разработан дифторметилорнитин (ДФМО). ДФМО достаточно инертен в растворе, но в результате реакции с витамином В6 приобретает способность связываться с орнитиндекарбоксилазой, которая быстро инактивируется (рис. 9). Эта реакция необратима. Таким образом ДФМО использует собственные реакции фермента для его уничтожения. Препарат показал высокую эффективность против африканской сонной болезни в клинических исследованиях и используется в настоящее время для ее лечения [1].
Рисунок 9. Комплекс производного ДФМО (голубой) с витамином В6 (зеленый) и ферментом орнитиндекарбоксилазой (серый).
А недавно ученые обнаружили, что ДФМО также может использоваться в качестве препарата против рака! Механизм действия ДФМО по отношению к раковым клеткам хорошо изучен. Так же, как и в случае лечения трипаносомоза, этот агент ингибирует действие орнитиндекарбоксилазы. Ведь, что интересно, в опухолевых клетках количество этого белка значительно выше, так как они интенсивно делятся! При инактивации орнитиндекарбоксилазы в раковых клетках падает уровень полиаминов, что нарушает правильную упаковку ДНК, в результате чего клетки перестают делиться. Этот эффект препарата называется цитостатическим. Однако если препарат применять долго, то происходит не замедление деления, а гибель раковых клеток! ДФМО сам по себе не обеспечивает достаточный противораковый эффект, но в комбинации с другими химиотерапевтическими препаратами этот компонент показал увеличение выживаемости пациентов и ускорение темпов выздоровления. Поэтому ДФМО имеет потенциал применения в качестве лекарства, предотвращающего возникновение онкологии, либо снижающего вероятность рецидива рака после удаления опухолевых клеток [20].
Есть ли будущее у необратимых ковалентных ингибиторов?
Долгие годы необратимые ингибиторы были окружены аурой скептицизма, возникшей из-за токсичности некоторых представителей этой группы, обнаруженной в 1970-е годы. Но эффективность и избирательность многих препаратов этой серии доказали, что страхи в их отношении не были оправданными. Конечно, они обладают потенциальной опасностью из-за возможности неспецифических взаимодействий и аллергических реакций, но клиническая практика показывает их незаменимость в лечении целого ряда заболеваний. Сейчас число препаратов этой группы неуклонно растет [6].
Сложность в том, что исследователь должен преследовать сразу несколько целей: повысить избирательность лекарства к ферменту-мишени и тщательно продумать механизм его действия. Но такие свойства необратимых ковалентных ингибиторов, как высокие избирательность и эффективность, высокая продолжительность действия, сниженный риск развития устойчивости к препарату, делают эту группу лекарств незаменимым инструментом в арсенале врачей и разработчиков лекарств [6].
Новый ингибитор репликации коронавируса связывает трехмерные структуры его РНК
Ученые из США и Великобритании показали, что производные диметиламилорида могут ингибировать репликацию SARS-CoV-2 in vitro. Малые молекулы связывают консервативные шпилечные структуры на 5’-конце вирусной РНК. Это первые кандидатные препараты для терапии СOVID-19, которые взаимодействуют с коронавирусной РНК.
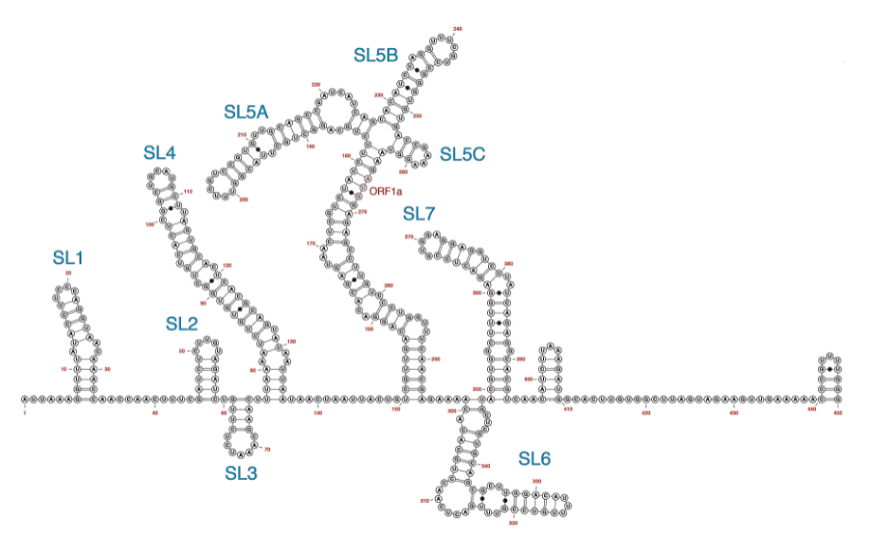
Шпилечные структуры на 5’-конце коронавирусной РНК
Большая часть исследований ориентирована на поиск ингибиторов вирусных белков, таких как РНК-зависимая РНК-полимераза. В этих случаях ингибиторы имеют дело с кодирующими последовательностями неструктурных белков, обеспечивающих размножение вируса. Эти белки более консервативны, чем структурные белки, но тоже достаточно быстро накапливают мутации. Согласно данным из геномных баз, в нетранслируемых участках генома коронавирусов мутации появляются реже. Поэтому эти области могут представлять интерес в качестве мишеней для лекарственной терапии.
Ранее в 5’- и 3’-нетранслируемых областях (UTR) различных коронавирусов были идентифицированы консервативные элементы — шпилечные структуры, регулирующие вирусную репликацию. Малые молекулы, связывающие подобные структуры, были эффективны при терапии некоторых (+)-РНК-вирусов, например, вируса гепатита С. Были идентифицированы производные диметиламилорида (DMA), которые таргетируют сайт внутренней инициации трансляции (IRES) энтеровируса 71 и ингибируют его трансляцию и репликацию.
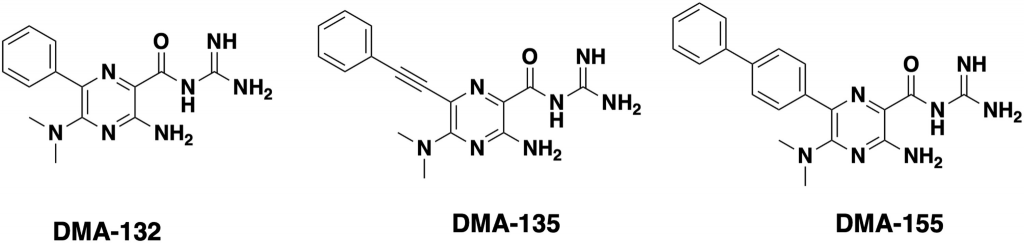
В новой работе авторы исследовали возможность соединений DMA связываться со шпилечными структурами в составе 5’-UTR геномов бетакоронавирусов (к которым относятся SARS-CoV, SARS-CoV-2, MERS и простудный вирус ОС43) и ингибировать их размножение. Антивирусную активность 23 кандидатов анализировали на клеточной культуре Vero E6 и простудном человеческом коронавирусе OC43. Дозозависимое снижение вирусных титров было показано после обработки клеток тремя препаратами –– DMA-132, DMA-135 и DMA-155. Эти три соединения также значительно снижали вирусные титры в клетках, зараженных SARS-CoV-2.
Для исследования механизма действия препаратов авторы сконструировали плазмиду, содержащую 805 нуклеотидов с 5’-конца генома SARS-CoV-2 (5’-UTR и часть кодирующей последовательности), 3’-UTR и репортерный ген (люциферазу). РНК с такой плазмиды трансфицировали клетки, которые затем обрабатывали различными концентрациями соединений DMA. Обработка препаратами DMA-132 и DMA-135 снижала уровень экспрессии гена-репортера слабее, чем обработка DMA-155. Удаление из конструкции плазмиды участка 3’UTR не влияло на результаты, из чего следует, что действие DMA-препаратов нацелено на 5’-участок.
Ученые планируют произвести дальнейшие модификации выявленных кандидатных препаратов на основе полученных данных, и затем начать испытания на животных.