ингибирующее действие на днк человека что это значит
Отряд самоубийц в медицине
Отряд самоубийц в медицине
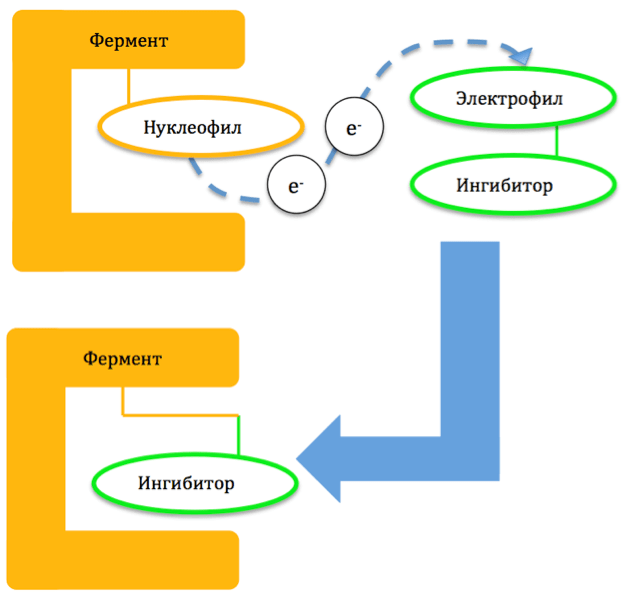
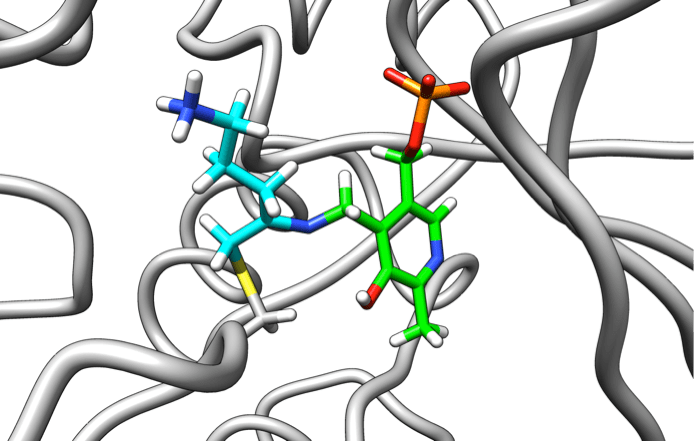
Необратимый ингибитор (оранжевый), подобно диверсанту, подрывает работу фермента (синий). Это потенциальное лекарство против трипаносомы крузи — главной причины болезни сердца в Латинской Америке.
Авторы
Редакторы
Статья на конкурс «био/мол/текст»: Многие лекарства конкурируют с природными молекулами за связывание со своей мишенью. Большинство таких препаратов связывается с белками за счет слабых взаимодействий, но некоторые способны образовывать прочные связи, «выключая» свою мишень до конца ее «жизни», пусть и ценой собственной. Такие лекарства относятся к классу необратимых ковалентных ингибиторов, получивших образное название суицидных ингибиторов (англ. suicide inhibitors). О них и пойдет речь в нашей статье. Как работают и насколько опасны одни из самых эффективных лекарств? Чья болезнь помогла открыть аспирин? Что общего между никотином и грейпфрутовым соком? Ответы на эти и многие другие вопросы вы найдете далее.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2017.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».
Из чего же, из чего же сделаны эти лекарства?
Сегодня сложно представить себе человека, который ни разу в жизни не принял ни одной таблетки. Каждый год прилавки аптек пополняются все новыми и новыми лекарствами. Независимо от цвета упаковки препарата и его лекарственной формы (будь то таблетка, мазь, капсула, раствор для инъекций и т.д.) внутри всегда содержится главный компонент лекарства — действующее вещество. Именно оно и обеспечивает терапевтический эффект.
Большинство действующих веществ является ингибиторами, то есть они блокируют функцию того или иного белка (чаще фермента, но иногда и рецептора) в нашем или чужеродном организме. Многие из них связываются со своей мишенью обратимо, то есть после встраивания в мишень молекула может выйти обратно, так что их возможности сильно ограничены. Но необратимые ковалентные ингибиторы «намертво» связываются со своей мишенью. В результате фермент больше не способен функционировать до тех пор, пока клетка не синтезирует его новые копии.
Низкомолекулярные «взломщики»
«В чем же секрет столь сильного связывания этих ваших необратимых ингибиторов?» — спросите вы. В ковалентной связи. Существует несколько механизмов связывания лекарств с их молекулярными мишенями. Обычно связывание происходит при помощи слабых взаимодействий [4]. Ковалентная же связь является сильнейшим из возможных взаимодействий и превосходит любые другие в десятки, а то и сотни раз (табл.1) [5]!
| Тип связи | Энергия, ккал/моль |
|---|---|
| Ковалентная | 50–150 |
| Электростатическая | 5–10 |
| Водородная | 2–5 |
| Гидрофобная | 0,5–1 |
Механизм образования ковалентной связи строится на том, что пара электронов одного из атомов молекулярной мишени (нуклеофила) распределяется между ним и одним из атомов ингибитора (электрофилом) (рис. 1). Из-за высокой прочности связи ингибитор оказывается необратимо присоединен к ферменту и приводит к разрушению последнего. Восстановление функции фермента наступает только после синтеза его новых копий [5].
Рисунок 1. Общий механизм действия необратимых ингибиторов.
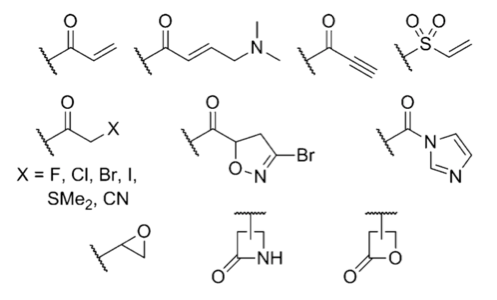
Как же выглядят эти электрофильные группы, которые используются для создания ковалентных необратимых ингибиторов? Найти ответ вы сможете, посмотрев на рисунок 2. Наличие одного из этих фрагментов в структуре лекарства может говорить о том, что оно действует по уже известному вам механизму [6].
Рисунок 2. Примеры электрофильных групп, встречающихся в необратимых ингибиторах.
Несмотря на то, что связывание необратимых ингибиторов приводит к гибели фермента, не следует думать, что одна доза такого лекарства может полностью уничтожить фермент в организме. Наличие и работа генов позволит создать его новые копии, пусть на это и понадобится от нескольких часов до пары дней [2].
Как и все в мире, ковалентные необратимые ингибиторы имеют свои преимущества и недостатки, которые мы представили в формате таблицы 2 [6].
| Преимущества | Недостатки |
|---|---|
| Высокие эффективность и избирательность позволяют использовать меньшие дозы и уменьшить риск побочных эффектов | Высокая активность некоторых представителей может приводить к некрозу печени, мутациям и даже раку! |
| Связывание с важными остатками фермента предотвращает развитие устойчивости микробов, что важно при лечении инфекций | Потенциальная иммуногенность, так как полученный продукт реакции может вызывать аллергический ответ |
| Длительное действие, так как активность фермента вновь появляется только при синтезе его новых копий |
Тернистые пути разработки эффективных лекарств
Если вы думаете, что разработка необратимых ковалентных ингибиторов — легкое дело, то вы глубоко заблуждаетесь. Даже если закрыть глаза на то, что разработка любого лекарства является крайне трудоемким и времязатратным процессом [7], задача не сильно упростится — ведь необратимые ингибиторы требуют особого подхода к своей персоне. Сегодня не так много одобренных препаратов действуют именно таким образом. А механизм действия многих из них открыли только спустя годы после разработки! Ученые на этом пути сталкиваются с большим количеством порой неразрешимых проблем.
Одна из них — участие одного фермента сразу в нескольких метаболических каскадах. Обсуждаемые лекарства необратимо связываются с ферментом-мишенью, уничтожая его на то время, которое требуется на синтез новых копий фермента. Этот процесс может занимать до нескольких суток! В том случае, если фермент-мишень выполнял несколько функций, это чревато серьезными побочными эффектами. Чтобы обойти проблему, необратимо связывающиеся ингибиторы чаще всего применяют для блокирования одного из ферментов потенциально опасных для человека вирусов, бактерий и т. д. [3].
Вторая проблема заключается в том, что при низкой избирательности необратимые ингибиторы могут связываться с нежелательными мишенями, похожими на выбранную нами для ингибирования. Это тоже может приводить к серьезным побочным эффектам. Поэтому важная задача при оптимизации структуры ингибиторов — повышение избирательности к своей мишени [3].
Опасения в отношении побочных эффектов необратимых ингибиторов не лишены оснований. Бум гонений на эту группу препаратов вызвали исследования 1970-х годов. Тогда выяснили, что два из наиболее широко известных представителей этой группы — парацетамол и фуросемид — обладают высокой токсичностью в связи с тем, что, метаболизируясь в печени, они образовывают активные производные, формирующие ковалентные связи с ее белками [2], [8]. Как выяснилось позже, эти единичные случаи не имеют отношения ко многим препаратам из группы необратимых ингибиторов, а парацетамол и фуросемид до сих пор активно используются в клинической практике.
Другим распространенным примером нежелательного необратимого ингибирования является цитохром P450. Цитохромы — группа ферментов в нашем организме, главной задачей которых является обезвреживание потенциально опасных веществ. Первыми необратимыми ингибиторами цитохрома стали алкены и алкины. В результате ингибирования этого фермента процессы детоксикации становятся невозможными. Неполный список препаратов, способных вступать в подобную реакцию, включает 17α-алкенил-стероиды, левомицетин, циклофосфамид, спиронолактон, фурокумарины, никотин, изониазид и барбитураты. Звучит опасно, не правда ли? Не многим опаснее, чем пить грейпфрутовый сок! Его компоненты способны необратимо связываться с цитохромом кишечника и лишать этот фермент активности на 24 часа! К чему это может привести? К тому, что принимаемые в это время лекарства будут более эффективно поступать в наш организм, а рост их концентрации повышает риск развития нежелательных эффектов [5]. Именно поэтому врачи рекомендуют запивать таблетки только водой.
Но всегда ли можно считать необратимые ингибиторы безопасными лекарствами? Конечно же, нет. Поиск необратимых ингибиторов, и правда, не всегда оборачивается успехом для исследователей. В частности, полным провалом завершились исследования мышьяк-содержащих органических соединений для лечения трипаносомоза [9]. Эти соединения необратимо ингибировали жизненно необходимые ферменты трипаносомы за счет образования связей между атомом мышьяка в составе исследуемых веществ и серосодержащими остатками фермента. Но они оказались токсичными не только для трипаносомы, но и для организма человека [5].
К счастью, несмотря на все перипетии судьбы, ученые вновь сфокусировали свои пристальные взгляды на необратимых ковалентных ингибиторах. Лучшее понимание реально существующих рисков и знание механизма химических преобразований открыли множество возможностей для разработки более эффективных лекарств и привели к резкому росту встречаемости необратимых ингибиторов в различных исследованиях [10].
«Ветераны» борьбы за здоровье человечества
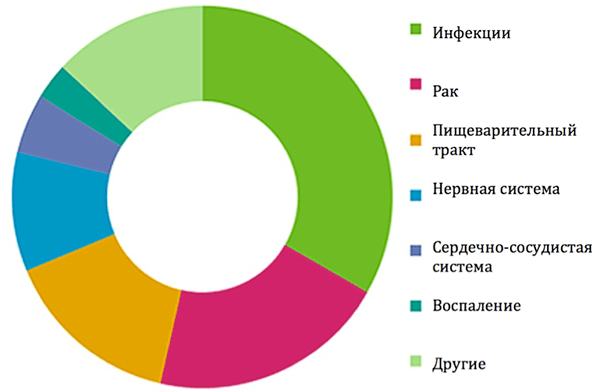
Многие из широко применяемых успешных препаратов — необратимые ковалентные ингибиторы [6]. Например, в 2009 году три необратимо связывающихся ингибитора попали в топ-10 наиболее продаваемых лекарств [2]. В 2011 году из 39 ковалентных лекарств, одобренных в США, 33% являлись противоинфекционными, 20% нашли применение в лечении рака, 15% применялись при болезнях пищеварительного тракта, 10% — при нарушении работы центральной нервной системы, 5% использовались при лечении сердечно-сосудистых заболеваний и один препарат обладал противовоспалительными свойствами (рис. 3) [6], [11].
Рисунок 3. Области применения одобренных в США необратимо связывающихся ингибиторов (данные за 2011 год).
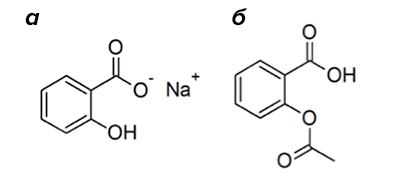
Рисунок 4. Структура салицилата натрия (а) и аспирина (б).
Давайте же поговорим о нескольких наиболее успешных примерах необратимых ковалентных ингибиторов.
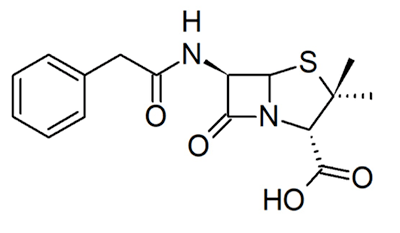
Натрия салицилат впервые применили в качестве противовоспалительного лекарства в 1875 году (рис. 4а). Препарат обладал ужасным вкусом и вызывал язвы ротовой полости и желудка. В конце XIX века отец одного из химиков компании Bayer Company, страдающий от тяжелого ревматоидного артрита, упросил своего сына, Феликса Хоффмана, заняться поиском менее опасного аналога салицилата натрия. Феликс синтезировал различные производные и обнаружил, что ацетилсалициловая кислота обладает лучшими свойствами. Так был обнаружен аспирин (рис. 4б). В 1899 году Bayer выпустила аспирин как противовоспалительное, обезболивающее и жаропонижающее средство [2]. Как и в случае многих других препаратов, механизм его действия открыли только спустя 70 лет после коммерциализации препарата [6], за что в 1982 году была вручена Нобелевская премия [2], [12]. Аспирин оказался необратимым ингибитором ферментов, участвующих в реакции воспаления — циклооксигеназ [6].
Рисунок 5. Структура пенициллина.
Другие примеры необратимых ковалентных ингибиторов — пенициллины [6]. Их родоначальника, пенициллин (рис. 5), открыл в 1928 году Александр Флеминг [13]. Ученым понадобилось еще 15 лет, чтобы достаточно изучить и начать использовать этот препарат в качестве антибактериального лекарственного средства, что спасло миллионы жизней во время Второй мировой войны [12]. Пенициллин нарушает синтез клеточной стенки бактерий. Он связывается с транспептидазой — ферментом, обеспечивающим первый этап сшивки пептидогликана, который является основным компонентом бактериальной клеточной стенки. Когда пенициллин связывается с транспептидазой, синтез бактериальной клеточной стенки блокируется, и многие бактерии погибают от разрыва клеточной мембраны под воздействием осмотического давления [1].
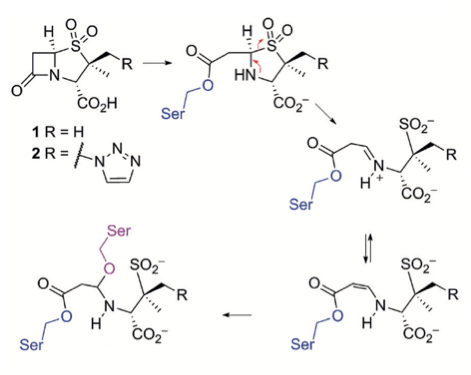
Однако все оказалось не так радужно — у бактерий обнаружились механизмы устойчивости [14]. В частности, резистентность к пенициллинам обеспечивается за счет наличия β-лактамаз — ферментов, расщепляющих пенициллины. Ученые не остановились на достигнутом и разработали ингибиторы этого фермента — сульбактам, тазобактам и клавулановую кислоту. Подобно пенициллинам, в результате нуклеофильной атаки эти соединения претерпевают открытие β-лактамного кольца. Отличие в том, что ингибиторы β-лактамаз подвергаются раскрытию и второго цикла, содержащегося в их структуре. При этом появляется возможность образования дополнительных связей, в том числе и ковалентных (рис. 6) [6], [15].
Рисунок 6. Механизм действия ингибиторов β-лактамаз
Рисунок 7. Структура ацикловира.
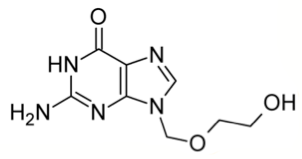
Ацикловир — один из самых эффективных препаратов с противовирусной активностью (рис. 7). Он был открыт в 1974 году крупной ныне фармацевтической компанией — GlaxoSmithKline (тогда она называлась Burroughs Wellcome) — в ходе широкомасштабного поиска противовирусного средства, начавшегося еще в 1960-е годы. А в 1988 году за изучение механизмов действия ацикловира и других препаратов вручили Нобелевскую премию [16].
В клинической практике ацикловир применяют для лечения вируса герпеса. Важно, что здоровые клетки человека не подвергаются действию препарата. Ведь ацикловир попадает в клетку благодаря одному из ферментов вируса — тимидинкиназе! Способность ацикловира связываться с этим ферментом в 200 раз выше, чем с любым ферментом нашего организма. Оказавшись в зараженных клетках, ацикловир преобразуется в ацикловир трифосфат, который связывается с вирусной ДНК и в таком виде необратимо ингибирует вирусные ДНК-полимеразы, необходимые для размножения вируса [17].
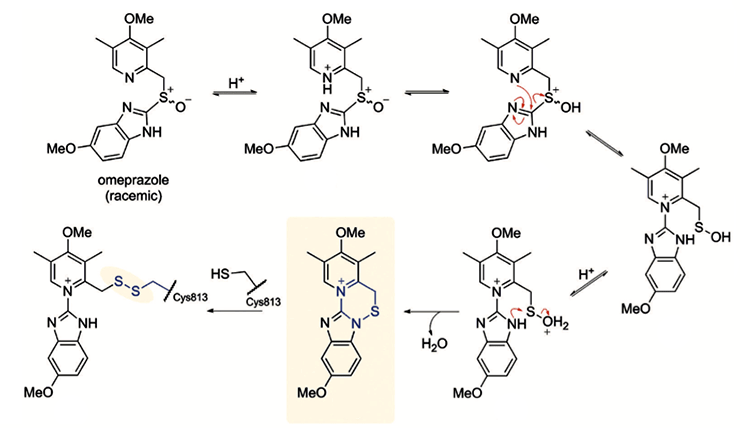
Другим широко известным примером необратимых ингибиторов является омепразол, одобренный к применению в 1980-х. Его применяют при заболеваниях пищеварительной системы, сопровождающихся усиленным выделением желудочной кислоты, таких как изжога или язва желудка. В нейтральной среде омепразол не оказывает действия на наш организм, но при ее закислении желудочным соком необратимо связывается с протонной помпой, ответственной за образование кислоты в желудке. Это происходит потому, что благодаря кислой среде омепразол претерпевает ряд внутримолекулярных перестроек и становится способным принять на себя нуклеофильную атаку каталитического цистеина протонной помпы, тем самым образуя прочную ковалентную связь и выключая этот белок (рис. 8) [6], [18], [19].
Рисунок 8. Механизм действия омепразола.
Африканская сонная болезнь, или африканский трипаносомоз, вызывается простейшими рода трипаносома. До конца XX века эта болезнь была практически неизлечима. Вакцины оказались неэффективны против трипаносом из-за того, что последние имеют механизмы обхода иммунной системы человека. Поэтому, основываясь на знаниях о жизненно необходимых ферментах этих простейших, ученые прибегли к разработке механизм-опосредованно связывающихся ингибиторов. Ахиллесовой пятой в метаболизме трипаносом оказался путь биосинтеза полиаминов, вовлеченных в процессы упаковки ДНК и в больших количествах необходимых при делении клеток. Первый этап их синтеза обеспечивает фермент орнитиндекарбоксилаза при участии вспомогательной молекулы — витамина В6. В клетках млекопитающих фермент синтезируется быстро, а у трипаносом этот процесс занимает гораздо больше времени. Именно поэтому необратимые ингибиторы орнитиндекарбоксилазы мало влияют на человеческие клетки, но крайне губительно действуют на паразита [1]. На базе этого механизма был разработан дифторметилорнитин (ДФМО). ДФМО достаточно инертен в растворе, но в результате реакции с витамином В6 приобретает способность связываться с орнитиндекарбоксилазой, которая быстро инактивируется (рис. 9). Эта реакция необратима. Таким образом ДФМО использует собственные реакции фермента для его уничтожения. Препарат показал высокую эффективность против африканской сонной болезни в клинических исследованиях и используется в настоящее время для ее лечения [1].
Рисунок 9. Комплекс производного ДФМО (голубой) с витамином В6 (зеленый) и ферментом орнитиндекарбоксилазой (серый).
А недавно ученые обнаружили, что ДФМО также может использоваться в качестве препарата против рака! Механизм действия ДФМО по отношению к раковым клеткам хорошо изучен. Так же, как и в случае лечения трипаносомоза, этот агент ингибирует действие орнитиндекарбоксилазы. Ведь, что интересно, в опухолевых клетках количество этого белка значительно выше, так как они интенсивно делятся! При инактивации орнитиндекарбоксилазы в раковых клетках падает уровень полиаминов, что нарушает правильную упаковку ДНК, в результате чего клетки перестают делиться. Этот эффект препарата называется цитостатическим. Однако если препарат применять долго, то происходит не замедление деления, а гибель раковых клеток! ДФМО сам по себе не обеспечивает достаточный противораковый эффект, но в комбинации с другими химиотерапевтическими препаратами этот компонент показал увеличение выживаемости пациентов и ускорение темпов выздоровления. Поэтому ДФМО имеет потенциал применения в качестве лекарства, предотвращающего возникновение онкологии, либо снижающего вероятность рецидива рака после удаления опухолевых клеток [20].
Есть ли будущее у необратимых ковалентных ингибиторов?
Долгие годы необратимые ингибиторы были окружены аурой скептицизма, возникшей из-за токсичности некоторых представителей этой группы, обнаруженной в 1970-е годы. Но эффективность и избирательность многих препаратов этой серии доказали, что страхи в их отношении не были оправданными. Конечно, они обладают потенциальной опасностью из-за возможности неспецифических взаимодействий и аллергических реакций, но клиническая практика показывает их незаменимость в лечении целого ряда заболеваний. Сейчас число препаратов этой группы неуклонно растет [6].
Сложность в том, что исследователь должен преследовать сразу несколько целей: повысить избирательность лекарства к ферменту-мишени и тщательно продумать механизм его действия. Но такие свойства необратимых ковалентных ингибиторов, как высокие избирательность и эффективность, высокая продолжительность действия, сниженный риск развития устойчивости к препарату, делают эту группу лекарств незаменимым инструментом в арсенале врачей и разработчиков лекарств [6].
Что такое ДНК-вакцины и с чем их едят?
Автор
Редактор
ДНК-вакцины относятся к типу принципиально новых биологических препаратов. С их разработкой связывают большие надежды на повышение эффективности профилактики не только заболеваний бактериальной, вирусной и паразитарной природы, но и аллергических, аутоиммунных и даже онкологических болезней. Более двадцати лет назад возникла идея использовать гены возбудителей заболеваний для активации защитных механизмов. Конструкция ДНК-вакцин гениально проста: главные компоненты в ней — вектор и целевой иммуноген. Но, несмотря на это, ДНК-вакцины не стоят на страже нашего здоровья: их не вводят пациентам в поликлиниках, они не продаются в аптеках.
Более сотни лет прошло с введения Л. Пастером термина «вакцина» (лат. vacca — корова) и более двух сотен — с легендарных экспериментов Э. Дженнера по прививанию коровьей оспы ребенку с целью предупреждения развития опасного человеческого варианта болезни. Принцип защитного действия введенных в организм ослабленных инфекционных агентов или их частей научным языком объяснили уже в XX веке: безопасный чужеродный антиген учит иммунную систему в дальнейшем быстро распознавать и уничтожать активного и опасного возбудителя с точно такими же антигенами*. Процесс часто сравнивают с раздачей фоторобота преступника сотрудникам полиции.
* — Хронологию разработки вакцин, информацию о влиянии вакцинации на характер эпидемий и численность человечества, доводы адептов движения антивакцинации и ответы на множество животрепещущих вопросов относительно целесообразности, пользы и вреда прививок можно найти в статье «Вакцины в вопросах и ответах» [1]. — Ред.
За 200 лет форма и содержание прививок претерпели существенные изменения: Дженнер инфицировал царапины содержимым оспинных пустул, Пастер облагородил процедуру, вводя ослабленных агентов шприцем, затем научились создавать вакцины из убитых и даже растерзанных возбудителей (сплит- и субъединичные вакцины), недавно начали использовать рекомбинантные вакцины, содержащие один или несколько антигенов (обычно белковых), синтезированных генно-инженерным путем. И вот в двери ВОЗ робко стучится новый плод, порожденный слиянием науки с фарминдустрией, — вакцина из нуклеиновых кислот [2].
Начало ДНК-вакцинологии связывают с работами Д. Танга (1992 г.), в которых была показана способность плазмидной ДНК, экспрессирующей гормон роста человека, индуцировать выработку антител.
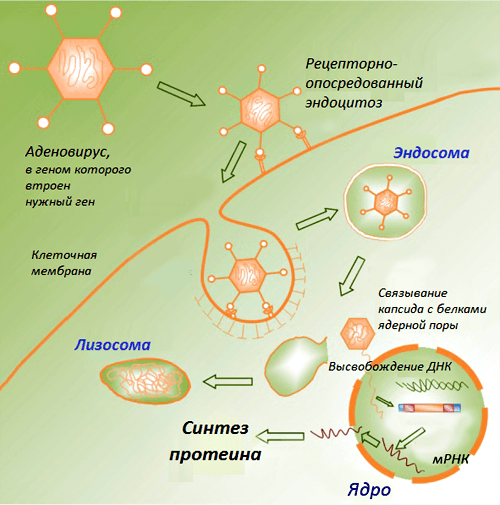
В классическом варианте такие вакцины состоят из плазмидных ДНК, содержащих гены возбудителей инфекционных заболеваний (целевые гены, или иммуногены). Продукты данных генов способны вызывать развитие защитных реакций организма, выступая в этом случае в роли антигенов. Доставку ДНК в макроорганизм первоначально осуществляли в комплексе с катионными липидами, однако эффект от введения препарата чистой нуклеиновой кислоты оказался более выраженным. Введенная в организм ДНК проникает в клеточное ядро, превращая клетку в завод по производству вакцины. Такая ДНК длительное время существует вне хромосом без репликации, транскрибируется за счет ферментов хозяйской клетки и экспрессирует соответствующие гены, продукты которых вызывают формирование иммунитета (рис. 1).
Рисунок 1. Схематическое изображение процессов в клетке после проникновения ДНК-вакцины. Рисунок из «Википедии».
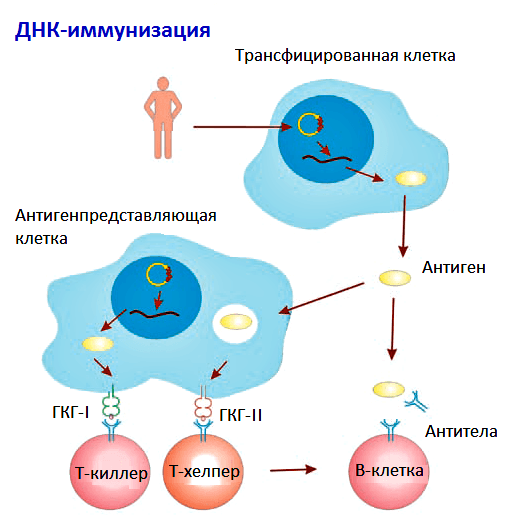
ДНК-вакцины сохраняются в организме 3–4 недели. За это время они успевают индуцировать Т- и В-клеточный иммунитет (рис. 2). Однако, несмотря на кажущуюся простоту, многие механизмы развития иммунного ответа на ДНК-вакцины остаются малоизученными [3].
Рисунок 2. Схема развития иммунного ответа на ДНК-вакцину. Рисунок из «Википедии».
Более чем 20-летняя эволюция ДНК-вакцин продолжается и сегодня. Прогресс в дизайне кодирующих антигены нуклеотидных последовательностей, в оптимизации состава (в том числе включение молекулярных адъювантов), в совершенствовании форм и физических методов доставки позволил второму поколению ДНК-вакцин преодолеть такие проблемы первого поколения, как низкий уровень трансфекции и недостаточная иммуногенность.
Сейчас разработки в области генетических вакцин проводятся во многих странах мира. В настоящее время сконструированы экспериментальные ДНК-вакцины для профилактики инфекционных заболеваний паразитарной (шистосомоз, лейшманиоз), бактериальной (хламидиоз, сибирская язва, микоплазмозы) и вирусной (бешенство, лихорадки Западного Нила и Эбола) природы. На разных стадиях доклинических и клинических испытаний находятся генетические вакцины против вирусов гриппа, гепатитов А и В, герпеса, кори, геморрагических лихорадок, ВИЧ, собачьей чумы, ящура, папилломавирусов, цитомегаловирусов. Столь интенсивное развитие данного направления вакцинологии, вероятно, уже в ближайшей перспективе обеспечит реальный выход в виде эффективных и безопасных вакцинных препаратов, рекомендованных для применения в здравоохранении и ветеринарии.
Чем же ДНК-вакцины хороши?
Но. всё хорошее имеет свои недостатки
Конструкция ДНК-вакцин
Для получения ДНК-вакцин ген, кодирующий продукцию иммуногенного белка, необходимо встроить в вектор, роль которого выполняют бактериальная плазмида или вирус [4]. Вектор не должен реплицироваться в клетках макроорганизма, поэтому может содержать только прокариотические сайты инициации репликации.
Для создания ДНК-вакцин используются хорошо изученные плазмиды грамотрицательных бактерий (в основном E. coli), в частности многокопийная pUC19 или pBR322 и их производные. Разработаны специальные векторы для ДНК-вакцин — pcDNA3 и pcDNA3.1 (Invitrogen), которые содержат цитомегаловирусный (ЦМВ) промотор и сигнал полиаденилирования гена гормона роста быка. Также к коммерчески доступным плазмидам, которые чаще всего используются в качестве векторов для ДНК-вакцин, относятся: pVAX1 (Invitrogen), pCI, VR1012 DNA, pJW4303, pVAC1-mcs и pVAC2-mcs (InvivoGen). Последние две применяются для усиления гуморального иммунного ответа и содержат антигены к поверхностным структурам мышечных клеток [5].
Из числа вирусных векторов, обеспечивающих более высокий уровень экспрессии целевого антигена, чаще всего используются: дефектный по репликации аденовирус серотипа 5 (AD5), ортопоксвирусы и модифицированные вирусы осповакцины, альфавирусы. Аденовирусный вектор обладает высокой эффективностью трансфекции — до 100 %, в него можно включать до 8 т.п.н. ДНК. Отрицательный момент — синтез собственных белков, способных индуцировать иммунный ответ. Самые используемые осповакцинные модификации — Ankara (MVA) и New York Vaccinia strain (NYVAC). Первая получена в результате 56-кратного пассирования вируса в куриных эмбриональных фибробластах. В геноме NYVAC удалено 18 открытых рамок считывания, ассоциированных с диапазоном хозяев и вирулентностью. В каждый из перечисленных векторов можно встроить до 50 т.п.н. ДНК [6].
Элементы конструктора
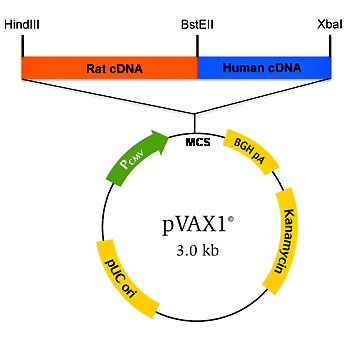
Рисунок 3. Конструкция ДНК-вакцины на основе вектора pVAX1 с химерным геном (Rat cDNA, Human cDNA). Pcmv — цитомегаловирусный промотор; MCS — сайт для множественного клонирования генов; BGH pA — терминатор с сигналом полиаденилирования гена гормона роста быка; Kanamycin — ген устойчивости к канамицину; pUC ori — участок начала репликации плазмид группы pUC; HindIII, BstEII, XbaI — сайты рестрикции. Рисунок из [5].
Чтобы пригодиться для создания ДНК-вакцин, каждый уважающий себя вектор должен содержать необходимые конструкционные элементы (рис. 3).
Службы доставки
Способам введения ДНК-вакцин в организм уделяется не меньше внимания, чем созданию самих конструкций, так как от этого зависит успех иммунизации в целом. Поэтому разработаны различные, порой весьма хитроумные, методы доставки таких вакцин в организм.
Самый простой — это парентеральный способ введения, который заключается в инъекции ДНК-вакцин в солевом растворе (внутримышечно, внутрикожно). При этом бόльшая часть ДНК поступает в межклеточное пространство и только потом включается в клетки.
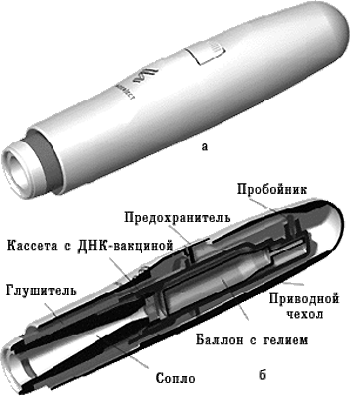
Использование генного пистолета. Для этого ДНК фиксируют на микроскопических золотых гранулах (около 1–2 мкм), а затем с помощью устройства, приводимого в действие сжатым гелием, гранулы «выстреливают» непосредственно внутрь клеток (рис. 4). Для данного способа доставки требуется значительно меньшее количество вводимого материала, чем для внутримышечной инъекции. Так, для инъекции мышам нужно 10-100 мкг препарата, а с использованием генного пистолета достаточно 0,1-1 мкг.
Электропорация — техника, которая с использованием электрических импульсов позволяет формировать поры в клеточной мембране и доставлять ДНК непосредственно в клетки.
Микроконтейнеры из полиматериалов. Московские ученые, например, создали пористую микросферу из карбоната кальция, покрытую несколькими слоями полисахаридов, в которую упаковывается молекула ДНК. Если микросферы в полимерной оболочке поместить в подкисленный раствор, карбонат кальция внутри растворится и уйдет через полимерную мембрану. Внутри останется только ДНК, подлежащая транспортировке. Подобных микроконтейнеров для доставки ДНК разработано не так много. Есть зарубежные аналоги, в которых оболочка капсулы выполнена из полимолочной кислоты. На их основе создают вакцины против гепатита и даже СПИДа. Средний диаметр микрокапсул для доставки ДНК-вакцин всего 1–2 микрона. Такие микрокапсулы можно ввести подкожно или даже в кровь. Если в микрочастицу вместе с ДНК или лекарством поместить фермент, расщепляющий оболочку капсулы изнутри, то высвобождением лекарства можно управлять: чем меньше фермента, тем медленнее рушится оболочка.
Липосомные носители обеспечивают высокую эффективность доставки при внутривенном введении, при этом экспрессия целевых генов значительно возрастает, так как осуществляется во многих органах, и особенно в селезенке.
ДНК-вакцины можно вводить перорально с использованием бактериальных носителей. Для этих целей применяются, например, модифицированные бактерии Shigella flexneri с делецией в гене asd. Мутантные бактерии растут in vitro на среде с диаминопимелиновой кислотой и, проникая в эукариотические клетки, не размножаются в них, так как отсутствует упомянутая кислота, а продуцируют закодированные в плазмиде антигены [6]. Для перорального введения создан вектор на основе ослабленного штамма Salmonella, который способен к самоуничтожению в организме через определенный период времени после выполнения иммунизационных задач. Для этого бактерию модифицировали таким образом, что ее выживание стало зависеть от наличия искусственных сахаров, не встречающихся в условиях организма. После того как в клетках, зараженных генно-инженерным штаммом Salmonella, заканчивается запас специфического сахара, поставляемого вместе с вакциной, бактерии не способны сохранить целостность своих клеточных стенок, что приводит к их гибели [11].
Была предложена оригинальная система доставки ДНК с помощью «теней» — неживых клеток грамотрицательных бактерий, лишенных цитоплазматического содержимого, но сохраняющих морфологию и антигенные структуры, включая адгезивные факторы. «Тени» обладают тропностью к антигенпрезентирующим клеткам макроорганизма и адъювантными свойствами, усиливающими иммунный ответ. Кроме того, в лиофильно-высушенном состоянии препараты «теней» хранятся при комнатной температуре неопределенно долгое время, а их производство дешево [6].
Разработана технология доставки ДНК-вакцин с использованием бактериофагов [12]. В данном случае вакцинная ДНК встраивается в геном вектора-бактериофага, которым затем иммунизируют макроорганизм [13].
Нужно учитывать, что разные методы доставки ДНК-вакцин в организм обеспечивают развитие различных клеточных реакций, при этом важные иммунологические пути могут быть стимулированы или, наоборот, не задействованы в ходе развития защитного ответа. Способы и места введения ДНК-вакцин варьируют для разных видов организмов. Например, уши свиньи — отличное место для инъекций, а вот введение препарата в уши овец или коров неэффективно.
Помощники генетических вакцин
Для усиления иммунного ответа, вызванного ДНК-вакцинами, совместно с ними вводят различные адъюванты, например, плазмиды, кодирующие синтез цитокинов, гранулоцитарно-макрофагального колониестимулирующего фактора и других костимуляторных молекул (B7.1 (CD80), B7.2 (CD86) и CD40) [14].
Для ДНК-вакцины против ВИЧ создана конструкция, которая обеспечивает получение более высокого титра антител и его сохранность в течение более длительного времени по сравнению с обычной ДНК-вакциной. Эта молекулярная вирусоподобная конструкция представляет собой частицы диаметром 25-30 нм, содержащие в центре полинуклеотидный комплекс — рекомбинантную плазмиду pGEX-2T-TBI с генами инфекционного агента ВИЧ-1 или двухцепочечную РНК, которая является стимулятором неспецифической резистентности организма. На поверхности конструкции располагаются гибридные белки, содержащие эпитопы ВИЧ-1 и фермент (например, глутатион-S-трансферазу или галактозидазу). Связь между полинуклеотидным комплексом и гибридными белками осуществляется посредством конъюгата: спермидин (для связи конъюгата с полинуклеотидным комплексом) — полиглюкин — субстрат для фермента (например, глутатион или галактопиранозид; для аффинной сорбции гибридных белков на конструкцию).
Современное состояние ДНК-вакцинологии
В настоящее время в разработке находится около 420 ДНК-вакцин против заболеваний различной этиологии как человека, так и животных.
Бόльшая часть разрабатываемых противоинфекционных терапевтических ДНК-вакцин нацелена на ВИЧ-1. Существенные успехи достигнуты в активной иммунизации против вируса папилломы человека. Некоторые вакцины находятся на стадии клинических испытаний и, возможно, в скором времени будут введены в обязательную практику. Так, американская компания Inovio, специализирующаяся на разработке ДНК-вакцин, создала препарат против цервикальной дисплазии VGX-3100, который проходит вторую фазу клинических испытаний. В 2013 г. VGX-3100 удостоилась награды «Лучшая терапевтическая вакцина» на Всемирном конгрессе по вакцинам. В I или IIа фазах клинических испытаний находятся: вакцины против гепатита С, цервикального рака, рака головы и шеи, СПИДа, гриппа. Компанией Inovio также ведется активная разработка вакцин против лихорадки Эбола* и рака простаты.
* — О более привычном, но не менее перспективном методе борьбы с вирусом Эбола — с помощью «коктейля» из моноклональных антител — читайте в статье «Вирус Эбола и макак-резус: получено новое эффективное лекарство» [15]. — Ред.
Разработке способов вакцинотерапии онкологических заболеваний при помощи рекомбинантных ДНК большое внимание уделяют и другие организации. Хорошую эффективность показала ДНК-вакцина против лейкемии, созданная в Саутгемптонском университете (но вводимая с помощью электропоратора всё той же Inovio). Вакцина направлена на подавление в организме активности гена WT1 (Wilms tumor gene). Именно повышенная активность этого гена отмечается в опухолевых клетках различных видов. В ходе I фазы клинических испытаний у пациентов наблюдалось развитие иммунного ответа, в том числе активация Т-киллеров и выработка антител; была также доказана безопасность новой вакцины. Испытания перешли в фазу II, однако из-за проблем с финансированием организаторы пока не могут увеличить число участников [16].
Животные нуждаются в такой же защите, как и люди. В связи с этим для ветеринарии разрабатываются ДНК-вакцины против бычьего и лошадиного герпесвирусов, собачьего вируса чумы, вируса классической свиной лихорадки, кроличьей папилломы, ящура, вируса инфекционного гемопоэтического некроза, вируса гриппа, вируса японского энцефалита, вируса бешенства, вируса везикулярного стоматита и т.д. [13]. Много ДНК-вакцин создается для борьбы с вирусными, бактериальными и эукариотическими патогенами рыб [17].
Активно разрабатываются ДНК-вакцины для повышения иммунитета птиц. Многокомпонентные ДНК-вакцины могут сократить количество прививок, необходимых во время короткой жизни птиц и позволят избежать риска увеличения вирулентности некоторых патогенов. В случае птицеводства проблема связана с тем, что вакцины вводятся в амниотическую жидкость яиц, которая обладает ДНКазной активностью, поэтому свойства ДНК-вакцины могут ухудшиться. Заключение ДНК в катионные липосомы, скорее всего, поможет решить эту проблему.
Из множества разработанных ДНК-вакцин на сегодняшний день лицензировано всего несколько, причем повезло в этом плане только животным (табл. 1).