интраэпителиальная неоплазия высокой степени шейки матки что это
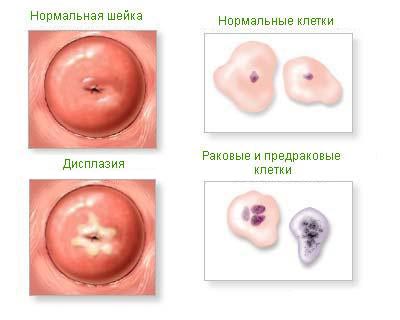
Дисплазия шейки матки
— Расскажите, пожалуйста, о заболеваниях шейки матки и о частом диагнозе дисплазия шейки матки, который так пугает женщин
Соотношение классификаций предраковых поражений шейки матки
| Система Папаниколау | Описательная система ВОЗ | CIN | ТБС (Терминологическая система Бетесда) |
| Класс 1 (норма) | Отсутствие злокачественных клеток | Отсутствие неопластических изменений | Норма |
| Класс 2 (метаплазия эпителия, воспалительный тип) | Атипия, связанная с воспалением | Реактивные изменения клеток ASC: ASC — US; ASC – Н | |
| Класс 3 («дискариоз») | Слабая дисплазия | CIN I Койлоцитоз | LSIL |
| Умеренная дисплазия | CIN II | HSIL | |
| Тяжелая дисплазия | CIN III | ||
| Класс 4 (клетки, подозрительные на рак или карцинома in situ) | Карцинома in situ | ||
| Класс 5 (рак) | Инвазивная карцинома | Карцинома | Карцинома |
— Как же определить эти клетки у себя и предотвратить или «поймать» раннюю стадию злокачественного процесса?
-Чем отличается анализ на цитологию от биопсии?
Показаниями к выполнению биопсии являются
— Если у вас обнаружены отклонения в анализе?
ASC-US ( сомнительный результат)
Женщинам от 25 и старше
ASC-US — самый частый аномальный результат цитологического исследования, при этом сопряженный с самым низким риском CIN3+, отчасти еще и из-за того, что примерно в трети случаев ASC-US не ассоциирован с ВПЧ-инфекцией. Риск CIN3+ у женщин с ASC-US не превышает 2%, в связи, с чем возможно наблюдение с повтором цитологического исследования через год, или ВПЧ-тестирование, что предпочтительнее.
При отсутствии ВПЧ — ко-тестирование через 3 года.
При обнаружении ВПЧ — кольпоскопия: при выявлении аномальных картин — биопсия, при их отсутствии — ко-тестирование через год.
При ASCUS с положительным ВПЧ-тестом может быть целесообразна сортировка женщин с помощью иммуноцитохимических тестов с окрашиванием на Р16 и РrоЕхС.
При этом у женщин с положительным анализом на ВПЧ 16 и/или 18 типов общий риск развития CIN III или микроинвазии в течение последующих 3 лет составляет около 21%, а при других типах — не более 5%
При ASCUS — повторная цитология ежегодно, немедленная кольпоскопия не показана. При повторном ASCUS или положительном ВПЧ-тесте — кольпоскопия, в соответствии с результатми кольпоскопии — биопсия.
Женщины, наблюдающиеся после хирургического лечения CIN
ASCUS у женщин, наблюдающихся после лечения CIN, — кольпоскопия.
Кольпоскопию можно отложить на послеродовый период (через 6 недель после родов).
женщинам с LSIL (плоскоклеточное интраэпителиальное поражение низкой степени)
LSIL значительно чаще ассоциированы с ВПЧ-инфекцией, чем ASC-US (ВПЧ имеется у 77% женщин с LSIL)
Женщинам с LSIL и положительным ВПЧ — кольпоскопия при:
— Отрицательном ВПЧ — повторное ко-тестирование через 1 год,
— Положительном ВПЧ или патологии в мазках — кольпоскопия, биопсия по показаниям,
— Отрицательных результатах обоих тестов — повторный скрининг через 3 года.
При LSIL — кольпоскопия. При отсутствии подозрения на тяжелые повреждения — повторное обследование после родов.
Женщины в постменопаузе
Показано ВПЧ-тестирование и кольпоскопия при любых результатах теста.
Риск CIN 3+ при ASC-H выше, чем при ASC-US или LSIL, но ниже, чем при HSIL. Этот риск увеличивается с возрастом. Всем больным показана кольпоскопия вне зависимости от ВПЧ-статуса, в том числе у женщин моложе 25 лет.
Женщинам HSIL ( плоскоклеточное порожение высокой степени )
При HSIL показана срочная кольпоскопия. При этом сортировка на основании результатов повторных мазков или ВПЧ-статуса недопустима. А при полной видимости ЗТ сразу же проводят эксцизию обнаруженных очагов CIN не только с диагностической, но и с лечебной целью — подход «see and treat» («смотри и лечи»). При неполной видимости ЗТ показана LLETZ с диагностической целью. Деструкции очагов поражения недопустимы!
При обнаружении AGC или AIS показана кольпоскопия с выскабливанием цервикального канала вне зависимости от результатов ВПЧ-тестирования. Кстати, у женщин старше 35 лет показано взятие аспирата из полости матки для исключения патологии эндометрия.
При всех доброкачественных (фоновых) заболеваниях шейки матки (1-я диспансерная группа) показано динамическое наблюдение 1 раз в год с проведением расширенной кольпоскопии; цитологическим исследованием, контролем ПЦР отделяемого из цервикального канала на ВПЧ ВКР. А дальнейшая тактика после хирургического лечения CIN II-III/CIS (интенсивное наблюдение или, в случае рецидива, повторная эксцизия) определяется с учетом результатов Пап-теста и ВПЧ-теста, типа ЗТ, возраста женщины, ее репродуктивных планов. В случае рецидива CIN II-/CIS выполнение повторных конизаций (2-3) с высокой вероятностью позволяет излечить больную и избежать гистерэктомии.
Данные клинические рекомендации, по данным приказа от 2 ноября 2017 года, определяют основные направления диагностики и ведения пациенток с доброкачественными и предраковыми заболеваниями шейки матки, однако обоснованное отступление от данного протокола с расширением объема обследования не является ошибкой.
Дисплазия шейки матки
Дисплазия шейки матки — более правилен термин «цервикальная интраэпителиальная неоплазия» (cervical intraepithelial neoplasia — CIN) — относится к истинному предраку шейки матки. Выделяют три степени тяжести: 1 и 2 соответствуют легкой и умеренной дисплазии, 3 включает одновременно тяжелую дисплазию и преинвазивную карциному.
Дисплазия шейки матки является пограничным состоянием, способным к регрессии, стабилизации и прогрессии — переходу в преинвазивный и инвазивный рак.
Причины дисплазии шейки матки
В возникновении истинного предракового состояния шейки матки большое значение придается родовой травме, либо травме после аборта (происходит нарушение трофики тканей и их иннервации). К группе риска относятся и женщины, которым ранее проводилось лечение шейки матки (различные виды коагуляции, хирургическое лечение), а также со старыми разрывами шейки матки. Также большую роль играют инфекционные агенты, вызванные вирусом герпеса типа 2 и вирусом папилломы человека. Известно, что фоном для возникновения злокачественных опухолей является сочетание дегенеративных и регенеративных процессов, вызванных хроническим воспалением, дистрофией, травмой, застойными явлениями. Велика роль и гормональных нарушений (отмечается повышение гонадотропной функции, нарушение метаболизма эстрогенов с преобладанием содержания эстрадиола), нарушений в системе иммунной защиты, наследственность (риск заболевания у женщин с семейной отягощенностью в 1,6 раза выше). Отмечено также, что большое значение имеет фактор смегмы у полового партнера (смегма, накапливающаяся под крайней плотью, содержит канцерогенные вещества и при несоблюдении личной гигиены партнером, попадает на шейку матки).
Клиника
Дисплазия шейки матки не имеет клинических проявлений, особенно если она возникает на непораженной шейке матки. Иногда первым сигналом о наличии предрака могут быть данные цитологического исследования содержимого влагалища и цервикального канала. У молодых женщин диспластически измененный эпителий чаще обнаруживается на влагалищной части шейки матки, после 40 лет — в цервикальном канале, причем одновременно может поражаться и влагалищная часть шейки матки.
Диагностика дисплазии шейки матки
Необходимо комплексное обследование: сбор анамнеза, жалоб, бимануального исследования, бактериоскопического и бактериологического, а также целого ряда дополнительных методов исследования: кольпоскопического (расширенная кольпоскопия), цитологического исследования мазков с поверхности шейки матки и из цервикального канала, а также соскоба с шейки матки и из цервикального канала, прицельная биопсия.
При морфологическом исследовании определяется степень тяжести дисплазии: CIN1 (легкая) изменения наблюдаются в нижней трети эпителия, при CIN2 (умеренная дисплазия) — в нижних двух третях эпителия, при CIN3 (тяжелая дисплазия и преинвазивная карцинома) — почти во всем или во всем эпителии. Характерно изменение размеров и формы клеток и ядер, дезорганизация волокнистой соединительной ткани стромы.
После лечения необходимо повторное кольпоскопическое обследование через 1,5 — 2 месяца после операции. Динамическое наблюдение осуществляется в течение 3 лет.
Цервикальная интраэпителиальная неоплазия: возможности диагностики и лечения
Цервикальные интраэпителиальные неоплазии являются предраковыми поражениями шейки матки. Ключевым фактором развития рака шейки матки является персистенция и интеграция вируса папилломы человека высокого онкогенного риска. В обзоре представлены современные методы диагностики цервикальных интраэпителиальных неоплазий, цитологическая и кольпоскопическая классификации, методы лечения.
Сervical intraepithelial neoplasia: possibilities of diagnosis and treatment
Рак шейки матки занимает второе место по частоте среди злокачественных новообразований органов репродуктивной системы у женщин и первое место среди онкогинекологических заболеваний у женщин в возрасте до 30 лет [1]. Раку шейки матки предшествуют цервикальные интраэпителиальные неоплазии (CIN). В оригинальной терминологии подобные поражения были подразделены на три стадии: CIN I, включающую недифференцированные клетки на протяжении одной трети расстояния от базальной мембраны до поверхности эпителия, соответствует легкой дисплазии, CIN II – на протяжении двух третей этого расстояния соответствует умеренной дисплазии и CIN III – на протяжении более чем двух третей толщи эпителиального пласта соответствует тяжелой дисплазии и Cainsitu. Объединение тяжелой дисплазии и Cainsitu в одну категорию было оправдано ввиду сложности их дифференцировки [2].
Диагноз интраэпителиальной неоплазии базируется на семи морфологических критериях: увеличение размеров ядра, изменение формы ядра, увеличение плотности ядерной окраски, ядерном полиморфизме, увеличение митозов, атипичных митозах, нарушении или отсутствии созревания [3].
Заподозрить CIN позволяет цитологическое исследование, обеспечивающее возможность ранней диагностики предраковых состояний рака шейки матки и позволяющее оценить в динамике эффективность проводимой терапии. Точность цитологического теста вариабельна и зависит от многих факторов, таких как методика приготовления мазков, техника приготовления мазков, квалификация лаборанта. Считается, что до 30% случаев рака шейки матки развивается у женщин, которые регулярно проходили цитологический скрининг, при этом забор материала или интерпретация результатов были ошибочными, т.е. давали ложноотрицательные результаты [4].
Цитологическое исследование в настоящее время один из экономически выгодных методов, однако, следует принимать во внимание, что чувствительность его составляет 58%, а специфичность 69% [5].
Очень важным является обнаружение в мазке как плоских, так и эндоцервикальных и метапластических клеток, это подтверждает, что была захвачена зона трансформации, являющаяся зоной максимального риска развития РШМ. В последние годы во многих странах используются цитологические классификации, включающие широкий спектр патологических изменений шейки. Наиболее распространенной из них является классификация, разработанная в городе Бетесда (США) в 1988 году – The Bethesda System (TBS) (табл. 1). В классификации Бетесда выделяют плоскоклеточные интраэпителиальные поражения низкой и высокой степени (squamous intraepithelial lesions low and highgrade – LSIL и HSIL) и инвазивный рак. Плоскоклеточные интраэпителиальные поражения низкой степени включают изменения, связанные с папилломавирусной инфекцией и слабой дисплазией (CIN I), высокой степени — умеренную дисплазию (CIN II), тяжелую дисплазию (CIN III) и внутриэпителиальный рак. Для обозначения клеточных изменений, трактовка которых затруднена, введен термин ASCUS – atypical squamous cell so fun determined significance (клетки плоского эпителия с атипией неясного значения ASCUS у женщин репродуктивного возраста характеризуется определенными критериями. Наиболее принципиальным является размер ядра в сравнении со средним размером ядра плоской клетки или плоской метаплазированной клетки. Размеры ядра клетки ASCUS в 2,5-3 раза больше среднего размера плоской клетки или в 1,5 раза больше ядра зрелой метаплазированной клетки. Если в мазке найдены клетки типа ASCUS, риск обнаружить при гистологическом исследовании CIN II– III составляет 10-20%, инвазивного рака — 0,1% [6].
Терминологическая система Бетесда (2001)
Адекватность образца
— Удовлетворительный (наличие или отсутствие компонента эндоцервикса/зоны трансформации;
— Неудовлетворительный (указать причину).
Интерпретация/результат исследования
1. Негативный в отношении интраэпителиального поражения или злокачественности:
— Микроорганизмы: Trichomonasvaginalis; Candida; изменения флоры, соответствующие бактериальному вагинозу; бактерии, морфологически соответствующие Actinomycessp.; клеточные изменения, соответствующие герпесвирусной инфекции;
— Другие доброкачественные признаки: реактивные клеточные изменения, связанные с воспалением, радиацией, ВМС; железистые клетки; атрофия.
2. Атипии плоских клеток:
— Атипические клетки плоского эпителия неясного значения (ASC-US) или атипичные клетки плоского эпителия, не позволяющие исключить HSIL (ASC-H);
— Низкая степень плоскоклеточного интраэпителиального поражения (LSIL): ВПЧ-эффект, легкая дисплазия, CINI;
— Высокая степень плоскоклеточного интраэпителиального поражения (HSIL): умеренная дисплазия, тяжелая дисплазия, CINII, CINIII, Cainsitu;
3. Атипии железистых клеток:
— Атипичные железистые клетки (AGC): эндоцервикальные, эндометриальные или не определенные (NOS);
— Атипичные железистые клетки, похожие на неопластичные: эндоцервикальные, эндометриальные или не определенные (NOS);
— Эндоцервикальная аденокарцинома insitu(AIS);
Все большее применение в клинической практике находит жидкостная цитология — новая технология приготовления цервикальных образцов. Преимуществом данного метода является уменьшение количества артефактов, связанных с высушиванием образцов, возможность избежать загрязнения проб эритроцитами, воспалительным экссудатом, что обеспечивает высокое качество препаратов. Жидкостная цитология улучшает качество образцов и является более чувствительным методом при более или менее идентичной специфичности по сравнению с традиционным цитологическим исследованием [7, 8].
Кольпоскопия является одним из ведущих методов обследования больных с патологией шейки матки. В настоящее время для интерпретации кольпоскопических картин используется Международная классификация кольпоскопических терминов, одобренная на 14 Всемирном конгрессе Международной федерации по кольпоскопии и цервикальной патологии (IFCPC), состоявшемся в июле 2011 года в Рио-де-Жанейро. Одним из важнейших критериев информативности кольпоскопического исследования является возможность визуализации зоны стыка эпителия. В новой номенклатуре зона трансформации (ЗТ) делится на 3 типа: ЗТ I типа визуализируется полностью; ЗТ II типа визуализируется не полностью, имеет эндоцервикальный компонент; ЗТ III типа полностью не визуализируется. В новой классификации различают тонкий и плотный ацетобелый эпителий. Тонкий ацетобелый эпителий может быть признаком как плоскоклеточных интраэпителиальных поражений низкой степени, так и незрелой метаплазии, реактивных изменений эпителия. Плотный ацетобелый эпителий характерен для плоскоклеточных интраэпителиальных поражений высокой степени тяжести. Пунктуация и мозаичность представляют собой проявления атипической васкуляризации эпителия и могут проявлением различных состояний: воспаления, быстро растущего метапластического эпителия, CIN, рака шейки матки. Нежная мозаика и пунктуация очень тонкие, неинтенсивные, часто сопровождают процессы метаплазии. Грубая мозаика и пунктуация по виду напоминают булыжную мостовую и характеризуют интраэпителиальные неоплазии высокой степени тяжести. К неспецифическим признакам аномальной кольпоскопической картины относятся лейкоплакия, эрозия и характер окрашивания эпителия раствором Люголя. Атипия сосудов является основным признаком при подозрении на инвазию и проявляется в виде хаотически расположенных не анастомозирующих сосудов причудливой формы [9].
Кольпоскопическое исследование обладает невысокой прогностической ценностью – 64,6% при чувствительности 88,4%, специфичности 43,2%. Наиболее специфичными признаками являются ацетобелый эпителий (прогностическая ценность – 91,7%), йодпозитивная мозаика и пунктуация (77,8%), атипическая зона трансформации (77,4%) [10].
Биопсия шейки матки при кольпоскопии необходима во всех случаях, поскольку гистологическому исследованию экзоцервикса в диагностике предраковых процессов принадлежит решающее значение. Для получения достоверных результатов рекомендуется проводить прицельную биопсию под контролем кольпоскопа из пораженных участков шейки матки. Считается, что кольпоскопически ориентированная биопсия повышает точность диагностики ЦИН на 25 %. Некоторые авторы рекомендуют брать несколько образцов ткани шейки матки, особенно при наличии множественных кольпоскопически неоднородных очагов. Эндоцервикальный соскоб исследуется наряду с биопсией шейки матки при ряде патологических состояний, когда требуется дополнительная информация о состоянии цервикального канала (неудовлетворительная кольпоскопия, во всех случаях HSIL) [10].
Существует биопсия двух видов: точечная (прицельная, punch-biopsy) и эксцизионная (расширенная, excisionalbiopsy). При этом показано, что чувствительность прицельной биопсии ниже на 50% по сравнению с петлевой электроэксцизией. В то же время, прицельная биопсия вызывает меньше осложнений последующей беременности, чем петлевая электроэксцизия [11].
Подтверждение этиологической роли ВПЧ в развитии РШМ привело к тому, что диагностика папилломавирусной инфекции стала рассматриваться как важнейший элемент скрининга и профилактики этого заболевания [12].
В скрининговых программах можно использовать только стандартизованные тесты, удовлетворяющие определенным требованиям чувствительности, специфичности, воспроизводимости. ВПЧ-тест должен выявлять по меньшей мере 13 типов ВПЧ высокого онкогенного риска. Разработаны и внедряются ВПЧ-тесты на основе новых технологий: ПЦР в реальном времени – метод, позволяющий определять концентрацию вируса в цервикальном эпителии; технология амплификации нуклеиновых кислот – выявляет мРНК генов Е6 и Е7 ВПЧ.
Одним из первых отечественных ВПЧ-тестов является тест «Апмли-Сенс ВПЧ ВКР скрин-титр-FL», который был разработан специально для скрининга и основан на ПЦР с детекцией в режиме реального времени. Тест позволяет выявлять и определять концентрацию ДНК 12 типов ВПЧ [9].
На основании данных, полученных во многих крупных международных исследованиях, были сформулированы следующие рекомендации по применению теста на ВПЧ в скрининге рака шейки матки:
— в первичном скрининге у женщин старше 30 лет в сочетании с цитологическим исследованием или в качестве самостоятельного теста;
— при ведении пациенток с ASCUS;
— для мониторинга терапии цервикальных поражений высокой степени- CIN II, CIN III, Cainsitu, инвазивный рак [9].
Обзор исследований, проведенных с целью оценки диагностических характеристик цитологического исследования и тестирования на ВПЧ, показал, что:
— чувствительность ВПЧ-тестирования (88-100%) значительно превышает чувствительность цитологического метода (68-86%);
— специфичность ВПЧ-тестирования (68-97% немного уступает специфичности цитологического исследования (78-99%);
— чувствительность и прогностическая значимость отрицательного теста на ВПЧ в сочетании с отрицательным результатом цитологического теста приближаются к 100% [9].
Попытки усовершенствовать раннюю диагностику рака шейки матки в настоящее время сосредоточены на поиске генов зараженной вирусом клетки – хозяина, экспрессия которых в дисплазиях и карциномах необратимо меняется под действием онкобелков вируса.
Одним из таких генов является ген INK4a (синонимы СDKN2А, МТS1, INK4a/ARF). Он кодирует белок р16ink4α, являющийся ингибитором циклин-зависимых киназ Сdk 4\6. На клеточных структурах было установлено следующее. Онкобелок Е7 вируса папилломы высокого онкогенного риска связывается с Rb. При этом распадается комплекс Rb с транскрипционными факторами Е2F. Освобождение Е2F – сигнал к переходу клетки из стадии G1 в стадию репликации ДНК. Существует негативная обратная связь между наличием и функциональной полноценностью Rb и транскрипционной активностью гена, кодирующего р16INK4а: активный Rb подавляет транскрипцию INK4a. Нарушение функции Rb и гиперэкспрессия р16INK4а коррелируют на уровне белка, наличие полноценного Rb приводит к исчезновению р16INK4а, а отсутствие Rb вызывает гиперпродукцию р16INK4а. Эти результаты получили подтверждение и на первичных дисплазиях и на карциномах шейки матки. Содержание Е7 в CINIII и инвазивных РШМ увеличено, а содержание Rb резко снижено; в подавляющем большинстве клеток РШМ Rb отсутствует [14].
Установлено, что окрашивание р16INK4а-специфическими антителами в дополнение к традиционному гистологическому анализу значительно превышает вероятность совпадения мнений гистологов при решении вопроса о стадии дисплазии. Использование р16INK4а как иммуногистохимического маркера может способствовать уменьшению ложноотрицательной и ложноположительной интерпритации биопсии, и таким образом, значительно повысить эффективность гистологического метода исследования в отношении раннего выявления РШМ [14].
Важный метод профилактики рака шейки матки — проведение тотального цитологического скрининга женского населения. Основываясь на опыте различных стран по организации скрининга рака шейки матки, предлагаются следующие рекомендации для проведения профилактических программ в России: возраст начала скрининга — 25 лет; возраст, в котором нецелесообразно продолжать скрининг — 65 лет; интервалы проведения скрининга – каждые 3 года у женщин моложе 50 лет и каждые 5 лет у женщин в возрасте 50-65 лет [9].
Тактика лечения CIN зависит от результатов клинических, кольпоскопических, морфологических методов исследования. Если при CIN I существует возможность как диспансерного наблюдения, так и деструктивного лечения, то при CIN II, CIN III проводится хирургическое лечение ввиду высокого риска прогрессирования заболевания.
Из хирургических методов лечения бесспорное преимущество имеют методы эксцизии, поскольку позволяют удалить ткань шейки матки на контролируемую глубину, а главное позволяют провести гистологическое исследование всего удаленного образца, т.е. выполнить расширенную биопсию и исключить инвазивный рак. У молодых нерожавших женщин объем удаляемой ткани должен быть минимальным. Деструктивные процедуры (лазерная вапоризация, криоабляция) могут быть проведены у женщин, планирующих беременность, у которых поражение имеет небольшие размеры, расположено на эктоцервиксе и полностью визуализируется при кольпоскопии [15].
В последние годы для лечения патологии шейки матки используется метод фотодинамической терапии, который обладает рядом преимуществ: селективная деструкция патологических участков, которая достигается как за счет преимущественного накопления фотосенсибилизатора в опухолевых и патологических тканях, так и за счет направленности светового воздействия; минимальное повреждение здоровой ткани; отсутствие резистентности и токсичности к повторным циклам; возможность многокурсового лечения и отличное заживление тканей с хорошими косметическими результатами. О.И. Трушина и соавт. (2008) проанализировали результаты фотодинамической терапии: противовирусный эффект был получен в 90,4% случаев [16].
Применение иммуномодулирующих препаратов в сочетание с деструкцией приводит к значительному улучшению состояния системы интерферона в крови. Лечение противовирусными и иммуномодулирующими препаратами может проводиться вторым этапом после деструкции, так как переход от инфицирования к дисплазии происходит при нарушенном иммунитете, что приводит к длительной персистенции инфекции и является ключевым фактором для возникновения последующего рецидива заболевания [15].
Л.И. Мальцева, А.В. Ахметзянова, Л.Н. Фаррахова, Н.А. Нигматуллина
Казанская государственная медицинская академия
Мальцева Лариса Ивановна
доктор медицинских наук, профессор, заведующая кафедрой акушерства и гинекологии № 1
1. Чиссов В.И., Старинский В.В., Петрова Г.В.Злокачественные новообразования в России, заболеваемость и смертность. — М., 2010.
2. Richart R.M. Cervical Intraepithelial neoplasia // Pathol. Ann. — 1973. — Vol. 8. — P. 301-328.
3. Reagan J.W., Seidermand I.L., Saracusa Y. The cellular morphology of carcinoma In situ and dysplasia or typical hyperplasia of the uterine cervix // Cancer. — 1983. — Vol. 6. — P. 224-235.
4. Nuovo J., Melnikow J., Howell L.P. New tests for cervical cancer screening / J. Nuovo // Am. Fam. Physician. — 2001. — Vol. 64, № 5. — P.780-786.
5. World Health Organization (WHO). Comprehensive Cervical Cancer Control. A guide to essential practice. — Geneva: WHO, 2006. — http:// www.who.int/ reproductive-health/publications/cervical_cancer_gep/text.pdf.
6. Solomon D., Davey D., Kurman R. et al. The 2001BethesdaSystem. Terminaligy for reporting results of cervical cytology // JAMA. — 2002. — Vol. 16. — P. 2114-2118.
7. Arbyn M., Bergeron C., Klinkhamer P. et al. Liquid compared with conventional cervical cytology: a systematic review and meta-analysis // Obstet. Gynecol. — 2008. — Vol. 111, № 1. — P. 167-177.
8. Ronco G., Segnan N., Giorgi-Rossi P. et al. Human papillomavirus testing and liquid-based cytology: results at recruitment from the new technologies for cervical cancer randomized controlled trial // J. Natl. Cancer. Inst. — 2006. — Vol. 98, № 11. — P. 765-774.
9. Профилактика рака шейки матки: Руководство для врачей. — М.: МЕДпресс-информ, 2012. — 192 с.
10. Роговская С.И. Практическая кольпоскопия. — М.: ГЭОТАР-Медиа, 2010. — 240 с.
11. Фролова И.И., Бабиченко И.И. Клинико-морфологические исследования дискератозов и предрака шейки матки // Вопросы гинекологии, акушерства и перинатологии. — 2003. — Т. 2, № 3. — С. 19-24.
12. Киселев В.И. Вирусы папилломы человека в развитии рака шейки матки. — М., 2004. — 179 с.
13. Narisawa-Saito M., Kiyono T. Basic mechanisms of high-risk human papillomavirus-induced carcinogenesis: roles of E6 and E7 proteins // Cancer Sci. — 2007. — Vol. 98, № 10. — P. 1505-1511.
14. Omori M., Hashi A., Nakazawa K. et al. Estimation of prognoses for cervical intraepithelial neoplasia 2 by p16INK4a immunoexpression and high-risk HPV in situ hybridization signal types // Am. J. Clin. Pathol. — 2007. — Vol. 128, № 2. — P.208-217.
15. Роговская С.И. Папилломавирусная инфекция у женщин и патология шейки матки. В помощь практикующему врачу. — М.: ГЭОТАР-Медиа, 2010. — 192 с.
16. Аполихина И.Н. и др. Фотодинамическая терапия у женщин с папилломавирусной инфекцией // Рос. вестн. акушер-гинеколога. — 2007. — № 1. — С. 28-34.