интратуморальное введение что это
Доктор, что это значит? Краткий онкологический словарь радиолога
В рамках международного онкологического форума «Белые ночи» 2021 на сессии для пациентов Павел Иванович Крживицкий, к.м.н., заведующий отделением радионуклидной диагностики, научный сотрудник, доцент НМИЦ онкологии им. Н.Н. Петрова, представил доклад о радионуклидной диагностике. Информация позволит пациентам лучше понимать термины, которые используют врачи-радиологи при общении с больными.
Радионуклидная диагностика – это область медицины, связанная с получением изображений на основе использования радиоактивных веществ, испускающих гамма-кванты. В основе радионуклидной диагностики лежит принцип «меченных атомов».
Изображения в лучевой и радионуклидной диагностике
Чем изображения радионуклидной диагностики отличаются от изображений лучевой диагностики? Лучевая диагностика — это визуализация изменений рентгеноморфологии, что больше относится к морфологической структуре или анатомии. С помощью радионуклидной диагностики специалисты видят физиологические или патофизиологические изменения, которые происходят в организме на клеточном уровне.
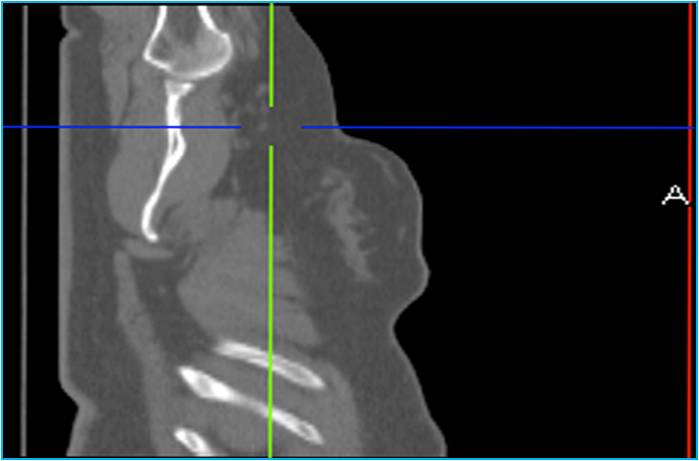
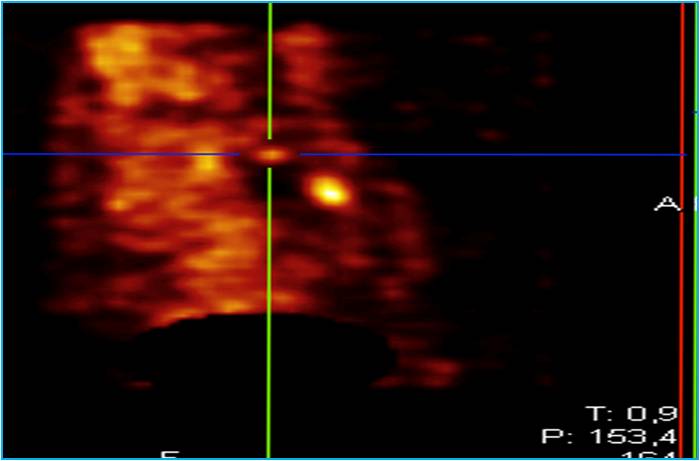
Рис. 1. Лучевая диагностика. Визуализация изменений морфологической структуры или анатомии
Рис. 2. Радионуклидная диагностика. Визуализация физиологических или патофизиологических процессов в организме
Что такое радиофармпрепарат и радионуклид?
Радионуклиды – это изотопы химического элемента, которые достигают своего стабильного состояния с помощью радиоактивного распада, в результате чего рождается гамма-квант. Во время проведения радионуклидной диагностики фиксируется именно гамма-квант.
Радиофармпрепарат (РФП). Любую молекулу, которая принимает участие в жизнедеятельности организма, можно пометить радионуклидом. Именно это и будет называться радиофармпрепарат. РФП могут использоваться как для диагностики, так и для лечения болезней.
Безопасны ли радиофармпрепараты? Дозировка РФП
— Один кубик сахара, который мы кидаем в чай – это 3 тысячи микрограмм сахарозы или 200 тысяч кристаллов. Доза фтордезоксиглюкозы (ФДГ), которую используют при ПЭТ-КТ исследовании, на одного пациента составляет 3 микрограмма, то есть одна пятая кристалла. Мы применяем такие микроконцентрации радиофармпрепаратов, чтобы у пациента не возникало фармакологических эффектов, например, аллергических реакций. Таким образом мы обеспечиваем безопасность обследований, — пояснил Павел Иванович Крживицкий.
Основные РФП используемые для ОФЭКТ-КТ в онкологии
На сегодняшний день существует около 12 радиофармпрепаратов для ОФЭКТ-КТ, каждый из них отвечает определенным целям. Например, в исследовании скелета (остеосцинтиграфии) необходимы меченные фосфаты.
Основные РФП используемые при ПЭТ-КТ в онкологии
Линейка РФП для ПЭТ-КТ еще шире. Однако чаще всего применяется фтордезоксиглюкоза, она позволяет точно диагностировать и контролировать эффективность лечения около 90% онкологических заболеваний.
Как проходит радионуклидное исследование? Методика
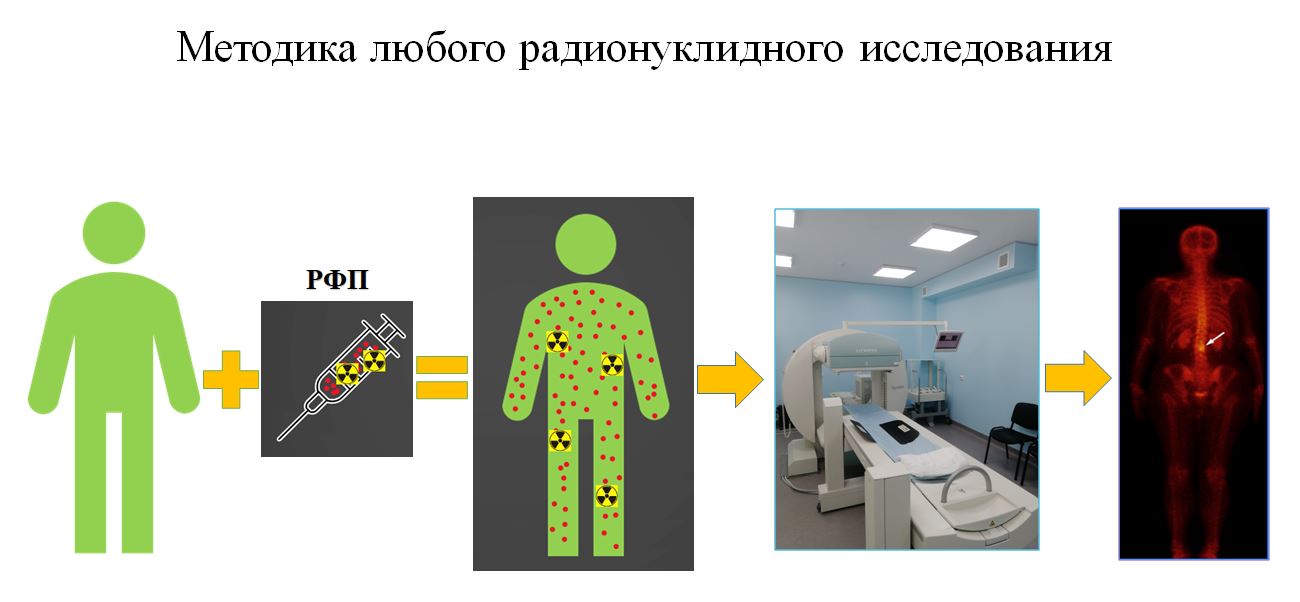
Радионуклидная диагностика включает в себя две составляющие – введение радиофармпрепарата и использование гибридных и специализированных технологий.
Сначала пациенту всегда вводится радиофармпрепарат. Чаще всего это внутривенная инъекция, хотя, бывают и другие способы введения, например – вентиляционная сцинтиграфия, то есть пациент вдыхает РФП, который находится в баллончике в газообразном состоянии. После введения происходит распределение препарата в организме. Далее специалист детектирует, то есть определяет, в какой части тела присутствуют или отсутствуют нарушения физиологического или патофизиологического процесса, — разъяснил Павел Иванович Крживицкий.
Методы радионуклидной диагностики
Методы радионуклидной диагностики различаются по типу радионуклида, включенного в метку. Если радионуклид при каждом распаде испускает один фотон — это однофотонные методы, например сцинтиграфия, ОФЭКТ, ОФЭКТ-КТ. Если радионуклид при каждом распаде испускает позитрон, который потом встречается с электроном и дает нам два фотона – это позитронно-эмиссионные методы, например ПЭТ, ПЭТ-КТ, ПЭТ-МРТ, — объяснил Павел Иванович Крживицкий.
Однофотонные методы исследования (радионуклид при каждом распаде испускает один фотон):
Позитронно-эмиссионные методы исследования (радионуклид при каждом распаде испускает позитрон, который путем аннигиляции с электроном образуя два фотона):
Методы лучевой диагностики
Анатомические методы лучевой диагностики:
Функциональный методы лучевой диагностики:
Гибридные методы лучевой диагностики (сочетание функциональных и анатомических):
Задачи радионуклидной диагностики в онкологии
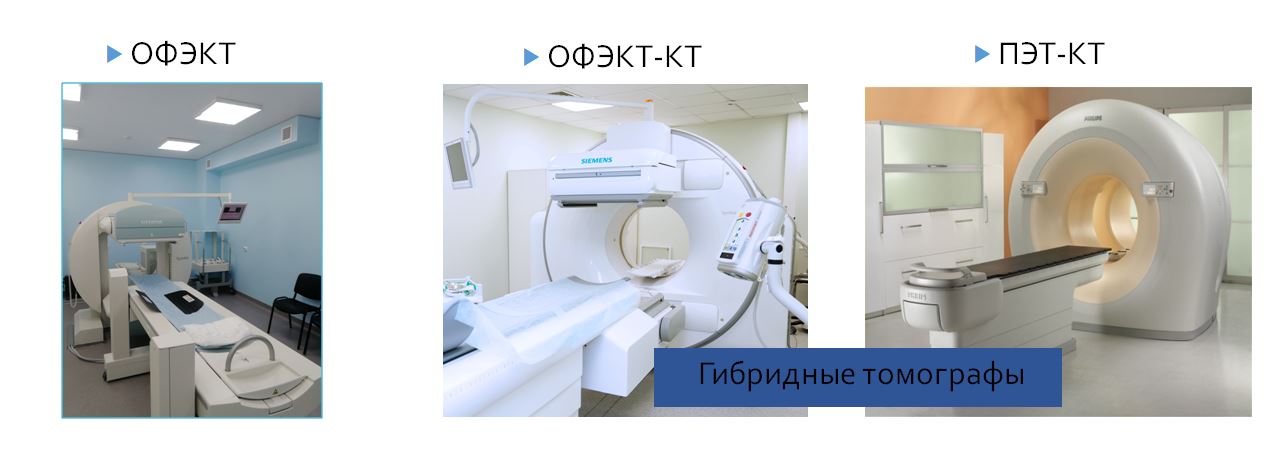
Какая аппаратура используется для радионуклидной диагностики?
Стандартная аппаратура:
Специализированные гамма-камеры камеры
В диагностике онкологических заболеваний могут применяться специализированные камеры. Например, камеры для молекулярной визуализации молочных желез. В нашем Центре есть новая камера, оснащенная очень чувствительным цифровым детектором. Он позволяет снизить дозу радиофармпрепарата примерно в 3-4 раза и увидеть опухоль молочной железы размером около 5 мм, — отметил Павел Иванович Крживицкий.
Что такое биопсия сигнальных лимфатических узлов?
Биопсия сигнальных лимфатических узлов — это манипуляция, во время которой у пациента берется образец тканей лимфоузла и изучается на предмет наличия опухолевых клеток. Эта технология требует командной работы врача-диагноста, врача-хирурга, который проводит манипуляцию по изъятию тканей лимфоузла, и врача-патоморфолога (врача-патолога), который исследует образец с помощью микроскопа и других специальных приборов. В 90% данная биопсия проводится с радионуклидной визуализацией и с радионуклидной меткой сигнального лимфатического узла.
Как проводится биопсия?
—Так же, как и при остальных методах радионуклидной диагностики, пациенту вводится РФП, однако в данном случае он вводится интратуморально, то есть внутрь опухоли, или перитуморально, то есть в область вокруг опухоли. Лимфоток, который идет от опухолевого очага, распределяет препарат в лимфатический узел. После этого хирург с помощью гамма-щупа находит этот узел и удаляет, а патоморфолог определяет, есть ли в лимфоузле метастатическое поражение или нет, — объяснил процесс Павел Иванович Крживицкий.
Что такое молекулярная визуализация молочных желез (маммосцинтиграфия)? Кому она показана?
Радионуклидная диагностика настолько чувствительна, что позволяет оценить изменения в организме на молекулярном уровне. Когда диагноз рак молочной железы невозможно установить с помощью маммограммы, на помощь приходит маммосцинтиграфия, которая проводится с помощью специальной гамма-камеры. Она позволяет обнаружить опухоль даже в самых сложных случаях. Она также может применяться у женщин, которые носят силиконовые протезы.
По данным исследований, комбинирование двух методов — маммографии и молекулярной визуализации — позволяет выявлять рак молочных желез в 4 раза чаще по сравнению с выполнением только одной маммографии.
Основные показания к исследованию Molecular Breast Imaging (Молекулярная визуализация молочных желез):
Радиационная безопасность
Пациенты часто задают вопросы о радиационной безопасности исследований.
Стоит отметить, что все люди подвержены радиации от естественных источников:
От естественных источников человек ежегодно получает дозу 3 микрозиверта, а от медицинского рентгеновского излучения – всего в 1,2 микрозиверта.
Для пациентов пределы доз не устанавливаются, но используются принципы обоснования: польза от назначенного исследования должна превышать все риски.
Кому противопоказаны методы радионуклидной диагностики?
Поскольку радионуклидные исследования связаны с введением радиофармпрепаратов, они не рекомендуются беременным и кормящим женщинам. Если исследование все-таки приходится на период лактации, то необходимо прекратить кормление ребенка в течение 24 часов после манипуляции. В зависимости от изотопа этот период может быть продолжительнее.
Как выбрать метод радионуклидного исследования?
Радионуклидные методы исследования чрезвычайно эффективны. При этом наиболее информативны исследования, проводимые на гибридных и специализированных аппаратах. Иными словами, ПЭТ-КТ лучше, чем ПЭТ, ОФЭКТ-КТ лучше, чем ОФЭКТ.
Также, радионуклидные исследования не проводятся без назначения врача. В силу сложности выбора исследования и вида РФП, назначение осуществляется лечащим врачом и/или врачом-радиологом. Самостоятельно назначать себе исследования и проходить их в частном порядке без назначения врача может быть опасно для пациента.
Беседовала
Алина Яринко
практикант отдела по связям с общественностью НМИЦ онкологии им. Н. Н. Петрова
Санкт-Петербургский государственный университет
Высшая школа журналистики и массовых коммуникаций
Материалы конгрессов и конференций
III РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
МИШЕНИ ЛЕКАРСТВЕННОЙ ТЕРАПИИ БУДУЩЕГО
Тюляндин С.А.
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России
Опыт применения стандартных методов лечения злокачественных опухолей, таких как хирургическое лечение, лучевая терапия или химиотерапия, показал ограниченность их возможностей. С их помощью в настоящее время удается излечивать чуть больше 50% всех больных. Если при ранних стадиях заболевания операция позволяет вылечивать 50% оперированных пациентов, то лечение местно-распространенных и диссеминированных форм опухолей представляется нерешенной задачей. Химиотерапия малоэффективна при таких наиболее часто встречаемых опухолях как рак легкого, толстой кишки, желудка, простаты. Причинами этого могут быть врожденная и приобретенная лекарственная резистентность, плохое попадание препарата в опухоль и его ускоренный выброс из опухолевой клетки. Назрела необходимость определения новых мишеней для создания противоопухолевых препаратов с отличным от существующих механизмом действия. Это становится возможным благодаря развитию фундаментальной науки, сделавшей более понятным процесс возникновения и функционирования опухолевой клетки.
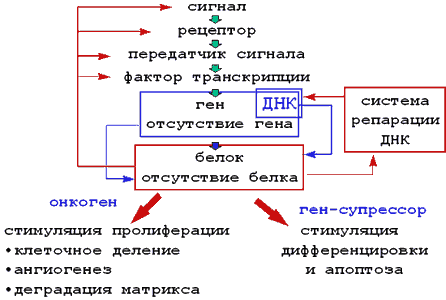
В жизни клетка делится, подвергается дифференцировке, двигается, погибает в ответ на сигналы, получаемые из внешней среды. Эти сигналы посредством контакта могут передавать клетки-соседи или клетки матрикса, а также различные внешние регуляторные молекулы, гормоны, факторы роста и.д., связываясь со специфичным трансмембранным рецептором (рис.1). Захват мембранной частью рецептора сигнальной молекулы (очень часто фактора роста) приводит к активации цитплазматической части рецептора, которая чаще всего представлена тирозинкиназой С. Это в свою очередь запускает целую серию реакций, приводящих к активации молекул-передатчиков сигнала с последующей активацией факторов транскрипции. Именно факторы транскрипции активируют гены или группы генов, вызывая их транскрипцию, трансляцию и синтез соответствующих белков.
Все гены опухолевой клетки можно разделить на две части: онкогены, активация которых приводит или способствует пролиферации клетки и метастазированию опухоли; гены-супрессоры, ингибирующие процесс пролиферации, стимулирующие дифференцировку и апоптоз. В геноме опухолевой клетке содержится поврежденная генетическая информация (мутации, неправильный обмен хромосомами генетической информации, в результате которой происходит потеря информации или чрезмерная активация того или иного гена и т.д.). В результате таких повреждения в опухолевых клетках наблюдается активация онкогенов, стимулирующих процесс клеточного деления, образования опухоли и ее метастазов. И наоборот, часто происходит ингибирование или полное выпадение функции генов-супрессоров, которые могли бы воспрепятствовать бесконтрольной клеточной пролиферации. Соответственно, белки, которые кодируются определенными генами будут подразделяться на онко-белки, запускающие процесс, клеточного деления, стимулируя расплавление матрикса и образования новых сосудов(ангиогенез) и белки-супрессоры, которые отвечают за ингибирование клеточного деления, запуск процесса дифференцировки и апоптоза. Эти белки могут быть факторами роста или рецепторами к ним, передатчиками сигналов, факторами транскрипции, ферментами, ответственными за поддержание пространственной структуры ДНК и т.д.
Понимание этой цепочки взаимосвязанных событий, представленной на рисунке 1 в упрощенном виде, уже сегодня позволило определить новые перспективные мишени для будущей противоопухолевой терапии.
Опухолевая клетка характеризуется чрезмерной экспрессией или активностью факторов роста и рецепторов к ним. Например, при раке молочной железы у 25-30% больных наблюдается чрезмерная экспрессия рецептора HER-2 из семейства рецепторов к эпидермальному фактору роста. Было показано, что экспрессия HER-2 является неблагоприятным прогностическим фактором и сочетается с высокой пролиферативной активностью опухоли, потерей гормональных рецепторов, высокой частотой метастазирования. Моноклональные антитела специфично связываются с определенным рецептором и блокируют возможность передачи через него стимулирующего сигнала, что приводит к опухолевой регрессии. В клинике у больных диссеминированным раком молочной железы была доказана эффективность назначения моноклональных антител к HER-2 (Герцептин).
Назначение Герцептина в чистом виде больным с прогрессированием болезни после многократных курсов химиотерапии эффективно у 15% больных и сочетается со значительной средней продолжительностью жизни (13 месяцев). Добавление моноклональных антител к проводимой индукционной химиотерапии антрациклин-содержащими комбинациями у больных метастатическим раком молочной железы достоверно увеличило частоту объективного эффекта (с 36% до 62%) и среднее время до прогрессирования (с 5.5 до 8.6 месяцев) по сравнению с химиотерапией только.
Рисунок 1. Схематическая иллюстрация событий, происходящих в клетке в ответ на получение внешнего cигнала.
Синтезированы химические вещества, способные селективно связываться с рецепторами, блокируя их функцию. Например вещество сурамин блокирует рецепторы тромбоцит-выделяемого фактора роста (PDGF), трансформирующего фактора роста-b (TGF-b), эпидермального фактора роста (EGF) и продемонстрировал противоопухолевый эффект у больных раком простаты и яичников.
Одной из самых изученных молекул-переносчиков сигналов является белок Ras, осуществляющий передачу от тирозинкиназных рецепторов в ядро клетки. Было обнаружено, что ген, кодирующий Ras, содержит мутацию, выявляемую у 90% больных раком поджелудочной железы, 40% раком легкого, 50% раком толстой кишки и 50% раком щитовидной железы. В результате мутации гена Ras белок Ras утрачивает способность терять фосфатную группу и постоянно находится в активированном состоянии, имитируя и передавая стимулирующие к пролиферации сигналы. Таким образом, белок Ras представляется перспективной мишенью для прерывания внутриклеточного сигнала.
Белок Ras для выполнения своей функции должен приобрести соотвествующую пространственную структуру и прикрепиться к врутренней поверхности мембраны. Для этого с помощью фермента фарнезилтрансферазы происходит присоединение 15 фарнезиловых групп на CООН-окончание белка. Без фарнелизации Ras не способен фосфорилироваться и передавать сигналы от рецептора к ядру клетки. Были разработаны ингибиторы фарнезилтрансферазы, которые в экспериментальных моделях показали способность специфично блокировать функцию Ras белка, что приводило к торможению опухолевого роста. В настоящее время эти препараты (L 778,123, SCH 66336, R 115777) проходят I фазу клинических испытаний.
Ген с-raf кодирует трионин-специфичную протеинкиназу, которая участвует в передаче пролиферативного сигнала. Была синтезирована последовательность из 34 олигонуклеотидов (ISIS 5132), которая подавляет продукцию белка, кодируемого c-raf. В эксперименте на животных бвло показано, что введение ISIS 5132 обладает минимальной токсичностью, уменьшая продукцию белка с-raf, что существенно замедляет рост опухоли. В настоящее время проводится I фаза клинических испытаний.
У больных неходжкинскими лимфомами низкой степени злокачественности отмечается гиперэкспрессия гена bcl2, который блокирует процесс апоптоза. Благодаря этому опухолевые клетки лимфомы быстро приобретают устойчивость к химиотерапии. В настоящее время синтезирован и проходит клинические испытания олигонуклеотид G3139, состоящий из 18 нуклеотидов и ингибирующий продукцию белка bcl2. Было показано, что препарат обладает минимальной токсичностью: повышение уровня глюкозы в крови и кожная реакция в месте введения препарата. Из 8 больных неходжкинскими лимфомами, резистентными к химиотерапии, у 2 отмечены объективные эффекты. Продолжается II фаза изучения препарата.
Как уже было сказано, в основе злокачественного роста лежит повреждение генетического материала клетки. С этих позиций логичным выглядит замена поврежденного гена на нормальный с целью восстановления его функции. Примером подобной генной терапии является восстановление функции гена р53. Ген р53 кодирует белок, который блокирует процесс деления клетки в случае повреждения его генетического материала. В злокачественных опухолях человека часто определяется мутированный ген р53, потерявший способность контролировать процесс клеточной пролиферации. Считается, что мутация гена р53 играет ключевую роль в приобретении клеткой злокачественного фенотипа. Напрашивается простой подход-замена дефектного гена р53 на нормальный, что вновь даст возможность контролировать процесс клеточного деления опухолевой клетки. Нормальный ген р53 получен в достаточных количествах с помощью рекомбинантной технологии. Проблема заключается в том, как осуществить его адресную доставку к опухолевой клетке и включение в геном. Для этого используются вирусы, в частности аденовирус, в геном которого встроен нормальный ген р53. Аденовирус проникает и встраивается в геном опухолевой клетки, доставляя туда и нормальную копию гена р53.
В проведенном исследовании 9 больным немелкоклеточным раком легкого с наличием мутированного гена р53 производили интратуморальное введение аденовируса, содержащего нормальный ген р53. Показано, что перенос нормального гена в опухолевые клетки произошел у всех больных, что привело к заметному увеличению апоптоза. Противоопухолевый эффект был зафиксирован у 3 больных и еще у 3 стабилизация опухоли. Таким образом, заместительная генная терапия демонстрирует значительные возможности даже на первых шагах своего развития.
Ингибиторы циклин-зависимых киназ.
Сегодня понятно, что цикл клеточного деления является сложным многоступенчатым процессом, на разных стадиях которого происходит временная активация регуляторных молекул (циклинов), ведущая к активации определенных ферментов и факторов транскрипции. Для активации различных циклинов на различных фазах клеточного цикла необходимы циклоспецифические циклин-зависимые киназы. Комплекс циклин-циклинзависимой киназы активирует различные белки и факторы транскрипции, необходимые клетке для подготовки к клеточному делению. Ингибирование циклин-зависимых киназ приводит к блокированию клеточного цикла. Два представителя этого класса препаратов проходят клинические испытания.
Флавопиридол, синтетический флавиноид, в экспериментах продемонстрировал арест клеточного деления в момент перехода G1-S и G2-M. Показано, что в основе этого лежит ингибиция циклин-зависимой киназы 1,2 и 4, вероятно за счет потери киназами активных центров фосфорилирования. При проведении I фазы препарат вводился в виде постоянной внутривенной инфузии, и дозо-лимитирующей токсичностью была диарея, контролирующаяся приемом лоперамида. Кроме того, препарат вызывал миалгию, слабость, гриппо-подобный эффект. При суточной дозе 98 мг/м 2 в крови была достигнута концентрация флавопиридола, которая в эксперименте была достаточной для ингибирования циклин-зависимых киназ. В настоящее время проводится исследование, в котором инфузия фловопиридола предшествует введению паклитаксела.
Другим препаратом из этой группы является UCN-01, изомер алкалоида стауоспорина, ингибирующий циклин-зависимые киназы 1 и 2. В клинике также испытывается в виде 72-часой постоянной внутривенной инфузии. Дозо-лимитирующей токсичностью являются гипергликемия, тошнота и рвота, легочная недостаточность.
Сосудообразование (ангиогенез) важнейший компонент опухолевого роста и метастазирования. Опухоль для своего роста нуждается в постоянном образовании сосудов, что обеспечивает достаточное питание и удаление продуктов жизнедеятельности. Опухолевые клетки продуцируют факторы, стимулирующие образование новых сосудов из клеток эндотелия. Инвазия сосудов в опухоль позволяет опухолевым клеткам проникать в кровоток и метастазировать в другие органы и ткани. В настоящее время в клинике изучается около 40 препаратов, ингибирующих различные звенья ангиогенеза. Это моноклональные антитела к рецепторам VEGF и FGF (эти рецепторы передают пролиферативный сигнал клеткам эндотелия), физиологические ингибиторы ангиогенеза (ангиостатин, фрагмент плазминогена, и эндостатин, фрагмент коллагена 18-го типа), препараты, ингибирующие разрушение внеклеточного матрикса, что необходимо для инвазии сосудов (ингибиторы металлопротеиназ, см. далее) и вещества, нарушающие процесс деления эндотелия (TNP-470) или их адгезию к элементам базальной мембраны (моноклональные антитела к интегрину avb3).
Важнейшим условием для опухолевой инвазии, ангиогенеза и метастазирования является деградация окружающего внеклеточного матрикса. Опухолевые клетки способны разрушать внеклеточный матрикс за счет продукции семейства трансмембранных протеаз из группы матричных металлопротеиназ. Подавление функции металлопротеиназ в эксперименте приводит не к гибели опухоли, а к ограничению или уменьшению ее размеров, подавлению ангиогенеза и метастазирования. Были синтезированы несколько препаратов, ингибирующих металлопротеиназы, которые находятся на этапе клинического изучения. Проведены I фазы клинических испытаний препаратов маримастат, батимастат, BAY12-9566, AG3340. Учитывая, что ингибиторы металлопротеиназ не обладают прямым цитотоксическим эффектом и при их применении можно ожидать лишь торможение опухолевого роста, в настоящее время проводятся рандомизированные исследования, в которых одним больным назначают химиотерапию, а другим-комбинацию химиотерапии и ингибиторов металлопротеиназ.
За 50-летнюю историю развития химиотерапии FDA дала разрешение на клиническое применение 79 противоопухолевым препаратам. В настоящее время только на различных этапах клинического изучения находятся более 300 новых субстанций, обладающих различными механизмами противоопухолевого эффекта. Это стало возможным благодаря развитию фундаментальных наук, которые позволили понять многие процессы функционирования нормальных и опухолевых клеток на молекулярно-генетическом уровне. Даже если 75% из них будут забракованы по тем или иным причинам, в ближайшие годы можно ожидать удвоения числа лекарственных препаратов, действие которых избирательно направлено на имеющиеся генетические или биохимические изменения конкретной опухолевой клетки конкретной опухоли у конкретного больного. Таким образом, от лечения нозологической формы опухоли мы начинаем переходить к лечению фенотипических и генетических изменений имеющихся в опухолевой клетке. В этой связи возрастает значение молекулярной и биохимической диагностики имеющихся в клетках опухоли отклонений, которая придет на смену постановке морфологического диагноза. Именно характер молекулярно-генетических нарушений в скором времени будет определять выбор лекарственных средств в онкологической клинике и, как хотелось бы надеяться, повысит результативность нашей терапии.
1. Bicknell R. New targets for cancer treatment: vessels. Educational book, 23 ESMO Congress, Athens, 1998, p. 61-63.
2. Giavazzi R., Taroboletti G. New targets for cancer treatment: matrix. Educational book, 23 ESMO Congress, Athens, 1998, p. 65-67.