испытания пки что это
Прагматические клинические исследования
Полный текст:
Аннотация
Прагматические исследования позволяют объединить преимущества наблюдательного исследования в реальной клинической практике с научной строгостью рандомизированного клинического исследования (РКИ) и тем самым дать более эффективные ответы на вопросы реальной клинической практики.
Цель. Оценка различий в проведении классических РКИ и прагматических клинических исследований (ПКИ), а также анализ особенностей, касающихся их проведения на разных этапах.
Методология. Проведён анализ ряда публикаций в период с 1999 по 2017 гг. на предмет выявления данных, посвящённых ПКИ.
Результаты. В проведении классических РКИ и ПКИ имеются существенные различия. Прежде всего, в ПКИ используют более гибкие критерии включения и отличается подход к выбору центра исследования. Также процедура получения информированного согласия имеет существенные отличия от таковой при классическом РКИ; предложены альтернативные варианты, однако единый подход пока не выработан. При проведении ПКИ требуются минимальные вмешательства монитора в рутинную медицинскую практику, что, однако, может привести к нарушению сбора отчётности. Вариантом решения может стать удалённый сбор данных.
Выводы. ПКИ представляют собой огромный потенциал для исследования эффективности лекарственных препаратов в условиях реальной клинической практики. Однако, несмотря на значительное увеличение количества таких исследований, всё ещё существует достаточное количество моментов, требующих урегулирования.
Ключевые слова
##article.ConflictsofInterestDisclosure##:
##article.articleInfo##:
Депонировано (дата): 26.09.2020
##article.reviewInfo##:
##article.editorialComment##:
Для цитирования:
Шевченко О.Р., Колбин А.С. Прагматические клинические исследования. Качественная Клиническая Практика. 2020;(3):52-60. https://doi.org/10.37489/2588-0519-2020-3-52-60
For citation:
Shevchenko O.R., Kolbin A.S. Pragmatic clinical trials. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2020;(3):52-60. (In Russ.) https://doi.org/10.37489/2588-0519-2020-3-52-60
Актуальность
Рандомизированные клинические исследования (РКИ) проводят с середины прошлого века, и их роль в современной медицине сложно переоценить. Основываясь на данных классического РКИ, под которым подразумевается двойное слепое рандомизированное плацебо-контролируемое исследование, можно судить о действенности (англ. efficacy) лекарственного препарата (ЛП). Данный вид исследований чаще всего используют при проведении предрегистраци-онных интервенционных клинических исследований [1]. Однако, даже если данные, полученные в ходе качественно проведённого РКИ, валидны, это не гарантирует получения такого же результата у пациентов, не соответствующих субъектам, подобранным по строгим критериям для участия в исследовании. В связи с этим, существует всё больше запросов на получение информации об эффективности ЛП в условиях реальной клинической практики (англ. Real-World Data, RWD).
Одно из определений RWD — «данные, относящиеся к системе здравоохранения, которые собирают из различных источников вне рамок предре-гистрационных рандомизированных клинических исследований» [2].
После анализа таких данных получают доказательства реального мира (англ. Real-World Evidence, RWE), с получением данных об эффективности (англ. effectiveness) [3].
В медицинском сообществе сложилось мнение, что основным источником данных RWD являются наблюдательные исследования [2, 4]. Как классическое РКИ, так и наблюдательные исследования имеют ограничения в предоставлении данных о сравнительной эффективности ЛП.
Недавнее метаэпидемиологическое исследование показало, что после проведённого РКИ можно получить совершенно разные ответы на одни и те же клинические вопросы в результате рутинного сбора данных о состоянии здоровья, что, несмотря на трудности в устранении статистических погрешностей, может привести к переоценке эффекта лечения [5]. Также при проведении РКИ минусом является исследование ограниченных групп населения в строго подобранных и контролируемых условиях, оптимизированных для демонстрации действия ЛП [6].
В случае с наблюдательными исследованиями нельзя исключить наличие систематических ошибок ( англ. bias), особенно, касающихся несопоставимости между группами пациентов [5].
Необходимо отметить, что в настоящий момент огромное количество данных о состоянии здоровья пациентов хранится на компьютерах, мобильных устройствах и других гаджетах. Эти данные могли бы быть полезны, чтобы лучше спланировать проведение клинических исследований.
Многими экспертами в качестве дополнительного источника данных о RWD предлагается рассматривать прагматические клинические исследования (ПКИ, англ. pragmatic clinical trials), которые позволяют объединить преимущества наблюдательного исследования в реальной клинической практике с научной строгостью рандомизированного клинического исследования, и тем самым более точно ответить на вопросы реальной клинической практики.
Цель: анализ особенностей проведения прагматических клинических исследования.
Методология
Был проведён систематический анализ данных литературы в период с 1967 по 2019 гг. на предмет выявления информации, посвящённой ПКИ. В ходе проведения поискового анализа использовали следующие критерии включения и исключения.
Критерии включения: в анализ вошли публикации, в которых описывали исследования по эффективности, сравнительной эффективности (наблюдательные исследования, прагматические клинические исследования).
Критерии исключения: в анализ не вошли клинические исследования, посвящённые обсуждению действенности и сравнительной действенности.
Ключевые слова поиска: клинические исследования; прагматические клинические исследования; реальная клиническая практика; исследования сравнительной эффективности.
Результаты
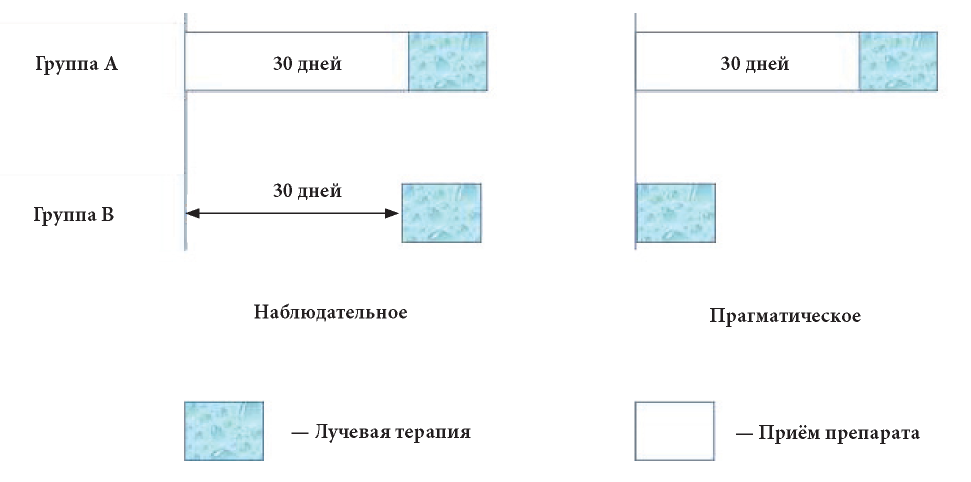
История. Впервые прагматические клинические исследования были предложены и описаны Schwartz D. и Lellouch J. в 1967 году [7]. В этой статье авторы представили два сценария испытаний по борьбе с раком, в которых исследовали лекарственный препарат, повышающий чувствительность к радиотерапии. Предположив, что ЛП следует вводить на протяжении 30 дней до радиотерапии, группы сравнения можно было сформировать двумя способами, которые представлены на рис. 1.
Рис. 1. Наблюдательный и прагматический подход в исследованиях [4]
Как видно из данных, представленных на рис. 1, чтобы при наблюдательном исследовании лучевая терапия проводилась в одно и то же время в каждой группе, в группе сравнения (Группа Б) лучевой терапии предшествует «пустой» период в 30 дней (приём препарата и другие вмешательства не осуществляются). Во втором случае (прагматическое исследование) лучевая терапия Группы Б могла быть начата одновременно с приёмом лекарственного препарата Группой А. Ни один из этих вариантов процедур нельзя было назвать «лучшим» по отношению к другому. Первый (наблюдательное исследование) позволял сравнивать две группы, которые похожи с точки зрения лучевой терапии и которые отличались только наличием или отсутствием ЛП. Была проведена оценка сенсибилизирующего действия лекарственного препарата. Вторая процедура (прагматическое исследование) позволила сравнить две процедуры в тех условиях, в которых они наиболее вероятно будут применяться на практике. Таким образом, это два абсолютно разных подхода к исследованию ЛП.
CONSORT. По мере роста количества клинических исследований также возросла необходимость обеспечения чёткого представления результатов. Для достижения этой цели были созданы Единые стандарты представления результатов исследований (англ. Consolidated Standards of Reporting Trials, CONSORT) и выпущен контрольный лист CONSORT, состоящий из 22 пунктов. В 2008 году было выпущено расширение заявления CONSORT для прагматических клинических исследований, которое не изменило основные пункты контрольного листа, однако внесло дополнения в 8 из них [8]. Расширения затронули такие пункты, как: исходные данные, участники исследования, вмешательства, результаты, размер выборки, ослепление, набор участников и обобщение результатов. Для каждого из восьми пунктов представлены стандартный текст CONSORT и дополнительные указания, пример хорошей отчётности по данному пункту и объяснение проблем. Важно отметить, что эти предложения следует рассматривать как дополнение к общим указаниям в основном пояснительном документе CONSORT и, при необходимости, к другим указаниям CONSORT. Эти расширения представлены вместе с иллюстративными примерами отчётности и объяснением каждого расширения.
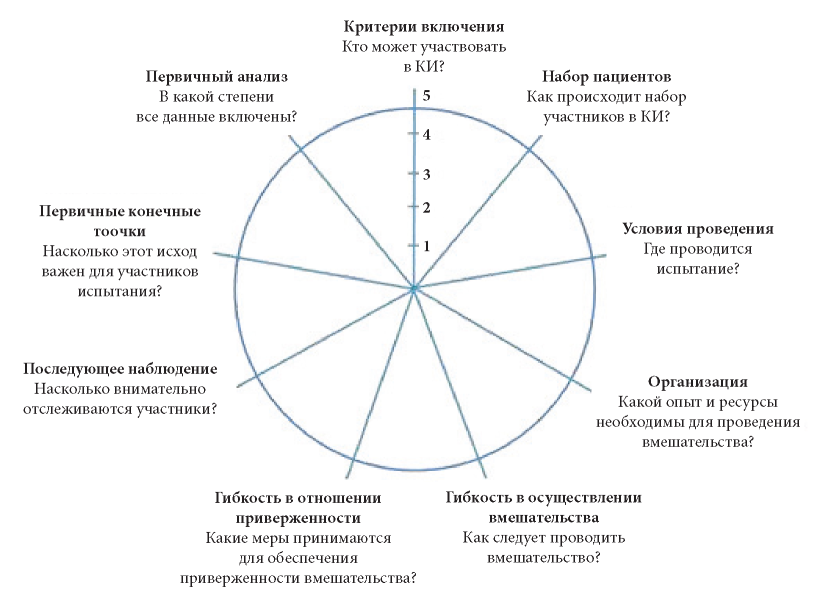
Колесо PRECIS-2. При планировании проведения исследования сравнительной эффективности существующей методологии или лекарственного препарата следует сделать выбор в пользу прагматического или наблюдательного подхода, поскольку они представляют собой две противоположные стороны одного континуума. С этой целью в 2005—2008 гг. команда из 25 международных экспертов и методистов разработала инструмент PRECIS ( англ. Pr agmatic- E xplanatory C ontinuum I ndicator S ummary) [9]. Далее первоначальная версия была усовершенствована, чтобы на этапе разработки исследований выбрать наиболее верный подход в соответствии с планируемой целью. Так, разработчиками было представлено «колесо» PRECIS-2 (рис. 2).
Рис. 2. Модель (колесо) PRECIS-2 [10]
Как видно из данных, представленных на рис. 2, представлен инструмент, который поможет выбрать наиболее соответствующий целям исследования подход. Модель (колесо) PRECIS-2 имеет 9 пунктов, каждый из которых оценивается по пятибалльной шкале, где 1 — «очень наблюдательные», идеальные условия, а 5 — «очень прагматичные условия», соответствующие реальной клинической практике. Целью «очень прагматичного» подхода в данном случае считается максимальное применение вмешательства для обычной помощи в реальной клинической практике и его эффективность, в то время как «очень наблюдательный» подход демонстрирует эффект вмешательства с помощью ожидаемого механизма, однако вопросу о том, будет ли этот результат достигнут в реальных условиях, уделяется минимальное внимание. К примеру, при выборе центра проведения исследования обычные стационары, осуществляющие рутинную медицинскую деятельность, будут соответствовать 5 баллам (прагматичный подход), в то время как специализированные для проведения исследований центры наберут 1 балл. Таким образом, используя это колесо решений, исследователям и клиницистам будет легче понять, соответствуют ли проектные решения их предполагаемому назначению.
Отличия в проведении ПКИ от классического РКИ. В табл. 1 суммированы и представлены основные отличия классического РКИ от прагматического.
Отличия классического рандомизированного клинического исследования от прагматического клинического исследования
Классическое рандомизированное клиническое исследование
Прагматическое клиническое исследование
По строгим критериям
В условиях реальной клинической практики
в проведении исследований
стандартная утверждённая форма
Возможно использовать упрощённую форму
о нежелательных реакциях
Стандартная форма отчётности
Различные источники, форма отчётности гибкая
При проведении ПКИ и РКИ есть существенные различия в методологии. В первую очередь, в ПКИ исследование осуществляется квалифицированными врачами, которые, однако, могут не иметь опыта в клинических исследованиях. При этом исследуется обширная группа пациентов, многие из которых не попали бы в РКИ в связи со строгими критериями включения. Таким образом, эти исследования могут помочь выяснить эффективность ЛП, например, у пожилых пациентов.
Несмотря на очевидные преимущества в получении реальных данных при проведении ПКИ, существуют определённые ограничения, которые необходимо разрешить.
Выбор центра исследования и протокола. Одним из серьёзных моментов при планировании ПКИ является выбор центра. Так, пациенты, которые регистрируются в одном центре, где планируется исследование, могут параллельно получать помощь и наблюдаться в других медицинских организациях, включая стационары, специализированные учреждения и амбулаторное звено. Это поднимает вопрос о необходимости качественного сбора всех соответствующих источников данных для получения полноценной информации о состоянии здоровья пациента [11]. При планировании ПКИ необходимым является участие гетерогенных центров, чтобы в исследовании приняли участие различные группы пациентов, и результаты были более представительны. Ещё одним важным вопросом до начала исследования является разработка протокола с учётом рутинной клинической практики, чтобы минимизировать вмешательства в ход рутинного лечебного процесса для наибольшей достоверности данных. Решить эту проблему можно путём привлечения врачей и персонала на ранней стадии разработки протокола [12].
Включение пациентов в исследование. Для включения пациента в классическое РКИ существуют строгие критерии отбора. Однако эти пациенты могут быть несопоставимы с пациентами из «реального мира», у которых присутствуют коморбидные патологии, тяжёлое течение заболевания, а также различные факторы риска [13]. С целью получения данных об эффекте исследуемого ЛП на более широкой популяции, в ПКИ используют более мягкие критерии включения. Количество критериев исключения желательно свести к минимуму. Однако, как и в других исследованиях, пациенты с абсолютными противопоказаниями не включаются в исследование. Традиционно возникают сложности с участием уязвимой группы населения. Однако принадлежность к таковой не должна являться критерием исключения. С учётом факта исследования уже зарегистрированного лекарственного препарата в ПКИ допускают участие таких пациентов с условием предоставления дополнительных мер защиты [14].
Уязвимые группы традиционно исключаются из предрегистрационных клинических исследований, поскольку они в меньшей степени способны защищать свои собственные интересы. Тем не менее, систематическое исключение из ПКИ препятствует нашему пониманию реальных преимуществ и вреда лекарственных препаратов, используемых этими группами.
Принадлежность к уязвимому населению сама по себе не должна быть критерием исключения из ПКИ, чтобы обеспечить равный доступ к знаниям, полученным в результате исследований. Предоставление этим группам возможности участвовать в ПКИ с помощью новых вмешательств даёт дополнительную выгоду от доступа к потенциально выгодному лечению. В настоящее время поощряется ответственное включение уязвимых лиц в ПКИ, если дополнительная защита обеспечивается там, где это считается необходимым, исходя из ожидаемых рисков, последствий и характеристик населения [14][15].
Рандомизация. Значительным отличием ПКИ от классического РКИ является и процедура рандомизации. Распределение пациентов в ПКИ осуществляется лечащим врачом (по возрастной группе, социальным признакам и так далее), а пациент обладает информацией о том, какой лекарственный препарат он принимает, или какое вмешательство осуществляется. Связанные с лечением процедуры исследования в ПКИ не должны менять рутинную медицинскую практику, поэтому решения о выборе дозировки ЛП, совместном вмешательстве и лечении нежелательных явлений оставляют на усмотрение лечащего врача [16, ][17]. Плацебо и другие методы ослепления пациентов и врачей для назначенной группы лечения, как правило, в ПКИ не используются, поскольку знание применяемого вмешательства, а также ожидания или изменения поведения, связанные с этими знаниями, являются частью эффекта лечения в реальной жизни. Кроме того, любые меры, принимаемые для содействия соблюдению режима лечения, должны отражать рутинную медицинскую практику [10][17].
Дизайн, где пациенты не имеют возможности выбрать предпочтительное вмешательство, часто рассматривается как барьер для участия в испытаниях [18], поэтому были предложены модификации процесса рандомизации. Одной из таких стал дизайн Зелена (предложен статистиком Высшей школы здравоохранения Гарварда Марвином Зеленом). В этой схеме пациенты рандомизируются либо в группу лечения, либо в контрольную группу прежде, чем дать информированное согласие. Поскольку группа, к которой относится данный пациент, известна, согласие может быть получено условно. Другим методом выступает кластерная рандомизация, предусматривающая назначение одинакового вмешательства определённой группе участников.
Информированное согласие. Одним из пунктов, ограничивающих участие пациента в ПКИ, является обширная и длительная процедура информированного согласия. При планировании таких исследований необходимо учитывать ограниченное количество визитов пациента в центр, что делает трудным проведение традиционной процедуры в условиях реальной медицинской практики. Также, в связи с ограниченным временем на приём пациента врачу представляется затруднительным длительное информирование пациента. Вышеперечисленное может привести к меньшему числу включённых пациентов в планируемое исследование, и менее репрезентативной выборке [19]. Учитывая это, был предложен ряд альтернатив для традиционного информированного согласия при проведении ПКИ, в которых сравниваются доказавшие свою действенность методы [20].
Интегрированное согласие. Модель предполагает обсуждение с пациентом предлагаемой терапии, существующих альтернатив, использование рандомизации, а также потенциальный вред и преимущества сравниваемого лечения [21]. Согласие пациента может быть получено устно или письменно. Врач документирует беседу и её результаты в электронную медицинскую карту (ЭМК).
Таргетированное согласие. Такая форма предлагается для сведения к минимуму вмешательства в реальную медицинскую практику при сравнении известных методов лечения [22]. Пациенту предлагается письменная форма согласия с указанием следующих данных: процедура и продолжительность исследования, инструкции по приёму ЛП, доступность исследуемого лечения для пациента вне рамок исследования, меры конфиденциальности, контактная информация и заявление об отказе от участия в исследовании в любое время без последствий. Разница с интегрированным согласием заключается в отсутствии информации о рандомизации [23].
Освещаемый подход. В этом случае используются общие уведомления, размещаемые на видных местах, информирующие пациентов о том, что они могут участвовать в сравнительных исследованиях эффективности со стандартными известными вмешательствами. Далее пациент сам может выразить желание об участии без явной процедуры письменного согласия, с учётом наличия минимальных рисков и информирования пациентов о возможном проведении в структуре здравоохранения интегрированных в практику исследований [24].
Отказ от согласия. В этом случае участники не проинформированы об исследовании и не принимают активного решения относительно участия. Теоретически такой вариант возможен для тех ПКИ, в которых все виды лечения, предлагаемые в исследовании, могут быть предложены за пределами испытания без специального информированного согласия, при этом лечение не связано с более чем минимальным дополнительным риском по сравнению с любой из альтернатив [25].
Отслеживание нежелательных лекарственных реакций. В ПКИ количество визитов пациента в центр и структурированный сбор данных сведены к минимуму, с целью минимизации вмешательства в рутинную медицинскую практику. Порядок отчётности о нежелательных явлениях (НЯ) и нежелательных лекарственных реакциях (НР) может оказать сильное вмешательство в этот процесс. В случае с прагматическими, порядок сбора отчётности может нарушаться, вследствие редкого посещения пациентов исследовательского центра. Также возникшая НР может привести к госпитализации пациента в другую клинику или обращению к другому специалисту, не связанному с исследовательским центром [26]. Поскольку в ПКИ задействованы врачи, которые могут не иметь опыта участия в исследованиях, у них может не быть опыта заполнения отчётности о НЯ, а также у них может быть недостаточная квалификация, чтобы связать возникновение НЯ с приёмом ЛП [27]. Решением в данном случае может стать применение ЭМК, однако данные системы должны быть валидированы для использования в исследовании [28]. Изменениям подвержен и традиционный подход к мониторингу клинического исследования. С учётом более широких критериев включения, число пациентов с рисками возрастает, однако частые визиты монитора нарушают рутинный медицинский процесс. Также мониторы могут не иметь полного доступа к ЭМК, что затруднит сбор данных. Вариантами решения данной проблемы может стать удалённый сбор данных, что избавит от необходимости регулярного посещения исследовательского центра [29]. Помимо этого, на этапе разработки протокола конкретного ПКИ требуется решить, какие данные и как часто будут необходимы для регулярной отчётности, а также каким образом обеспечить доступ к этим данным.
Преимущества и недостатки прагматических клинических исследований показаны в табл. 2.
Преимущества и недостатки прагматических клинических исследований
ОСТ 1.41724-90 Отраслевая система управления качеством продукции. Входной контроль комплектующих изделий. Порядок проведения
ОТРАСЛЕВАЯ СИСТЕМА УПРАВЛЕНИЯ КАЧЕСТВОМ ПРОДУКЦИИ
ВХОДНОЙ КОНТРОЛЬ КОМПЛЕКТУЮЩИХ ИЗДЕЛИЙ
ПОРЯДОК ПРОВЕДЕНИЯ
ОТРАСЛЕВАЯ СИСТЕМА УПРАВЛЕНИЯ
Дата введения 01.06.91 г.
2. ОРГАНИЗАЦИЯ ВХОДНОГО КОНТРОЛЯ ПКИ
3. ПОРЯДОК ПРОВЕДЕНИЯ ВХОДНОГО КОНТРОЛЯ ПКИ
4. ВЗАИМООТНОШЕНИЯ ПОДРАЗДЕЛЕНИЙ ВХОДНОГО КОНТРОЛЯ ПКИ С ЦЕХАМИ И СЛУЖБАМИ ПРЕДПРИЯТИЯ
5. ОФОРМЛЕНИЕ РЕЗУЛЬТАТОВ ВХОДНОГО КОНТРОЛЯ ПКИ
Приложение 1 ТРЕБОВАНИЯ К СКЛАДСКИМ ПОМЕЩЕНИЯМ И ПЛОЩАДКАМ ДЛЯ ХРАНЕНИЯ КОМПЛЕКТУЮЩИХ ИЗДЕЛИЙ
Приложение 2 ТРАНСПОНИРОВКА КОМПЛЕКТУЮЩИХ ИЗДЕЛИЙ
Приложение 3 ЖУРНАЛ УЧЕТА И ВЫДАЧИ ПКИ
Настоящий стандарт распространяется на покупные комплектующие изделия, изготавливаемые по государственным, отраслевым стандартам и техническим условиям.
Стандарт устанавливает основные положения по организации, проведению работ по входному контролю, взаимоотношению подразделений, осуществляющих входной контроль, с цехами и отделами на серийных предприятиях.
Стандарт разработан в соответствии с ГОСТ 24297., ГОСТ В 15.703., ОСТ 1.42093.
1. ОБЩИЕ ПОЛОЖЕНИЯ
1.1. Входной контроль покупных комплектующих изделий (ПКИ) проводится с целью предотвращения запуска в производство поступающих на предприятие комплектующих изделий, не соответствующих требованиям нормативно-технической документации (НТД)*, образцам-эталонам и договорам.
отбора ПКИ по параметрам, которые не установлены в НТД и договоре на поставку на эти изделия;
проверки пригодности ПКИ для их применения в режимах, отличных от указанных в НТД и договоре на поставку на эти изделия.
1.2. Входной контроль ПКИ осуществляется по параметрам (требованиям) и методам, установленным в НТД на контролируемую продукцию и в договорах на ее поставку.
1.3. Поставка продукции осуществляется по договорам, которые оформляются отделом внешней кооперации с поставщиками в соответствии с «Положением о поставках продукции производственно-технического назначения» и «Положением о поставках товаров народного потребления», утвержденными постановлением СМ СССР от 25 июля 1988 г. № 888.
Договор является основным документом, определяющим права и обязанности сторон по поставке всех видов продукции.
Номера и индексы НТД указываются в договоре.
1.4. Входной контроль ПКИ проводится в специально отведенном помещении (участке), оборудованном средствами контроля, испытаний и оргтехники, а также отвечающем требованиям к производственной среде, безопасности труда и санитарным нормам.
1.5. Рабочие места и персонал, осуществлявший входной контроль, должны быть аттестованы в установленном порядке.
1.6. Методики проверки ПКИ должны быть согласованы с предприятием-поставщиком* и представительством заказчика на поставщике и предприятии-потребителе**.
1.7. Потребитель устанавливает тесные рабочие контакты и систему обратной связи о каждым из поставщиков. Это обеспечивает выполнение программы по постоянному повышению качества продукции, позволяет избежать разногласий в вопросах качества или разрешать их в самый короткий срок, а также позволяет сократить объемы контроля.
2. ОРГАНИЗАЦИЯ ВХОДНОГО КОНТРОЛЯ ПКИ
2.1. Составление перечня ПКИ, подлежащих входному контролю
2.1.1. Необходимость введения и объем входного контроля определяет потребитель совместно с представительством заказчика (Государственной приемкой*).
2.1.2. Номенклатура ПКИ, контролируемые параметры (требования), вид и объем контроля определяется, исходя из стабильности качества продукции поставщиков, степени освоения новых видов продукции, отнесения к особо ответственным элементам конструкции, важности данного параметра (требования) для функционирования выпускаемой продукции и устанавливается в перечне ПКИ, подлежащих входному контролю.
2.1.3. Перечень ПКИ разрабатывают конструкторские службы предприятия-потребителя совместно с технологическим бюро (группой) подразделения входного контроля.
2.1.4. Перечень ПКИ, подлежащих входному контролю, должен содержать:
наименование, марку (чертежный номер) и тип (индекс) ПКИ;
обозначение НТД, требованиям которой должны соответствовать ПКИ (реквизиты договора на поставку);
контролируемые параметры (требования) или пункты НТД (договора, технических условий**, эксплуатационной и товарно-сопроводительной документации и т.д.), в которых они установлены;
* Государственная приемка устанавливается для товаров народного потребления и гражданской продукции
вид и объем контроля;
средства измерений, испытательное оборудование и их технические характеристики (при необходимости);
гарантийные сроки хранения и эксплуатации ПКИ;
указания о маркировке (клеймении) ПКИ по результатам входного контроля (если она предусмотрена в НТД);
допустимый расход ресурса при входном контроле (для изделий, имеющих ограниченный ресурс). Расход ресурса должен быть минимальным, что оговаривается в договоре.
1. Гарантийные сроки устанавливают в стандартах и ТУ; если в этих документах они не установлены, то они могут быть предусмотрены в договоре. Гарантийный срок на ПКИ считается равным гарантийному сроку на основное изделие и истекает одновременно с истечением гарантийного срока на это изделие, если иное не предусмотрено НТД на основное изделие.
2. При необходимости в перечень допускается включать требования или указания, отражающие особенности продукции.
Перечень утверждается главным инженером предприятия-потребителя, а также заместителем директора предприятия, (объединения) по качеству (начальником ОТК (УТК).
2.1.6. Перечни оформляются по формам 2 и 2а ГОСТ 2.104. Обозначения перечням присваивает отдел стандартизации.
Подлинники перечней сдаются в отдел технической документации для хранения и выдачи подразделениям.
2.1.7. Вид входного контроля (оплошной или выборочный) устанавливается потребителем и представителем заказчика. По мере накопления опыта изготовления и эксплуатации основного изделия вид входного контроля на те или иные ПКИ по согласованию с заместителем директора по качеству (начальником ОТК), отделом надежности и представительством заказчика может быть пересмотрен.
2.1.8. При входном контроле допускается проводить тренировки ПКИ в условиях и режимах, предусмотренных НТД, при этом в перечне ПКИ, подлежащих входному контролю, должны быть соответствующие указания (запись).
2.1.9. Перечень ПКИ, подлежащих входному контролю, ежегодно пересматривается в целях сокращения объема, изменения периодичности проведения или отмены входного контроля.
Решение по этим вопросам принимают составители перечня совместно с отделом надежности по согласованию с представительством заказчика (Госприемкой) на основе результатов входного контроля за предшествующий период (например, 3-5 лет) и результатов работы ПКИ в эксплуатации.
Пересмотренные перечни и их изменения оформляются в соответствии с п. 2.1.5. настоящего стандарта.
2.2. Входной контроль проводят подразделения входного контроля, входящие в состав службы технического контроля предприятия.
2.3. Входной контроль делится на:
входной контроль в состоянии поставки;
входной контроль основных технических параметров в установленном объеме.
2.4. Входной контроль ПКИ в состоянии поставки
2.4.1. Входной контроль ПКИ в состоянии поставки осуществляет бюро (группа) технического контроля (БТК, ГТК) внешней приемки отдела внешней кооперации (ОВК) (или складов материально-технического снабжения (ОМТС), находящихся в подчинении главного инженера.
2.4.2. Основной задачей БТК (ГТК) внешней приемки является оценка технического состояния ПКИ до проверки технических параметров в лабораториях (цехах) входного контроля.
2.4.3. БТК (ГТК) внешней приемки руководствуется в своей деятельности приказами заместителя директора предприятия по качеству (начальника ОТК), отраслевой и действующей на предприятии НТД, отраслевым Положением об ОТК.
2.4.4. Для проведения входного контроля на складах ОМТС и ОВК администрация выделяет и оборудует рабочие места контролеров, отвечающие установленным в НТД требованиям по входному контролю, соответственно оснащенные и соответствующие действующим санитарным нормам.
2.4.5. БТК (ГТК) внешней приемки выполняет следующие функции:
проверку наличия сопроводительной документации на ПКИ, удостоверяющей качество и комплектность изделий, и правильность ее оформления;
контроль изделий в состоянии поставки: сохранность тары и упаковки, наличие и целостность пломб ОТК и заказчика предприятия-поставщика на таре;
контроль соответствия комплектности изделий товарно-сопроводительной документации (паспорт, формуляр, этикетка, альбом электросхем и т.д.);
оформление установленной на предприятии документации на годные и забракованные ПКИ;
изоляцию и контроль за своевременной изоляцией забракованных изделий;
контроль соблюдения правил и сроков хранения ПКИ на складах и выдачи их в производство;
накопление статистических данных о фактическом уровне качества получаемых ПКИ и разработка на их основе предложений по его повышению;
составление плановых отчетов по результатам контроля;
участие в разработке стандартов предприятия и другой документации по входному контролю ПКИ (хранение, выдача и т.д.).
2.4.6. Структура и штаты БГК (ГТК) внешней приемки устанавливаются в зависимости от объема и характера производства заместителем директора по качеству (начальником ОТК).
2.4.7. Для изоляции забракованных на предприятии ПКИ в ОВК (ОМТС) организуется изолятор брака.
Хранение изделий в изоляторе брака должно осуществляться при соблюдении правил хранения, консервации, при температуре и в условиях, оговоренных в технической документации на эти изделия.
2.5. Входной контроль основных технических параметров.
2.5.1. Входной контроль основных технических параметров ПКИ осуществляют подразделения (цех, лаборатория) входного контроля, подчиненные заместителю директора по качеству (начальнику ОТК) или главному инженеру.
В зависимости от объема, сложности и номенклатуры ПКИ входной контроль может производиться на специально оборудованных участках цехов основного производства.
2.5.2. Для проведения контрольных испытаний и др. проверок, связанных с входным контролем, продукция может быть передана в другие подразделения предприятия (лаборатории, контрольно-испытательные станции и др.).
2.5.3. Подразделение входного контроля выполняет следующие функции:
входной контроль ПКИ в режимах и по методам испытаний, указанных в НТД на эти изделия, и в технической документации разработчика основного изделия;
установление характера или внешнего проявления неисправностей и отказов ПКИ;
проведение исследований, направленных на обеспечение надежности ПКИ;
участие в разработке средств объективного контроля;
систематический учет результатов проведения входного контроля ПКИ с доведением до поставщиков сведений о характере отказов для их устранения.
2.5.4. Основными структурными единицами подразделений входного контроля могут быть:
специализированные контрольно-измерительные лаборатории;
специальные конструкторские бюро (группы) для проектирования нестандартного оборудования для проведения входного контроля ПКИ;
специализированные лаборатории для проведения контрольных испытаний ПКИ;
участки ремонта и монтажа контрольно-измерительной аппаратуры и испытательных стендов;
2.5.5. Организационная структура подразделения входного контроля ПКИ может быть построена по принципу специализации по типам комплектующих изделий.
В зависимости от специфики ПКИ и объема контроля количество специализированных лабораторий и их наименования в подразделении входного контроля могут быть различны.
2.5.6. Контрольно-измерительные лаборатории подразделений входного контроля выполняет следующие функции:
контроль соответствия качества и комплектности ПКИ требованиям НТД поставщика и предприятия в условиях и режимах, максимально приближенных к условиям эксплуатации. Перечень агрегатов, подлежащих проверке в условиях, максимально приближенных к условиям эксплуатации, и виды воздействий на них представляет разработчик основного изделия;
установление характера или внешнего проявления неисправностей и отказов ПКИ, забракованных при входном контроле;
систематизацию и своевременную передачу результатов входного контроля ОТК, отделу (бюро) надежности;
состояние технической документации на забракованные ПКИ с указанием характера отказов и неисправностей (протоколы проверки, технические акты и др.);
участвует в разработке технической документации по входному контролю ПКИ;
участвует в исследованиях, направленных на обеспечение надежности ПКИ;
участвует в разработке мероприятий по повышению надежности изделий предприятия и предупреждению дефектов ПКИ, возникших в результате нарушения условий хранения, транспортировки и т.п.);
участвует в разработке средств объективного контроля.
2.5.7. В функции технологического бюро (группы) подразделения входного контроля (если таковые имеются на предприятии) входит:
участие в разработке перечня ПКИ, технологических процессов, методик и стандартов предприятия по входному контролю ПКИ;
участие в составлении технических заданий на проектирование средств объективного контроля;
внедрение совместно с лабораториями контрольно-измерительного и испытательного оборудования;
контроль за правильной эксплуатацией оборудования в подразделении;
контроль соблюдения техпроцесса входного контроля;
участие в разработке средств объективного контроля;
участие в установлении причин неисправностей и отказов ПКИ на входном контроле.
2.6. Методы контроля, метрологические средства и испытательное оборудование, применяемое при входном контроле.
2.6.1. Методы входного контроля должны обеспечивать:
изучение объективной информации о качестве ПКИ;
контроль ПКИ в условиях и режимах, максимально приближенных к эксплуатационным;
проверку системы в комплексе и на взаимовлияние, если они предусмотрены НТД;
максимальное использование автоматизированных и автоматических средств измерений.
2.6.2. Средства измерений и испытательное оборудование, используемое при входном контроле ПКИ, выбирают в соответствии с требованиями НТД на контролируемую продукцию и ГОСТ 8.002.
Если метрологические средства и методы контроля отличаются от указанных в НТД, то технические характеристики используемых средств и методы контроля согласовываются между потребителем и поставщиком, а также представительством заказчика (Госприемкой) у потребителя и поставщика.
2.6.3. При необходимости потребитель может проводить дополнительные проверки ПКИ по параметрам, не предусмотренным НТД. Объем и методы проверок (метрологические средства) дополнительных проверок согласовываются с поставщиком и представительством заказчика (Госприемкой) поставщика и потребителя.
2.6.4. Применяемые на входном контроле аппаратура и стенды по своей схеме должны воспроизводить условия проверок изделий в условиях, приближенных к условиям эксплуатации.
Для обеспечения этих условий и определения степени взаимовлияния систем и изделий в процессе работы в лабораториях контрольных испытаний, занимающихся входным контролем, создаются специальные места проверки, аналогичные размещению систем и ПКИ на основном изделии, выпускаемом на предприятии (наличие привода, мест крепления коммуникаций и т.д.).
2.6.5. Используемая на входном контроле испытательная аппаратура и стенды должны иметь аттестаты на средства измерений, выдаваемые метрологической службой потребителя и подвергаться периодическим поверкам (калибровкам).
3. ПОРЯДОК ПРОВЕДЕНИЯ ВХОДНОГО КОНТРОЛЯ ПКИ
3.1. К входному контролю допускаются ПКИ, указанные в перечне ( п. 2.1.4.) и принятые ОТК, представительством заказчика (Госприемкой) поставщика и поступившая с сопроводительной и пономерной документацией (паспорт, формуляр, этикетка, альбом электросхем и т.д.), оформленной в установленном порядке.
3.2. Входной контроль поступающих на предприятие ПКИ необходимо осуществлять согласно НТД, образцам-эталонам и действующему на предприятии технологическому процессу входного контроля, который разрабатывает подразделение входного контроля (техбюро, группа) на основе перечня и НТД на каждый тип ПКИ.
В технологическом процессе должны быть отражены:
объем и последовательность контроля;
средства измерений и испытательное оборудование;
нормы времени на проведение контроля;
порядок оформления и анализа результатов входного контроля;
формы документации, необходимой для проведения входного контроля.
3.3. Входной контроль электрорадиоизделий необходимо осуществлять в соответствии с «Положением о входном контроле электрорадиоизделий на предприятиях-изготовителях аппаратуры по заказам МО, о порядке предъявления и удовлетворения рекламаций на эти электрорадиоизделия», утвержденным министерствами и введенным в действие с 1 января 1990 года Государственной комиссией СМ СССР от 14 сентября 1989 г. КП-8/1989.
3.4. Порядок и сроки проведения входного контроля ПКИ устанавливаются в соответствии с «Инструкцией о порядке и приемки продукции производственно-технического назначения и товаров народного потребления по качеству», утвержденной постановлением Госарбитража при СМ СССР № П7 от 25 апреля 1966 г. с дополнениями и изменениями, утвержденными постановлением Госарбитража СССР от 14 ноября 1974 г. № 98 и определяются в производственных инструкциях, методиках, положениях и другой документации предприятия по входному контролю.
3.5. Контроль ПКИ в состоянии поставки
3.5.1. Работники складов хранения ОВК после распаковки тары и расконсервации ПКИ (при необходимости) предъявляют их работникам БТК внешней приемки с сопроводительной документацией и документацией, регистрирующей поступление ПКИ (приходный ордер, акт или другой принятый на предприятии документ).
1. Все ПКИ должны иметь заводские номера и сопроводительную документацию (на единицу изделия или на партию ПКИ).
3.5.2. При контроле сопроводительной документации работники БТК внешней приемки проверяют:
правильность оформления товарно-сопроводительной документации (паспорта, формуляра, этикетки, электросхем и т.д.);
соответствие документации данным изделиям (их наименование, шифры, наличие необходимых подписей, печатей и дат);
наличие заключения о пригодности изделия к эксплуатации с указанием гарантийных обязательств.
3.5.3. При осмотре ПКИ контролер БТК внешней приемки и проверяет:
состояние внутренней упаковки, наличие и целостность пломб предприятий-поставщиков, маркировок, внешний вид;
комплектность изделий и документации и соответствие номеров изделий номерам, указанным в паспортах и другой товарно-сопроводительной документации;
соответствие образцу-эталону (при необходимости);
целостность изделий, отсутствие внешних механических повреждений и посторонних предметов в местах, доступных для осмотра без вскрытия блоков и нарушения пломб;
отсутствие влаги, загрязнений и коррозии.
3.5.4. При положительных результатах осмотра контролер БТК внешней приемки, принявший ПКИ, делает отметку о проведении входного контроля во вкладыше паспорта (ставится гриф и дата проверки).
3.5.5. Забракованные ПКИ немедленно изолируются от годных (в изоляторах брака) и учитываются в установленном порядке.
Контролеры БТК внешней приемки оформляют рекламационные акты в соответствии с документацией, перечисленной в п. 5.4. настоящего стандарта, и сообщают в ОВК сведения о забраковании ПКИ для вызова представителя поставщика, ведут учет дефектов, обнаруженных в процессе внешней приемки ПКИ, и принятых по рекламациям мер.
3.5.6. После внешнего осмотра, контроля сопроводительной документации и устранения всех замечаний, если таковые имелись, работники ОВК передают ПКИ в соответствующее подразделение входного контроля (цех, лабораторию) для дальнейшего проведения контроля их качества по технологическому процессу.
3.5.7. Требования к складским помещениям и площадкам для хранения комплектующих изделий и их транспортировке изложены в справочных приложениях 1, 2.
3.6. Контроль ПКИ в лабораториях (цехах.) входного контроля*
3.6.1. ПКИ поступают в подразделение входного контроля после их контроля по внешнему виду с сопроводительной документацией комплектно, со всеми необходимыми для контроля штатными и технологическими принадлежностями, в упаковке поставщика и на специальных тележках.
Подготовку ПКИ перед отправкой на контроль осуществляют работники ОВК.
3.6.2. Ответственность за соблюдение правил транспортировки ПКИ и их своевременное возвращение на склады после проверки (перепроверки) несет ОВК.
Ответственность за своевременный контроль и сохранность ПКИ во время их нахождения в подразделении несет подразделение входного контроля.
3.6.3. Подразделение входного контроля ведет учет всех поступивших в подразделение ПКИ в установленном на предприятии порядке (например, в журнале учета и выдачи ПКИ, см. приложение 3 спр.).
3.6.5. Подразделение (лаборатория, контрольно-испытательная станция и др.), получившее ПКИ на испытания, проводит их в установленные сроки с выдачей подразделению входного контроля заключения о соответствии испытанных ПКИ установленным требованиям.
Результаты испытаний вместе с проверенной продукцией передаются в производство.
3.6.6. Подразделения входного контроля проводят регламентные работы и тренировки ПКИ в объеме работ, оговоренных в техдокументации поставщика, с оформлением паспортов и вкладышей.
3.6.7. При соответствии ПКИ установленным требованиям работники подразделения входного контроля принимают решения о передаче их в производство и направляют на склад ОВК для хранения (и выдачи в цехи-потребители) или непосредственно в производство.
Работники склада ОВК организуют учет возвращенных годных и забракованных ПКИ.
3.7. Продукция, поступившая от поставщика до проведения входного контроля, хранится в ОВК отдельно от принятой и забракованной на входном контроле.
3.8. Порядок выдачи ПКИ в производство
3.8.1. Принятые по результатам входного контроля ПКИ передаются в цехи-потребители с соответствующей отметкой в учетных и сопроводительных документах.
Допускается маркировка (клеймение) принятой продукции (что оговаривается в договоре на поставку и техпроцессе).
3.8.2. Выдача ПКИ в производство осуществляется по установленной на предприятии документации (например, лимитные карты, разовые требования и др., которые выписываются цехами-потребителями в соответствии с установленным планом).
3.8.3. ПКИ выдаются в цехи-потребители с запасом гарантийного срока складского хранения, который должен соответствовать (или быть больше) периоду времени технической обработки (сборка и испытание) основного изделия на предприятии.
1. Сроки складского хранения исчисляются со дня приемки изделия заказчиком на предприятии-поставщике.
2. Для ПКИ, у которых в паспортах не указан срок хранения на складах, сроком складского хранения следует считать общий гарантийный срок изделий без учета гарантийного срока на основное изделие.
3. Для ПКИ, не имеющих паспортов (в которых указан год выпуска изделия), год складского хранения следует отсчитывать с 1 июля года выпуска, обозначенного на корпусе изделия.
3.9. Изоляция забракованной продукции
3.9.1. Забракованные при входном контроле ПКИ маркируются «Брак» и направляются в изолятор брака.
3.9.2. Хранение ПКИ в изоляторе брака должно осуществляться с соблюдением правил хранения, консервации в условиях, оговоренных в технической документации на эти изделия.
4. ВЗАИМООТНОШЕНИЯ ПОДРАЗДЕЛЕНИЙ ВХОДНОГО КОНТРОЛЯ ПКИ С ЦЕХАМИ И СЛУЖБАМИ ПРЕДПРИЯТИЯ
4.1. В связи с введением Закона о госпредприятии состав подразделений, осуществляющих входной контроль ПКИ, и порядок их взаимодействия о цехами и отделами определяется в стандартах предприятий.
4.2. При разработке данных стандартов рекомендуется установить порядок и процедуры взаимодействия:
БТК внешней приемки (БТК ВП) с отделом внешней кооперации;
БТК ВП с подразделениями (лабораториями, цехами) входного контроля;
БТК ВП с БТК цехов-потребителей комплектующих изделий;
лабораторий, цехов входного контроля с отделами и цехами предприятия (отделами: главного технолога, метролога, технического контроля, надежности и др.);
подразделений, осуществляющих входной контроль, с представительством заказчика на предприятии.
5. ОФОРМЛЕНИЕ РЕЗУЛЬТАТОВ ВХОДНОГО КОНТРОЛЯ ПКИ
5.1. По результатам входного контроля ПКИ составляется заключение о соответствии продукции установленным требованиям и заполняется журнал учета результатов входного контроля (см. рекомендуемое приложение 1 ГОСТ 24297-87).
5.2. В сопроводительных документах на ПКИ делается, отметка о проведении и входного контроля и его результатах, продукция маркируется (клеймится), если это предусмотрено в перечне ПКИ, подлежащих входному контролю, и техпроцессе.
5.3. При соответствии продукции установлениям требованиям подразделение входного контроля передает ее в цехи потребители.
5.4. При выявлении в процессе входного контроля несоответствия установленным требованиям продукцию бракуют и возвращают поставщику с предъявлением рекламации (оформляется рекламационный акт) в соответствии с порядком и в сроки, предусмотренные следующими документами:
инструкциями о порядке приемки продукции производственно-технического назначения и товаров народного потребления по количеству и по качеству, утвержденными постановлениями Госарбитража при СМ СССР от 15 июня 1965 г. № П6 и от 25 апреля 1966 г. № П7 с дополнениями и изменениями, утвержденными постановлением Госарбитража СССР от 14 ноября 1974 г. № 98;
положениями о поставках продукции производственно-технического назначения и товаров народного потребления, утвержденных постановлением СМ СССР от 25 июля 1988 г. № 888;
ОСТ 1.42093. «Порядок взаимоотношений между предприятиями отрасли при предъявлении претензий по качеству комплектующих изделий».
5.5. На основании перечисленных в п. 5.4. документов потребитель разрабатывает производственную инструкцию (или стандарт предприятия) о порядке оформления рекламационных документов и движения забракованных ПКИ с указанием исполнителей и сроков работ по рекламациям.
5.6. При неоднократном получении некачественной продукции или получении ее в крупных размерах потребитель сообщает об этом в территориальный орган Прокуратуры СССР по месту нахождения поставщика.
5.7. По результатам входного контроля потребитель в необходимых случаях информирует о несоответствии продукции установленным требованиям министерство поставщика, представительство заказчика (Госприемку) на предприятии-поставщике для принятия мер в соответствии с возложенными на них функциями (см. приложение 3 ГОСТ 24297-87).
Приложение 1
ТРЕБОВАНИЯ К СКЛАДСКИМ ПОМЕЩЕНИЯМ И ПЛОЩАДКАМ ДЛЯ ХРАНЕНИЯ КОМПЛЕКТУЮЩИХ ИЗДЕЛИЙ
1. Складское помещение, предназначенное для хранения комплектующих изделий, должно быть отапливаемым, вентилируемым, оборудовано специальными стеллажами для хранения комплектующих изделий, приборами для контроля температуры и влажности воздуха.
3. Приборы для измерения температуры и влажности воздуха (термометры и психрометры) могут быть стационарными или переносными и должны устанавливаться на уровне 1,5 м от пола и не ближе 2 м от дверей, вентиляционных отверстий и отопительных устройств.
4. Складские помещения должны быть оборудованы специальными стеллажами, шкафами и настилами, изготовленными из металла, дерева или его заменителей.
4.1. Размещение стеллажей и шкафов на складах производится с учетом обеспечения максимального удобства в работе, освещенности и использования площадей.
4.2. Стеллажи и шкафы должны быть окрашены атмосфероустойчивой огнезащитной краской и содержаться в чистоте.
4.3. Стеллажи должны быть закрыты устройствами для предохранения изделий, хранящихся на них, от пыли и прямого солнечного облучения.
Допускается хранение изделий в стеллажах без защитных устройств, если упаковка предприятия-поставщика предохраняет их от попадания пыли.
4.4. Стеллажи для хранения комплектующих изделий располагаются на расстоянии не менее 0,5 м от отопительных приборов.
4.5. На нижнем стеллаже должна быть указана предельная нагрузка. Нижние полки стеллажей, шкафов и настилов должны располагаться на высоте не менее 15 см от пола.
5. Допускается укладка комплектующих изделий одно на другое под контролем БТК, исключая их повреждения, в упаковке поставщика (если это оговорено в НТД на изделия).
6. В холодный период времени (при температуре внешней среды 0 °С и ниже) вскрытие тары необходимо производить не ранее, чем через 5 часов после внесения их в теплое помещение.
7. Кислородное оборудование и приборы должны храниться в отдельном помещении склада, исключающем возможность загрязнения их в процессе хранения жировыми веществами.
8. Запрещается на одних и тех же складах хранить годные и списанные или неприменяемые в производстве изделия.
Допускается на складах ОВК хранить изделия, применяемые в цехах вспомогательного производства.
9. Допускается хранение отдельных упакованных комплектующих изделий на открытых площадках (если такие условия оговорены в НТД поставщика).
10. Складские помещения должны содержаться в чистоте и полной технической исправности:
стены и кровля должны быть плотными, полы исправными и своевременно ремонтироваться;
двери и окна плотно закрываться.
11. Освещенность рабочего места, где производится приемка комплектующих изделий, должна быть не менее 200 лк.
12. Уборку складских помещений рекомендуется проводить не реже одного раза в день.
13. БТК (группа) внешней приемки ОВК ежедневно контролирует условия хранения комплектующих изделий на складах с отметкой в соответствующем журнале.
Приложение 2
ТРАНСПОНИРОВКА КОМПЛЕКТУЮЩИХ ИЗДЕЛИЙ
1. Для организации транспортировки комплектующих изделий в транспортном цехе, отделе внешней кооперации (снабжения) и в цехах-потребителях назначаются материально ответственные лица.
2. К погрузке, разгрузке и транспортировке комплектующих изделий допускаются лица, прошедшие специальный инструктаж.
Инструктаж должен проводиться не реже одного раза в год в установленном порядке.
3. Внутризаводская транспортировка комплектующих изделий должна производиться на специально выделенных для этой цели автомашинах, электрокарах или тележках в таре предприятия-поставщика без изъятия из тары амортизационных кронштейнов, прокладок и хлорвиниловой упаковки.
3.1. В случае невозможности использования тары поставщика допускается транспортировка отдельных комплектующих изделий в технологической транспортировочной таре, изготовленной на предприятия, при условии обеспечения сохранности изделий при транспортировке.
Номенклатура комплектующих изделий, для которых применяется технологическая транспортировочная тара, устанавливается отделом внешней кооперации и цехами-потребителями и согласовывается с отделом главного конструктора и представительством заказчика (Госприемкой). Изготовление чертежей на данную тару производится в установленном порядке.
4. При погрузке, разгрузке и транспортировке комплектующих изделий нельзя подвергать изделия ударам, толчкам и т.п. из-за возможности забракования изделий по вине предприятия-потребителя.
5. Транспортировочные средства должны исключать возможность механических повреждений комплектующих изделий и попадания в них атмосферных осадков или других загрязнений.
7. Скорость движения транспорта по территории завода не должна превышать 5 км/час.