к чему относится ацетон
Ацетон
| Ацетон | |
 | |
 | |
| Общие | |
|---|---|
| Традиционные названия | ацето́н, пропан-2-он |
| Химическая формула | C3H6O |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветная жидкость |
| Молярная масса | 58,08 г/моль |
| Плотность | 0,7899 г/см³ |
| Термические свойства | |
| Температура плавления | −95 °C |
| Температура кипения | 56,1 °C |
| Температура вспышки | −19 °C |
| Оптические свойства | |
| Показатель преломления | 1,3588 |
| Классификация | |
| Рег. номер CAS | 67-64-1 |
| Безопасность | |
| ЛД50 | 1159 мг/кг |
| Токсичность | малотоксичен |
Ацето́н (диметилкето́н, систематическое наименование: пропан-2-о́н) — простейший представитель кетонов. Формула: CH3-C(O)-CH3. Бесцветная легкоподвижная летучая жидкость с характерным запахом. Полностью смешивается с водой и большинством органических растворителей. Ацетон хорошо растворяет многие органические вещества (ацетилцеллюлозу и нитроцеллюлозу, воск, резину и др.), а также ряд солей (хлорид кальция, иодид калия). Является одним из метаболитов, производимых человеческим организмом.
Содержание
Получение
Мировое производство ацетона составляет более 6,9 миллионов тонн в год (по данным на 2012 г. [1] ) и устойчиво растёт. [1]
В промышленности
В промышленности получается напрямую или косвенно из пропена.
Основную часть ацетона получают как сопродукт при получении фенола из бензола по кумольному способу, заключающемуся в следующих трёх этапах: [2]
Прямым окислением пропена в жидкой фазе в присутствии PdCl2 в среде растворов солей Pd, Cu, Fe при температуре 50-120 °C и давлении 50-100 атм:
Химические свойства
Ацетон является одним из наиболее реакционноспособных кетонов. Так, он один из немногих кетонов образует бисульфитное соединение
Вступает в альдольную самоконденсацию под действием щелочей, с образованием диацетонового спирта.
При пиролизе (700 °C) образует кетен.
Легко присоединяет циановодород с образованием ацетонциангидрина.
Атомы водорода в ацетоне легко замещаются на галогены. Под действием хлора (иода) в присутствии щёлочи образует хлороформ (йодоформ).
Ацетон, как и другие кетоны, в щелочной среде способен изомерироваться в пропаналь, последний — до пропенового спирта. В кислой среде и в присутствии ионов двухвалентной ртути, пропеновый спирт изомерируется сразу в ацетон. Между этими веществами всегда существует таутомерное равновесие:
Биохимия
В крови в норме содержится 1-2 мг/100 мл ацетона, в суточном количестве мочи — 0,01-0,03 г. При нарушениях обмена веществ, например, при сахарном диабете, в моче и крови повышается содержание ацетона. Незначительная часть ацетона превращается в оксид углерода (IV), который выделяется с выдыхаемым воздухом. Некоторое количество ацетона выделяется из организма в неизменном виде с выдыхаемым воздухом и через кожу, а некоторое — с мочой.
Применение
Ацетон применяется как сырьё для синтеза многих важных химических продуктов, таких как уксусный ангидрид, кетен, диацетоновый спирт, окись мезитила, метилизобутилкетон, метилметакрилат, дифенилпропан, изофорон, бисфенол А и др.; пример:
Последний широко применяется при синтезе поликарбонатов, полиуретанов и эпоксидных смол.
Ацетон также является популярным растворителем, значительно превосходящим в плане безопасности бензин, скипидар и отчасти керосин. В частности как растворитель используется он:
Без ацетона невозможно хранить в компактном (сжиженном и в баллоне) состоянии ацетилен, который не может храниться под давлением в чистом виде из-за опасности взрыва. Для этого используют ёмкости с пористым материалом, пропитанные ацетоном. 1 литр ацетона растворяет до 250 литров ацетилена.
Лабораторное применение
В органической химии ацетон применяется в качестве полярного апротонного растворителя, в частности в реакции алкилирования
ArOH + RHal + K2CO3 → ArOR + KHal + KHCO3,
для окисления спиртов в присутствии алкоголятов алюминия по Оппенауэру
Также незаменим для приготовления охлаждающих бань в смеси с «сухим льдом» и жидким аммиаком (охлаждает до температуры −78 °C).
Очень полезен для мытья химической посуды, благодаря низкой цене, малой токсичности, высокой летучести и лёгкой растворимости в воде, а также для быстрой сушки посуды и неорганических веществ.
Для очистки в лабораторных условиях ацетон перегоняют в присутствии небольшого количества перманганата калия (до слабо-розовой окраски раствора).
Безопасность
Пожароопасность =
Одна из основных опасностей при работе с ацетоном — его легковоспламеняемость. Температура воспламенения +465 °C, температура замерзания
+ −20 °C. Воздушные смеси, содержащие от 2,5 % до 12,8 % (по объёму) взрывоопасны. С этим необходимо считаться, так как ацетон быстро испаряется, и образующееся облако может распространиться до места воспламенения (нагрев или искра) вдали от места работы с ним.
Токсичность
Ацетон при высоких концентрациях (при более чем кратковременном воздействии) раздражает органы дыхания и вызывает жжение в глазах, при более длительном воздействии происходит кратковременный глазной отёк. Вероятно, способен вызывать головокружение, тошноту и дезориентацию при воздействии паров высоких концентраций.
Экология
Из-за высокой летучести, значительная часть ацетона испаряется в атмосферу, где период полураспада под действием ультрафиолета составляет 22 дня. ЛД50 для рыб 8,3 г/л в течение 96 часов, а период полураспада в данной среде от 1 до 10 суток. Ацетон может вызывать значительное понижение уровня кислорода в воде из-за потребления его микроорганизмами. [источник не указан 64 дня]
Однако ацетон в небольших концентрациях, быстро поглощается рядом бактерий, использующих его в качестве питательной среды.
Примечания
Ссылки
Ланостерол · Зимостерол · 7-Дегидродесмостерол · Десмостерол · Холестерин
| Кортикостероиды (C-21-прегнаны) |
| ||||
| Половые гормоны |
|
| Фитостеролы | Стигмастерол · Брассикастерол |
| Эргостеролы | Эргостерол · Эргокальциферол |
| Экдизоны | α-экдизон · β-экдизон |
Полезное
Смотреть что такое «Ацетон» в других словарях:
АЦЕТОН — (уксусный спирт) органическое соединение, получаемое при сухой перегонке уксусно кислых солей; бесцветная жидкость с сильным запахом; уд. в. 0,79. Словарь иностранных слов, вошедших в состав русского языка. Павленков Ф., 1907. АЦЕТОН уксусный… … Словарь иностранных слов русского языка
АЦЕТОН — (от латинского «ацетум» уксус) органический растворитель, бесцветная горючая жидкость с резким запахом. В быту применяется для удаления пятен от смол, жиров, масел, масляной краски, нитролака, в том числе лака для ногтей, и т. д. Так как ацетон… … Краткая энциклопедия домашнего хозяйства
ацетон — а, м. acétone f. <лат. acetum уксус. хим. Бесцветная горючая жидкость с резким запахом, используемая обычно как растворитель органических веществ. БАС 2. Ацетон и цетон. обл. Замарала <платье>. Дай цетон. ПССГ. Лекс. Энц. сл. 1862:… … Исторический словарь галлицизмов русского языка
АЦЕТОН — АЦЕТОН, CH3 CO CH3 (диметилкетон), бесцветная, воспламеняющаяся жидкость с удельным весом 0,79 при 18°, с приятным запахом, жгучего вкуса. Кипит при 56,5°, легко растворяется в воде, в алкоголе и эфире. Ацетон получается 1) при сухой… … Большая медицинская энциклопедия
Ацетон — Ацетон, СН3СОСН3 – простейший кетон, прозрачная горючая жидкость с характерным запахом. При 20 С растворяет в одном объёме до 24 объемов ацетилена. Ацетон применяют в сварочной технике как растворитель ацетилена, в лабораторной практике как … Энциклопедия терминов, определений и пояснений строительных материалов
АЦЕТОН — (диметилкетон, пропанон), бесцветная, легковоспламеняющаяся жидкость (СН3СОСН3), получаемая путем окисления изопропанола (изопропилового спирта). Является сырьем для многих важных химических веществ, а также широко используется как растворитель.… … Научно-технический энциклопедический словарь
АЦЕТОН — АЦЕТОН, а, муж. Бесцветная горючая жидкость, употребляемая в технике и медицине, а также как растворитель. | прил. ацетоновый, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
ацетон — сущ., кол во синонимов: 2 • пропанон (1) • растворитель (67) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
Ацетон — Ацетон, диметилкетон органическое соединение, образующееся присухой перегонке уксуснокислых солей, а также, на ряду с прочимипродуктами, при сухой перегонке дерева и многих других органическихвеществ. В крайне ничтожных количествах А. найден в… … Энциклопедия Брокгауза и Ефрона
Ацетон
| Ацетон | |
|---|---|
 | |
 | |
| Систематическое наименование | пропан-2-он |
| Традиционные названия | ацетон, диметилкетон |
| Хим. формула | C3H6O |
| Рац. формула | CH3—C(O)—CH3 |
| Состояние | жидкость |
| Молярная масса | 58,08 г/моль |
| Плотность | 0,7899 г/см³ |
| Энергия ионизации | 9,69 ± 0,01 эВ |
| Т. плав. | −95 °C |
| Т. кип. | 56,1 °C |
| Т. всп. | −20 °C |
| Т. свспл. | 465 ± 1 градус Цельсия |
| Пр. взрв. | 2,5 ± 0,1 об.% |
| Кр. точка | 235,5°C; 4.7МПа |
| Энтальпия образования | −216,5 кДж/моль |
| Энтальпия плавления | 5,69 кДж/моль |
| Давление пара | 180 ± 1 мм рт.ст. |
| pKa | 19,16 ± 0,04 |
| Показатель преломления | 1,3588 |
| ГОСТ | ГОСТ 2603-79 ГОСТ 2768-84 |
| Рег. номер CAS | 67-64-1 |
| PubChem | 180 |
| Рег. номер EINECS | 200-662-2 |
| SMILES | |
| RTECS | AL3150000 |
| ChEBI | 15347 и 40571 |
| Номер ООН | 1090 |
| ChemSpider | 175 |
| ЛД50 | 1159 мг/кг |
| Токсичность | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
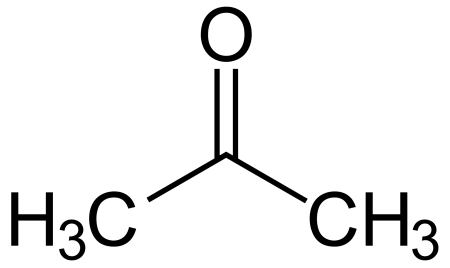
Ацетон (диметилкетон, пропанон-2) — органическое вещество, имеющее формулу CH3—C(O)—CH3 (C3H6O), простейший представитель насыщенных кетонов.
Своё название ацетон получил от лат. acetum — уксус. Это связано с тем, что ранее ацетон получали из ацетатов, а из самого ацетона получали синтетическую ледяную уксусную кислоту. В 1848 году немецкий профессор медицины и химии Леопольд Гмелин ввёл термин в официальное употребление, использовав старое немецкое слово Aketon (кетон, ацетон), которое также берёт корни от латинского acetum.
Содержание
Открытие
Один из простейших и в то же время важнейших из кетонов — ацетон — впервые выявлен в 1595 году немецким химиком Андреасом Либавием в процессе сухой перегонки ацетата свинца. Однако точно определить его природу и химический состав удалось только в 1832 году Жану-Батисту Дюма и Юстусу фон Либиху. До 1914 года ацетон получали практически исключительно коксованием древесины, однако повышенный спрос на него в годы Первой мировой войны очень быстро стимулировал создание новых методов производства.
Физические свойства
Ацетон — бесцветная подвижная летучая жидкость (при н.у.) с характерным резким запахом. Во всех соотношениях смешивается с водой, диэтиловым эфиром, бензолом, метанолом, этанолом, многими сложными эфирами и так далее.
Основные термодинамические свойства ацетона:
Ацетон хорошо растворяет многие органические вещества, в частности, ацетил- и нитроцеллюлозы, воски, алкалоиды и так далее, а также ряд солей.
Ацетон образуется при ацетоновом (ацетон-бутиловом) брожении углеводов, вызываемом Clostridium acetobutylicus. В результате образуется ацетон и бутанол-1, а также ряд побочных примесей. В качестве промышленного такой метод получения ацетона был популярен в XIX — начале XX вв., но был вытеснен технологиями химического синтеза.
Химические свойства
Ацетон является одним из наиболее реакционноспособных кетонов. Так, он один из немногих кетонов образует бисульфитное соединение:
Под действием щелочей вступает в альдольную самоконденсацию, с образованием диацетонового спирта:
Восстанавливается цинком до пинакона:
При пиролизе (700 °C) образует кетен:
Легко присоединяет циановодород с образованием ацетонциангидрина:
Атомы водорода в ацетоне легко замещаются на галогены. Под действием хлора (иода) в присутствии щёлочи образует хлороформ (йодоформ).
Hal2 + 2NaOH ⟶ NaHal + NaOHal + H2O
Качественной реакцией на диметилкетон есть наличие интенсивно-красной окраски с нитропруссидом натрия в щелочной среде. При добавлении CH3COOH окраска переходит в красно-фиолетовую.
Получение
Мировое производство ацетона составляет более 6,9 миллионов тонн в год (по данным на 2012 г.) и устойчиво растёт.
В промышленности получается напрямую или косвенно из пропена.
Основную часть ацетона получают как сопродукт при получении фенола из бензола по кумольному способу. Процесс протекает в 3 стадии.
На первой стадии бензол алкилируется пропеном с получением кумола, на второй и третьей (реакция Удриса — Сергеева) полученный кумол окисляется кислородом воздуха до гидропероксида, который при действии серной кислоты разлагается на фенол и ацетон:
По данному методу изопропанол окисляют в паровой фазе при температурах 450—650 °C на катализаторе (металлические медь, серебро, никель, платина). Ацетон с высоким выходом (до 90 %) получают на катализаторе «серебро на пемзе» или на серебряной сетке:
Ацетон получают также прямым окислением пропена в жидкой фазе в присутствии PdCl2 в среде растворов солей Pd, Cu, Fe при температуре 50-120 °C и давлении 50-100 атм:
Некоторое значение имеет метод брожения крахмала под действием бактерий Clostridium acetobutylicum с образованием ацетона и бутанола. Метод характеризуется малыми выходами. Используются также методы получения из изопропилового спирта и ацетилена.
Применение
Ацетон применяется как сырьё для синтеза многих важных химических продуктов, таких как уксусный ангидрид, кетен, диацетоновый спирт, окись мезитила, метилизобутилкетон, метилметакрилат, дифенилпропан, изофорон, бисфенол А и так далее; пример:
Последний широко применяется при синтезе поликарбонатов, полиуретанов и эпоксидных смол.
Ацетон также является популярным растворителем. В частности он используется как растворитель
Без ацетона невозможно хранить в компактном (сжиженном и в баллоне) состоянии ацетилен, который под давлением в чистом виде крайне взрывоопасен. Для этого используют ёмкости с пористым материалом, пропитанным ацетоном. 1 литр ацетона растворяет до 250 литров ацетилена.
Ацетон используется также при экстракции многих растительных веществ.
Ацетон служит также сырьём для синтеза уксусного ангидрида, кетена, диацетонового спирта и многих других соединений.
Лабораторное применение
В органической химии ацетон применяется в качестве полярного апротонного растворителя, в частности, в реакции алкилирования
для окисления спиртов в присутствии алкоголятов алюминия по Оппенауэру
Ацетон применяется для приготовления охлаждающих бань в смеси с «сухим льдом» и жидким аммиаком (охлаждает до температуры −78 °C).
В лабораториях используется для мытья химической посуды благодаря низкой цене, малой токсичности, высокой летучести и лёгкой растворимости в воде, а также для быстрой сушки посуды и неорганических веществ.
Для очистки в лабораторных условиях ацетон перегоняют в присутствии небольшого количества перманганата калия (до слабо-розовой окраски раствора).
Обнаружение
В химико-токсикологическом анализе для обнаружения ацетона применяют реакции с растворами йода, нитропруссида натрия, фурфурола, ο-нитробензальдегида и метод микродиффузии.
Реакция на образование йодоформа.
При взаимодействии ацетона с раствором йода в щелочной среде образуется трииодметан (йодоформ):
К 1 мл исследуемого раствора прибавляют 1 мл 10%-го раствора аммиака и несколько капель раствора йода в йодиде калия (йодной настойки). В присутствии йода образуется желтый осадок трииодметана с характерным запахом, а его кристаллы имеют характерную гексалучевую форму. Предел обнаружения — 0,1 мг ацетона в пробе.
Реакция с нитропруссидом натрия (проба Легаля).
Ацетон с нитропруссидом натрия в щелочной среде дает интенсивно-красную окраску. При подкислении уксусной кислотой окраска переходит в красно-фиолетовую. Кетоны, в молекулах которых отсутствуют метильные группы, непосредственно связанные с кетоновыми (СО—) группами, не дают такой реакции. Соответственно такие кетоны как метилэтилкетон, метилпропилкетон и другие — также дадут красную окраску с нитропруссидом.
К 1 мл исследуемого раствора прибавляют 1 мл 10%-го раствора гидроксида натрия и 5 капель 1%-го свежеприготовленного раствора нитропруссида натрия. При наличии ацетона в пробе появляется красная или оранжево-красная окраска. При прибавлении 10%-го раствора уксусной кислоты до кислой реакции через несколько минут окраска переходит в красно-фиолетовую или вишнёво-красную. Следует заметить, что бутанон дает аналогичную окраску с нитропруссидом натрия.
Пожароопасность
Одна из основных опасностей при работе с ацетоном — его легковоспламеняемость. Температура самовоспламенения +465 °C, температура вспышки −20 °C. Воздушные смеси, содержащие от 2,5 % до 12,8 % (по объёму), взрывоопасны. С этим необходимо считаться, так как ацетон быстро испаряется, и образующееся облако может распространиться до места воспламенения (нагрев или искра) вдали от места работы с ним.
Метаболизм и токсикология
Ацетон является естественным метаболитом, производимым организмами млекопитающих, в том числе и человеческим организмом. Некоторое количество вещества выводится с выдыхаемым воздухом и выделениями кожи, некоторое — с мочой. В медицине ацетон относят к кетоновым телам. Нарушение нормального метаболизма, например, при сахарном диабете, приводит к так называемой ацетонурии — избыточному образованию и выведению ацетона.
В крови в норме содержится 1-2 мг/100 мл ацетона, в суточном количестве мочи — 0,01-0,03 г. При нарушениях обмена веществ, например, при сахарном диабете, в моче и крови повышается содержание ацетона. Незначительная часть ацетона превращается в оксид углерода (IV), который выделяется с выдыхаемым воздухом. Некоторое количество ацетона выделяется из организма в неизменном виде с выдыхаемым воздухом и через кожу, а некоторое — с мочой.
Ацетон ядовит, но относится к малоопасным веществам (класс опасности IV, категория безопасности для здоровья по NFPA — 1). Сильно раздражает слизистые оболочки: длительное вдыхание больших концентраций паров приводит к возникновению воспаления слизистых оболочек, отёку лёгких и токсической пневмонии. Пары оказывают слабое наркотическое действие, сопровождаемое, чаще всего, дисфорией. При попадании внутрь вызывает состояние опьянения, сопровождаемое слабостью и головокружением, нередко — болями в животе; в существенных количествах возникает выраженная интоксикация, хотя, как правило, отравления ацетоном не смертельны. Возможно поражение печени (токсический гепатит), почек (уменьшение диуреза, появление крови и белка в моче) и коматозное состояние. При ингаляционном воздействии ацетон выводится гораздо медленнее (в течение нескольких часов), чем поступает, и поэтому может накапливаться в организме.





