к чему ведет отсутствие рандомизации в исследовании
К чему ведет отсутствие рандомизации в исследовании
Рандомизированные клинические испытания (РКИ) остаются основным методом и «золотым стандартом» проверки безопасности и эффективности новых лекарственных и биологических препаратов, например, вакцин, хирургических и системных вмешательств. Рандомизированные клинические испытания (РКИ) имеют ряд характерных особенностей. Они являются контролируемыми, рандомизированными и обычно «ослепленными»; помимо этого, значимость результатов определяют с помощью статистических методов по заранее установленному алгоритму. В ходе рандомизированных испытаний обычно происходит сравнение двух и более методов лечения (например, препарата А с препаратом В) с целью выявления их сходных свойств или преимуществ одного над другим в лечении, диагностике или профилактике того или иного заболевания. Хотя лишь немногие из существующих кодексов исследовательской этики, рекомендаций или регуляторных документов содержат указания на специфические проблемы из области морали, возникающие при проведении рандомизированных клинических испытаний, организация таких испытаний создает целый спектр уникальных этических проблем.
«При работе над рандомизированными клиническими испытаниями среднестатистический представитель этического комитета бывает сбит с толку их сложностью и множеством возникающих проблем».
Этическое обоснование для проведения рандомизированного испытания обычно описывают как «нулевую гипотезу», или равновесие, или клиническое равновесие. В рандомизированном клиническом испытании свойства вмешательств А и В считают клинически уравновешенными, если не существует убедительных доказательств о превосходстве одного из них (например, свидетельств о том, что препарат А более эффективен или менее токсичен, чем В). Задачей рандомизированных клинических испытаний является нарушение этого равновесия путем получения обоснованных доказательств относительной ценности каждого из этих методов.
В основе идеи о «равновесии» лежит представление о том, что даже в ходе клинического исследования пациентам должно быть назначено более эффективное лечение, а не то, которое признано менее эффективным, и пациентам нельзя отказывать в доступном более эффективном лечении. В рандомизированных клинических испытаниях назначение каждой группе пациентов разного вида терапии является приемлемым с точки зрения этики, поскольку пациенты не знают о том, какое из них более или менее эффективно; по этой же причине все участники исследования имеют равные шансы получить именно эффективный метод лечения. Говоря о «равновесии», необходимо упомянуть ряд спорных моментов.
Некоторые утверждают, что «равновесие» возникает вследствие недопустимого слияния исследовательской работы с лечением пациентов, а потому такой подход следует запретить.
В рандомизированных клинических испытаниях существуют и другие спорные моменты. Например, не существует общепринятого представления О том, что такое «убедительные доказательства». Общепринятое определение статистической значимости результата при значении р = 0,05, означающего, что различия между вмешательствами в рандомизированных клинических испытаниях случайны менее чем в 5% случаев, создает возможность для исключения клинически значимых, но статистически недостоверных методов. Существуют разногласия и о степени влияния предварительных результатов, данных предыдущих исследований, неконтролируемых и пилотных исследований, а также исторических данных на баланс доказательств. В некоторых случаях существование данных такого типа делает «равновесие» невозможным. Однако применение данных небольших неконтролируемых исследований может привести к возникновению ошибочного впечатления о безопасности и эффективности методов лечения, которые на самом деле могут оказаться вредными.
Недостаточное количество убедительных доказательств о преимуществах того или иного метода лечения в долговременной перспективе в определенной группе пациентов не обязательно помешает принять решение о том, что будет лучшим для конкретного пациента в данный момент времени. Уникальные симптомы, побочные эффекты, преимущества, предпочтения и другие факторы могут привести к тому, что один из методов лечения будет более предпочтителен для данного пациента, чем другие; в таком случае пациент вряд ли является подходящим кандидатом для участия в рандомизированных клинических испытаниях. Врачи, ответственные за лечение пациента, всегда должны принимать во внимание эти факторы. Если врач в то же время является и исследователем в испытаниях, в которых участвует его пациент, может возникнуть ролевой конфликт. В такой ситуации для соблюдения прав пациента может потребоваться помощь других участников исследовательской группы, информирование пациента или в некоторых случаях разделение обязанностей исследователя и врача.
Другим важным научным и этическим вопросом является выбор переменных, которые будут результатами исследования, и оценка преимуществ того или иного метода. Использование различных параметров для оценки эффективности лечения, например, выживаемости, уменьшения размеров опухоли, регресса клинических проявлений, искусственных конечных точек качества жизни, может привести к различным выводам. Выбор конечных точек никогда не является чисто научным вопросом.
В рандомизированных клинических испытаниях пациентам назначают лечение в результате рандомизации. Это означает, что каждому участнику рандомизированных клинических испытаний лечение назначают случайным образом с помощью компьютерных программ или с использованием таблиц случайных чисел, а не исходя из индивидуальных потребностей и особенностей. Целью рандомизации является контроль вмешивающихся факторов путем создания двух или более групп лечения, сходных по релевантности и другим параметрам, которые нельзя контролировать иначе. Помимо рандомизации в исследованиях нередко применяют одинарное (пациент не знает, какое ему назначено лечение) или двойное ослепление (ни пациент, ни исследователь не знают, какое лечение было назначено).
Рандомизацию и ослепление применяют для уменьшения ошибок и получения более достоверных результатов. Хотя рандомизация и ослепление способствуют достижению целей исследования, они не всегда действуют в интересах пациента. Было показано, что в некоторых слепых плацебо-контролируемых исследованиях как исследователь, так и испытуемый могут догадаться (чаще, чем этого можно ожидать при случайном распределении), получает пациент лекарственный препарат или плацебо.37 Таким образом, необходимость и эффективность ослепления и рандомизации следует оценить еще на стадии планирования исследования и изучения протокола. Если рандомизация и ослепление признаны полезными и подходящими для применения в исследовании, возникают два основных этических вопроса: (1) предпочтение того или иного метода лечения и информация о том, какое лечение будет назначено, могут быть важными для принятия самостоятельного решения; (2) информация о проводимом лечении может потребоваться при оказании медицинской помощи при побочных эффектах и в других экстренных ситуациях.
Что касается первого пункта, когда пациент дает согласие на участие в рандомизированном исследовании, ему сообщают о целях исследования и просят согласиться с назначением случайного лечения и с тем, что он временно не будет знать, какое именно лечение получает. Чтобы найти баланс между научной объективностью и уважением к потребности человека в информации, необходимой для принятия решения, исследователи должны предоставить участникам испытаний достаточный объем данных о целях и методах рандомизации и ослепления, а также оценить, насколько участники исследования понимают их суть. Участникам исследования предлагают согласиться, что они не будут получать информации о проводимом лечении до его завершения или другого заранее установленного момента, после которого их полностью информируют.
Информация о принимаемых пациентом препаратах может потребоваться при оказании помощи при побочных эффектах и других осложнениях, вызванных лекарственными средствами, что является проявлением заботы о безопасности и здоровье участников исследования. Чтобы сохранить равновесие между требованиями научной объективности и безопасностью пациентов, исследователи должны заранее предусмотреть условия, допускающие прекращение «ослепления» для лечения нежелательных эффектов. В частности, в протоколе должно быть указано местонахождение кодов, обстоятельства, допускающие их раскрытие (если такие предусмотрены), лицо, имеющее полномочия это сделать, способ передачи информации (т. е. будут ли поставлены в известность исследователь, пациент, этический комитет и лечащий врач) и то, как раскрытие данных повлияет на анализ результатов. Участники исследования должны знать, к кому обратиться в экстренной ситуации. Этический комитет должен убедиться, что разработанный план действий отвечает требованиям безопасности пациентов.
В настоящее время большое внимание стали уделять вопросу о доступности для участников исследования изучаемых эффективных методов лечения после завершения испытаний. Существует мнение о том, что добровольцы, участвовавшие в рандомизированных клинических испытаниях, заслуживают гарантированного доступа к лечению, эффективность которого была доказана в исследовании. Т. е. участники исследования, которые попали в группу лечения, оказавшегося более эффективным, продолжат его получать, а те, кто попал в группу, где было назначено менее эффективное лечение, получат доступ к тому, что было признано лучшим. Существует ряд возражений по поводу обязанностей исследователей и спонсоров по обеспечению такого доступа. Требуется решение вопроса о практической реализации такого доступа и необходимых для этого ресурсах.
Дать согласие на рандомизацию для пациента может быть сложнее, если в одной из групп будет применяться плацебо. Многие пациенты тяжело воспринимают возможность назначения плацебо, поскольку это может лишить их возможности получать необходимое лечение. С другой стороны, при «клинической равноценности» препаратов и отсутствии доказательств преимуществ экспериментального лечения пациенты, получающие плацебо, просто оказываются избавленными от токсического воздействия бесполезного препарата. С точки зрения науки, сравнение экспериментального препарата или метода лечения с плацебо является наиболее результативным и надежным методом оценки его эффективности.
В качестве альтернативы в рандомизированных исследованиях может производиться сравнение нового метода лечения с уже существующим, что позволяет исследователям выявить преимущество одного над другим или их равноценность (т. е. отсутствие различий между экспериментальным препаратом и стандартной терапией, применяемой в группе контроля). Проведение пла-цебо-контролируемых исследований обосновано в том случае, когда никакое другое лечение не разработано, когда новые данные позволяют усомниться в эффективности стандартного лечения или при исследовании на пациентах, невосприимчивых к стандартной терапии или отказавшихся от нее.40 В исследованиях, соответствующих этим критериям, применение плацебо не наносит вреда его участникам и не является нарушением их прав. Под вопросом остается правомерность применения плацебо при наличии доступных альтернативных методов лечения. Некоторые авторы считают применение плацебо в таких случаях недопустимым в силу самого факта и противоречащим принципам Хельсинкской декларации.
Другие специалисты считают, что выбор наиболее подходящего метода контроля зависит от задач исследования, последствий назначения препаратов в каждой группе, достоверности доказательств эффективности существующей терапии, ожидаемой вариабельности исходов и роли, которую может сыграть эффект плацебо. Некоторые авторы занимают промежуточную позицию и предлагают считать научные задачи исследования и возможные риски основными факторами, определяющими приемлемость плацебо. Однако все согласны с тем, что в ситуации, когда отсутствие лечения или назначение плацебо может привести к смерти пациента, его инвалидизации или к развитию тяжелых заболеваний, применение плацебо в качестве контроля недопустимо.
Рандомизированное контролируемое исследование в медицине
Введение в доказательную медицину
Читая статьи, и получая консультации на нашем сайте, вы част.
Это означает, что выпуская новый лекарственный препарат, новый метод диагностики или лечения, компания-производитель должна проверить как эффективность, так и безопасность своего метода исследования или лечения, проведя рандомизированное контролируемое исследование (РКИ).
На схеме показана т.н. пирамида доказательности. Как видите РКИ занимает первое место в этой иерархической системе.
Что же означают эти три слова в данном методе клинического анализа: рандомизированное контролируемое исследование?
Рандомизированное – означает, что решение о том, в какую группу попадет пациент, в испытательную (ту, в которой будут испытывать новый метод), традиционную (ту, в которой будет использоваться общепринятое лечение данного заболевания) или в контрольную (ту, в которой будут использовать плацебо, то есть «пустышку») принимается совершенно случайным образом.
Контролируемое – означает, что в исследовании обязательно будет осуществляться контроль, путем сравнения с традиционным методом лечения, или с группой плацебо.
Исследование – напоминает, что препарат проходит испытание, в ходе которого он обязан показать как свою эффективность в лечении этой патологии, так и свою безопасность, в противном случае ему никогда не попасть в аптеки.
Почему в клинических исследованиях требуется рандомизация?
Случайный отбор кандидатов крайне важен, поскольку в противном случае, если мы предоставим пациенту или врачу выбирать, в какую группу поместить участника исследования, это может сильно исказить полученные результаты.
Благодаря рандомизации мы избавляемся от всякой предвзятости и делаем группы максимально однородными: по полу, возрасту, анамнезу, длительности заболевания, осложнениям, сопутствующим заболеваниям и т.д., чтобы сократить количество искажений результатов исследования от посторонних факторов до минимума.
Скажем, если врач очень хочет получить положительные результаты от изобретенного им препарата, он может сознательно или неосознанно помещать более тяжелых пациентов в группу плацебо (т.е. в группу контроля), а менее тяжелых пациентов – в группу, получающую экспериментальный препарат. Тогда он гарантированно получит в экспериментальной группе лучшие показатели лечения, но таким показателям совсем нельзя будет доверять.
А теперь представьте себе, что врач не просто хотел бы получить хорошие результаты, но и подкуплен фармацевтической компанией, напрямую заинтересованной в самых положительных результатах исследования их нового препарата. В таком случае ставки очень высоки, и финансовые потоки – тоже. Именно поэтому, проводя тщательную рандомизацию пациентов, мы исключаем не только любую предвзятость, но и любое случайное искажение.
Зачем клинические испытания «контролируются»?
Исследование случай-контроль
Исследование типа «случай-контроль» является одной.
Еще одним обязательным свойством исследования, увеличивающим степень контроля, является наличие достаточно большого количества участников исследования. Это необходимо, чтобы случайные различия и необычные случаи не оказывали большого влияния на полученные результаты.
Контрольная группа обычно получает плацебо: это препарат-пустышка, который выглядит, пахнет, имеет вкус идентичный настоящему препарату, однако не содержит действующего вещества.
ЭФФЕКТ ПЛАЦЕБО (PLACEBO EFFECT) — как правило (но не обязательно или не всегда), благоприятный эффект, приписываемый пациентами лекарственному средству или лечению, назначенному лечащим врачом. Ощущаемое благоприятное действие плацебо связано с ожиданием эффекта от лечения, например, из-за внушения. Подробнее об эффекте плацебо.
Сравнение со стандартным лечением
Помимо группы плацебо, сравнение нередко происходит с группой, получавшей стандартное и общепринятое при изучаемой патологии, лечение. Целью такого сравнения является определить, каковы преимущества и каковы риски экспериментальной терапии по сравнению со стандартной.
Тот факт, что новый препарат оказывает терапевтический эффект при данном заболевании – недостаточен для его одобрения и широкого использования. Он должен быть более эффективен и/или более безопасен, нежели стандартная общепринятая терапия, хотя бы в некоторых случаях, при определенных известных условиях.
Кроме всего этого, немаловажным является стоимость новой терапии, в сравнении со стоимостью стандартного лечения. Если препарат менее эффективен, но значительно более дешев – это может стать аргументом в его пользу.
Непрактичность и неэтичность плацебо в некоторых РКИ
Оценка качества медицинской информации
Не все медицинские исследования предоставляют одинаково наде.
Если подобные препятствия не позволяют провести РКИ, то для такого исследования выбирается иной, более подходящий дизайн. Решение о допустимости проведения РКИ принимается специальным этическим комитетом. Клиническое испытание не может быть начато без одобрения этого комитета
Научная электронная библиотека
Наумова Е. А., Шварц Ю. Г., Семенова О. Н.,
Рандомизированные клинические исследования
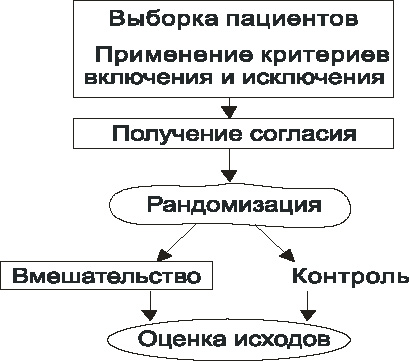
Общая схема РКИ приведена на рис. 8.
Рандомизация – это процесс случайного распределения испытуемых в группу вмешательства и группу контроля. Именно она является основным моментом в проведении РКИ. Однако обратите внимание, что это не первый этап исследования. Первым этапом происходит формирование выборки пациентов: определяется круг лиц, максимально похожих друг на друга (насколько это возможно), и происходит это на основании критериев включения и исключения, описанных в протоколе исследования.
Это основной документ, в котором подробнейшим образом описываются обоснование исследования, его цели, задачи, дизайн, критерии включения и исключения, все процедуры исследования. Четко описываются все манипуляции с пациентом: когда, на какие сутки/или минуты, будет забираться кровь, выполняться электрокардиография (ЭКГ), биопсия или какие-либо иные действия. Протокол пишется разработчиками – экспертами, одобряется регуляторными органами, и именно по данному документу в дальнейшем работают все врачи-исследователи, принимающие участие в эксперименте. Благодаря этому врачи разных исследовательских центров выполняют одинаковые действия, строго следуя протоколу исследования. Отклонения от протокола исследования не допустимы, но если они случаются, то это документируется и сообщается и организаторам, и регуляторным органам. Если по ходу исследования было допущено множество отклонений от протокола, то его результаты могут быть поставлены под сомнение, и разработчикам может быть отказано в регистрации препарата.
Критерии включения и исключения
Это подробное описание тех симптомов, признаков, показателей, которые обязательно должны быть у пациента (критерии включения), и которых не должно быть ни в коем случае (критерии исключения). Например, в исследование включаются пациенты старше 40 лет, но не старше 71 года, поступившие не позднее 2 часов от появления клинических симптомов острого коронарного синдрома (ОКС), обязательно имеющие элевацию сегмента ST не менее 1 мм в не менее чем 2 смежных стандартных отведениях и/или не менее 2 мм в 2 смежных грудных отведениях. При этом у них не должно быть острой сердечной недостаточности Killip 3-4, не должно быть онкологических заболеваний, почечной, печеночной недостаточности. Это делается для того, чтобы группа пациентов, которые могут участвовать в исследовании была максимально однородной. Если пациент соответствует основным критериям включения и не имеет критериев исключения, то ему предлагают участвовать в данном клиническом исследовании. Врач-исследователь проводит с пациентом беседу, в ходе которой он объясняет суть исследования, риски и пользу от участия в исследовании, и предлагает для ознакомления документ, под названием ИС.
Информированное согласие (ИС)
Основополагающим документом, определяющим этические принципы проведения биомедицинских исследований с участием людей, является Хельсинкская Декларация Всемирной Медицинской Ассоциации. Хельсинкская Декларация гласит: «При проведении любого исследования с участием людей в качестве субъектов каждый потенциальный субъект исследования должен быть надлежащим образом проинформирован о целях, методах, ожидаемой пользе и возможном риске исследования, а также о неудобствах, которые могут быть вызваны экспериментом. Участники исследования должны быть проинформированы о том, что они имеют неограниченное право отказаться от участия в исследовании и в любое время взять назад согласие на участие. Врач должен получить такое согласие – свободное и информированное – от субъекта исследования, желательно в письменном виде».
Пациенты могут включаться в научное исследование только после того, как они получили полную информацию о нём и дали осознанное и добровольное согласие на участие.
Получение ИС – важнейший элемент надлежащего проведения любого исследования на человеке. Этот процесс строго регламентирован. Письменную форму ИС (сейчас в России Информационный листок пациента и Форма ИС) для КИ составляет фирма-спонсор или сам врач-исследователь (если он проводит свое, менее масштабное, например диссертационное исследование).
ИС обязательно должно содержать следующую информацию:
1. Кто проводит данное исследование?
3. Какой препарат (метод) исследуется, что он из себя представляет. Используется ли плацебо или какая-либо контрольная терапия?
4. Подробнейшее описание всех процедур исследования (сколько раз пациент посещает исследовательский центр, какие исследования выполняются и когда (максимально детально, вплоть до количества миллилитров крови, которое будет забрано).
5. Что потребуется от пациента (например, регулярное посещение центра)?
6. Каковы возможные риски и неудобства от участия в программе?
7. Какую пользу может получить пациент от своего участия в эксперименте?
8. Какая компенсация предусмотрена в случае нанесения вреда здоровью?
9. Предусмотрена ли оплата за участие в эксперименте (характерно для 1 фазы КИ)?
10. В обязательном порядке подчеркивается добровольность участия в исследовании (указывается, что в случае отказа – никакого влияния на стандартную помощь и терапию это не окажет) и возможность отказа от участия в нем в любой момент (и даже без объяснения причин).
11. Гарантируется конфиденциальность всей информации о пациенте (никто, кроме самого врача-исследователя не будет знать, что вся информация о данном участнике исследования – это данные, в том числе и персональные, принадлежащие именно данному человеку, все остальные участники процесса будут получать данные пациента только в обезличенном виде).
12. Оговаривается возможность проведения проверок (при соблюдении конфиденциальности) представителями официальных инстанций.
13. Указываются имена и телефоны контактных лиц (врача-исследователя, этического комитета).
14. Обязательно вносится предупреждение о том, что одномоментно пациент может участвовать только в одном клиническом исследовании.
ИС обязательно предоставляется на родном языке пациента (если необходим перевод, то он осуществляется сертифицировано) Форма согласия должна быть удобна для чтения (не мелкий шрифт, четкость и последовательность изложения информации). Документ утверждается официальными инстанциями страны, где проходит КИ и Комитетом по Этике.
Важно помнить, что ИС получается ДО выполнения любых действий с пациентом в рамках исследования, а не только до непосредственного назначения исследуемого препарата. Что это означает? Ни одно обследование, измерение, назначение в рамках протокола (а не стандартной практики) не может происходить без подписанного ИС, даже если это безболезненная и безопасная процедура, например обычный осмотр пациента или ультразвуковое исследование почек. Если данные процедуры выполняются только по причине участия в протоколе, то это уже эксперимент, и требуется согласие пациента. С другой стороны, если, например проводится исследование среди стационарных пациентов с пневмонией, то выполнение рентгенологического исследования легких является процедурой, обязательной для всех, не зависимо от участия в исследовании. В этом случае, подписывать дополнительное согласие на рентген нет необходимости, оно включено в стандартное согласие пациента на предложенный план лечения в стационаре. Если в протокол исследования вносятся какие-либо изменения, так или иначе связанные с пациентом (появляется новая информация о лекарственном средстве, изменяются процедуры исследования), то должна быть подготовлена, затем одобрена соответствующими инстанциями, а затем и подписана пациентом новая версия ИС, содержащая все внесенные изменения.
При получении ИС пациент не может быть как-либо ограничен во времени. Он может забирать форму для ознакомления домой. Может показывать форму согласия любому другом врачу, родственнику, адвокату, т. е. любому лицу, с которым захочет посоветоваться.
Форма ИС собственноручно подписывается и датируется пациентом в двух оригинальных экземплярах. Затем форму подписывает и датирует врач-исследователь, проводивший разъяснительные беседы с пациентом. Один оригинал согласия остается в исследовательском центре, а второй оригинал – забирает пациент. В истории болезни пациента обо всем этом делается соответствующая запись.
Если пациент не может сам подписать ИС (это несовершеннолетний ребенок, лицо, признанное в законном порядке недееспособным), то согласие за него может подписать его законный представитель или официально назначенный опекун.
Если пациент не может сам прочесть форму ИС (например, вследствие проблем со зрением), то в процессе чтения, и обсуждения принимает участие Свидетель (независимое лицо, не связанное с персоналом клиники). Он помогает пациенту, и в этом случае также подписывается в специальных строках формы согласия (после подписания формы пациентом).
В редких случаях возможно включение пациента в исследование без подписания ИС. Это относится к исследованиям, в реанимационной практике, когда велика вероятность поступления пациента без сознания, и без сопровождающих официальных лиц. Это подробно описывается в протоколе исследования. Такие испытания нуждаются в очень весомых обоснованиях и также проходят одобрение официальных инстанций и Этического комитета. После того, как пациент пришел в себя, с ним проводится беседа, описывается суть произошедшего, и пациент знакомится с информационным листком пациента и формой ИС. Если пациент их подписывает, то он продолжает участие в эксперименте, если пациент отказывается (а он имеет на это полное право), то его участие в научном исследовании завершено, он продолжает только стандартное лечение.
Как мы уже обсуждали выше, рандомизация – это процесс случайного распределения заранее отобранных, имеющих максимально сходные характеристики испытуемых в основную и контрольную группы. Сам термин «рандомизация» произошел от англ. слова random, т. е. случайный выбор.
Рандомизация – наиболее оптимальный способ распределения испытуемых в группы, так как именно он позволяет минимизировать возможность систематической ошибки.
Систематическая ошибка (bias) – это «систематическое (неслучайное, однонаправленное) отклонение результатов от истинных значений». Она может быть связана с отбором пациентов (selection bias), с процедурами измерения (measurements bias) и с вмешивающимися факторами (confounding bias).
Почему так важен отбор пациентов? Достаточно очевидно, что при сравнении двух групп, существенно отличающихся друг от друга (например, по возрасту или тяжести заболевания), невозможно сравнивать их исходы (как при наличии медицинского вмешательства, так и нет). То есть, у кого тяжесть заболевания выше, всегда будут иметь больше негативных исходов, чем пациенты с более легкой формой болезни. Отбор пациентов по строгим критериям включения и исключения с последующим случайным распределением в основную группу и группу контроля и направлен на предотвращение данной ошибки.
Ошибка, обусловленная измерением, связана с различными способами оценки каких-либо параметров в двух исследуемых группах. Это могут быть погрешности измерения в различных лабораториях (и поэтому очень часто в КИ используют единую центральную лабораторию), различия в измерениях какого-либо интервала на ЭКГ, различия в опросе пациента, и акцентирование или нет при разговоре с ним на какие-либо факторы. Для нивелирования этих факторов в КИ и используют унифицированные процедуры работы с пациентами, строго прописанные в протоколе, очень часто – в различные центры для измерений поставляются одинаковые измерительные приборы, как уже отмечалось выше, используется центральная лаборатория.
Ошибка, связанная с действием вмешивающихся факторов. Очень часто два каких-либо фактора сильно взаимосвязаны между собой, и возможна ситуация, когда из-за этого неверно оценивается эффект каждого из факторов.
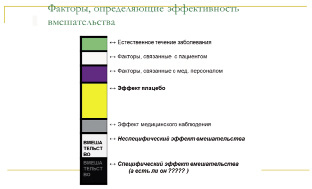
Если рассматривать КИ эффективности вмешательств, то условно все факторы, так или иначе влияющие на эту самую эффективность (т. е. на исходы) можно представить рис. 9.
Во-первых, у любого заболевания есть свое определенное течение, и очень часто это чередование обострений и ремиссий. Если вы набираете пациентов в фазу обострения, а затем фиксируете выздоровление, то как определить связано это выздоровление с применимым вмешательством (например, лекарственным средством), или с естественным течением заболевания (выздоровление наступило самостоятельно, независимо от вашего лечения). Задумайтесь, ведь не случайно имеется такое количество «эффективных» средств от простуды? Большинство простудных заболеваний всегда заканчиваются выздоровлением, независимо от использованных средств (помните поговорку, насморк без лечения проходит за неделю, а с лечением – за 7 дней). Именно этим и пользуются недобросовестные производители, которые проводят нерандомизированные исследования своих «чудо – препаратов», фиксируют выздоровление пациентов, и даже не пытаются обосновывать реальную взаимосвязь между улучшением самочувствия пациента и применением «чудо-средства».
Рис. 9. Факторы, определяющие эффективность вмешательства
Факторов, связанных с пациентом и с его врачом также немало. К сожалению, все люди имеют особенности, которые могут влиять не только на течение заболевания, на оказание помощи пациенту, но и на восприятие каждого фактора, в том числе и тех, оценка которых является целью исследования.
Эффект плацебо также существует, также, как и эффект самого вмешательства, т. е. так называемый эффект Хортона. Эффект Хортона в данном случае проявляется тем, что повышенное внимание к испытуемому, дополнительные обследования и вмешательства повышают положительное восприятие пациентом своего участия в эксперименте и того лечения, которое он получает, и тем самым искажает результаты исследования. Все это в итоге крайне затрудняет оценку эффективности именно изучаемого вмешательства. Только правильно организованные КИ с отбором схожих пациентов и случайным делением на группы, в каждой из которых и будут действовать все описанные факторы, позволяют делать вывод об эффекте изучаемого препарата/прибора/процедуры: если все другие факторы одинаково действовали в двух группах, то разница в исходах как раз и связана с проводимым лечением.
Типы рандомизации представлены на рис. 10.
Рис. 10. Типы рандомизации (Р. Флетчер Клиническая эпидемиология)
Фиксированная рандомизация – пациент попадает в группу вмешательства или контроля строго на основании заранее сгенерированных/запрограмированных таблиц, последовательностей чисел и т. п. Изменений в данных последовательностях по ходу исследования не происходит.
Простая рандомизация – для каждого участника пациента вероятность попадания в группу вмешательства или контроля 50/50 %. Типичный пример – подбрасывание монетки: орел или решка. При таком подходе группы могут различаться, а иногда и существенно и по числу испытуемых в группе, и по некоторым характеристикам (пол, возраст и т. п.)
Блоковая рандомизация – для достижения большей сбалансированности между группами, все участники делятся на блоки, в каждом из которых всегда равное число участников группы контроля или вмешательства, однако последовательность участников в каждом блоке случайна и неизвестна (рис. 11). Пациент рандомизируется в определенный блок, и занимает в нем порядковое место. При таком подходе группы получаются более сбалансированными, но если исследователю будет известен размер блока, то он может повлиять на распределение пациентов в группы.
Рис. 11. Метод блоковой рандомизации
Стратифицированная (послойная) рандомизация – при распределении в группы учитывается ряд факторов (например пол, возраст, ключевые особенности заболевания). Таким образом опять же достигается большая сбалансированность исследуемых групп.
Динамическая рандомизация – распределение пациентов по группам «балансируется» по ходу исследования.
Метод «несимметричной монеты» – применяется для достижения более равномерного распределения участников в группы по определенному критерию. Например, нам важно, чтобы по возрасту группы были максимально идентичны. В этом случае, если при рандомизации в какой-либо из групп участников молодого возраста меньше, то очередной участник молодого возраста будет иметь больше шансов (обычно 66,6 %, но не более!) попасть именно в эту группу. Если же на данном этапе набора участников исследования по возраст группы сопоставимы, то новый испытуемый имеет шансы оказаться в группе вмешательства/контроля 50/50.
При адаптивной рандомизации – распределение участников в группы динамически меняется так, чтобы к концу исследования наибольшее число испытуемых получило более эффективный способ терапии (это определяется после промежуточных анализов же, собранных по ходу данного исследования баз данных). Минусом такой рандомизации является необходимость частичного раскрытия данных для определенной группы аналитиков, и сложность контроля за этим.
Как на практике выглядит рандомизация? В многоцентровых клинических исследованиях она может быть локальной (на территории самой клинической базы), либо централизованной. В первом случае это как правило метод конвертов: исследователь центра получает ряд запечатанных, пронумерованных конвертов, в каждом из которых указан вид лечения/препарата. Согласно определенным процедурам протокола пациенту назначается один из конвертов, и препарат с номером, указанным внутри.
В настоящее время наиболее часто используется централизованная рандомизация. Врач-исследователь вводит определенные обезличенные данные пациента (пол, возраст, тяжесть заболевания и др.) через специальную телефонную линию или интернет в специальную единую компьютерную систему, в которой и происходит рандомизация, т. е. распределение пациента в одну из двух групп, и в ответ врач получает номер упаковки с ИП. Все упаковки имеют одинаковый внешний вид, а препарат в них в идеале должен иметь не только одинаковый внешний вид, но и одинаковый запах, вес, вкус, и для исследователя и пациента отличаются только номером. Упаковка с указанным номером выдается пациенту.