Т хелперы повышены что это
Т хелперы повышены что это
Иммунофенотипирование, клеточный иммунитет, многоцветный клеточный анализ методом проточной цитометрии, Т-клетки, Т-хелперы, Т-цитотоксические клетки, Т-регуляторные лимфоциты.
Human Immune System, Immunophenotyping, Multicolor Flow Cytometry Cell Analysis, Human Leukocyte Differentiation Antigens, Human T cells, T helper cells, Cytotoxic T cells, T-reg Cells, Activation markers.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Общая информация об исследовании
В основе проточной цитофлуориметрии лежит проведение фотометрических и флюоресцентных измерений отдельных клеток, пересекающих одна за другой вместе с потоком жидкости луч монохроматического света, обычно света лазера.
Этот маркер позволяет идентифицировать зрелые покоящиеся (интактные) Т-клетки и подсчитать общее количество Т-лимфоцитов. Количественная оценка субпопуляции CD3+ лимфоцитов имеет диагностическую значимость в следующих случаях:
— первичные и вторичные иммунодефициты;
— острые вирусные инфекции, включая ВИЧ;
— внутриклеточные бактериальные и паразитарные инфекционные заболевания (туберкулез, лепра, лейшманиоз);
— реакции отторжения трансплантатов и болезни «трансплантат против хозяина»;
— лимфопролиферативные расстройства (острый Т-лимфобластный лейкоз).
При сахарном диабете довольно часто наблюдается снижение у больных процентного содержания и абсолютного числа СD3+ лимфоцитов.
Определение количества CD4+ клеток имеет значение при диагностике состояний, связанных с дефектами антителопродукции и реакций клеточно-опосредованного иммунитета. Показателю числа CD4+ клеток отводится решающая роль для прогноза течения ВИЧ-инфекции.
Функциональное состояние CD4+ лимфоцитов тестируют по цитокиновому профилю: функциональная полноценность Th1-клеток подтверждается по секреции g-IFN, а Th2-клеток – по секреции IL-4.
Дифференцировочная молекула CD8 представляет собой гликопротеин, обнаруживаемый на поверхности тимоцитов и Т-лимфоцитов и участвующий в распознавании антигенных пептидов в контексте с молекулами главного комплекса гистосовместимости (MHC) класса I.
Клиническая значимость определения количества СD8+ лимфоцитов: вирусные инфекции (при определенной модификации имеется возможность количественной оценки вирусоспецифических цитолитических CD8+ Т-лимфоцитов); при ряде заболеваний большое прогностическое значение имеет соотношение между CD4- и CD8-субпопуляциями Т-лимфоцитов (иммунорегуляторный индекс CD4/CD8); например, прогрессирующее снижение иммунорегуляторного индекса у ВИЧ-инфицированных больных может свидетельствовать о переходе в СПИД; злокачественные новообразования; оценка эффективности проведенной вакцинации (в особенности противовирусными вакцинами).
До недавнего времени приписываемая субпопуляции CD8+ клеток супрессорная активность сейчас практически полностью отвергается. По данным большинства экспериментальных и клинических исследований, считается, что существование какой-либо отдельной популяции Т-супрессорных клеток даже без привязки к CD8-маркеру маловероятно.
При аутоиммунных тиреоидитах, в частности при диффузном токсическом зобе (ДТЗ), в реакциях клеточного иммунитета отмечается снижение субпопуляции CD8+ лимфоцитов и снижение функциональной активности цитотоксических лимфоцитов.
При сахарном диабете также отмечается уменьшение функциональной активности и количества CD8+ лимфоцитов.
Снижение фракции СD8+ лимфоцитов наблюдается также у больных с первичной хронической недостаточностью коры надпочечников (болезнь Аддисона).
Антиген CD25 известен как низкоаффинный рецептор ИЛ2, имеющий молекулярную массу 55 кД.
Молекула CD25, ассоциированная с b-цепью (CD122) и общей g-цепью (CD132), формирует высокоаффинный комплекс рецептора ИЛ-2. В процессе воспаления может вырабатываться растворимая форма ИЛ-2R. Маркер CD25 присутствует на субпопуляцях Т- и В-лимфоцитов периферической крови, в том числе на активированных макрофагах, НK. Его экспрессия резко возрастает при активации ФГА и КонА на поверхности CD3-активированных Т-лимфоцитов, на Т-клетках из смешанной культуры лимфоцитов, на инфицированных HTLV Т-лимфоцитах лейкемической линии при Т-лимфоцитарной лейкемии.
Метод позволяет определить количественное соотношение основных популяций Т-лимфоцитов:
малые клеточные популяции, а также изучить их функциональную активность:
Когда назначается исследование?
Вместе с тем регуляторные Т-клетки снижают противоопухолевый иммунитет и иммунитет к инфекциям.
Особый интерес представляют исследования, связанные с изучением соотношения аутоактивных клонов В-клеток и регуляторных Т-клеток при различной патологии воспалительного генеза. Так, при осложненном течении ряда патологических воспалительных процессов сохранение высокого уровня Т-reg и В1- клеток к 30-м суткам характеризует сохранение напряженности воспалительного процесса и, возможно, начало формирования дефекта функционирования Т-reg клеток, которое впоследствии может привести к хронизации воспаления и к развитию аутоиммунного процесса.
Таким образом, наличие и количественные характеристики этой популяции служат важным диагностическим признаком.
Рекомендовано для комплексного обследования пациентов, входящих в группу риска по четырем основным иммунопатологическим синдромам.
С инфекционным синдромом:
С аллергическим (атопическим) синдромом:
С аутоиммунным синдромом:
С иммунопролиферативным синдромом:
Что означают результаты?
Изменения различных клеточных популяций лимфоцитов в сторону повышения или понижения развиваются при различных патологических процессах в организме, таких как инфекции, аутоиммунные и онкологические заболевания, иммунодефициты, в постоперационном периоде, при трансплантации органов.
Ниже представлена таблица с клиническими ситуациями, которые могут приводить к изменениям в субпопуляционном составе лимфоцитов.
Субпопуляция лимфоцитов
Повышение показателя
Снижение показателя
Т-цитотоксические лимфоциты (CD3 + CD8 + CD45 + )
T-reg. (Регуляторные Т-клетки
В совокупности с клиническими данными, симптоматикой, другими методами лабораторных исследований вышеуказанные изменения являются диагностическим признаком возникновения этих патологических процессов в организме человека.
Т хелперы повышены что это
Исследование включает в себя определение абсолютного и относительного количества CD4+ Т-лимфоцитов (Т-хелперы). Рекомендуется к назначению для контроля показателей клеточного звена иммунной системы в динамике после комплексного иммунологического обследования.
Иммунофенотипирование, клеточный иммунитет, многоцветный клеточный анализ методом проточной цитометрии, Т-клетки, Т-лимфоциты, Т-хелперы.
Human Immune System, Immunophenotyping, Multicolor Flow Cytometry Cell Analysis, Human Leukocyte Differentiation Antigens, Human T cells, T helper cells.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Общая информация об исследовании
В основе проточной цитофлуориметрии лежит проведение фотометрических и флюоресцентных измерений отдельных клеток, пересекающих одна за другой вместе с потоком жидкости луч монохроматического света, обычно света лазера.
Определение количества CD4+ клеток имеет значение в диагностике состояний, связанных с дефектами антителопродукции, и реакций клеточно-опосредованного иммунитета. Показателю числа CD4+ клеток отводится решающая роль для прогноза течения ВИЧ-инфекции.
Функциональное состояние CD4+ лимфоцитов тестируют по цитокиновому профилю: функциональная полноценность Th1-клеток подтверждается по секреции g-IFN, а Th2-клеток – по секреции IL-4.
Метод позволяет определить количество популяции Т-лимфоцитов:
Когда назначается исследование?
Рекомендовано для комплексного обследования пациентов, входящих в группу риска по четырем основным иммунопатологическим синдромам.
С инфекционным синдромом:
С аллергическим (атопическим) синдромом:
С аутоиммунным синдромом:
С иммунопролиферативным синдромом:
Что означают результаты?
Изменения различных клеточных популяций лимфоцитов в сторону повышения или понижения развиваются при различных патологических процессах в организме, таких как инфекции, аутоиммунные и онкологические заболевания, иммунодефициты, в постоперационном периоде, при трансплантации органов.
Ниже представлена таблица с клиническими ситуациями, которые могут приводить к изменениям в субпопуляционном составе лимфоцитов.
Субпопуляция лимфоцитов
Повышение показателя
Снижение показателя
В совокупности с клиническими данными, симптоматикой, другими методами лабораторных исследований вышеуказанные изменения являются диагностическим признаком возникновения этих патологических процессов в организме человека.
Исследование иммунного статуса
ВОЗ рекомендовано определение CD3, CD4, CD8, CD19, CD16+56, соотношение CD4/CD8. Иммунологическое исследование позволяет определить относительное и абсолютное количество основных популяций лимфоцитов: Т-клетки – CD3, В-клетки – CD19, натуральные киллеры (NK) – CD3- CD16++56+, субпопуляции Т лимфоцитов (Т-хелперы CD3+ CD4+, Т-цитотоксические CD3+ CD8+ и их соотношение).
Т-лимфоциты (CD3+ клетки)
Повышенное количество CD3+ клеток свидетельствует о гиперактивности иммунитета, наблюдается при острых и хронических лимфолейкозах. Увеличение относительного показателя встречается при некоторых вырусных и бактериальных инфекциях в начале заболевания, обострениях хронических заболеваний.
Снижение абсолютного количества Т-лимфоцитов свидетельствует о недостаточности клеточного иммунитета, а именно о недостаточности клеточно-эффекторного звена иммунитета. Выявляется при воспалениях разнообразной этиологии, злокачественных новообразованиях, после травмы, операций, инфаркта, при курении, приеме цитостатиков. Повышение их числа в динамике заболевания – клинически благоприятный признак.
В-лимфоциты (CD19+ клетки)
Увеличение отмечается при аутоиммунных заболеваниях, хронических заболеваниях печени, циррозе, муковисцедозе, бронхиальной астме, паразитарных и грибковых инфекциях. Характерно в период реконвалесценции после перенесенных острых и хронических вирусных и бактериальных инфекций. Выраженное увеличение наблюдается при хроническом В-лимфолейкозе.
NK-лимфоциты с фенотипом CD3-CD16++56+
Натуральные киллеры (NK-клетки) – популяция больших гранулярных лимфоцитов. Они способны лизировать клетки-мишени, инфицированные вирусами и другими внутриклеточными антигенами, опухолевые клетки, а также другие клетки аллогенного и ксеногенного происхождения.
Увеличение количества NK-клеток связано с активацией антитрансплантационного иммунитета, в некоторых случаях отмечается при бронхиальной астме, встречается при вирусных заболеваниях, повышается при злокачественных новообразованиях и лейкозах, в периоде реконвалесценции.
Снижение наблюдается при врожденных иммунодефицитах, паразитарных инфекциях, аутоиммунных заболеваниях, облучении, лечении цитостатиками и кортикостероидами, стрессе, дефиците цинка.
Т-лимфоциты хелперы с фенотипом CD3+CD4+
Увеличение абсолютного и относительного количества наблюдается при аутоиммунных заболеваниях, может быть при аллергических реакциях, некоторых инфекционных заболеваниях. Это увеличение свидетельствует о стимуляции иммунной системы на антиген и служит подтверждением гиперреактивных синдромов.
Снижение абсолютного и относительного количества Т-клеток свидетельствует о гипореактивном синдроме с нарушением регуляторного звена иммунитета, является патогномичным признаком для ВИЧ-инфекции; встречается при хронических заболеваниях (бронхитах, пневмониях и т.д.), солидных опухолях.
Т-цитотоксические лимфоциты с фенотипом CD3+ CD8+
Повышение выявляется практически при всех хронических инфекциях, вирусных, бактериальных, протозойных инфекциях. Является характерным для ВИЧ-инфекции. Снижение наблюдается при вирусных гепатитах, герпесе, аутоиммунных заболеваниях.
Исследование соотношения CD4+/CD8+ (CD3, CD4, CD8, CD4/CD8) рекомендовано только для мониторинга ВИЧ-инфекции и контроля эффективности АРВ терапии. Позволяет определить абсолютное и относительное количество Т-лимфоцитов, субпопуляций Т-хелперов, ЦТЛ и их соотношение.Диапазон значений – 1,2–2,6. Снижение наблюдается при врожденных иммунодефицитах (синдром Ди-Джоржи, Незелофа, Вискотта-Олдрича), при вирусных и бактериальных инфекциях, хронических процессах, воздействии радиации и токсических химических веществ, множественной миеломе, стрессе, снижается с возрастом, при эндокринных заболеваниях, солидных опухолях. Является патогномичным признаком для ВИЧ-инфекции (менее 0,7). Увеличение значения более 3 – при аутоиммунных заболеваниях, остром Т-лимфобластном лейкозе, тимоме, хроническом Т-лейкозе. Изменение соотношения может быть связано с количеством хелперов и ЦТЛ у данного пациента. Например, снижение количества CD4+ Т-клеток при острой пневмонии в начале заболевания ведет к снижению индекса, а ЦТЛ при этом могут не измениться.
Для дополнительного исследования и выявления изменений иммунной системы при патологиях требующих оценки наличия острого или хронического воспалительного процесса и степени его активности, рекомендуется включать подсчет количества активированных Т-лимфоцитов с фенотипом CD3+HLA-DR+ и ТNK–клеток с фенотипом CD3+CD16++56+.
Субпопуляция натуральных киллеров с фенотипом CD3- CD56+
Молекула CD56 – адгезивная молекула, широко представленная в нервной ткани. Кроме натуральных киллеров, экспрессируется на многих типах клеток, в том число на Т-лимфоцитах.
Увеличение данного показателя свидетельствуют о расширении активности специфического клона клеток киллеров, которые имеют меньшую цитолитическую активность, чем NK-клетки с фенотипом CD3- CD16+. Количество этой популяции возрастает при гематологических опухолях (ЕК-клеточная или Т-клеточная лимфома, плазмоклеточная миелома, апластическая крупноклеточная лимфома), хронических заболеваниях, некоторых вырусных инфекциях.
Снижение отмечается при первичных иммунодефицитах, вирусных инфекциях, системных хронических заболеваниях, стрессе, лечении цитостатиками и кортикостероидами.
Снижение доли CD95+-лимфоцитов в крови пациентов свидетельствует о нарушении эффективности последнего этапа выбраковки дефектных и инфицированных собственных клеток, что может привести к рецидиву заболевания, хронизации патологического процесса, развитию аутоиммунных заболеваний и повышению вероятности опухолевой трансформации (к примеру, рака шейки матки при папилломотозной инфекции). Определение экспрессии CD95 имеет прогностическое значение при миело- и лимфопролифератиных заболеваниях.
Т-активированные лимфоциты с фенотипом CD3+CD25+, рецeптор к ИЛ2 CD25+ – маркер ранней активации. О функциональном состоянии Т-лимфоцитов (CD3+) свидетельствует количество экспрессирующих рецепторов к IL2 (CD25+). При гиперактивных синдромах количество этих клеток возрастает (острые и хронические лимфолейкозы, тимома, отторжение трансплантата), кроме того, повышение их может свидетельствовать о ранней стадии воспалительного процесса. В периферической крови их можно выявить в первые три дня болезни. Снижение числа этих клеток может наблюдаться при врожденных иммунодефицитах, аутоиммунных процессах, ВИЧ-инфекции, грибковых и бактериальных инфекциях, ионизирующей радиации, старении, отравлении тяжелыми металлами.
Т-цитотоксические лимфоциты с фенотипом CD8+CD38+ Присутствие CD38+ на ЦТЛ лимфоцитах отмечено у пациентов с разными заболеваниями. Информативный показатель при ВИЧ-инфекции, ожоговой болезни. Увеличение числа ЦТЛ с фенотипом CD8+CD38+ наблюдается при хронических воспалительных процессах, онкологических и некоторых эндокринных заболеваниях. При проведении терапии показатель снижается.
Повышение интенсивности апоптоза наблюдается при вирусных заболеваниях, септических состояниях, при употреблении наркотических средств.
Т хелперы повышены что это
здоровым людям (взрослым и детям) для оценки индивидуальных показателей иммунограммы в стабильном, здоровом состоянии. Это необходимо знать для оценки иммунного статуса пациента при заболевании в сравнении с его границами нормальных показателей. Для каждого пациента более информативна именно индивидуальная норма, нежели показатели границ нормальных колебаний из стандартного бланка анализа. В этом аспекте как раз и повышается значимость наблюдений за изменениями иммунологических показателей в динамике.
пациентам (взрослым и детям), страдающим тем или иным заболеванием (как в стадии обострения, так и при хроническом течении), для возможности сделать вывод о наличии изменений в иммунном статусе, вызванных заболеванием. При обнаружении существенных отклонений иммунного статуса от нормы в двух и более показателях, даже при отсутствии симптомов болезни, пациент относится к группе повышенного риска развития иммунопатологии.
женщинам с привычным невынашиванием беременности, при бесплодии, в том числе неясного генеза, при многократных имплантационных потерях, как однократное самопроизвольное прерывание беременности, так и привычная потеря плода в естественном цикле и после применения ВРТ (ЭКО). Это позволяет выявить особенности иммунного статуса у женщин с такими проблемами и подобрать терапию при подготовке к беременности.
женщинам и мужчинам с рецидивирующими смешанными инфекциями урогенитального тракта для исключения нарушений в системном иммунитете и развитии вторичных иммунодефицитных состояний, которые часто становятся причиной хронизации инфекционных процессов и развития резистентности к общепринятой терапии
Основные показания к назначению анализа:
рецидивирующие инфекции, инфекционные заболевания с хроническим и затяжным течением (в том числе ВИЧ, гепатиты В и С, герпес, ВПЧ);
частые простудные заболевания (бронхиты, синуситы, отиты);
хронические тонзиллиты, гаймориты;
аллергические заболевания (крапивница, бронхиальная астма, атопический дерматит, поллиноз и др.);
подозрение на генетически обусловленный (первичный иммунодефицит, ПИД) или приобретённый иммунодефицит (вторичный иммунодефицит, ВИД);
подозрение на синдром приобретённого иммунодефицита (СПИД);
обследование реципиентов до и после трансплантации органов;
обследование пациентов перед серьёзными оперативными вмешательствами; осложнённое течение послеоперационного периода;
Возможные причины повышения и снижения показателя
Повышенное количество свидетельствует о гиперактивности иммунитета, наблюдается при T-клеточных лейкозах. Увеличение относительного показателя встречается при некоторых вирусных и бактериальных инфекциях в начале заболевания, обострениях хронических заболеваний. Может повышаться при приёме биологически активных добавок, длительном приёме лекарственных препаратов (особенно монотерапии), интенсивном занятии спортом и при беременности.
Снижение абсолютного количества Т-лимфоцитов свидетельствует о недостаточности клеточного иммунитета. Выявляется при воспалениях разнообразной этиологии; вирусных, грибковых и паразитарных хронических инфекциях; аутоиммунных заболеваниях; доброкачественных и злокачественных новообразованиях; после травмы, операций, инфаркта, кровоизлияний, ожогов, стрессов; при курении, алкогольном циррозе печени, приеме цитостатиков. Повышение их числа в динамике заболевания – клинически благоприятный признак.
Увеличение абсолютного и относительного количества наблюдается при аутоиммунных заболеваниях, может быть при аллергических реакциях, некоторых инфекционных заболеваниях. Это увеличение свидетельствует о стимуляции иммунной системы на антиген и служит подтверждением гиперреактивных синдромов.
Снижение абсолютного и относительного количества Т-клеток свидетельствует о гипореактивном синдроме с нарушением регуляторного звена иммунитета, является однозначным признаком для ВИЧ-инфекции; встречается при хронических заболеваниях (бронхитах, пневмониях и т.д.), солидных опухолях.
Повышение выявляется при острой фазе аллергии, при ряде Т-клеточных лимфом, практически при всех хронических инфекциях, вирусных, бактериальных, протозойных инфекциях. Является характерным для ВИЧ-инфекции.
Снижение наблюдается при вирусных гепатитах, герпесе, аутоиммунных заболеваниях, иммуносупрессивной терапии.
Снижение наблюдается при врожденных иммунодефицитах (синдром Ди-Джоржи, Незелофа, Вискотта-Олдрича), при вирусных (особенно цитомегаловирусной инфекции и хроническом вирусном гепатите) и бактериальных инфекциях, хронических процессах, воздействии радиации и токсических химических веществ, множественной миеломе, остром и хроническом стрессе, снижается с возрастом, при эндокринных заболеваниях, солидных опухолях, сепсисе, гемофилии, малярии, шистосомозе, инфекционном мононуклеозе, кори, язвенном колите, перитоните, иммунодефиците с тимомой. Является однозначным признаком для ВИЧ-инфекции (менее 0,7).
Увеличение отмечается при аутоиммунных заболеваниях, хронических заболеваниях печени, циррозе, муковисцедозе, бронхиальной астме, паразитарных и грибковых инфекциях. Характерно в период реконвалесценции после перенесенных острых и хронических вирусных и бактериальных инфекций. Выраженное увеличение наблюдается при хроническом В-лимфолейкозе.
Снижение наблюдается при физиологических и врожденных гипогаммаглобулинемиях и агаммаглобулинемиях, лечении иммунодепрессантами, острой вирусной и хронической бактериальной инфекциях, состоянии после удаления селезенки.
NK-клетки способны лизировать клетки-мишени, инфицированные вирусами и другими внутриклеточными антигенами, опухолевые клетки, а также другие клетки аллогенного и ксеногенного происхождения.
Увеличение количества NK-клеток связано с активацией антитрансплантационного иммунитета, в некоторых случаях отмечается при бронхиальной астме, встречается при вирусных заболеваниях, повышается при злокачественных новообразованиях и лейкозах, в периоде реконвалесценции.
Снижение наблюдается при врожденных иммунодефицитах, паразитарных и вирусных инфекциях, аутоиммунных заболеваниях, облучении, лечении цитостатиками и кортикостероидами, хроническом стрессе, дефиците цинка.
Т-лимфоциты, экспрессирующие маркеры NK-клеток
Эти клетки имеют свойства как Т-, так и NK-клеток. Исследование рекомендовано как дополнительный маркер при острых и хронических заболеваниях.
Т-клетки активированные (CD3+HLA-DR+D45+)
Маркер поздней и длительной активации клеток, показатель гиперреактивности иммунитета. По экспрессии данного маркера можно судить о выраженности и силе иммунного ответа. Появляется на Т-лимфоцитах после 3-го дня острого заболевания. При благоприятном течении заболевания снижается до нормы. Увеличение экспрессии на Т-лимфоцитах может быть при многих заболеваниях, связанных с хроническим воспалением. Отмечено его повышение у пациентов с гепатитом С, пневмониями, ВИЧ-инфекцией, солидными опухолями, аутоиммунными заболеваниями.
В норме клетки с подобным фенотипом в кровотоке присутствуют в незначительном количестве. Они представляют собой высокодифференцированные клетки памяти
Системная иммунология: секреты Т-клеточного репертуара
Репертуар Т-клеточных рецепторов (TCR) определяет эффективность адаптивного иммунного ответа. Рисунок в оригинальном разрешении.
Автор
Редакторы
Иммунология — одна из самых «прикладных» и «практичных» биологических дисциплин, и эпидемия COVID-19 позволила лишний раз в этом убедиться. Одновременно это, пожалуй, один из самых сложных разделов науки о живом. В реализации иммунного ответа задействованы десятки разных типов клеток; сотни белков-лигандов: цитокинов, хемокинов; тысячи генов. Приложение методов системной биологии к решению иммунологических задач породило самостоятельную дисциплину — системную иммунологию. В третьей статье цикла «Пятерка по системной биологии» мы увидим, как методы системной биологии помогают разобраться в фундаментальных и прикладных аспектах Т-клеточного ответа.
Пятерка по системной биологии
Победителями Стипендиальной программы по системной, клеточной и молекулярной биологии, организованной российскими аффилированными лицами компании «Филип Моррис Интернэшнл» (ФМИ) на базе Центра наук о жизни Сколковского института науки и технологий, ежегодно становятся пять молодых ученых до 35 лет. Знания по своим темам у стипендиатов, без сомнения, также заслуживают «пятерки» — поэтому спецпроект и получил такое название.
В статьях цикла наши авторы пообщаются со стипендиатами разных лет, профессорами и преподавателями Сколтеха, а также с представителями ФМИ.
Партнер спецпроекта — российские аффилированные лица компании «Филип Моррис Интернэшнл» (ФМИ), которая активно ведет исследования в области биомедицины, системной биологии и биотехнологий.
Т-клеточный рецептор (TCR) — ключевая молекула адаптивного иммунного ответа
Иммунная система нашего организма состоит из двух «подсистем»: врожденного и приобретенного (адаптивного) иммунитетов. В основе этого деления лежит фундаментальное различие в молекулярных механизмах распознавания чужеродных молекул — антигенов — в этих двух подсистемах. Значимость изучения иммунной системы сложно переоценить: в 2011 году за это присудили Нобелевскую премию [1–3].
Клетки врожденного иммунитета (наиболее изученные из них — макрофаги) синтезируют множество различных рецепторов, распознающих «типичные» сигналы опасности — например, молекулу липополисахарида (LPS): важный компонент клеточной стенки бактерий. Счет таких рецепторов идет на десятки. Самая известная и хорошо изученная группа — это Toll-подобные рецепторы, но есть и другие. Число антигенов, которые могут распознать рецепторы врожденного иммунитета, может показаться небольшим, но все они проверены миллионами лет естественного отбора, так что в конечном счете врожденный иммунитет, несмотря на свою кажущуюся простоту, — весьма надежная защита. Во всяком случае, беспозвоночные животные, среди которых встречаются и крупные, и достаточно долгоживущие организмы, им обходятся.
Приобретенный (адаптивный) иммунитет устроен совсем иначе. Т-лимфоциты синтезируют лишь один тип рецепторов — Т-клеточные рецепторы (TCR). Однако если взять тысячу макрофагов, синтезирующих рецептор TLR4, то все эти рецепторы будут распознавать одну и ту же молекулу LPS. А если случайным образом выделить из пробы крови тысячу Т-клеток, то они будут распознавать тысячу разных антигенов. Подобное разнообразие достигается благодаря уникальным молекулярным механизмам, задействованным в созревании лимфоцитов: Т- и В-клеток. Подробнее обо всех этих хитросплетениях можно прочесть в статье «Иммунитет: борьба с чужими и. своими» [4].
Ген Т-клеточного рецептора на ранних стадиях созревания Т-лимфоцитов подвергается множеству перестроек и многократно мутирует в той области, которая кодирует часть рецептора, отвечающую за распознавание антигена. В разных клетках-предшественниках этот процесс идет независимо. Так что в результате зрелые Т-лимфоциты несут миллионы вариантов TCR. При этом каждая клетка синтезирует только один определенный вариант рецептора. Миллионы TCR способны распознавать миллионы антигенов — эта способность делает адаптивный иммунный ответ столь точным или, как предпочитают говорить ученые, «специфичным». Разнообразие Т-клеточных рецепторов в организме или в определенной популяции Т-лимфоцитов называется репертуаром TCR («Биомолекула» уже писала об этом [5]).
Чем богаче этот репертуар, тем больше чужеродных молекул способна распознать и обезвредить иммунная система данного человека. Изучение разнообразия Т-клеток и их рецепторов — одно из важнейших направлений современной иммунологии и интереснейшая задача с точки зрения системно-биологических подходов. Вот поэтому стипендия, которую аффилированные лица компании «Филип Моррис Интернэшнл» (ФМИ) в России вручают на базе Сколковского института науки и технологий, поддержала уже три проекта в этой области. Ну а нам особенно приятно отметить, что оба стипендиата, о которых будет рассказано далее, — не только замечательные молодые ученые, но и давние авторы и друзья «Биомолекулы».
Если у вас возник вопрос, что же такое «системная биология» и «системная иммунология», то почитайте нашу предыдущую статью из этого спецпроекта [6].
«Довольно сложно, на мой взгляд, выделить системную иммунологию во что-то отдельное от “просто иммунологии”, — говорит Иван Звягин, с.н.с. отдела геномики адаптивного иммунитета ИБХ РАН. — Методы in silico в настоящее время используются при решении практически любой задачи в иммунологии, да и в других биологических науках. Но для их разработки и совершенствования требуются “мокрые” эксперименты, в результате которых, собственно, и появляются те данные, которые системные биологи позже используют для проверки качества предсказаний. Сложно выделить “вычислительные” методы в самостоятельную науку, на мой взгляд».
Однако термин «системная иммунология» прижился, и ученые, которые заняты преимущественно теоретическими и вычислительными изысканиями в этой области, предпочитают использовать его, чтобы отличать себя от иммунологов-врачей и иммунологов-экспериментаторов.
Системная иммунология в контексте курения
«Биомолекула» спросила у Джулии Хёнг (Julia Hoeng), директора по системной токсикологии «Филип Моррис Интернэшнл», — почему же ФМИ интересно изучать иммунную систему в контексте курения?
Чтобы оценить преимущества, связанные с переходом на альтернативные продукты с пониженным риском, важно полностью понимать последствия курения для здоровья. Курение сигарет, выделяющих множество токсикантов, оказывает пагубное воздействие на иммунную систему, и этот эффект лежит в основе развития многих, если не всех, связанных с курением заболеваний. Иммунная система страдает даже у на первый взгляд здоровых курильщиков. Компоненты табачного дыма затрагивают множество клеточных популяций, участвующих в иммунном ответе, включая эндотелиальные и эпителиальные клетки, лимфоциты, макрофаги, нейтрофилы и дендритные клетки [7].
Воспалительная реакция, управляемая иммунной системой, участвует в развитии сердечно-сосудистых заболеваний (ССЗ), хронической обструктивной болезни легких (ХОБЛ) и астмы. Хроническое воздействие сигаретного дыма приводит к развитию симптомов ХОБЛ у части курильщиков: прогрессирующей потери функции легких, разрушению дыхательных путей и альвеол [8]. Иммунные клетки и их лиганды участвуют в воспалительной реакции при ХОБЛ. Нейтрофилы и макрофаги секретируют сериновые протеазы, включая нейтрофильную эластазу, катепсин G и протеиназу-3, а также матриксные металлопротеиназы ММП-8 и ММП-9, которые могут способствовать разрушению альвеол. Дополнительно было показано влияние цитотоксических CD8+ Т-лимфоцитов, Тh1 и Th17 CD4+ клеток, а также В-клеток на продукцию антител при ХОБЛ. Количество CD8+ Т-лимфоцитов в легких существенно возрастает по мере развития болезни. Эти данные говорят о влиянии иммунного ответа на прогрессирование ХОБЛ [9].
Мы надеемся, что понимание влияния сигаретного дыма на кардиореспираторные заболевания позволит оценить потенциал продуктов с пониженным риском для уменьшения побочных эффектов от курения.
Вакцина из табака
Кстати, говоря о проектах ФМИ в области иммунологии, нельзя не упомянуть и то, что компания «Медикаго», чьим акционером является одна из дочерних компаний ФМИ, достигла соглашения с правительством Канады о сотрудничестве в рамках ускоренной работы над своей кандидатной вакциной от COVID-19. «Медикаго» уже объявила о поставке 76 миллионов доз вакцины в случае ее одобрения Министерством здравоохранения Канады. Для производства вакцины применяют растительные биотехнологии с использованием растений табака (Nicotiana benthamiana).
«Близнецовый метод» в системной иммунологии
Стипендиат 2016 года: Михаил Погорелый, научный сотрудник Института биоорганической химии РАН (отдел геномики адаптивного иммунитета). Автор статьи «Мир до и после изобретения вакцин» [10] в рамках спецпроекта по вакцинации на «Биомолекуле».
Название проекта: «Секвенирование репертуара Т-клеточных рецепторов (TCR) у однояйцевых близнецов после вакцинации против желтой лихорадки».
В формировании иммунитета, как и в любом сложном биологическом процессе, участвуют по меньшей меры две силы: наследственность человека, запечатленная в его генах, и факторы внешней среды, определяющие особенности индивидуального развития. Чтобы сравнить их относительный вклад, в биологии издавна используется близнецовый метод.
Однако репертуар Т-клеточных рецепторов на первый взгляд не кажется особенно подходящим объектом для изучения таким способом. Перестройка гена ТCR [11] происходит случайно не только в каждом организме, но в каждой отдельной клетке-предшественнице (рис. 1), так что, казалось бы, у близнецов не больше шансов иметь клетки с одинаковыми Т-клеточными рецепторами, чем у любых случайно взятых людей. Однако Михаил Погорелый, стипендиат 2016 года, решил проверить, а так ли это на самом деле?
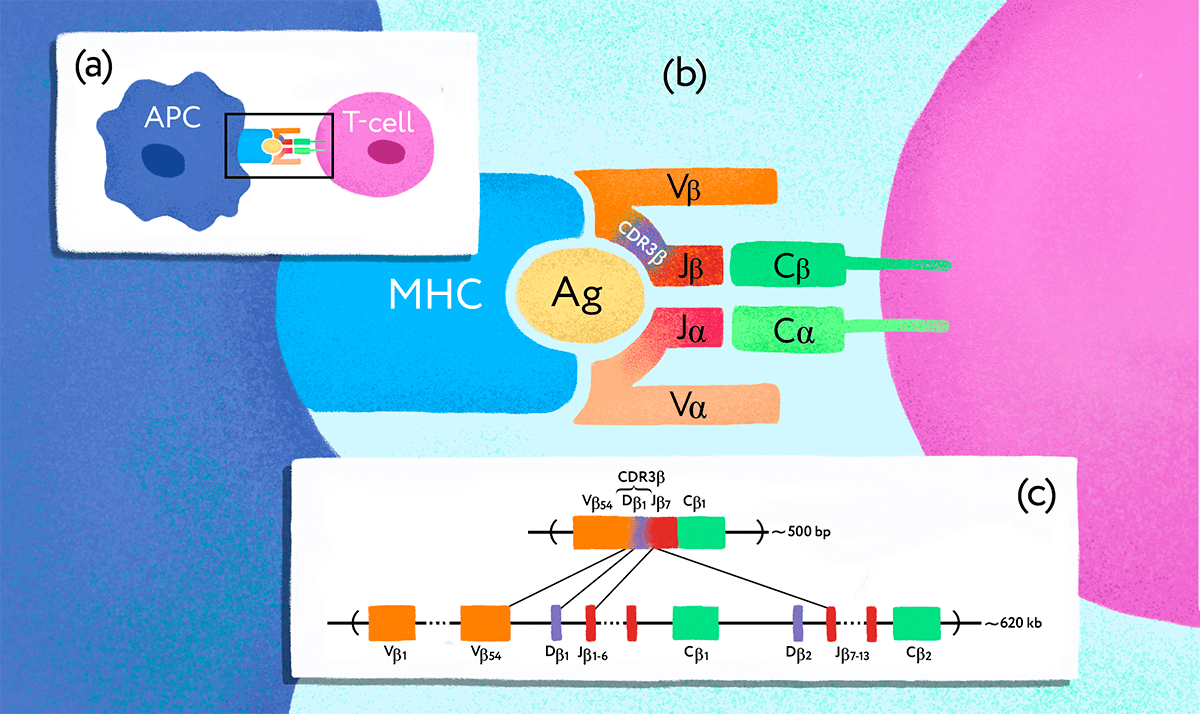
Рисунок 1. Ген Т-клеточного рецептора подвергается перестройке в клетках-предшественниках Т-лимфоцитов. (a) — Взаимодействие антигенпрезентирующей клетки (APC) и Т-лимфоцита (T-cell). (b) — TCR, состоящий из субъединиц ɑ и β, распознает чужеродный антиген (Ag), связанный с MHC. Разнообразие Т-клеточных рецепторов обеспечивается специальными молекулярными механизмами. (c) — В результате процесса, получившего название «VDJ-рекомбинация», в каждой Т-клетке оказывается свой уникальный вариант рабочего гена — так на генетическом уровне формируется репертуар разнообразных TCR.
Первая неожиданность: оказалось, что у близнецов больше клонов Т-лимфоцитов с одинаковым Т-клеточным рецептором! Как такое возможно в свете всего выше изложенного? Дело в том, что иммунная система начинает формироваться еще до рождения человека, хотя полностью «созревает» лишь через несколько лет после рождения. Однояйцевые близнецы делят одну плаценту на двоих, и похоже, что через нее они могут обмениваться иммунными клетками [12].
Дальше исследователи решили проверить, как организмы уже взрослых близнецов реагируют на введение чужеродного антигена.
«Мы использовали вакцину от желтой лихорадки как модель острой вирусной инфекции, — рассказывает Михаил Погорелый “Биомолекуле”. — Отсеквенировали репертуар TCR близнецов в нескольких временных точках, чтобы найти клоны Т-лимфоцитов, которые значимо возросли после вакцинации. Это сработало: нашли, что в каждом человеке около 1000 последовательностей β-цепи TCR проходят клональную экспансию, поскольку специфичны к эпитопам вируса желтой лихорадки».
Рецептор TCR представляет собой гетеродимерный белок, состоящий из двух субъединиц — α и β либо γ и δ, представленных на поверхности клетки (рис. 1). Субъединицы закреплены в мембране и связаны друг с другом дисульфидной связью, α/β вариант рецептора присутствует на подавляющем большинстве Т-лимфоцитов и лучше всего изучен. — Прим. автора статьи.
Михаил продолжает: «Дальше посмотрели на сами эти последовательности. Выяснилось, что:
Из результатов этой работы родилась следующая идея. Поскольку в активном иммунном ответе принимает участие много схожих TCR одновременно, то можно создать алгоритм, который будет по единственному образцу репертуара находить TCR, вовлеченные в текущий иммунный ответ (они часто собраны в кластеры схожих последовательностей). Такой алгоритм был разработан и протестирован в лаборатории. И действительно, оказалось, что он позволяет выявлять клоны, отвечающие на вакцинацию, по единственному анализу репертуара (скажем, через три недели после вакцинации). Это, разумеется, куда дешевле и проще, чем делать множество измерений в разных временных точках с той же целью [14].
Проект Михаила — наглядный пример того, как в рамках одного исследования «классическая иммунология», то есть секвенирование рецепторов близнецов, эволюционирует в «системную иммунологию» — разработку алгоритма для поиска кластеров Т-клеток, вовлеченных в текущий иммунный ответ. Именно такой логике следует общее развитие системной иммунологии в наши дни.
Михаил Погорелый о стипендии ФМИ на базе Сколтеха:
Как вы узнали о программе? Какие впечатления от участия в ней?
О программе узнал от коллег. Подготовка документов была достаточно простой, минимум формальностей: всё можно было сделать самостоятельно (без ученых советов/справок/протоколов и пр.), быстро (около одного рабочего дня) и отправить в электронном виде — выгодное отличие от большинства других стипендий. Потом оказалось, что это стиль программы в целом: минимум формальностей и бюрократии, но каждые полгода-год отчеты о ходе твоей работы в форме конференции. При этом на самих конференциях есть реальная обратная связь со стороны экспертов: вопросы, критика и т.д. На последнем году программы нам организовали поездку в Швейцарию, в исследовательский центр ФМИ в Невшателе (рис. 2). Было очень интересно посмотреть, как системная биология применяется большими корпорациями. Сложно придумать, что можно было бы улучшить в программе. Конечно, я бы советовал всем молодым ученым участвовать в ней.
Рисунок 2. Михаил Погорелый с проектом High throughput sequencing of identical twins TCR repertoires after yellow fever vaccination на отчетном семинаре в научно-исследовательском центре ФМИ в швейцарском городе Невшатель
Чем занимаетесь сейчас, через четыре года после получения стипендии?
Мы продолжаем заниматься мониторингом иммунного ответа на инфекции/вакцинацию с помощью секвенирования репертуаров, но под другими углами: на примере других вирусов (лихорадка Денге, новая коронавирусная инфекция [15]) и с большим числом пациентов.
Эти многоликие Т-лимфоциты
Стипендиат 2019 года: Софья Касацкая, аспирант Сколтеха и научный сотрудник Института биоорганической химии РАН (отдела геномики адаптивного иммунитета). Победитель конкурса «Био/Мол/Текст»-2015 «Биомолекулы» со статьей «Т-лимфоциты: путешественники и домоседы» [16] в номинации «Лучшая статья по иммунологии» и участница проекта «Наука на завтрак».
Название проекта: «Исследование формирования функциональных субпопуляций Т-лимфоцитов человека через анализ репертуаров Т-клеточных рецепторов».
Человеку, знакомому с разнообразием клеток врожденного иммунитета (макрофаги, дендритные клетки, нейтрофилы, эозинофилы и так далее), система приобретенного иммунитета может показаться даже примитивной, ведь в ней, казалось бы, всего два типа клеток: Т-лимфоциты и В-лимфоциты. Однако это впечатление ошибочно. Во-первых, Т-клетки делятся на две большие группы: «киллеры» (CD8+) и «хелперы» (CD4+). А во-вторых, даже внутри этих групп, особенно среди Т-хелперов, также наблюдается большое разнообразие. Разные группы Т-хелперов — Th1, Th2, Treg, Th9, Th22 — синтезируют различные типы цитокинов и тем самым обеспечивают разнообразие и гибкость иммунного ответа. Все эти Т-лимфоциты экспрессируют на своей поверхности TCR. Естественным образом возникает вопрос: а насколько одинаковы или, напротив, различны репертуары Т-клеточных рецепторов в разных Т-клеточных популяциях? Поискам ответа на него посвящен проект Софьи Касацкой, стипендиата 2019 года.
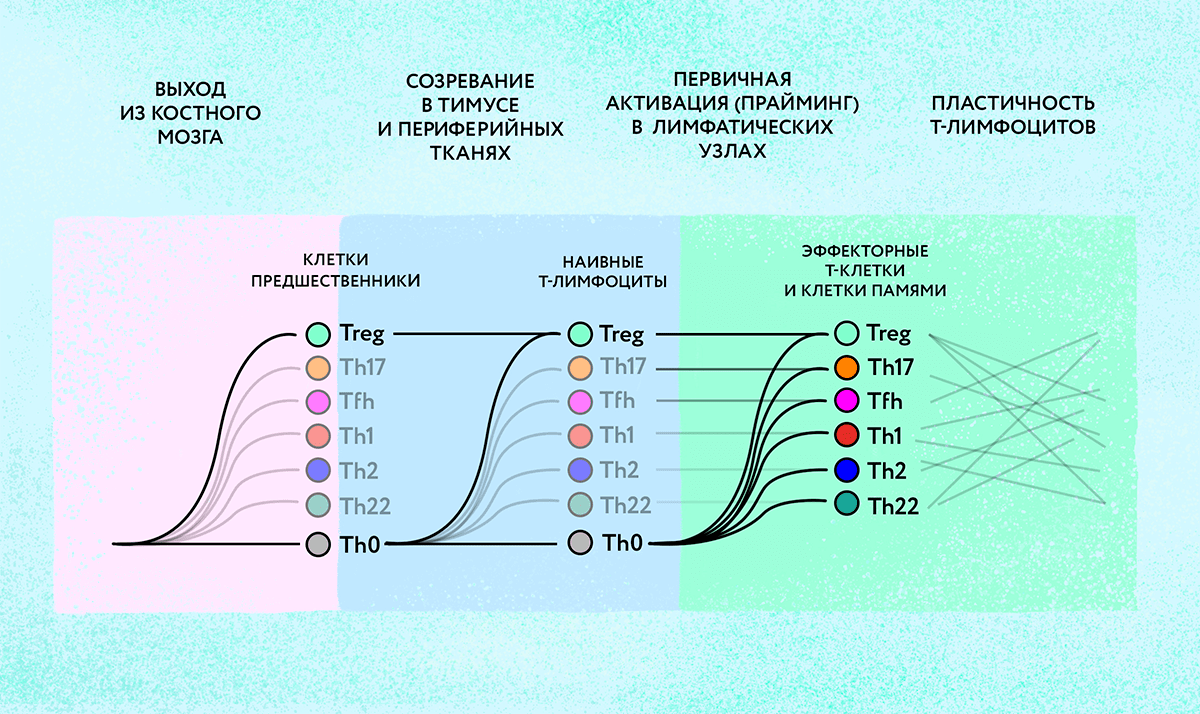
При этом нужно учесть, что различные типы Т-хелперов при определенных условиях способны превращаться («перепрограммироваться») друг в друга (рис. 3). Механизмы и пути таких перевоплощений изучены пока недостаточно. Но анализ репертуаров ТСR может пролить свет на запутанные отношения между различными популяциями Т-лимфоцитов. Совпадение репертуаров рецепторов в двух разных популяциях клеток-хелперов дает основания полагать, что эти группы клеток имеют общее происхождение и, вероятно, способны превращаться друг в друга. И, напротив, различия в репертуарах ТСR будет знаком того, что данные популяции лимфоцитов формируются независимо.
Рисунок 3. Дифференциация Т-лимфоцитов в различные субпопуляции — длительный и сложный процесс, молекулярные механизмы которого изучают иммунологи. Потенциальная способность зрелых Т-лимфоцитов менять свою специализацию (пластичность) является перспективной целью для иммунотерапии различных заболеваний.
иллюстрация Любови Колосовской по данным Софьи Касацкой
Софье удалось показать, что репертуары TCR в популяциях Th17- и Th22-лимфоцитов, играющих важную роль в регуляции аутоиммунных реакций, частично совпадают с репертуаром Th2-клеток, что указывает на тесную связь между этими тремя популяциями. При этом клетки типа Th1-17, обладающие, как это следует из названия, свойствами как Th1, так и Th17-лимфоцитов, имеют общие TCR только с Th1-клетками, но не с Th17. Это позволяет с уверенностью говорить об их происхождении от Th1-лимфоцитов [17]. Так, изучение разнообразия Т-клеточных рецепторов позволяет пролить свет на механизмы пластичности Т-лимфоцитов, понимание которых очень важно, например, при разработке новых видов иммунотерапии.
Особое внимание в проекте уделяется регуляторным Т-клеткам (Treg). Эта популяция Т-лимфоцитов имеет особый путь развития. Их задача в организме — удерживать иммунный ответ в безопасных для организма рамках. Нарушение в активности этих клеток может привести к развитию аутоиммунных заболеваний. Чтобы изучить процесс формирования этой стороны иммунитета, исследователи планируют сравнить TCR-репертуар регуляторных клеток у новорожденных с незрелой иммунной системой, контактировавшей лишь с небольшим числом чужеродных агентов, и у взрослых людей.
Первая статья с результатами по этому проекту уже отправлена в журнал, так что пожелаем Софье скорой и успешной публикации.
Софья Касацкая о стипендии:
Как вы узнали о программе? Какие впечатления от участия в ней?
Я предложила свой проект на конкурс на второй год обучения в аспирантуре: у меня уже были наработки и хорошее понимание проекта, и я знала, что есть такой конкурс, который вместе проводят Philip Morris International и Сколтех. На тот момент мой коллега и соавтор Женя уже получил стипендию на год раньше, с другим проектом.
Евгений Егоров получил стипендию ФМИ в 2017 году, для исследований по теме «Влияние возраста на репертуар Т-клеточных рецепторов наивных Т-лимфоцитов». Результаты этой научной работы опубликованы в статье The Changing Landscape of Naive T Cell Receptor Repertoire With Human Aging [18]. — Прим. автора статьи.
В этом месте менеджер индустриальных проектов Сколтеха Вера Рыбко отмечает, что обычно обратная связь дается на отчетном семинаре, который не проводился только в 2020 году из-за эпидемиологической обстановки. Этот семинар обязательно возобновится в будущем. — Прим. автора статьи.
Тем, кто планирует участвовать в конкурсе, советую побольше обсуждать план проекта для стипендии перед тем, как подавать заявку. Советы старших коллег и кого-то, кого вы хотели бы видеть своим ментором, могут помочь доработать заявку, сделать ее более реалистичной и хорошо спланировать части исследования по годам выполнения проекта. Может быть, советы даст человек, который не так хорошо знает вашу область науки, как вы, но обладает бóльшим опытом организации, администрирования таких проектов. Лучше пройти несколько итераций такой обратной связи, чем подавать сыроватую заявку, когда вы в себе не уверены.
Что вам дало получение стипендии, что изменило в вашей жизни? Что вы планируете делать после ее завершения?
Мое рабочее время делится между несколькими проектами, к которым добавляется участие в проектах моих коллег и коллабораторов. Только часть этой деятельности связана со стипендией и кандидатской диссертацией. Не могу сказать, что стипендия сильно меняет фокус или режим работы или жизни. Но исследования, использующие высокопроизводительное секвенирование, всегда дорогостоящие, и тут поддержка моих экспериментов Сколтехом и стипендией ФМИ очень ценна: получается покрыть стоимость реагентов на 1–2 запуска прибора в год.
Широкие горизонты системной иммунологии
Так получилось, что оба упомянутых в статье стипендиата работают над задачами, связанными с репертуаром Т-клеточных рецепторов. Но это далеко не единственная область иммунологии, где применяются методы системной биологии. Одни ученые собирают и упорядочивают информацию о сигнальных путях иммунных клеток — чтобы использовать ее при анализе разнообразных омиксных данных. Другие строят математические модели, описывающие поведение лимфоцитов. Третьи используют технологии «распознавания образов» (image recognition) для того, чтобы углубить наше знание о взаимодействии иммунных клеток. И это далеко не полный перечень тем и подходов, которые используют иммунологи сегодня. Своими соображениями о будущем системной иммунологии и самых интересных задачах, стоящих перед этой наукой, с нами поделился старший научный сотрудник ИБХ РАН Иван Звягин (рис. 4):
Рисунок 4. Иван Звягин, с.н.с. отдела геномики адаптивного иммунитета ИБХ РАН и зав. лабораторией механизмов иммунотолерантности НИИ трансляционной медицины РНИМУ им. Н.И. Пирогова
«В современной иммунологии есть интереснейшие направления, где алгоритмы анализа больших “иммунологических” и вообще “биологических” данных играют главенствующую роль, так как на их основе можно создавать инструменты, предсказывающие те или иные иммунологические явления и позволяющие манипулировать иммунным ответом в нужном направлении.
В частности, на данный момент мы плохо понимаем, каким образом в каждом конкретном случае происходит связывание Т-клеточного рецептора с комплексом пептид—МНС (pMHC, peptide-loaded major histocompatibility complex), которое приводит к активации Т-лимфоцитов.
Если мы научимся предсказывать силу связывания TCR с тем или иным pMHC на основе их аминокислотных последовательностей, это позволит понять, чем определяется иммуногенность того или иного антигена. В сочетании со знаниями о закономерностях формирования репертуара распознающих рецепторов, это даст возможность разработать алгоритмы для предсказания оптимальных эпитопов для выработки нужного иммунного ответа против новых инфекций или терапии опухолей, оценки риска распознавания “своего” и рационального дизайна узнающей части рецепторов при совершенствовании способов клеточной терапии (например CAR-T-терапия [19]).
С другой стороны, те же алгоритмы будут задействованы и в направлении создания неиммуногенных вариантов белковых последовательностей, когда это важно — например при генотерапии.
Ответы на все эти вопросы — дело ближайшего будущего. Полученные данные и созданные алгоритмы в дальнейшем позволят разрабатывать способы рационального дизайна иммунной системы, исходя из особенностей конкретного человека, с целью снижения риска развития заболеваний и увеличения продолжительности активной жизни».
Свое видение будущего системной иммунологии есть и у Джулии Хёнг из ФМИ:
Ключевая задача биологии и иммунологии XXI века состоит в том, чтобы определить, на какие факторы мы должны воздействовать, чтобы перепрограммировать иммунную систему в нужном нам направлении и улучшить здоровье человека при различных воспалительных заболеваниях. Чтобы добиться этой цели, мы должны понимать сложные молекулярные взаимодействия, которые управляют развитием болезни. Системная иммунология позволяет измерять, как различные компоненты иммунной системы изменяются и взаимодействуют во времени и пространстве в ответ на изменение факторов внешней среды или генетические вариации, с целью точного определения ключевых компонентов (молекул, клеток, тканей) и взаимодействий, которые управляют иммунными реакциями. Вычислительный анализ тысяч молекулярных изменений одновременно должен обеспечить понимание иммунных изменений в пораженной ткани [20], [21].
Кроме того, современные проблемы диагностики и лечения заболеваний заключаются в отсутствии биомаркеров, которые можно было бы обнаружить в образцах, взятых неинвазивным путем (кровь, моча и т.д). Воспаленная ткань посылает сигналы в систему кровообращения, когда ситуация обостряется. Однако если бы болезнь можно было обнаружить на ранних стадиях, у нас было бы больше возможностей для вмешательства. В настоящее время неинвазивные (например, из крови, а не из биоптата тканей) биомаркеры, как правило, основаны на отдельных молекулах и плохо работают в ранней диагностике. Но можно надеяться, что вычислительные методы системной иммунологии, позволяющие анализировать тысячи молекул и их взаимодействий одновременно, позволят найти более эффективные решения для ранней диагностики многих заболеваний [22], [23].
В частности, наша группа продемонстрировала потенциал подобного подхода на примере образцов крови курильщиков [24] и при переходе на продукты с пониженным риском [25].
Заключение
Иммунные клетки, как было рассказано выше, проходят сложные пути дифференциации и развития, которые мы пока понимаем лишь отчасти. Чтобы разобраться в фундаментальных механизмах, определяющих разнообразие клеточных популяций в человеческом теле (около 200 типов!), мы должны опуститься еще глубже — с клеточного на молекулярный уровень — и попытаться понять, каким образом организация хроматина в ядрах клеток определяет их способность участвовать в тех или иных сигнальных путях. Этой интереснейшей теме будет посвящена следующая статья нашего цикла.