Таблетки мочевина для чего применение
Мочевина
Показания к применению
Отек мозга (профилактика и лечение); глаукома (острый приступ); предоперационная подготовка больных с высоким внутриглазным давлением.
Возможные аналоги (заменители)
Действующее вещество, группа
Лекарственная форма
Лиофилизат для приготовления раствора для инфузий
Противопоказания
Гиперчувствительность к компонентам препарата, дегидратация, тяжелая печеночная/почечная недостаточность, отек мозга на фоне геморрагического инсульта (возможно повторное кровотечение).
C осторожностью. ХСН, почечная/печеночная недостаточность, гиповолемия.
Как применять: дозировка и курс лечения
Фармакологическое действие
Побочные действия
Особые указания
Растворение препарата происходит с поглощением тепла (раствор охлаждается); перед введением раствор выдерживают, пока его температура не достигнет комнатной.
Для предупреждения нарушения водного баланса в первые 24 ч после введения проводят в/в капельную инфузию препаратом 500-800 мл 0.9% раствора NaCl или декстрозы, с добавлением 0.2-0.3 г аскорбиновой кислоты, 0.1-0.15 г тиамина.
Больным, находящимся в бессознательном состоянии или во время общей анестезии, проводят катетеризацию мочевого пузыря.
При в/в введении следует избегать попадания раствора под кожу во избежание раздражения и некроза тканей.
Возможно применение при СН (только в комбинации с петлевыми диуретиками) и при гипертоническом кризе с энцефалопатией.
В период лечения необходим контроль АД, электролитов, функции почек, концентрации азота Мочевины.
Взаимодействие
Повышает выведение почками Li+. Др. диуретики, включая ингибиторы карбоангидразы, могут снижать эффект препарата (необходимость коррекции дозы).
Вопросы, ответы, отзывы по препарату Мочевина
Приведенная информация предназначена для медицинских и фармацевтических специалистов. Наиболее точные сведения о препарате содержатся в инструкции, прилагаемой к упаковке производителем. Никакая информация, размещенная на этой или любой другой странице нашего сайта не может служить заменой личного обращения к специалисту.
Гидроксикарбамид (500 мг)
Инструкция
Торговое название
Международное непатентованное название
Лекарственная форма
Капсулы 250 мг, 500 мг
Состав
Одна капсула содержит
активное вещество – гидроксикарбамид – 250 мг или 500 мг;
вспомогательные вещества – кислота лимонная моногидрат, динатрия фосфат безводный, кальция стеарат, натрия лаурилсульфат, натрия цитрат 5,5-водный.
Состав
Состав
Описание
Капсулы твердые желатиновые белого цвета, размером № 0 ( для дозировки 250 мг);
Капсулы твердые желатиновые желтого цвета, размером № 0 ( для дозировки 500 мг);
Фармакотерапевтическая группа
Прочие противоопухолевые препараты. Гидроксикарбамид.
Фармакологические свойства
Фармакокинетика
При приеме внутрь гидроксикарбамид хорошо абсорбируется из желудочно-кишечного тракта и сразу проникает в ткани. Не кумулирует в организме. В спинномозговой жидкости находится 10-20%, в асцитической – 15-50% концентрации в плазме. Проходит через гематоэнцефалический барьер. Максимальная концентрация в плазме крови достигается через 1-4 часа после приема препарата и составляет в среднем 22,9-65,6 мг/л. Через 24 часа после приема содержание препарата в плазме приближается к нулю. Период полувыведения составляет 3-4 часа. При увеличении доз наблюдается непропорциональное увеличение Cmax и AUSs. Данные о влиянии пищи на абсорбцию гидроксикарбамида отсутствуют. Препарат распределяется быстро и по всему организму. До 60% от пероральной дозы препарата проходит метаболические пути, которые полностью не охарактеризованы. Метаболизируется препарат частично в печени, частично, незначительно, путем деградации уреазой кишечных бактерий. Выделяется преимущественно почками. Около 80% препарата, принятого внутрь или введенного внутривенно в дозах от 7 до 30 мг/кг, выводится с мочой в течение 12 ч после приема. Выводится также через дыхательные пути в виде диоксида углерода. Подвергается элиминации во время диализа.
Особые группы населения:
Нет различий в фармакокинетике у людей в зависимости от возраста, пола, расы. Также нет фармакокинетических данных в педиатрической практике.
У пациентов с нарушенной функцией почек необходимо снижать дозу препарата. У таких пациентов необходимо тщательно контролировать показатели крови. Нет данных, поддерживающих необходимость снижения дозы препарата у пациентов с нарушенной функцией печени. Однако, у таких пациентов также необходимо контролировать показатели крови.
Фармакодинамика
Гидроксикарбамид – противоопухолевый препарат. Точный механизм действия гидроксикарбамида неизвестен. Наиболее важный эффект гидроксикарбамида связан с блокированием системы рибонуклеидредуктазы, которая приводит к подавлению синтеза ДНК. Клеточная резистентность к гидроксикарбамиду обычно связана с повышением уровня рибонуклеидредуктазы в результате амплификации гена.
Показания к применению
хронический миелолейкоз, остеомиелофиброз, эритремия, эссенциальная тромбоцитемия, меланома;
злокачественные опухоли головы и шеи (за исключением рака губы) при невозможности радикального хирургического лечения или лучевой терапии;
рак шейки матки (в комбинации с лучевой терапией).
Способ применения и дозы
Препарат принимают внутрь, до еды, запивая небольшим количеством воды. При невозможности проглатывания капсулы ее содержимое можно высыпать в стакан с небольшим количеством воды, перемешать и немедленно принять, не дожидаясь полного растворения.
Применяют как в режиме монотерапии (паллиативная химиотерапия III-IV линии), так и в комбинации с другими цитостатическими препаратами или лучевой терапией. Дозы препарата, кратность приема и продолжительность курса лечения определяются врачом индивидуально, в соответствии с показаниями и состоянием больного, в зависимости от веса пациента. Из-за низкой частоты встречаемости меланомы, устойчивого хронического миелолейкоза, рака яичников и рака головы и шеи у детей, схемы приема препарата не были установлены. При использовании препарата совместно с другими миелосупрессивными препаратами может потребоваться коррекция дозы лекарственного средства. Препарат может привести к увеличению уровня в сыворотке крови мочевой кислоты, что требует необходимости коррекции дозы урикозурических препаратов.
Побочные действия
— подавление функции костного мозга, лейкопения, мегалобластоз
— анорексия
— тошнота, рвота, стоматит
— увеличение показателей ферментов печени, увеличение уровня билирубина в крови
— макулопапулезная сыпь, эритема лица, акральная эритема
— транзиторное нарушение клубочковой функции почек, сопровождающееся увеличением мочевой кислоты в крови, повышением уровня мочевины и креатинина в крови, задержка мочи, отек, интерстициальный нефрит
— лекарственная лихорадка, озноб, недомогание
— синдром лизиса опухоли
— неврологические нарушения, включая головную боль, головокружение, дезориентацию, судороги
— отек легких, острые легочные реакции: диффузная инфильтрация легких, легочный фиброз, одышка
— похожие на дерматомиозит изменения кожи, гиперпигментация кожи, атрофия кожи, пигментация ногтей, атрофия ногтей, кожные язвы (особенно, язвы нижних конечностей), зуд, актинический кератоз, рак кожи (плоскоклеточный рак, базально-клеточная карцинома), фиолетовые папулы, десквамация
Случаи развития панкреатита и гепатотоксичности (с возможным смертельным исходом), а также тяжелой периферической нейропатии отмечены у больных с ВИЧ, которые принимали гидроксикарбамид совместно с антиретровирусными препаратами, в частности диданозин в комбинации со ставудином или без него.
У пациентов, получавших гидроксикарбамид в сочетании с диданозином, ставудином и индинавиром, было отмечено снижение количества CD4 клеток примерно 100/мм3.
Противопоказания
— повышенная чувствительность к активному веществу или любому другому компоненту лекарственного средства
— острая почечная или печеночная недостаточность
— тромбоцитопения (менее 100×109/л), выраженная лейкопения (менее
2,5× 109/л), анемия тяжелой степени
— вирусные (ветряная оспа, опоясывающий лишай) и другие инфекции
— беременность, период лактации
— детский возраст до 18 лет
С осторожностью: лица пожилого возраста и дети (требуется уменьшение доз), пациенты, которым ранее проводилась лучевая или химиотерапия, больные с опухолью почек.
Лекарственные взаимодействия
Гидроксикарбамид повышает фармакологические эффекты цитарабина; ослабляет – 5-фторурацила и метотрексата. Увеличивает (взаимно) миелотоксичность препаратов, угнетающих функцию костного мозга. Риск развития нефропатии возрастает при совместном назначении с урикозурическими средствами. В сочетании с антидепрессантами, антигистаминными, седативными, снотворными, наркотическими препаратами и алкоголем усиливает торможение скорости реакции. При введении живых вирусных вакцин возможны усиление побочных эффектов или снижение выработки антител; инактивированных вакцин – снижение выработки противовирусных антител.
Комбинация с лучевой терапией может приводить к усилению побочных эффектов, которые связаны с миелосупрессией, поражением слизистой оболочки желудка.
Исследования показали, что существует аналитическая интерференция гидроксикарбамида с ферментами (уреаза, уриказа, лактатдегидрогеназа), которые используются при лабораторном определении содержания мочевины, мочевой кислоты и молочной кислоты, что приводит к ложному увеличению результатов анализов у пациентов, принимающих это лекарственное средство.
Особые указания
Лечение должен проводить только опытный гематолог или онколог.
Перед началом лечения или в ходе терапии показана коррекция глубокой анемии (переливание препаратов цельной крови).
Перед и во время лечения (не реже 1 раза в неделю) необходим регулярный анализ крови, включающий определение уровня гемоглобина, развернутой лейкоцитарной формулы и числа тромбоцитов. При уменьшении числа лейкоцитов ниже 2,5×109/л и тромбоцитов ниже 100×109/л, курс лечения прерывают до появления четкой тенденции к нормализации гематологических показателей. Рекомендуется также динамический контроль за уровнем мочевой кислоты, креатинина, трансаминаз. При снижении клиренса креатинина менее 10 мл/мин, дозу гидроксикарбамида уменьшают в 2 раза.
В процессе лечения важно потребление достаточного количества жидкости с целью усиления диуреза для обеспечения выведения мочевой кислоты. Пациентов следует проинформировать о необходимости обильного питья.
У пациентов, длительно применяющих гидроксикарбамид для лечения таких миелопролиферативных заболеваний, как истинная полицитемия и тромбоцитемия, возможно развитие вторичной лейкемии.
Во время лечения гидроксикарбамидом рекомендуется проводить мониторинг состояния кожных покровов, так как описаны отдельные случаи развития сквамозной карциномы кожи.
Гидроксикарбамид не следует применять для лечения больных с редкой наследственной патологией: непереносимостью галактозы, дефицитом лактазы (болезнь Лапа) или нарушением всасывания глюкозы и галактозы.
Больные с почечной или печеночной недостаточностью
Опыт применения препарата у пациентов с нарушенной функцией печени и (или) почек незначителен. Поэтому при лечении подобных больных следует соблюдать особую осторожность, особенно на начальной стадии терапии.
Пожилые пациенты могут оказаться особенно чувствительными к действию гидроксикарбамида, поэтому нередко требуется снижение дозы препарата.
Особенности влияния лекарственного средства на способность управлять транспортным средством или потенциально опасными механизмами
В период лечения необходимо воздержаться от занятий потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций.
Передозировка
Симптомы: при назначении высоких доз препарата (выше 60 мг/кг/сут.) могут усиливаться нежелательные эффекты, в т.ч. с тяжелыми нарушениями функции костного мозга.
Лечение: симптоматическое, профилактическая противоинфекционная терапия, переливание компонентов крови по показаниям. В отдельных случаях – гемодиализ.
Форма выпуска и упаковка
По 10 капсул в контурную ячейковую упаковку. По 1 или 3 контурных упаковки вместе с инструкцией по медицинскому применению на государственном и русском языках помещают в пачку.
Упаковка для стационаров: по 150 контурных упаковок с соответствующим количеством инструкций по медицинскому применению на государственном и русском языках помещают в коробку.
Условия хранения
Хранить в защищенном от влаги и света месте при температуре не выше 25 C.
Хранить в недоступном для детей месте.
Срок хранения
Не использовать по истечении срока годности, указанного на упаковке.
Условия отпуска из аптек
Производитель
РУП «Белмедпрепараты», Республика Беларусь
Юридический адрес и адрес для принятия претензий:
220007, г. Минск, ул. Фабрициуса, 30,
т./ф.: (+375 17) 220 37 16,
Наименование и страна владельца регистрационного удостоверения
РУП «Белмедпрепараты», Республики Беларусь
Адрес организации, принимающей на территории Республики Казахстан претензии от потребителей по качеству продукции:
Юридический адрес: РК050028, г. Алматы, ул. Бейсебаева д.151
Фактический адрес: РК 050022, г.Алматы, ул Абая 48 А 2 этаж
Номера телефонов/факса: 8(727) 383-93-74; 383-93-69
Местное применение мочевины в уходе за кожей: обзор
Леонардо Челлено, Католический университет Святого Сердца, Рим, Италия, WILEY Дерматологическая терапия, 19 июля 2018 г., DOI: 10.1111/dth.12690
Аннотация
Нарушения барьерной функции связывают с рядом кожных заболеваний, включая ксероз, атопический дерматит и псориаз. Мочевина, компонент естественного увлажняющего фактора кожи, играет важную роль в сохранении гидратации и целостности кожи. Несколько исследований изучали влияние мочевины в клинических условиях. В настоящей статье мы обобщаем доступные клинические данные о влиянии мочевины на поддержание здоровья кожи и лечение кожных заболеваний. В более низких дозах (≤10%) препараты местного применения, содержащие мочевину, действуют как увлажнитель кожи, в то время как при более высоких концентрациях (>10% мочевины) препараты на основе мочевины оказывают кератолитическое действие. (например, Аквапилинг (aquapiling.net)) Мочевина также полезна при комбинированной терапии противовоспалительными и противогрибковыми препаратами в силу своей активности в качестве усилителя проникновения.
КЛЮЧЕВЫЕ СЛОВА
атопический дерматит, вульгарный ихтиоз, кератолитическое средство, увлажняющее средство, онихомикоз, псориаз, мочевина местного применения, ксероз
ВВЕДЕНИЕ
Роль кожи заключается в защите тела от вредного воздействия окружающей среды при сохранении соответствующих механических свойств, в том числе эластичности. Здоровая кожа характеризуется эффективным контролем потери воды, что позволяет поддерживать хороший уровень увлажнения и, следовательно, прочный физический и химический барьер (Verdier-Sévrain & Bonté, 2007).
Мочевина – это полярная гигроскопическая молекула, эндогенно вырабатываемая человеческим организмом и естественным образом обнаруживаемая в коже. Мочевина образуется в результате метаболизма белков и других органических соединений азота и выделяется с мочой и потом (Kapuscinska & Nowak, 2014; Mosher, 1933). Как один из компонентов натурального увлажняющего фактора (NMF), мочевина способствует сохранению здорового уровня увлажнения кожи. Несмотря на постоянное открытие новых ингредиентов и новых составов для ухода за кожей, мочевина по-прежнему остается одной из самых полезных молекул, доступных дерматологам из-за ее молекулярных и функциональных характеристик. В настоящей статье мы представляем обзор клинических данных, подтверждающих использование мочевины для поддержания целостности кожи и лечения заболеваний, связанных с дисфункцией кожного барьера.
МОЧЕВИНА И КОЖА
Соответствующий уровень гидратации необходим для поддержания механических свойств кожи, таких как прочность, гибкость и эластичность (Mojumdar, Pham, Topgaard, & Sparr, 2017). In vivo нормальный уровень гидратации находится в диапазоне 30–50% от сухого веса рогового слоя (Caspers, Lucassen, Carter, Bruining, & Puppels, 2001). Вода, обнаруживаемая в роговом слое, в основном поглощается корнеоцитами, способными увеличивать свой вес при набухании до 50% (Richter, Müller, Schwarz, Wepf, & Wiesendanger, 2001; Mojumdar et al., 2017). В условиях низкой относительной влажности (RH) роговой слой является хрупким и ломким, становясь более эластичным по мере увеличения относительной влажности (Mojumdar et al., 2017). Изменения относительной влажности также изменяют подвижность кератиновых нитей, присутствующих в корнеоцитах, подтверждая тем самым роль воды в пластификации кератина (Mojumdar et al., 2017).
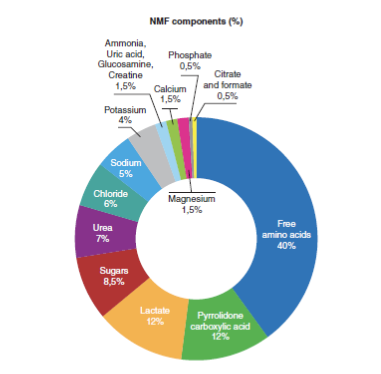
NMF имеет решающее значение для поддержания здорового рогового слоя, поскольку играет важную роль в увлажнении кожи (Robinson, Visscher, Laruffa, & Wickett, 2010). Снижение уровня NMF вызывает потерю воды в роговом слое и снижает эластичность эпидермиса (Verdier-Sévrain & Bonté, 2007). NMF состоит из молекул, которые образуются в результате распада белков или секретируются сальными и потовыми железами. Подробный состав NMF изображен на рисунке 1. Разложение филаггрина, кератин-агрегирующего белка оболочки ороговевших клеток, который образуется во время дифференцировки кератиноцитов (Simon et al., 1996; Kezic, Kammeyer, Calkoen, Fluhr, & Bos, 2009), приводит к образованию гигроскопичных аминокислот и других побочных продуктов, включая мочевину (Björklund et al., 2014). В здоровом роговом слое мочевине соответствует 7% NMF, процент, который снижается с возрастом (Verdier-Sévrain & Bonté, 2007).
По часовой стрелке: свободные аминокислоты; пирролидонкарбоновая кислота; лактат; сахара; мочевина; хлориды; натрий; калий; аммиак, мочевая кислота, глюкозамин, креатинин; кальций; фосфаты; цитрат и формиат.
РИСУНОК 1 Химический состав NMF. Данные из (Verdier-Sévrain & Bonté, 2007 г.)
МОЧЕВИНА И ФУНКЦИОНАЛЬНАЯ ЦЕЛОСТНОСТЬ МОЗОЛИСТОГО СЛОЯ
На протяжении многих лет увлажняющее действие мочевины исследовалось in vivo (Serup, 1992; Bettinger, Gloor, Gehring, & Wolf, 1995; Treffel & Gabard, 1995; Loden, 1996, 1997; Kuzmina, Hagströmer, & Emtestam, 2002); Grether-Beck, Mühlberg, Brenden, & Krutmann, 2008; Borelli, Bielfeldt, Borelli, Schaller, & Korting, 2011). Пан и его коллеги проанализировали эти клинические данные в 2013 году (Pan, Heinecke, Bernardo, Tsui, & Levitt, 2013). Было отмечено, что мочевина снижает трансэпидермальную потерю воды (Loden, 1996, 1997; Borelli et al., 2011), улучшает гидратацию (Borelli et al., 2011) и удерживает воду (Treffel & Gabard, 1995). Кроме того, мочевина способна увеличивать количество свободной воды в условиях высокой влажности (Bettinger et al., 1995) и действовать как мощный увлажнитель кожи и отшелушивающее средство (Serup, 1992).
Следует отметить тот факт, что во всех указанных клинических исследованиях использовались составы для местного применения в виде крема, эмульсии или пены с концентрацией мочевины 10% или меньше. О нежелательных явлениях не сообщалось, что подтверждает безопасность применения препаратов на основе мочевины для местного применения.
Мочевина увеличивает содержание воды в роговом слое, действуя как увлажнитель, но также за счет сохранения текучести рогового слоя (Albèr et al., 2014; Mojumdar et al., 2017). Путём измерения корнеометрии, Albèr et al. обнаружили, что мочевина способствует увлажнению кожи даже при применении в составе с пониженной водной активностью (Albèr et al., 2014). В последующем исследовании изучались молекулярные характеристики кератина и макроскопические свойства рогового слоя (SC) после добавления мочевины к дегидратированным SC и корнеоцитам, и было обнаружено, что изменения были аналогичны изменениям, происходящим при увеличении относительной влажности в отсутствие мочевины (Mojumdar et al., 2017). Эти данные подтверждают гипотезу о том, что мочевина действует как естественный эндогенный увлажнитель, заменяя воду в условиях низкой влажности и поддерживая уровень жидкости в составе рогового слоя (Mojumdar et al., 2017). В более высоких концентрациях (>10%) (например, Аквапилинг (aquapiling.net)) мочевина оказывает смягчающее/кератолитическое действие. Первые доказательства были получены в исследованиях Суонбека в 60-х годах. Эти исследования показали, что препараты с высокой концентрацией мочевины можно использовать для лечения ихтиоза и других гиперкератозных состояний (Swanbeck, 1968a, 1968b; Swanbeck & Rajka, 1970). Суонбек предположил, что при высоких концентрациях мочевина способна растворять кератин, способствуя разрушению водородных связей. Дальнейшие исследования показали, что мочевина способна вызывать конформационные изменения кератина, вызывающие денатурацию белковой структуры (Pan et al., 2013).
Помимо свойств увлажнения, сохранения текучести SK и активизации денатурации кератина, мочевина также способна участвовать в регуляции экспрессии генов (Friedman, von Grote, & Meckfessel, 2016). В исследовании Grether-Beck et al. указывается на, что мочевина индуцирует экспрессию эпидермальных генов (Grether-Beck et al., 2012). Хотя необходимы дополнительные исследования для лучшего понимания участия мочевины в регуляции экспрессии генов в SK, активная роль мочевины как индуктора экспрессии эпидермальных генов может объяснить положительные эффекты мочевины в сохранении функции кожного барьера.
МОЧЕВИНА И ЛЕЧЕНИЕ ДЕРМАТОЛОГИЧЕСКИХ СОСТОЯНИЙ
Нарушения кератинизации характеризуются качественными или количественными изменениями структуры рогового слоя. Мочевина, используемая отдельно или в комбинированной терапии, улучшает лечение таких патологических состояний, включая ксероз, атопический дерматит, вульгарный ихтиоз, псориаз и онихомикоз (Pan et al., 2013).
Ксероз или сухость кожи может быть результатом обезвоживания или изменения выработки липидов. Обезвоженная кожа, типичная для пожилых людей, в тканях которых отсутствует вода – тонкая, слабая и хрупкая. Низкое количество кожного сала и аномальные уровни липидов в эпидермисе (как при атопическом дерматите) делают кожу нежной, непрозрачной, красной и гиперчувствительной к внешним агентам. В обоих случаях составы для местного применения, содержащие мочевину, играют важную роль в лечении заболеваний. При использовании в низких дозах (в основном 10%) оказывает смягчающее/кератолитическое действие. Как усилитель проникновения через кожу мочевина облегчает пересечение кожного барьера другими молекулами и, таким образом, улучшает действие лекарств, используемых в комбинированной терапии. Составы для местного применения, содержащие мочевину, доступны в различных концентрациях и предоставляют врачам широкий спектр альтернатив для повышения эффективности лечения кожных заболеваний и улучшения самочувствия пациента.
БЛАГОДАРНОСТЬ
Поддержка по составлению и редактированию медицинских текстов была предоставлена Ракель Карвалхоса, доктором философии, и компанией «ЭРА МС СРЛ (ERA MS SRL)». Финансовую поддержку при составлении и редактировании медицинских текстов оказала компания «РЕЛАЙФ СРЛ (RELIFE SRL)».
КОНФЛИКТ ИНТЕРЕСОВ
Авторы заявляют об отсутствии конфликта интересов.
Диагностика и лечение подагрического артрита
Подагра — хроническое прогрессирующее заболевание, связанное с нарушением пуринового обмена, которое характеризуется повышением мочевой кислоты в крови и отложением в тканях опорно-двигательного аппарата и внутренних органах натриевой соли мочевой кислот
Подагра — хроническое прогрессирующее заболевание, связанное с нарушением пуринового обмена, которое характеризуется повышением мочевой кислоты в крови и отложением в тканях опорно-двигательного аппарата и внутренних органах натриевой соли мочевой кислоты (уратов) с развитием рецидивирующего острого артрита и образованием подагрических узелков (тофусов).
Подагра относится к «старым» болезням и известна со времен глубокой древности. Термин «подагра» происходит от греческих слов pus, что означает стопа, и agra — захват. Таким образом, уже в названии заболевания подчеркивается одно из кардинальных проявлений подагрического артрита. Подагра рассматривается не только как недуг, при котором патологический процесс локализуется в опорно-двигательном аппарате, но и как системное заболевание, характеризующееся поражением жизненно важных органов, и прежде всего почек. Распространенность подагры в различных регионах варьирует в широких пределах и во многом связана с особенностями питания населения, составляя в среднем 0,1%. В США этот показатель равен 0,84% (возможно, эта цифра завышена).
Подагрой болеют преимущественно мужчины (отношение мужчины/женщины составляет 9:1). У мужчин и в норме наблюдается более высокий уровень мочевой кислоты. У женщин репродуктивного возраста повышенное содержание эстрогенов способствует увеличению почечного клиренса уратов. В постменопаузальном периоде уровень мочевой кислоты у них такой же, как и у мужчин соответствующего возраста. Поэтому, если пик заболеваемости у мужчин падает на возраст 35–50 лет, то у женщин — на 55–70 лет. Однако подагра может развиваться и в более молодом возрасте и отмечается даже у детей.
Как известно, мочевая кислота является конечным продуктом расщепления пуринов и выделяется из организма почками. У здоровых лиц за 24 ч выделяется с мочой 400–600 мг мочевой кислоты. Для понимания патогенеза подагры следует остановиться на клиренсе мочевой кислоты. Он характеризует объем крови, способный очиститься в почках от мочевой кислоты за 1 мин. В норме этот показатель равен 9 мл/мин. Источником образования мочевой кислоты в организме являются пуриновые соединения, которые поступают с пищей или образуются в организме в процессе обмена нуклеотидов. В плазме крови мочевая кислота находится в виде свободного урата натрия. В норме верхняя граница этого показателя для мужчин составляет 0,42 ммоль/л (7 мг%) и для женщин — 0,36 ммоль/л (6 мг%). Содержание мочевой кислоты выше этих цифр расценивается как гиперурикемия и рассматривается в качестве фактора высокого риска развития подагры. Так, по данным Фремингемского исследования, развитие подагрического артрита наблюдается у 17% мужчин и женщин с урикемией 7,0–7,9 мг%, у 25% — с 8–8,9 мг% и у 90% — при уровне мочевой кислоты выше 9,0 мг%.
При наличии стойкого повышения мочевой кислоты в сыворотке крови выше для данного индивидуума уровня она начинает откладываться в тканях в виде свободного урата натрия, который в мочевых путях переходит в мочевую кислоту.
Выделяются следующие клинические варианты подагры:
Гиперурикемия может длительное время протекать без каких-либо субъективных и объективных симптомов и лишь случайно диагностироваться при обследовании больного. Однако она не столь безобидна, как это может показаться на первый взгляд, и нередко ассоциируется с нарушениями жирового и углеводного обмена, а также, что еще более серьезно, приводит к уратной нефропатии. Следует отметить условность дефиниции «асимтоматическая подагра». Для ее выявления необходимо повторно исследовать уровень мочевой кислоты, особенно у «подагрической личности», т. е. у мужчин молодого возраста с пристрастием к алкоголю, ожирением и артериальной гипертонией. В некоторых случаях период асимптоматической (химической) гиперурикемии длится несколько лет и только после этого происходит клиническая презентация подагры. Следует иметь в виду, что гиперурикемии обычно предшествует гиперурикозурия. Поэтому у больных с мочекислым диатезом нужно повторно исследовать уровень мочевой кислоты не только в крови, но и в моче с целью своевременного выявления подагры.
Содержание мочевой кислоты в крови может повышаться под влиянием различных факторов, как внутренних, так и внешних. Эти факторы способствуют либо увеличению образования эндогенных пуринов, либо замедлению их выделения почками. С этих позиций выделяют два типа гиперурикемии — метаболический и почечный. Метаболический тип характеризуется повышением синтеза эндогенных пуринов при наличии высокой урикозурии и нормальном клиренсе мочевой кислоты. Напротив, при почечном типе наблюдается низкий клиренс мочевой кислоты и, следовательно, нарушение выделения мочевой кислоты почками. Представленные типы гиперурикемии имеют первостепенное значение в выборе противоподагрических модифицирующих болезнь препаратов, используемых в терапии этого заболевания.
Причины повышенного биосинтеза пуринов
Нозологические формы и клинические синдромы:
Лекарства, диета и хронические интоксикации:
Причины замедления выведения мочевой кислоты почками
Нозологические формы и клинические синдромы:
Лекарства и хронические интоксикации:
Выделяют также первичную и вторичную подагру. При первичной подагре какое-либо фоновое заболевание, предшествующее ее развитию, отсутствует. В основе такой подагры лежит семейно-генетическая аномалия пуринового обмена, детерминированная несколькими генами, или так называемый «конституциональный диспуризм». Исследования уратного гомеостаза показали аутосомно-доминантный тип наследования таких аномалий. В частности, это наблюдается при врожденных нарушениях в содержании энзимов, занимающих ключевое положение в метаболизме пуринов. Так, при снижении активности гипоксантин-гуанин-фосфорибозилтрансферазы происходит увеличение ресинтеза пуринов из нуклеотидов, что способствует развитию синдрома Леша-Найхана. Этот синдром встречается только у детей и у лиц молодого возраста и обычно заканчивается уратной нефропатией с летальным исходом. При высоком содержании фосфорибозилпирофосфата также наблюдается метаболический тип гиперурикемии, так как этот фермент участвует в синтезе предшественников мочевой кислоты. Что касается вторичной подагры, то она является одним из синдромов другого заболевания, «второй болезнью», развивающейся при многих патологических процессах и чаще всего при хронической почечной недостаточности.
Большое значение в распознавании подагры, особенно ее ранней стадии, имеет клиническая картина острого подагрического артрита. Она хорошо известна, однако частота диагностических ошибок в первый год заболевания достигает 90%, а через 5–7 лет правильный диагноз ставится только в половине случаев. Поздняя диагностика связана с недооценкой классических ранних признаков заболевания, а также с многообразием дебюта и течения подагры. Ее диагностика строится на особенностях клинической картины заболевания, повышенного содержания мочевой кислоты в крови и обнаружения кристаллов урата натрия в тканях. На практике широко применяются следующие так называемые Римские диагностические критерии подагры:
Диагноз подагры считается достоверным при наличии любых двух из четырех критериев.
Менее распространены диагностические критерии подагры, предложенные Американской коллегией ревматологов (АСК) в 1977 г., которые скорее характеризуют острый воспалительный артрит или его рецидивирующие атаки, нежели подагру в целом. Согласно этим критериям, достоверный диагноз ставится при наличии 6 из 12 признаков:
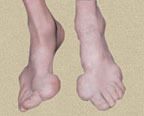
В первые 3–4 года подагра протекает по типу рецидивирующего острого воспалительного моноартрита с полным обратным развитием и восстановлением функции суставов, при этом межприступный период продолжается от нескольких месяцев до 1–2 лет. В дальнейшем этот период укорачивается, в процесс вовлекаются все новые и новые суставы и воспалительные явления локализуются не только в суставах стоп, но распространяются на суставы верхних конечностей, что обычно совпадает с образованием тофусов. Тофусы представляют собой депозиты кристаллов мочевой кислоты. Они появляются в среднем спустя 6 лет после первого приступа подагры, но иногда и через 2–3 года. Ураты чаще всего откладываются на поверхности суставного хряща, в синовиальной оболочке, синовиальных влагалищах, сухожилиях, а также в субкортикальной области эпифизов костей. Наиболее часто они располагаются на ушных раковинах и на задней поверхности локтевых суставов. Тофусы подразделяются на единичные и множественные, а также классифицируются в соответствии с их размерами, при этом к мелким относят тофусы до 1 см в диаметре, к средним — от 1 до 2,5 см и к крупным — более 2,5 см. Подагрические узлы с локализацией в опорно-двигательном аппарате являются основным элементом формирования хронического подагрического артрита. Тофусы могут располагаться в почках и других висцеральных органах.
Хроническое течение подагры не ограничивается только вовлеченностью суставов и формированием тофусов, но и характеризуется поражением внутренних органов. Подагрическая нефропатия является наиболее важным с прогностической точки зрения проявлением подагры и самой распространенной причиной летальных исходов при этом заболевании. Среди отдельных вариантов подагрической нефропатии выделяют острую мочекислую блокаду канальцев почек, мочекислый нефролитиаз, обусловленный отложением солей мочевой кислоты в чашечках и лоханках почек, хроническую уратную нефропатию и диффузный гломерулонефрит. Острая мочекислая блокада канальцев почек происходит, например, при распаде опухоли вследствие массивной медикаментозной или рентгенотерапии. Хроническая уратная нефропатия связана с отложением уратов в интерстиции почек, а развитие диффузного гломерулонефрита — с иммунными нарушениями у лиц с дисрегуляцией пуринового обмена. Такой гломерулонефрит по своей иммуноморфологии чаще всего является мезангиопролиферативным и при нем выявляют депозиты IgG и комплемента. Следует иметь в виду, что подагра часто ассоциируется с такими патологическими состояниями, как артериальная гипертония, ожирение, гиперлипидемия, жировая дистрофия печени, атеросклероз, нарушения мозгового кровообращения, алкогольная зависимость.
Течение подагры характеризуется разнообразием темпов развития болезни. Возможно относительно доброкачественное течение с редкими приступами, небольшой гиперурикемией и урикозурией и длительным сохранением функциональной недостаточности опорно-двигательного аппарата. В других случаях, напротив, с самого начала заболевания наблюдаются частые атаки острого артрита с сильными болями или непрерывные атаки с множественным поражением суставов на протяжении нескольких недель или месяцев (подагрический статус). Рефрактерное к проводимой терапии течение подагры приводит к быстрому развитию функциональной недостаточности суставов и почек.
В основе выделения вариантов течения подагры лежат: количество приступов артрита в течение года, число пораженных суставов, выраженность костно-хрящевой деструкции, наличие тофусов, патология почек и ее характер.
Варианты течения подагры
Легкое: приступы артрита 1–2 раза в год и захватывают не более 2 суставов, нет поражения почек и деструкции суставов, тофусы отсутствуют или они единичные и не превышают 1 см в диаметре.
Средней тяжести: 3–5 приступов в год, поражение 2–4 суставов, умеренно выраженная костно-суставная деструкция, множественные мелкие тофусы, поражение почек ограничено почечно-каменной болезнью.
Тяжелое: частота приступов более 5 в год, множественное поражение суставов, множественные тофусы крупных размеров, выраженная нефропатия.
Основными задачами терапии подагрического артрита являются:
Купирование острого подагрического артрита проводится противовоспалительными средствами. Для этих целей используются: колхицин — колхицин, колхикум-дисперт; нестероидные противовоспалительные препараты (НПВП) — вольтарен, дикловит, диклоран, целебрекс, мовалис); кортикостероиды — полькортолон, преднизолон, метилпреднизолон; или комбинация НПВП и кортикостероидов — амбене. Как колхицин, так и НПВП способствуют обратному развитию острого артрита в течение нескольких часов, в то время как у не прошедших лечение больных он может длиться несколько недель. До недавнего времени полагали, что лучшим препаратом для купирования приступа острого артрита при подагре является колхицин. Ярко выраженный и быстрый (в течение 48 ч) эффект колхицина рассматривался как один из диагностических признаков этого заболевания. Колхицин способен предупредить дальнейшее развитие острого приступа подагры при его назначении в первые 30–60 мин атаки. Его лечебное действие обусловлено угнетением фагоцитарной активности нейтрофилов. При остром приступе подагры мононатриевые соли уратов, фагоцитированные нейтрофилами, приводят вследствие мембранолитического их действия к гибели этих клеток и высвобождению лизосомальных ферментов, которые отвечают за развитие острого воспаления.
Из НПВП предпочтение отдают индометацину (индотард, метиндол) и диклофенаку (вольтарен, диклоран, диклофен). Эти препараты назначают в дозе 200–250 мг/сут, причем в первые часы приступа применяют большую часть суточной дозы. Проведенные контролированные исследования не выявили более высокой эффективности традиционных НПВП по сравнению с селективными ингибиторами ЦОГ-2 (нимесил, нимулид, целебрекс), например целекоксибами (коксиб, целебрекс). Однако окончательное суждение о сравнительной эффективности этих препаратов можно вынести только в ходе дальнейших исследований. Суточная доза колхицина составляет 4–6 мг/сут, причем 2/3 этой дозы больной принимает до 12 ч дня в первый день приступа. Обычно разовая доза составляет 0,6 мг и ее принимают каждый час до явного снижения подагрического воспаления. После значительного уменьшения воспаления дозу колхицина начинают снижать по 0,6 мг 2 раза в день, вплоть до полной отмены. Нередко у больных не удается наращивать суточную дозу до оптимальной из-за появления побочных реакций. Основными побочными эффектами колхицина являются тошнота, рвота, понос, возможны также геморрагический гастроэнтерит, лейкопения, нейропатия. При подагрическом статусе, характеризующемся непрерывными атаками острого артрита, рефрактерными к терапии НПВП, возможно внутривенное введение колхицина.
Противоподагрическая терапия (базисная, модифицирующая болезнь) направлена на профилактику рецидивов острого артрита, снижение содержания мочевой кислоты в крови, предупреждение дальнейшего формирования тофусов и их обратное развитие. Все противоподагрические препараты делятся на две большие группы: урикодепрессоры (урикостатики) и урикозурики. Урикодепрессоры тормозят синтез мочевой кислоты путем ингибирования фермента ксантиноксидазы, превращающего гипоксантин в ксантин, а ксантин в мочевую кислоту. Урикозурики повышают экскрецию мочевой кислоты, подавляя обратную реабсорбцию уратов почечными канальцами.
К препаратам первой группы относится аллопуринол (аллопуринол, аллопуринол-эгис, аллупол, пуринол, ремид, тиопуринол, милурит), который занимает лидирующее положение среди дру-гих противоподагрических средств. Показанием к применению аллопуринола являются метаболическая подагра, высокая гиперурикемия, частые острые атаки артрита, мочекислая болезнь, генетически обусловленный дефицит гипоксантин-гуанин-фосфорибозилтрансферазы. Применение аллопуринола возможно и у больных с подагрической нефропатией с начальными проявлениями хронической почечной недостаточности и небольшой азотемии. Начальная доза аллопуринола составляет 300 мг/сут. В случае неэффективности такой дозы ее увеличивают до 400–600 мг/сут, а при достижении клинического эффекта постепенно снижают. Поддерживающая доза определяется уровнем гиперурикемии и обычно составляет 100–300 мг/сут.
Аллопуринол способствует исчезновению атак острого артрита или их заметному ослаблению, обратному развитию тофусов и отчетливому их размягчению, снижению уровня мочевой кислоты до субнормальных цифр, нормализации показателей мочевого синдрома, урежению почечных колик и выделительной функции почек. У некоторых больных он поначалу вызывает повышение уровня мочевой кислоты и обострение подагрического артрита, поэтому на первом этапе терапии его комбинируют с противовоспалительными препаратами, в частности с низкими дозами колхицина или НПВП. По этой причине его не следует принимать при остром подагрическом артрите. При лечении аллопуринолом нередко развиваются побочные реакции, которые проявляются желудочно-кишечной токсичностью, аллергическими реакциями (кожная сыпь, эозинофилия), гепатотоксичностью с повышением сывороточных аминотрансфераз.
Урикозурические препараты, представляющие собой слабые органические кислоты, имеют меньшее значение в терапии подагры, чем урикостатики. Их не следует назначать при высоком содержании мочевой кислоты в крови, а также при нефропатии даже с начальными проявлениями почечной недостаточности. Из урикозурических препаратов сульфинпиразон и пробенецид особенно широко используются в США. Сульфинпиразон (сульфинпиразон, апо-сульфинпиразон, антуран) назначают по 200–400 мг/сут в два приема. Его, как и другие урикозурические средства, принимают с большим количеством жидкости, которую для профилактики нефролитиаза следует ощелачивать. Побочные реакции встречаются относительно часто и проявляются желудочной и кишечной диспепсией, лейкопенией, аллергическими реакциями. Противопоказанием к назначению сульфинпиразона является язвенная болезнь желудка и, конечно, подагрическая нефропатия.
Пробенецид (бенемид) является производным бензойной кислоты. Препарат назначается по 1,5–2,0 г/сут. Бензойная кислота содержится в клюкве, а также в ягодах и листьях брусники. Поэтому отвары и морсы из ягод и листьев этих растений показаны больным подагрой и в большей степени больным с подагрической нефропатией, тем более что помимо бензойной кислоты они содержат гиппуровую кислоту, обладающую урикосептическими свойствами. Урикозурическая активность присуща блокатору рецептора ангиотензина II и фенофибрату (грофибрат, нофибал). Наиболее эффективны производные бензбромарона, которые обладают не только урикозурическими свойствами, но и урикодепрессорными. Они используются в качестве монотерапии или в сочетании с аллопуринолом. Таким комбинированным препаратом является алломарон. Алломарон содержит 20 мг бензбромарона и 100 мг аллопуринола, его обычно принимают по 1 таблетке 2 раза в день.
Составной частью комплексной терапии подагры являются ощелачивающие препараты и ощелачивающие растворы, которые способны снизить риск развития нефропатии и, в частности, мочекаменной болезни. К этим препаратам относятся магурлит, блемарен и уралит. Их применение должно регулярно контролироваться показателем рН мочи. Помимо этих средств, можно принимать питьевую соду 2–4 г в день или щелочные минеральные воды.
При выраженных симптомах артрита необходимо также проводить местное лечение (долобене, финалгон, диклоран плюс, долгит крем, немулид гель, бишофит-гель).
Диете при подагре придают наибольшее значение по сравнению с другими ревматическими болезнями. Она предусматривает снижение общего калоража пищи, тем более что при подагре обычно наблюдается повышенная масса тела. Необходимо уменьшить поступление в организм экзогенных пуринов и животных жиров. Жиры снижают экскрецию мочевой кислоты почками. Крайне осторожно следует подходить к употреблению любых алкогольных напитков, включая пиво и красное вино. Исключают из пищевого рациона печенку, почки, жирные сорта мяса, мясные бульоны, копчености, горох, бобы, чечевицу, шпинат, цветную капусту, шпроты, сельдь. Следует ограничить потребление мяса до 2–3 раз в неделю, при этом лучше употреблять его в отварном виде.
Сочетание строгой диеты с длительным применением противоподагрических препаратов, а также активное воздействие на заболевания, которые повышают содержание мочевой кислоты в крови, способны существенно замедлить темпы прогрессирования костно-хрящевой деструкции, предупредить дальнейшее формирование тофусов и сохранить функциональное состояние опорно-двигательного аппарата и почек.
В. В. Бадокин, доктор медицинских наук, профессор
РМАПО, Москва