Тапентадол что это такое
ИНСТРУКЦИЯ
по применению лекарственного препарата
для медицинского применения
Регистрационный номер:
Торговое название препарата:
Международное непатентованное название:
Лекарственная форма:
Состав
Фармакотерапевтическая группа
Код АТХ: N02AX06
Фармакологические свойства
Фармакокинетические взаимодействия
Тапентадол главным образом метаболизируется посредством 2 фазы (глюкуронирования), и только малое количество метаболизируется через окислительные процессы 1 фазы. Поскольку глюкуронирование является системой высоких возможностей с низким аффинитетом, какое-либо клинически значимое взаимодействие, связанное с глюкуронированием, маловероятно. Это подтверждено опытом одновременного применения тапентадола с напроксеном и пробенецидом, наблюдался рост AUC тапентадола на 17% и 57% соответственно. При одновременном применении с парацетамолом и ацетилсалициловой кислотой никаких изменений фармакокинетических показателей тапентадола не наблюдалось. Тапентадол не является индуктором или ингибитором изоферментов цитохрома Р450. Поэтому клинически значимые взаимодействия, опосредуемые через систему изоферментов цитохрома Р450, маловероятны.
Фармакокинетика тапентадола не менялась под влиянием увеличения рН или перистальтики желудочно-кишечного тракта, вызванных омепразолом и метоклопрамидом соответственно.
Связывание тапентадола с белками плазмы крови низкое (примерно 20%). По этой причине вероятность фармакокинетических взаимодействий за счёт замещения из связи с белками плазмы мала.
Показания к применению
Противопоказания
Применение во время беременности и в период грудного вскармливания
Способ применения и дозы
Взаимодействие с другими лекарственными препаратами
Одновременное применение тапентадола с бензодиазепинами, барбитуратами и опиоидами (анальгезирующие, противокашлевые средства и средства для лечения синдрома «отмены») может повысить риск угнетения дыхания. Препараты, угнетающие деятельность центральной нервной системы (ЦНС) (бензодиазепины, нейролептики, блокаторы Н1-гистаминовых рецепторов, опиоиды, алкоголь), могут усиливать седативный эффект тапентадола и угнетение ЦНС. Если комбинация тапентадола и препаратов, вызывающих угнетение дыхания или ЦНС, необходима, следует решить вопрос о снижении дозы препаратов.
Агонисты-антагоиисты опиоидных рецепторов. Следует соблюдать осторожность при одновременном применении тапентадола с агонистами-антагонистами мю-опиоидных рецепторов (например, пентазоцин, налбуфин) или частичными агонисгами мю-опиоидных рецепторов (например, бупренорфин). При одновременном применении с бупренорфином была отмечена необходимость повышения дозы агонистов мю-опиоидных рецепторов, и в данных обстоятельствах необходим тщательный мониторинг таких побочных эффектов, как угнетение дыхания.
Имеются единичные сообщения о развитии серотонинового синдрома, по времени совпадавшего с одновременным применением тапентадола и серотонинергических препаратов, например, селективных ингибиторов обратного захвата серотонина (СИОЗС). Возможными симптомами серотонинового синдрома могут быть, например: спутанность сознания, возбуждение, повышение температуры тела, повышенное потоотделение, атаксия, гиперрефлексия, миоклопия и диарея. Отмена серотонинергических препаратов обычно приводила к быстрому исчезновению симптомов. Терапия определяется характером и выраженностью симптомов.
Поскольку основным путём метаболизма тапентадола является конъюгация с глюкуроновой кислотой с участием изоферментов UGT1A6, UGT1A9 и UGT2B7. одновременное применение с мощными ингибиторами этих изоферментов (такими как кетоконазол, флуконазол, меклофенамовая кислота) может увеличивать системную экспозицию тапентадола. Пациентам, находящимся на лечении тапентадолом, следует соблюдать осторожность в начале и при окончании одновременного применения мощных индукторов микросомальных ферментов печени (например, рифампиципа, фенобарбитала, препаратов зверобоя продырявленного), поскольку это может привести соответственно к снижению эффективности или риску возникновения побочных эффектов.
Тапентадол противопоказан пациентам, получающим ингибиторы моноаминоксидазы (МАО) или принимавшим их последние 14 дней, т.к. возможно повышение содержания но-радреналина, что может вызвать побочные эффекты со стороны сердечно-сосудистой системы, такие как гипертонический криз.
При одновременном применении тапентадола с напроксеном и пробенецидом наблюдался рост AUC тапентадола на 17% и 57% соответственно. При одновременном применении с парацетамолом и ацетилсалициловой кислотой никаких изменений фармакокинетических показателей тапентадола не наблюдалось.
Особые указания
Влияние на способность к управлению транспортными средствами и механизмами
Как и другие препараты-агонисты мю-опиоидных рецепторов, Палексия может негативно влиять на способность к управлению автотранспортом и сложными механизмами, т.к. оказывает влияние на центральную нервную систему. Особенно часто такое действие возможно в начале лечения, при любых изменениях дозы препарата, при одновременном приёме с транквилизаторами или алкоголем. Пациенты должны воздерживаться от вождения автомобиля и занятий потенциально опасными видами деятельности.
Форма выпуска
Срок годности
Условия хранения
Условия отпуска
Производитель
Наименование и адрес юридического лица, на имя которого выдано регистрационное удостоверение/Выпускающий контроль качества
Грюненталь ГмбХ, Германия, 52078, Аахен, Циглерштрассе, 6.
Grunenthal GmbH. Zieglerstrasse 6. 52078 Aachen, Germany
Фасовщик/Упаковщик
Фармацеутичи Форменти С.п.А., Италия,
21040, Ориджио (провинция Варезе), улица ди Витторио, 2.
Грюненталь ГмбХ, Германия,
52078, Аахен, Циглерштрассе, 6.
Претензии направлять по адресу:
ООО «Г рюненталь», 125040. Москва, ул. Правды, 26.
Тапентадол что это такое
Научно-исследовательский институт ревматологии им. В.А. Насоновой, Москва, Россия
Введение
Остеоартрит (ОА) – одна из наиболее частых причин хронического болевого синдрома наряду с болью в нижней части спины и головной болью. Число пациентов, страдающих ОА, постоянно увеличивается в связи со старением населения и нарастанием распространенности ожирения. Боль, обусловленная тяжестью ОА, приводит не только к инвалидизации пациента, ухудшению качества жизни, но и к уменьшает ее продолжительности, являясь значимым предиктором риска смерти [1].
Пациенты с ОА используют различные обезболивающие средства и методы, среди которых несомненным лидером остаются нестероидные противовоспалительные препараты (НПВП). Однако, несмотря на проводимое лечение, от 27 до 61% больных продолжают испытывать хроническую боль (ХБ) и не удовлетворены терапией [2].
Особенности болевого синдрома при остеоартрозе
Основной причиной болевого синдрома при ОА считаются воспалительные и дегенеративные изменения в суставе и околосуставных тканях. Однако обследование и наблюдение за пациентами с ОА в ряде случаев свидетельствуют, что интенсивность боли не всегда коррелирует с деструктивными изменениями [3] и оперативное лечение зачастую не избавляет пациента от болевого синдрома. До 44% пациентов после адекватно выполненного эндопротезирования коленного сустава и до 27% – тазобедренного продолжают испытывать боль [4].
Эти факты можно объяснить тем, что болевой синдром при ОА может иметь смешанный характер, включая признаки ноцицептивной боли и боли при центральной сенситизации (ЦС) [5].
ЦС определяют как усиление нервных сигналов в центральной нервной системе, что обеспечивает гиперчувствительность к боли – иными словами, это гипервозбудимость центральных ноцицепторов, в результате которой снижается их порог возбуждения и они сами начинают генерировать болевые импульсы, становясь источником боли [6, 7]. Впервые ЦС при формировании ХБ была описана C. Woolf в 1983 г. [8]. Длительно существующее в суставе воспаление приводит к гиперчувствительности периферических афферентных нейронов, т.е. формируется периферическая сенситизация [9]. При продолжающейся периферической сенситизации в центральной нервной системе происходят нейропластические изменения и возникает ЦС – главный механизм патогенеза хронического болевого синдрома [3, 10].
ЦС сопровождают следующие феномены: прогрессивное нарастание активности нейронов (феномен взвинчивания – wind-up), при котором нейроны становятся более восприимчивыми к повторяющимся стимулам; повышенная чувствительность к боли в интактных тканях, располагающихся далеко от зоны повреждения (вторичная гипералгезия); возрастание амплитуды и продолжительности нейронного ответа; уменьшение порога возбуждения, когда неболевые в норме стимулы активируют ноцицепторы (аллодиния) [11, 12].
Классическим примером ЦС служит фибромиалгия – заболевание, при котором нет ни воспаления, ни поражения суставов [13], а причиной является дисфункция болевой системы. Согласно данным последних исследований, явления ЦС могут встречаться не только при фибромиалгиях, но и при мигрени, боли в шее, тазовой боли, синдроме хронической усталости и др., а также при ревматических заболеваниях [14–17].
В результате хронического воспаления в суставе и его деструкции возбуждаются периферические болевые рецепторы и болевые импульсы по периферическим нервам передаются в задние рога спинного мозга. Они находятся под контролем противоболевых (антиноцицептивных) систем, деятельность которых направлена на модуляцию боли. При условии продолжающегося возбуждения, в данном случае воспаления в суставе, и слабости антиноцицептивных систем возникает ЦС.
По сравнению с ноцицептивной ХБ пациенты с ЦС сообщают о более интенсивном болевом синдроме, большем его влиянии на качество жизни, более выраженном нарушении функциональной активности, депрессии и тревоге [18].
Причины возникновения ЦС до сих пор не установлены, но можно обсуждать генетические и внешние средовые факторы. Если у пациента есть ЦС, то в клинической картине может наблюдаться быстрый переход в ХБ и недостаточный ответ на лечение [19, 20].
ЦС в спинальных и супраспинальных болевых нейронах изменяет клинические характеристики болевого синдрома. Появляются нейропатические симптомы (жжение, покалывание, онемение, прострелы током и др.), которые в отличие от собственно нейропатической боли локализуются в анатомически нелогичных зонах, т.е. топически не соответствуют какому-либо поражению соматосенсорной нервной системы. При ОА ЦС по опроснику Pain DETECT встречается у 28–30% пациентов [21–24], нейропатические характеристики боли при описании своих жалоб используют до 34% больных [25].
Наличие ЦС у пациентов с ОА подтверждается значительно более низким порогом боли на давление по сравнению со здоровой контрольной группой.
В исследовании M. Imamura et al. [26] для определения состояния нервной системы у 62 женщин с ОА коленного сустава оценивались пороги боли на давление в мышцах, связках, сухожилиях и коже нижней конечности. Было показано, что у всех больных ОА отмечались достоверно более низкие пороги боли на давление. Такое снижение коррелировало с высокой интенсивностью боли, низким качеством жизни, низкой функциональной активностью и нетрудоспособностью.
В другой работе L. Arendt-Nielsen et al. [27] производили оценку ЦС при помощи измерения порогов боли на давление (в области сустава и в отдаленной точке) у 48 женщин с ОА коленного сустава и у 24 здоровых женщин. Были выявлены достоверно более низкие пороги боли на давление у больных ОА как в области сустава, так и в отдаленной точке. Была показана обратная корреляция между значениями интенсивности боли и средними показателями порогов боли на давление в отдаленной точке.
Патогенетическая терапия наиболее эффективна при лечении ХБ. Оказывая противовоспалительное действие в области пораженного сустава, НПВП способны уменьшать ноцицептивную импульсацию. Однако их прием сопряжен с высоким риском развития нежелательных явлений со стороны как желудочно-кишечного тракта, так и сердечно-сосудистой системы. Таким образом, пациентам с тяжелой сопутствующей патологией необходим подбор противоболевой терапии с учетом их анамнеза. Ноцицептивные импульсы с периферии играют важную роль в клинической картине ХБ, однако фармакологические средства периферического действия не способны уменьшать ЦС. Только препараты центрального действия могут воздействовать на процессы, вовлеченные в ЦС, поэтому наряду с традиционной терапией пациентам с признаками ЦС следует назначать комплексное лечение, включающее также препараты центрального действия.
Опиоидный анальгетик тапентадол PR
Новый сильнодействующий анальгетик центрального действия тапентадол PR, обладающий двойным механизмом действия, связывается с мю-опиоидными рецепторами, а также ингибирует обратный захват норадреналина (НА) [28].
Мю-рецепторы, самый изученный тип опиоидных рецепторов, локализуются в нервной системе, а также в желудочно-кишечном тракте и других тканях. Среди регулируемых ими функций следует отметить ноцицепцию, дыхание, память, обучение, секрецию нейрогормонов, сократительную активность кишечника и др. При активации опиоидных рецепторов закрываются потенциал-зависимые ионные кальциевые каналы в пресинаптических нейронах и снижается выброс возбуждающих медиаторов, например глутамата, а активация калиевых каналов в постсинаптических нейронах приводит к гиперполяризации мембран, что уменьшает чувствительность нейронов к возбуждающим нейромедиаторам и таким образом уменьшается передача болевых импульсов [29].
НА является ключевым нейротрансмиттером в нисходящих антиноцицептивных путях. Путем ингибирования обратного захвата НА после его высвобождения в синапсах тапентадол увеличивает уровень этого нейротрансмиттера, активируя рецепторы α2. Эта повышенная активация рецепторов приводит к подавлению передачи боли через нейроны второго порядка. Ингибирование обратного захвата НА служит дополнением к воздействию тапентадола на мю-опиоидные рецепторы и усиливает его анальгетическую эффективность [30, 31].
Тапентадол назначают пациентам с сильной и очень сильной болью. Доза подбирается индивидуально в соответствии с выраженностью болевого синдрома, ранее проводимой терапией (отсутствие эффекта от НПВП) и возможностью наблюдения за пациентом. Тапентадол PR (пролонгированного действия) следует принимать дважды в сутки независимо от приема пищи. Таблетку необходимо принимать внутрь с достаточным количеством жидкости не разжевывая, не разламывая и не растворяя. Пациенты, не принимавшие ранее наркотических анальгетиков, начинают терапию с дозы 50 мг 2 раза в сутки с последующим титрованием при необходимости. Имеющийся опыт свидетельствует, что режим подбора дозы тапентадола с увеличением на 100 мг в сутки каждые 3 дня большинству пациентов оказывается достаточным для достижения адекватного контроля боли [34].
Эффективность тапентадола была исследована на пациентах с болевой формой диабетической полинейропатии [35]. В исследовании приняли участие 588 пациентов с полинейропатией, не удовлетворенных ранее проведенной противоболевой терапией опиоидными или неопиодными анальгетиками в течение 3 месяцев, с сохраняющейся интенсивностью боли минимум 5 баллов по 11-балльной числовой школе оценки боли NRS (Numeric rating Scale for pain). Все больные в течение 3 недель получали тапентадол с титрацией оптимальной индивидуальной дозы до 100–250 мг в сутки. Те пациенты, у которых отмечалось уменьшение интенсивности боли хотя бы на 1 балл (n=395), были далее разделены на две группы. Одна группа пациентов получала плацебо, вторая – оптимальную фиксированную дозу тапентадола в течение 12 недель.
Эффективность тапентадола также изучалась при лечении нейропатического компонента боли у пациентов с ХБ в спине в комбинации с антиконвульсантом прегабалином. Монотерапия тапентадолом в дозе 500 мг/сут (n=152) сравнивалась с комплексной терапией прегабалином 300 мг/сут и тапентадолом 300 мг/сут (n=136). В обеих группах наблюдали выраженное уменьшение показателей нейропатической боли. Вторичная оценка эффективности лечения по шкалам SF-12 и EQ-5D выявила сходную положительную динамику как при монотерапии тапентадолом, так и при комбинированной терапии тапентадолом/прегабалином. Однако случаи тошноты и сонливости отмечались значительно чаще у пациентов на комбинированной терапии [36].
Применение тапентадола PR при остеоартрозе
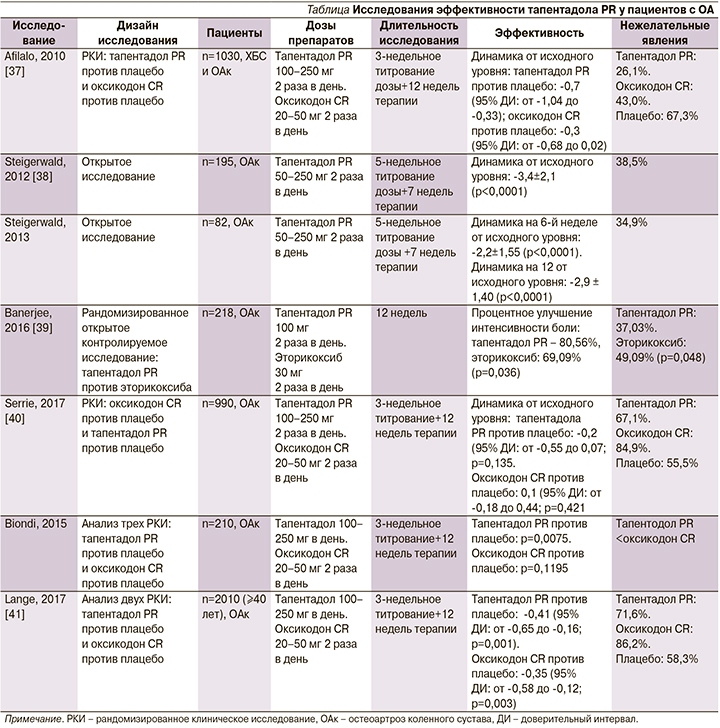
Эффективность тапентадола PR в лечении пациентов с ОА была оценена в нескольких исследованиях (см. таблицу).
В рандомизированном двойном слепом плацебо-контролируемом многоцентровом исследовании M. Afilalo et al. [37] оценивали сравнительную эффективность тапентадола PR, оксикодона и плацебо для пациентов с ОА в течение 3-недельного периода титрования с последующим 12-недельным периодом терапии и наблюдения. 1030 пациентов с ХБ в колене, обусловленной ОА, были рандомизированы для получения тапентадола 100–250 мг 2 раза в день, оксикодона 20–50 мг 2 раза в день или плацебо. В группе тапентадола отмечен значительно более высокий процент пациентов, достигших уменьшения интенсивности боли на ≥50% (32,0% [110/344]), по сравнению с плацебо (24,3% [82/337]; р=0.027), в то время как в группе оксикодона этот процент был существенно ниже (17,3% [59/342]; р=0,023). Нежелательные побочные явления со стороны желудочно-кишечного тракта отмечены у 26,1% пациентов в группе плацебо, 43,0% – на фоне терапии тапентадолом и у 67,3% больных, получавших оксикодон.
Важным аспектом выбора опиоидного анальгетика является не только выраженность обезболивающего действия, но и его переносимость. Известно, что при использовании препаратов данной группы нередко возникают нежелательные явления из-за воздействия на мю-опиоидные рецепторы, широко представленные в различных органах и тканях. Среди них выделяют желудочно-кишечные (тошнота, запоры), кардиоваскулярные (артериальная гипертензия), легочные (угнетение дыхания), эндокринные (снижение потенции) и психические эффекты, нежелательное влияние на вождение автомобиля, а также риск злоупотребления. Двойной механизм действия тапентадола в значительной степени снижает риск развития нежелательных явлений, т.к. воздействие препарата на мю-опиоидные рецепты на 40% ниже, чем у остальных опиоидов. Таким образом, выраженное обезболивающее действие и хорошая переносимость – важные преимущества препарата среди других опиоидных анальгетиков.
Риск возникновения лекарственной зависимости – также существенный фактор, ограничивающий использование опиоидных анальгетиков пациентами с хроническим болевым синдромом. В 2012 г. была исследована частота возникновения злоупотребления при лечении пациентов тапентадолом PR, оксикодоном, гидрокодоном и трамадолом, показавшая наиболее редкое развитие зависимости при применении первого из них [44, 45].
Заключение
ОА является широко распространенным заболеванием среди лиц пожилого возраста. Эффективный контроль боли имеет решающее значение в улучшении качества жизни пациентов. Выбор эффективной терапии болевого синдрома при ОА должен определяться как интенсивностью боли, так и ее патогенезом, т.е. лекарственный препарат должен воздействовать как на ноцицептивный механизм, так и на ЦС.
Механизм двойного действия тапентадола позволяет использовать его в качестве патогенетической терапии выраженной боли у пациентов с ОА. Хорошая переносимость и высокая эффективность позволяют рекомендовать тапентадол PR пациентам пожилого возраста для консервативного лечения ОА при наличии противопоказаний или недостаточной эффективности НПВП, а также в качестве терапии постоперационной боли больным, перенесшим эндопротезирование сустава, и в рамках реабилитации.
Литература
1. Roy S., Meachim G. Chondrocyte ultrastructure in adult human articular cartilage. Ann Rheum Dis. 1968;27:544–58.
2. Breivik H., Collett B., Ventafridda V., et al. Survey of chronic pain in Europe: prevalence, impact on daily life, and treatment. Eur J Pain. 2006;10: 287–333. Doi. 10.1016/j.ejpain.2005.06.009.
3. Kidd B.L. Osteoarthritis and joint pain. Pain 2006;123(1–2):9. Doi: 10.1016/j.pain.2006.04.009.
4. Wylde V., Hewlett S., Learmonth I.D., Dieppe P. Persistant pain after joint replacement: Prevalence, sensory qualities, and postoperative determinants. Pain. 2011;152:566–72. Doi: 10.1016/j.pain.2010.11.023.
5. Филатова Е.С., Туровская Е.Ф., Алексеева Л.И. Исследование эффективности прегабалина в терапии хронической боли у пациентов с остеоартрозом коленных суставов. Терапевтический архив. 2017;89(12):81–5. Doi: 10.17116/terarkh2017891281-85.
6. Staud R., Craggs J.G., Robinson M.E., et al. Brain activity related to temporal summation of C-fiber evoked pain. Pain. 2007;129:130–42.
7. Woolf C.J. Central sensitization: Implications for the diagnosis and treatment of pain. Pain 2011;152:S2–S15. Doi: 10.1016/j.pain.2010.09.030.
8. Woolf C.J. Evidence for a central component of post-injury pain hypersensitivity Nature. 1983;306:686–88.
9. Waxman S.G., Cummins T.R., Dib-Hajj S., et al. Sodium channels, excitability of primary sensory neurons, and the molecular basis of pain. Muscle Nerve. 1999;22:1177–87.
10. Dickenson A.H., Sullivan A.F. Evidence for the role of the NMDA receptor in the frequency dependent potentiation of deep rat dorsal horn nociceptive neurons following Cfibre stimulation. Neuropharmacology. 1987;26:1235–38.
11. Данилов А.Б., Давыдов О.С. Нейропатическая боль. М.: Боргес, 2007. 198 c.
12. Алексеев В.В., Амелин А.В., Давыдов О.С. и др. Методические рекомендации по диагностики и лечению невропатической боли –Невропатическая боль: клинические наблюдения. Под ред. Н.Н. Яхно и соавт. М.: Издательство РАМН, 2009. C. 6–31.
13. Clauw D.J. Fibromyalgia. JAMA. 2014;311(15):1547–55. Doi:10.1001/jama.2014.3266.
14. Desmeules J.A., Cedraschi C., Rapiti E., et al. Neurophysiologic evidence for a central sensitization in patients with fibromyalgia. Arthritis Rheumatism. 2003;48:1420–29.
15. Arendt-Nielsen L., Nie H., Laursen M.B., et al. Sensitization in patients with painful knee osteoarthritis. Pain 2010;149:573–81. Doi: 10.1016/j.pain.2010.04.003.
16. Lluch Girbes E., Nijs J., Torres Cueco R., et al. Pain treatment for patients with osteoarthritis and central sensitization. Phys Ther. 2013;93:842–51. Doi: 10.2522/ptj.20120253.
18. Smart K.M., Blake C., Staines A., Doody C. Self-reported pain severity, quality of life, disability, anxiety and depression in patients classified with “nociceptive”, “peripheral neuropathic” and “central sensitisation” pain. The discriminant validity of mechanisms-based classifications of low back (±leg) pain. Manual Ther. 2012;17:119–25.
19. Jull G., Sterling M., Kenardy J., Beller E. Does the presence of sensory hypersensitivity influence outcomes of physical rehabilitation for chronic whiplash? A preliminary RCT. Pain. 2007;129:28–34.
20. Coombes B.K., Bisset L., Vicenzino B. Thermal hyperalgesia distinguishes those with severe pain and disability in unilateral lateral epicondylalgia. Clin J Pain. 2012;28:595–601. Doi: 10.1097/AJP.0b013e31823dd333.
21. Hochman J.P., Gagliese L., Davis A.M. Neuropathic pain symptoms in a community knee OA cohort. Osteoarthritis and Cartilage. 2011;19:647–54. Doi: 10.1016/j.joca.2011.03.007.
22. Dimitroulas T., Duate R.V., Behura A., et al. Neuropathic pain in osteoarthritis: a review of pathophysiological mechanisms and implications for treatment. Semin Arthritis Rheumatol. 2014;44:145–54. Doi: 10.1016/j.semarthrit.2014.05.011.
23. Thakur M., Dickenson A.H., Baron R. Osteoarthritic pain: nociceptive or neuropathic? Nat Rev Rheumatol. 2014;10:374–80. Doi: 10.1038/nrrheum.2014.47.
24. Филатова Е.С., Туровская Е.Ф., Алексеева Л.И. и др. Анализ патогенетических механизмов хронической суставной боли у больных ревматоидным артритом и остеоартрозом коленных суставов. Научно-практическая ревматология. 2014;52(6):631–35. Doi: 10.14412/1995-4484-2014-631–35.
25. Hochman J.R., French M.R., Bermingham S.L. The nerve of Osteoarthritis Pain. Arthritis Care Res (Hoboken). 2010;62(7):1019–23. Doi: 10.1002/acr.20142.
26. Imamura M., Imamura S.T, Kaziyama H.H.S. Impact of nervous system hyperalgesia on pain, disability, and quality of life in patients with knee osteoarthritis: A controlled Analysis. Arthritis Rheumatism. 2008;59(10):1424–31. Doi: 10.1002/art.24120.
27. Arendt-Nielsen L., Hongling Nie, Laursen M.B. Sensitisation in patient with knee osteoarthritis. Pain. 2010;149: 573–81. Doi: 10.1016/j.pain.2010.04.003.
28. Schröder W., Tzchentke T., Terlinden R., et al. Synergistic Interaction between the Two Mechanisms of Action of Tapentadol in Analgesia. JPET. 2011;337:312–20. Doi: 10.1124/jpet.110.175042.
29. Li J.G., Chen C., Yin J., et al. ASP147 in the third transmembrane helix of the rat mu opioid receptor forms ion-pairing with morphine and naltrexone. Life Sci. 1999;65(2):175–85.
30. Tzschentke T., Jahnel U., Kögel B., et. al. Tapentadol hydrochloride: a next-generation, centrally acting analgesic with two mechanisms of action in a single molecule. Drugs Today. 2009;45:483–96. Doi: 10.1358/dot.2009.45.7.1395291.
31. Schröder W., Tzchentke T., Terlinden R., et al. Synergistic Interaction between the Two Mechanisms of Action of Tapentadol in Analgesia. JPET. 2011;337:312–20. Doi: 10.1124/jpet.110.175042.
32. Tzschentke T.M., Christoph T., Kögel B., et al. (-)-1R,2R)-3-(3-Dimethylamino-1-ethyl-2-methyl-propyl)-phenol Hydrochloride (Tapentadol HCl): a Novel mu-Opioid Receptor Agonist/Norepinephrine Reuptake Inhibitor with Broad-Spectrum Analgesic Properties. J Pharmacol Exp Ther. 2007;323:265–76.
33. Schröder W., Tzschentke T.M., Terlinden R., et al. Synergistic Interaction between the Two Mechanisms of Action of Tapentadol in Analgesia. JPET. 2011;337:312–20. Doi: 10.1124/jpet.110.175042.
34. Регистр лекарственных средств России® РЛС®. 2000–2019.
35. Schwartz S., Etropolski M., Shapiro D.Y., et al. Safety and efficacy of tapentadol ER in patients with painful diabetic peripheral neuropathy: results of a randomized-withdrawal, placebo-controlled trial. Curr Med Res Opin. 2011;27(1):151–62. Doi: 10.1185/03007995.2010.537589.
36. Baron R., Martin-Mola E., Muller M., et al. Effectiveness and Safety of Tapentadol Prolonged Release (PR) Versus a Combination of Tapentadol PR and Pregabalin for the Management of Severe, Chronic Low Back Pain With a Neuropathic Component: A Randomized, Double-blind, Phase 3b Study. Pain Pract. 2015;15(5):455–70. Doi: 10.1111/papr.12200.
37. Afilalo M., Etropolski M., Kuperwasser B., et al. Efficacy and Safety of Tapentadol Extended Release Compared with Oxycodone Controlled Release for the Management of Moderate to Severe Chronic Pain Related to Osteoarthritis of the Knee: Results of a Randomized, Double-blind, Placebo- and Active-controlled Phase 3 Study. Clin Drug Invest. 2010;30:489–505.
38. Steigerwald I., Müller M, Kujawa J., et al. Effectiveness and safety of tapentadol prolonged release with tapentadol immediate release on-demand for the management of severe, chronic osteoarthritis-related knee pain: results of an open-label, phase 3b study. J Pain Res. 2012;5:121–38. Doi:10.2147/JPR.S30540.
39. Banerjee M., Mondal S., Sarkar R., et al. Comparative study of efficacy and safety of tapentadol versus etoricoxib in mild to moderate grades of chronic osteorthritis of knee. Indian J Rheumatol. 2016;11(1):21–5. Doi:10.1016/j.injr.2015.12.001
40. Serrie A., Lange B., Steup A. Tapentadol prolonged-release for moderate-to-severe chronic osteoarthritis knee pain: a double-blind, randomized, placebo- and oxycodone controlled release-controlled study. Curr Med Res Opin. 2017;33(8):1423–32. Doi:10.1080/03007995.2017.133518.
41. Lange B., von Zabern D., Elling C., Dubois C. Efficacy and safety of tapentadol prolonged release for moderate-to-severe chronic osteoarthritis knee pain: a pooled analysis of two double-blind, randomized, placebo- and oxycodone controlled release-controlled studies. Curr Med Res Opin. 2017;33(8):1413–22. Doi:10.1080/03007995.2017.1335188.