Тераностика что это такое
Онкоэндокринология и тераностика
Наиболее значимые достижения в современной медицине возникают на стыке наук, например, молекулярной генетики и терапии, молекулярной визуализации и хирургии, дозиметрии и радионуклидной терапии.
Структура Института включает отдел ядерной медицины (радионуклидной диагностики и терапии), группа радионавигационной хирургии, лаборатория молекулярной онкоэндокринологии, лаборатория дозиметрического обеспечения тераностики, кабинет нейрофониатрической реабилитации, лаборатория онкоморфологии и онкобиобанка.
В Институте выполняется полный спектр радиоизотопных исследований патологии эндокринных органов: щитовидной железы, паращитовидной железы, надпочечников, поджелудочной железы. А также сцинтиграфия костей скелета, сердца, легких, почек (динамическая сцинтиграфия). Здесь внедряются инновационные методы интраоперационной навигации (гамма-зондирование, контрастная и аутофлуоростная ангиография).
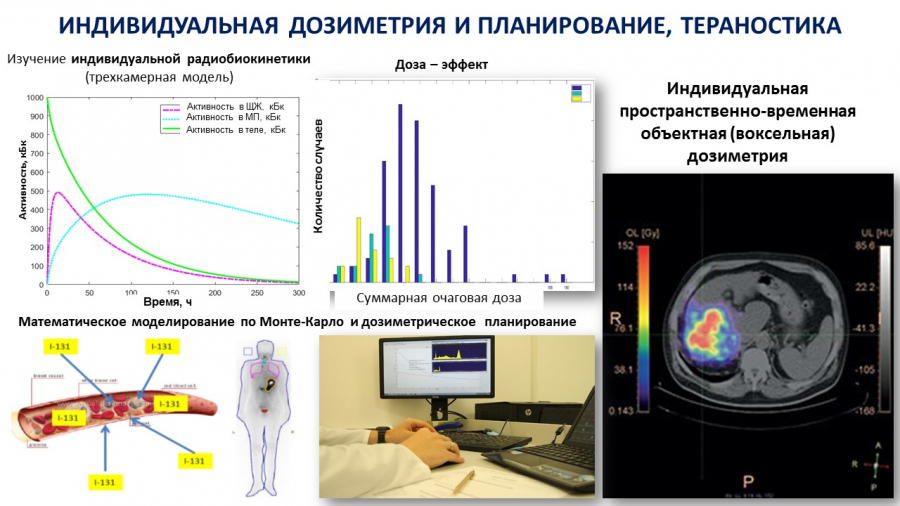
Для развития в данном направлении необходим альянс всех современных технологий молекулярной визуализации (ОФЭКТ/КТ, ПЭТКТ/МРТ), индивидуальной биодозиметрии, радиофармацевтики, онко и радио «омики»: геномики, траскрипромики, метоболомики.
Повышение эффективности терапевтического воздействия на патологический очаг и безопасности для здоровых тканей в большой степени зависит от правильного выбора молекулярной мишени и селективности воздействия на нее. Такой подход применим для диагностики и лечения различных видов заболеваний, таких как онкологические, аутоиммунные, сердечно-сосудистые, и представляется особенно актуальным в области онкологии и онкоэндокринологии.
НИИ активно занимается международным сотрудничеством с Японией и Германией, проводя совместные конференции и обмениваясь опытом.
Директором Института назначен д.м.н. Румянцев Павел Олегович, онколог-радиолог-эндокринолог, имеющий богатый опыт мультидисциплинарной научно-практической деятельности в России и за рубежом.
Тераностика в Институте ядерной медицины
Термин «тераностика» включает в себя два понятия – «терапия» и «диагностика» [греч. Θεραπεία — лечение и διάγνωση — способный распознавать; θερα+γνώση = Тераностика].
Это новый подход к созданию фармацевтических композиций, заключающийся в комплексном решении терапевтических и диагностических проблем. В основе лежит применение препаратов, которые являются одновременно и средством ранней диагностики, и терапевтическим агентом.
Тераностика в ядерной медицине основана на применении так называемых Тераностических Пар.
Другими словами, меняя радиоактивную метку в молекуле, мы получаем, например, диагностический эффект от применения 68 Ga при ПЭТ/КТ сканировании и терапевтический от 177 Lu. Остальная часть молекулы остается неизменной по своим свойствам и распространяется по организму практически одинаково.
Типичные пары радионуклидов в тераностике
При ПЭТ/КТ или ОФЭКТ/КТ сканировании мы не только видим на изображениях распространение опухолевого процесса, но также можем получить количественную информацию по накоплению радиофармацевтического лекарственного препарата (РФЛП), измерив данные SUV. Далее, по полученным данным, радиолог может просчитать не только предполагаемый эффект терапии при использовании уже терапевтической радиоактивной метки, но и определить возможные побочные эффекты по накоплению РФЛП в условно не пораженных опухолью органах.
Возможности тераностики ограничены только нашей фантазией и техническими особенностями синтеза РФЛП. Но открывают перед нами новые подходы к индивидуальной, таргетной терапии. В недалеком будущем, получив информацию об особенностях опухоли после проведенной биопсии, можно будет смоделировать индивидуальную для конкретного пациента тераностическую пару.
Дополнительным плюсом метода является возможность коррекции терапии, так как исследования ПЭТ/КТ или ОФЭКТ/КТ можно провести на любом этапе и определить не только изменения объема образования, но и оценить активность интересующих нас процессов в патологической ткани.
Радионуклидная тераностика злокачественных образований
Полный текст:
Аннотация
Ключевые слова
Об авторах
Список литературы
1. Chan I.S., Ginsburg G.S. Personalized medicine: progress and promise. Ann. Rev. Genomics Hum. Genet. 2011; 12: 217–44.
2. Дедов И.И., Тюльпаков А.Н., Чехонин В.П., Баклаушев В.П., Арчаков А.И., Мошковский С.А. Персонифицированная медицина: современное состояние и перспективы. Вестник РАМН. 2012; 12: 4–12.
3. Scudellari M. Genomics contest underscores challenges of personalized medicine. Nat. Med. 2012; 18: 312–26.
4. Hoggatt J. Personalized medicine trends in molecular diagnostics: exponential growth expected in the next ten years. Mol. Diagn. Ther. 2011; 15: 53–5.
5. Hodgson D.R., Wellings R., Harbron C. Practical perspectives of personalized healthcare in oncology. N. Biothechnol. 2012; 29 (Suppl. 6): 656–64.
6. Thomson A. Why do therapeutic drug monitoring. Pharm. J. 2004; 273: 153–5.
7. Idée J.M., Louguet S., Ballet S., Сorot C. Theranostics and contrast-agents for medical imaging: a pharmaceutical company viewpoint. Quant Imaging Med. Surg. 2013; 3 (Suppl. 6): 292–7.
8. Kelkar S.S., Reineke T.M. Theranostics: combining imaging and therapy. Bioconjug. Chem. 2011; 22: 1879–903.
9. Полянский О.Л., Лебеденко Е.Н., Деев С.М. ERBB онкогены – мишени моноклональных антител. Биохимия. 2012; 77 (Приложение 3): 289–311.
10. Baselga J., Gelmon K.A., Verma S., Wardley A., Conte P., Miles D. et al. Phase II trial of pertuzumab and trastuzumab in patients with human growth factor receptor 2-positive metastatic breast cancer that progressed during prior trastuzumab therapy. J. Clin. Oncol. 2010; 28: 1138–44.
11. Blackwell K.L., Burstein H.J., Storniolo A.M., Rugo H., Sledge G., Koehler M. et al. Randomized study of lapatinib alone or in combination with trastuzumab in women with ErbB2-positive, trastuzumabrefractory metastatic breast cancer. J. Clin. Oncol. 2010; 28: 1124–30.
12. Boussen H., Cristofanilli M., Zaks T., DeSilvio M., Salazar V., Spector N. Phase II study to evaluate the efficacy and safety of neoadjuvant lapatinib plus paclitaxel in patients with inflammatory breast cancer. J. Clin. Oncol. 2010; 28: 3248–55.
13. Burstein H.J., Sun Y., Dirix L.Y., Jiang Z., Paridaens R., Tan A.R. et al. Neratinib, an irreversible ErbB receptor tyrosine kinase inhibitor, in patients with advanced ErbBpositive breast cancer. J. Clin. Oncol. 2010; 28: 1301–7.
14. Laverman P., Sosabowski J.K., Boerman O.C., Oyen W.J. Radiolabelled peptides for oncological diagnosis. Eur. J. Nucl. Med. Mol. Imaging. 2012; 39 (Suppl. 1): 78–92.
15. Лишманов Ю.Б., Чернов В.И. Национальное руководство по радионуклидной диагностике. Том 1. Томск: STT; 2010.
16. Фомин Д.К., Тарарухина О.Б., Назаров А.А., Борисова О.А. Варианты системной лучевой терапии в лечении метастатического поражения скелета. Вестник рентгенологии и радиологии. 2012; 6: 30–4.
17. Denoye D., Pouliot N. Radionuclide theranostics in cancer. J. Mol. Imaging Dynam. 2013; 4 (Suppl. 1): 1–2.
18. Baum R.P., Kulkarni H.R. Theranostics: from molecular imaging using Ga-68 labeled tracers and PET/CT to personalized radionuclide therapy – the bad berka experience. Theranostics. 2012; 2: 437–47.
19. Hicks R.J. Use of molecular targeted agents for the diagnosis, staging and therapy of neuroendocrine malignancy. Cancer Imaging. 2010; 10: 83–91.
20. Jandl T., Revskaya E., Jiang Z., Bryan R.A., Casadevall A., Dadachova E. Complement dependent cytotoxicity of an antibody to melanin in radioimmunotherapy of metastatic melanoma. Immunotherapy. 2013; 5: 357–64.
21. Beer A.J., Haubner R., Sarbia M., Goebel M., Luderschmidt S., Grosu A.L. et al. Positron emission tomography using [18F] GalactoRGD identifies the level of integrin alpha(v)beta3 expression in man. Clin. Cancer Res. 2006; 12: 3942–9.
22. Janssen M.L., Oyen W.J., Dijkgraaf I., Massuger L.F., Frielink C., Edwards D.S. et al. Tumor targeting with radiolabeled alpha(v)beta(3) integrin binding peptides in a nude mouse model. Cancer Res. 2002; 62: 6146–51.
23. Sharkey R.M., Goldenberg D.M. Cancer radioimmunotherapy. Immunotherapy. 2011; 3 (Suppl. 3): 349–70.
24. Кодина Г.Е., Красикова Р.Н. Методы получения радиофармацевтических препаратов и радионуклидных генераторов для ядерной медицины. М.: МЭИ; 2014.
25. Cutler C.S., Hennkens H.M., Sisay N., Huclier-Markai S., Jurisson S.S. Radiometals for combined imaging and therapy. Chem. Rev. 2013; 113 (Suppl. 2): 858–83.
26. Lin F.I., Iagaru A. Current concepts and future directions in radioimmunotherapy. Cur. Drug Discov. Technol. 2010; 7 (Suppl. 4): 253–62.
27. Farrokhi S., Ravanbod M.R., Amiri S., Nabipour I., Assadi M. Radioimmunotherapy-based treatment of cancer. Iran J. Nucl. Med. 2012; 20 (Suppl. 1): 45–53.
28. Kawashima H. Radioimmunotherapy: A Specific Treatment Protocol for Cancer by Cytotoxic Radioisotopes Conjugated to Antibodies. Sci. World J. 2014; 14: 1–10.
29. Wilken J.A., Maihle N.J. Primary trastuzumab resistance: new tricks for an old drug. Ann. NY Acad. Sci. 2010; 1210: 53–65.
30. Chen K.T., Lee T.W., Lo J.M. In vivo examination of (188) Re(I)-tricarbonyl-labeled trastuzumab to target HER2-overexpressing breast cancer. Nucl. Med. Biol. 2009; 36 (Suppl. 4): 355–61.
31. Rasaneh S., Rajabi H., Babaei M.H., Daha F.J. 177Lu labeling of Herceptin and preclinical validation as a new radiopharmaceutical for radioimmunotherapy of breast cancer. Nucl. Med. Biol. 2010; 37 (Suppl. 8): 949–55.
32. Song H., Hobbs R.F., Vajravelu R., Huso D.L., Esaias C., Apostolidis C. et al. Radioimmunotherapy of breast cancer metastases with alpha-particle emitter 225Ac: Comparing efficacy with 213Bi and 90Y. Cancer Res. 2009; 69 (Suppl. 23): 8941–8.
33. Song H., Shahverdi K., Huso D.L., Esaias C., Fox J., Liedy A. et al. 213Bi (alpha-emitter) – antibody targeting of breast cancer metastases in the neu-N transgenic mouse model. Cancer Res. 2008; 68 (Suppl. 10): 3873–80.
34. Abbas N., Heyerdahl H., Brul and О.S., Borrebak J., Nesland J., Dahle J. Experimental a-particle radioimmunotherapy of breast cancer using 227Th-labeled p-benzyl-DOTAtrastuzumab. EJNMMI Research. 2011; 1: 1–12.
35. Agulnik M. New approaches to EGFR inhibition for locally advanced or metastatic squamous cell carcinoma of the head and neck (SCCHN). Med. Oncol. 2012; 29: 2481–91.
36. Sihver W., Pietzsch J., Krause M., Baumann M., Steinbach J., Pietzsch H.-J. Radiolabeled cetuximab conjugates for EGFR targeted cancer diagnostics and therapy. Pharmaceuticals. 2014; 7: 311–38.
37. Rades D., Nadrowitz R., Buchmann I., Hunold P., Noack F., Schild S.E. et al. Radiolabeled cetuximab plus whole-brain irradiation (WBI) for the treatment of brain metastases from non-small cell lung cancer (NSCLC). Strahlenther. Onkol. 2010; 186: 458–62.
38. Heskamp S., Boerman O.C., Molkenboer-Kuenen J.D., Oyen W.J., van der Graaf W.T., van Laarhoven H.W. et al. Bevacizumab reduces tumor targeting of antiepidermal growth factor and anti-insulinlike growth factor 1 receptor antibodies. Int. J. Cancer. 2013; 133 (Suppl. 2): 307–14.
39. Kinuya S., Yokoyama K., Koshida K., Mori H., Shiba K., Watanabe N. et al. Improved survival of mice bearing liver metastases of colon cancer cells treated with a combination of radioimmunotherapy and antiangiogenic therapy. Eur. J. Nucl. Med. Mol. Imaging. 2004; 31: 981–5.
40. Salaun P.Y., Bodet-Milin C., Frampas E., Oudoux A., Saї-Maurel C., Faivre-Chauvet A. et al. Toxicity and efficacy of combined radioimmunotherapy and bevacizumab in a mouse model of medullary thyroid carcinoma. Cancer. 2010; 116: 1053–8.
41. Kraeber-Bodere F., Bodet-Milin C., Niaudet C., Saї-Maurel C., Moreau A., Faivre-Chauvet A. et al. Comparative toxicity and efficacy of combined radioimmunotherapy and antingiogenic therapy in carcinoembryonic antigenexpressing medullary thyroid cancer xenograft. J. Nucl. Med. 2010; 51: 624–31.
42. Баклаушев В.П., Павлов К.А., Чехонин В.П. Моноклональные антитела в диагностике низкодифференцированных лимфом. Биомедицинская химия. 2009; 2: 140–54.
43. Kitson S.L., Cuccurullo V., Moody T.S., Mansi L. Radionuclide antibody-conjugates, a targeted therapy towards cancer. Current Radiopharm. 2013; 6 (Suppl. 2): 57–71.
44. Boerman O.C., van Schaijk F.G., Oyen W.J.G., Corstens F.H. Pretargeted radioimmunotherapy of cancer: progress step by step. J. Nucl. Med. 2003; 44 (Suppl. 3): 400–11.
45. Семенова А.И. Основные принципы системной терапии Her-2-позитивного рака молочной железы. Практическая онкология. 2010; 11 (4): 239–46.
Диагностика старения
Диагностика старения и антивозрастная медицина – это выявление признаков старения на ранних этапах и снижение риска смертности от возрастных заболеваний. Это залог активного долголетия и сохранение высокого качества жизни. В арсенале лаборатории ДНКОМ есть различные комплексы исследований, направленные на диагностику старения.
Какую панель выбрать?
В самом начале знакомства со своим организмом и начальном этапе контроля биомаркёров старения, вам подойдет стартовая панель Биомаркёры старения.
(61.652) Биомаркёры старения — это начальная оценка параметров организма, которые отражают его функциональные показатели. Панель включает в себя базовые маркёры и дает начальное понятие о состоянии организма.
Для более глубокого и точного исследования состояния организма мы предлагаем более расширенные панели, которые оценивают все системы организма в комплексе.
(61.655) Лабораторный чекап, стандартная панель — это лабораторное исследование, которое помогает в комплексе определить состояние основных систем организма и внутренних органов: сердечно-сосудистой, функцию печени, почек и поджелудочной железы. Комплексное исследование позволяет определить состояние белкового, жирового и липидного обмена в организме. На основе результатов исследования проводится выбор тактики дальнейшего обследования и подборе препаратов для профилактики и лечения.
Тераностика 1.4 — это новая расширенная панель биомаркёров здоровья, направленная на диагностику старения. Сигнальные маркёры старения можно обнаружить при комплексном лабораторном исследовании организма. Понимание процессов, происходящих внутри организма, позволит взять процесс старения под контроль и надолго сохранить здоровье.
Панель Тераностика 1.4 и состоит из 54 лабораторных количественных анализов, которые позволяют оценить состояние сосудов и сердца, щитовидной железы, функцию почек, функцию печени. Исследование дополнено тестами, характеризующими обмен витаминов и микроэлементов. Комплексная панель позволяет оценить уровень воспалительной реакции, риски нарушений углеводного обмена — индекс HOMA, гликированный гемоглобин и другие.
В ее состав входят:
Вариант Тераностика 1.4 бис (61.700) включает в себя те же лабораторные исследования, исключая инструментальные (ЭКГ и дуплексное сканирование сонных артерий определением толщины комплекса интима-медиа).
Сохраняйте и приумножайте свое здоровье вместе с Лабораторией «ДНКОМ» — первой в России anti-age лабораторией!
Тераностика что это такое
Одной из главных задач современной медицины является поиск новых методов диагностики на ранних этапах заболеваний. Также большое значение имеет комплексная терапия с рациональным использованием новых препаратов. Создание таких препаратов должно работать в нескольких направлениях. Во-первых, это повышение эффективности и биодоступности, что позволяет принимать лекарства в малых дозах и меньшее количество дней. Во-вторых, это снижение количества побочных эффектов и осложнений, что позволит предотвратить множество проблем. В-третьих, это снижение затрат на производство в условиях современной рыночной экономики [6]. Статистические данные показывают, что большое количество тяжелых исходов и осложнений бывают именно из-за отсутствия в арсенале врачей ранних методов диагностики. В стоматологии данная проблема также актуальна. Скрытое течение многих заболеваний, а также низкая осведомленность населения, приводят к частичной или полной адентии и необходимости дальнейшего ортопедического лечения, стоимость которого доступна не для всех слоев населения. Таким образом, своевременная диагностика и раннее эффективное лечение позволяет поддерживать качество жизни и уровень здоровья на оптимальном уровне.
Цель: изучить понятие «тераностика», узнать способы ее реализации в стоматологической практике.
Материалы и методы
Для достижения поставленных задач мы использовали анкетирование среди студентов университетов. В анкетировании приняли участие 100 студентов из таких ВУЗов, как СГМУ (78 человек), СГУ (20 человек), СПбГУ (2 человека). Возраст опрошенных составил от 18 до 25 лет. Студентам были заданы такие вопросы, как «Знали ли вы о существовании тераностики?», «Считаете ли Вы правдой, что в настоящее время разработана концепция диагностики и уничтожения раковых клеток в организме человека?», «Считаете ли вы возможным применение тераностики в стоматологии?», «В каких областях стоматологии может применяться тераностика?».
Результаты и обсуждение
Существует новый подход к созданию фармацевтических композиций, заключающийся в комплексном решении терапевтических и диагностических проблем путем создания препаратов, которые являются одновременно и средством ранней диагностики, и терапевтическим агентом [4]. Этим занимается новая отрасль медицины – тераностика (терапия + диагностика), возникшая в последнее десятилетие в результате создания новых наноматериалов [1,7]. В настоящее время тераностика активно используется в таких областях, как онкология и наномедицина. Ее главным подходом является выбор молекулярной мишени и селективности воздействия на нее с помощью специфических терапевтических агентов, представляющих собой наночастицы.
Тераностический агент – это наночастица с уникальными свойствами, способная проходить через любые биологические жидкости и ткани. Тераностические агенты могут быть оптическими, радиоактивными, магнитными, рентгеноконтрастными и СВЧ-чувствительными [5]. Например, в качестве тераностического агента может быть применен особый материал – оксид графена. Графен – особое производное углерода, представляющее собой одноатомную плоскую сетку из атомов. Разнообразные оксиды графена путем присоединения различных атомных групп получили в 2014 году в США [5]. Областями применения этого материала являются биомедицина, фармакология, производство индикаторов для обнаружения патологических очагов, изучение образования активных форм кислорода в живых клетках. Его основными функциями, имеющими значение для медицинского использования, являются высокая селективность, уникальные электрические и оптические свойства, адресность доставки диагностических и лекарственных веществ, ускорение роста и дифференцировки стволовых клеток, что весьма перспективно в инженерии и регенеративной медицине [5]. Он не только ищет поврежденные клетки, но и выборочно уничтожает их, оставляя живыми здоровые клетки, в отличие, например, от химиотерапии [6].
В стоматологии оксид графена используется в качестве вещества, способного подавлять рост бактерий, устойчивых к антибиотикам [2]. Учеными были проведены исследования, при которых оксид графена воздействовал на три наиболее распространенные бактерии полости рта: Streptococcus mutans, Porphyromonas gingivalis, Fusobacterium nucleatum. Вторым направлением использования данного материала в стоматологии является введение его в состав пломбировочного материала. Обладая достаточной механической прочностью, в 200 раз превосходящей прочность стали, он не оказывает токсического действия на слизистую полости рта, тем самым являясь перспективным материалом, заслуживающим внимания.
Полученные с помощью анкетирования данные говорят о том, что тераностика – новая наука, известная немногим. С учетом того, что данные, полученные от студентов СГМУ, не отличаются от таковых других университетов, мы решили представить обобщенные данные.
1. N (число опрошенных) =100
90% (90 человек) опрошенных не знали о существовании тераностики, 10% (10 человек) ответили «да». Мы можем сделать вывод о том, что тераностика – действительно новое направление в структуре современной медицины.
2. N (число опрошенных) =100
77% (77 человек) опрошенных ответили, что считают правдивым способность тераностических агентов диагностировать и уничтожать раковые клетки, 23% (23 человека) считают это невозможным. Данная диаграмма показывает осведомленность студентов в современных методиках лечения раковых опухолей.
3.N(число опрошенных) =100
41% (41 человек) опрошенных считают, что тераностика в стоматологии возможна, 7% (7 человек) считают обратное, 52% (52 человека) испытали трудности с ответом на данный вопрос.
Большее количество анкетированных считают, что тераностика в стоматологии может использоваться при лечении злокачественных новобразований, чуть меньшее количество людей посчитали, что тераностика используется в лечении кариеса. Перспективными направлениями также посчитали лечение воспалительных заболеваний, заболеваний пародонта, удаление зубов и выращивание новых тканей зуба с помощью тераностических агентов.
1. Тераностика – новый подход к созданию фармацевтических композиций, заключающийся в комплексном решении терапевтических и диагностических проблем путем создания препаратов, которые являются одновременно и средством ранней диагностики, и терапевтическим агентом. Наночастица должна обладать особым комплексом характеристик, чтобы обеспечить все ее функции. Первое – это направленная доставка к мишени, второе – визуализация патологического очага в процессе лечения, третье – эффективное и селективное воздействие на мишень.
2. Большинство студентов не осведомлено о существовании тераностики.
3. Основными сферами применения тераностики в стоматологии являются лечение кариеса и создание новых пломбировочных материалов.