Тесталамин для чего назначают мужчинам
Тесталамин ® (Testalamine) инструкция по применению
Владелец регистрационного удостоверения:
Контакты для обращений:
Лекарственная форма
Форма выпуска, упаковка и состав продукта Тесталамин ®
Таблетки, покрытые кишечнорастворимой оболочкой от светло-кремового до кремового цвета, круглой формы, диаметром 7 мм, массой 0.155 мг; возможно наличие специфического запаха.
| 1 таб. | |
| тесталамин порошок* | 10 мг |
* комплекс полипептидов и нуклеиновых кислот, полученный из семенников крупного рогатого скота.
Вспомогательные вещества: лактоза (наполнитель), сахар-песок (загуститель), крахмал картофельный (разрыхлитель), кальция стеарат (агент антислеживающий), дисперсия сополимера метакриловой кислоты (кишечнорастворимое покрытие), пропиленгликоль (эмульгатор).
Компоненты для производства Тесталамина, получаемые из семенников крупного рогатого скота, представляют собой комплекс белков и нуклеопротеидов, обладающих избирательным воздействием на клетки яичек, что способствует повышению их функциональной активности, препятствует развитию атрофических процессов в тканях яичек, а также стимулирует сперматогенез.
Клинические испытания Тесталамина проводились у 83 мужчин с различными проявлениями синдрома частичной андрогенной недостаточности.
Оценка эффективности использования Тесталамина основывается на динамике субъективных жалоб и объективных показателей лабораторных и инструментальных исследований.
Применение Тесталамина в комплексной терапии синдрома частичной андрогенной недостаточности у всех пациентов способствовало улучшению общего самочувствия, повышению либидо, значительному снижению интенсивности астенических проявлений и нормализации вегетативной регуляции. На фоне применения Тесталамина отмечалось восстановление содержания гормонов гипоталамо-гипофизарно-гонадной группы до нормальных и близких к нормальным величин. Наиболее отчетливо этот эффект проявлялся в отношении содержания общего тестостерона в крови. Положительные изменения выявлялись также при оценке эякулята: увеличилось количество сперматозоидов и их подвижность, уменьшилось количество их патологических форм, снизилось количество лейкоцитов, что свидетельствует о повышении репродуктивной способности пациентов.
Тесталамин ® рекомендуется применять для восстановления функций яичек после воздействия различных токсических веществ, ионизирующего излучения, при различных формах мужского бесплодия, проявлениях мужского климактерического периода, импотенции различного происхождения, после тяжелых стрессовых ситуаций у мужчин. Применение Тесталамина также рекомендуется мужчинам старшего и пожилого возраста для поддержания функции семенников и улучшения общего жизненного тонуса.
Тесталамин ® является натуральным продуктом, не содержит консервантов, красителей и ароматизаторов.
Открыть список кодов МКБ-10
| Код МКБ-10 | Показание |
| E29.1 | Гипофункция яичек |
| E30.0 | Задержка полового созревания |
| N45 | Орхит и эпидидимит |
| N46 | Мужское бесплодие |
| Z51.4 | Подготовительные процедуры для последующего лечения или обследования, не классифицированные в других рубриках |
| Z73.3 | Стрессовые состояния, не классифицированные в других рубриках (физическое и умственное напряжение) |
| Z98.8 | Другие уточненные послехирургические состояния |
Тесталамин ® рекомендуется принимать внутрь за 15-20 мин до еды, запивая водой, не разжевывая.
Взрослым назначают по 1-3 таб. 2-3 раза/сут.
Тесталамин Таблетки, 40 шт, 10 мг
Компоненты для производства «Тесталамина», получаемые из сем.
Инструкция
Показания к применению
Противопоказания
Индивидуальная непереносимость компонентов продукта, беременность, кормление грудью.
Инструкция
Регистрационный номер
Лекарственная форма
Состав
вспомогательные вещества:сахароза (лактоза),
Описание
БАД. Не является лекарственным средством
Фармакологические свойства
Компоненты для производства «Тесталамина», получаемые из семенников крупного рогатого скота, представляют собой комплекс белков и нуклеопротеидов, обладающих избирательным воздействием на клетки семенников, что способствует повышению их функциональной активности, препятствует развитию атрофических процессов в тканях яичек, а также стимулирует сперматогенез.
Клинические испытания «Тесталамина» проводились у 83 мужчин с различными проявлениями синдрома частичной андрогенной недостаточности.
Оценка эффективности использования «Тесталамина» основывается на динамике субъективных жалоб и объективных показателей лабораторных и инструментальных исследований.
Использование «Тесталамина» в комплексной терапии синдрома частичной андрогенной недостаточности у всех пациентов способствовало улучшению общего самочувствия, повышению либидо, значительному снижению интенсивности астенических проявлений и нормализации вегетативной регуляции.
На фоне приема «Тесталамина» отмечалось восстановление содержания гормонов гипоталамо-гипофизарно-гонадной группы до нормальных и близких к нормальным величин. Наиболее отчетливо этот эффект проявлялся в отношении содержания общего тестостерона в крови.
Положительные изменения выявлялись также при оценке эякулята: увеличилось количество сперматозоидов и их подвижность, уменьшилось количество их патологических форм, снизилось количество лейкоцитов, что свидетельствует о повышении репродуктивной способности пациентов.
«Тесталамин» рекомендуется применять для восстановления функций семенников после воздействия различных токсических веществ, ионизирующего излучения, при различных формах мужского бесплодия, проявлениях мужского климактерического периода, импотенции различного происхождения, после тяжелых стрессовых ситуаций у мужчин.
Прием «Тесталамина» также рекомендован мужчинам старшего и пожилого возраста для поддержания функции семенников и улучшения общего жизненного тонуса.
Показания к применению
Противопоказания
Индивидуальная непереносимость компонентов продукта, беременность, кормление грудью.
Способ применения и дозы
Тесталамин рекомендуется принимать внутрь за 15-20 мин до еды, запивая водой, не разжевывая.
Взрослым назначают по 1-3 таб. 2-3 раза/сут.
Побочное действие
Продукт не оказывает побочного действия.
Особые указания
Не является лекарственным средством.
Перед применением рекомендуется проконсультироваться с врачом.
Форма выпуска
Таблетки, покрытые оболочкой
Условия хранения
Продукт следует хранить в сухом, недоступном для детей месте при температуре от 2°С до 25°С.
Срок годности
Заместительная гормональная терапия для мужчин с возрастным андрогенным дефицитом
Специализация: урология, андрология
Синдром возрастного андрогенодефицита у мужчин — это нарушение биохимического баланса, возникающее в зрелом возрасте по причине недостаточности андрогенов в сыворотке крови, нередко сопровождающейся снижением чувствительности организма к андрогенам. Как правило, это приводит к значительному ухудшению качества жизни и неблагоприятно сказывается на функциях практически всех систем организма. Естественно, что огромный интерес вызывают вопросы терапии андрогенного дефицита, поскольку именно она ставит сложную задачу перед врачом-клиницистом: выбрать из широкого арсенала методов и препаратов гормональной терапии наиболее оптимальный, сочетающий в себе качество, эффективность, а также удобство в применении.
В настоящее время врачи-урологи и андрологи наиболее часто применяют заместительную терапию тестостероном. Данный метод позволяет решить целый ряд задач: снизить симптомы возрастного андрогенодефицита путем повышения либидо, общей сексуальной удовлетворенности, уменьшить выраженность либо полностью ликвидировать вегетососудистые и психические расстройства. Кроме того, если заместительная терапия тестостероном применяется более 1 года, у пациентов наблюдается повышение плотности костной массы, снижение выраженности висцерального ожирения, а также нарастание мышечной массы. Также после длительного курса лечения нормализуются лабораторные параметры: наблюдается повышение уровня гемоглобина или количества эритроцитов, снижение уровня ЛПОНП (липопротеинов очень низкой плотности) и ЛПНП (липопротеинов низкой плотности) при неизмененном уровне ЛПВП (липопротеинов высокой плотности). Многие авторы считают, что такого эффекта можно достичь, добившись восстановления концентрации тестостерона в крови до нормального уровня (10–35 нмоль/л). Следует также учитывать, что *17α-алкилированные препараты тестостерона флуоксиместеролон и метилтестостерон обладают выраженной гепатотоксичностью, оказывая токсическое и канцерогенное влияние на печень, а также отрицательно воздействуют на липидный спектр крови (резкое повышение уровня атерогенных и снижение уровня антиатерогенных липопротеидов). Поэтому применение этих производных тестостерона в клинической практике было прекращено.
В настоящее время из пероральных препаратов предпочтение отдается тестостерону ундеканоату (Андриол). Указанный эфир тестостерона не подвергается первичному печеночному метаболизму, так как всасывается в лимфатическую систему, минуя печень. После гидролиза тестостерона ундеканоата в лимфатической системе в системный кровоток поступает тестостерон, который оказывает лечебное действие как сам по себе, так и через свои основные метаболиты – дигидротестостерон (ДГТ) и эстрадиол, обусловливающие полный спектр андрогенной активности тестостерона. Таким образом, тестостерона ундеканоат сохраняет свою активность при пероральном применении. Вместе с этим, минуя систему воротной вены и прохождение через печень, тестостерона ундеканоат не оказывает гепатотоксического и гепатоканцерогенного действия. Период полувыведения препарата из плазмы составляет 3–4 часа. В связи с этим режимом дозировки тестостерона ундеканоата является 2-кратный прием в течение суток, это не всегда удобно для пациентов. Исходя из собственного опыта, мы считаем, что Андриол является достаточно мягким препаратом и помогает только в случаях начальных и минимальных проявлений возрастного андрогенного дефицита.
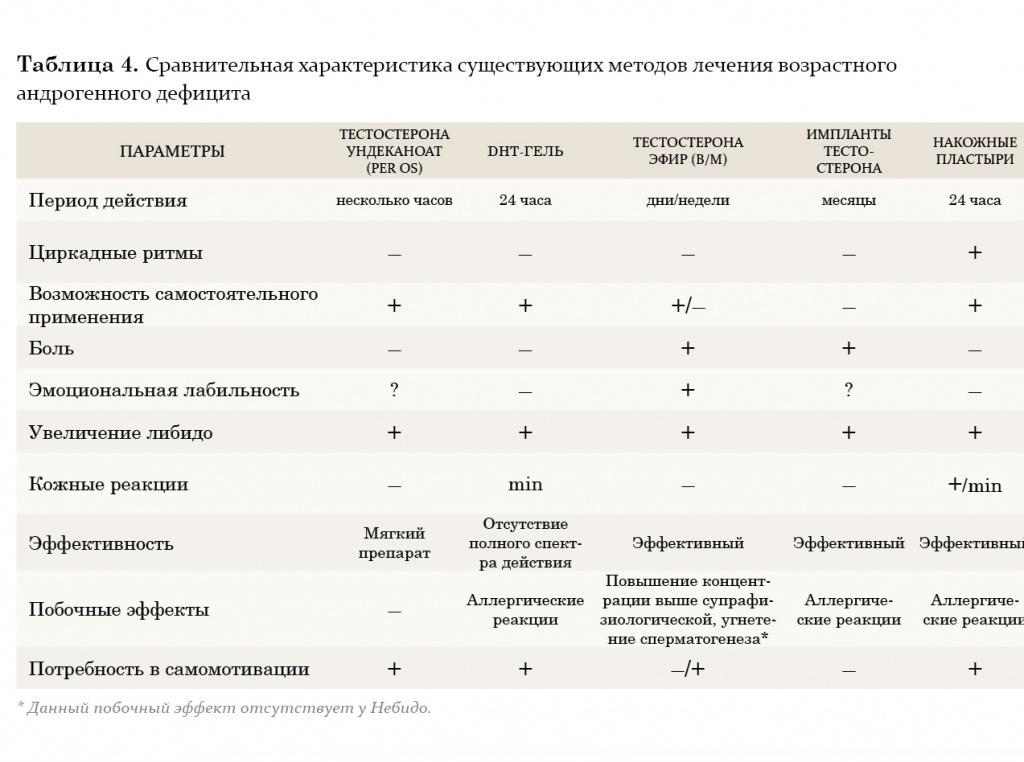
Внутримышечные инъекции пролонгированных эфиров тестостерона также являются широко применяемым методом заместительной терапии у мужчин с гипогонадизмом. Два наиболее известных эфира тестостерона – тестостерона ципионат и тестостерона энантат, имеют похожую фармакокинетику. При внутримышечном введении этих препаратов создается депо, из которого препарат высвобождается в кровеносное русло. В течение первых 2–3 дней после введения уровень тестостерона повышается до супрафизиологических цифр, а затем медленно снижается на протяжении последующих 2 недель до субнормальных значений. Положительной стороной этих препаратов является длительность терапевтического действия. Тем не менее резкие изменения в уровне тестостерона, зачастую ощущаемые самим пациентом в виде подъемов и снижения либидо, общего самочувствия, эмоционального статуса, являются нежелательными качествами данных препаратов. В связи с этим большие надежды возлагаются на новый препарат Небидо (Шеринг), фармакокинетика которого значительно отличается от других эфиров тестостерона. Небидо представляет собой тестостерона ундеканоат и является препаратом, не обладающим пиком повышения концентрации.
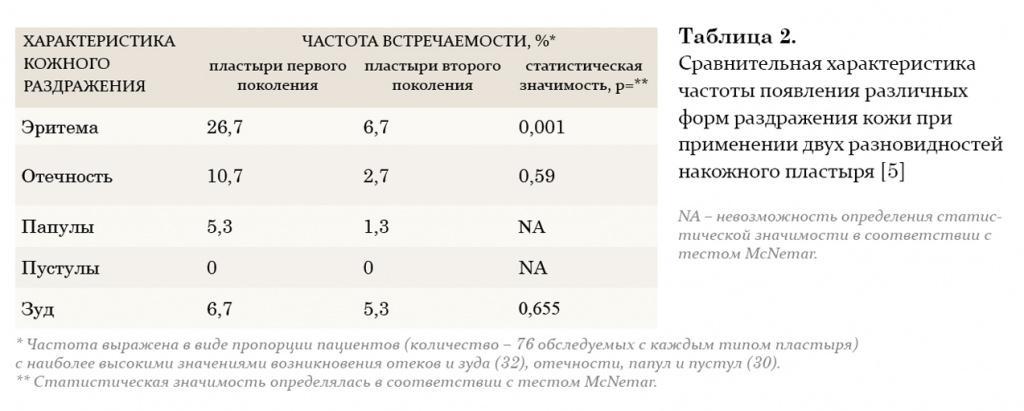
На протяжении двух последних десятилетий большое внимание уделяется исследованию преимуществ трансдермального применения препаратов тестостерона. Мошоночные пластыри обладают эффективным действием, и некоторые пациенты считают их наиболее удобным методом лечения. Накожные пластыри наиболее хорошо воспринимаются пациентами и дают эффективный уровень тестостерона в сыворотке крови. Тем не менее существуют некоторые различия между этими двумя разновидностями пластырей относительно их аллергогенного потенциала: при применении накожных пластырей отмечается гораздо большая частота возникновения аллергических реакций и раздражения кожи, чем при применении мошоночных пластырей.
Гель тестостерона обладает всеми преимуществами пластырей и не вызывает развития кожных реакций. Единственный его недостаток заключается в наличии возможности контакта геля с партнершей и недостаточном количестве долговременных исследований по его применению.
Трансдермальный путь введения тестостерона позволяет избежать его первичного метаболизма в печени и инактивации, как это происходит при применении пероральных андрогенных препаратов, а также позволяет имитировать циркадные ритмы высвобождения физиологического немодифицированного тестостерона и его естественных метаболитов, эстрадиола и ДГТ. К тому же терапию с использованием пластырей и геля в случае необходимости можно легко прервать. К положительным моментам этого метода лечения также относится низкий риск возникновения лекарственной зависимости.
Европейский препарат 5-α-дигидротестостерон-гель (ДГТ) хотя и признан эффективным, однако неизвестно, оказывает ли изолированное применение неароматизированного андрогена, каким является ДГТ, такое же действие, как тестостерон, в связи с тем, что метаболиты тестостерона включают эстрадиол. По мнению многих авторов, применение препарата не рекомендуется, так как ДГТ вследствие невозможности превращения в эстрадиол не обладает полным спектром терапевтических свойств тестостерона (например, влиянием на костную ткань и сердечно-сосудистую систему).
Некоторые из препаратов заместительной терапии, такие как тестостерона ундеканоат, ДГТ-гель и мошоночные пластыри, вызывают существенное увеличение концентрации ДГТ в сыворотке крови. ДГТ известен как главный андроген простаты, и в связи с этим проводилось много дискуссий по поводу способности его вызывать заболевания предстательной железы. Однако, несмотря на эти предположения, в последнее 10-летие не зафиксировано данных в пользу увеличения частоты возникновения патологии простаты при назначении препаратов ДГТ.
Таким образом, существует множество препаратов заместительной андрогенотерапии, однако все они имеют те или иные побочные эффекты, а также обладают угнетающим действием на сперматогенез. В последнее время появляется все больше работ, демонстрирующих вторичный характер возрастного андрогенного дефицита. Согласно материалам ВОЗ, получены данные о сохранении секретирующей функции клетками Лейдига у пожилых мужчин, что позволило ученым предложить принципиально новый подход в лечении возрастного андрогенного дефицита, основанный на стимуляции синтеза эндогенного тестостерона.
Однако не стоит забывать, что наряду с абсолютными противопоказаниями для заместительной терапии андрогенами (рак грудной и предстательной желез) существуют и дополнительные (доброкачественная гиперплазия предстательной железы с выраженной обструкцией, пролактинома, полицитемия). К относительным противопоказаниям относятся нарушения сна в виде апноэ, обструктивные заболевания легких, интенсивное курение.
К побочным эффектам андрогенов относятся усиление ночного апноэ, полицитемия, гинекомастия, приапизм, задержка жидкости, повышение АД, отеки, увеличение размеров простаты, торможение сперматогенеза.
То есть сегодня существуют методы лечения возрастного андрогенного дефицита, которые можно разделить на две группы, принципиально различающиеся по механизму действия:
заместительная терапия экзогенными андрогенными препаратами; терапия, стимулирующая синтез эндогенного тестостерона.
Таким образом, можно сказать, что оптимального для всех средства для лечения возрастного андрогенного дефицита у мужчин не существует. И к выбору препарата следует подходить строго индивидуально, учитывая возраст пациента, индекс массы тела, необходимость сохранения сперматогенеза, показатели гематокрита и сопутствующие заболевания.
Обзор фармакологических средств, применяемых при лечении эректильной дисфункции
Согласно современным представлениям, понятие «эректильная дисфункция» (ЭД) подразумевает неспособность к достижению и/или сохранению эрекции, достаточной для проведения полового акта (NIH Consensus Statement of Impotence, 1993). ЭД можно классифицировать
Согласно современным представлениям, понятие «эректильная дисфункция» (ЭД) подразумевает неспособность к достижению и/или сохранению эрекции, достаточной для проведения полового акта (NIH Consensus Statement of Impotence, 1993). ЭД можно классифицировать с учетом этиологии и тяжести. С точки зрения этиологии выделяют органическую и психогенную формы. В свою очередь, органическую ЭД подразделяют на сосудистую, нейрогенную, анатомическую и эндокринную. Психогенная форма может быть генерализованной и ситуационно зависимой (Lizza and Rosen, 1999) и иметь подвиды.
I. Генерализованная форма.
А. Генерализованная алибидемия.
В. Перманентное угнетение либидо.
II. Ситуационная форма.
А. Связанная с партнершей.
B. Связанная непосредственно с половым актом.
C. Связанная с психологическим дистрессом (депрессивный моноидеизм).
Помимо изолированной органической и психогенной форм часто встречается ЭД смешанного происхождения. Кроме того, ЭД может возникать в результате приема некоторых лекарственных препаратов (например, β-адреноблокаторов, селективных ингибиторов обратного захвата серотонина, диуретиков и др.) (Meinhardt et al., 1997). В зависимости от тяжести нарушений эрекции выделяют легкую, умеренной степени, средней степени выраженности и тяжелую ЭД.
Согласно Massachusetts Male Aging Study (Feldman et al., 1994), частота встречаемости ЭД у мужчин в возрасте 40–70 лет составила 52%. В другом американском исследовании (National Health and Social Life Survey; Laumann
et al., 1999) ЭД наблюдалась у 31% мужчин в возрасте от 18 до 60 лет. В ходе немецкого исследования (Cologne Male Survey, Braun et al., 2000) удалось установить, что частота ЭД увеличивалась на 10% у мужчин в возрасте 40–49 лет, на 16% — в возрасте 50–59 лет, на 34% — в возрасте 60–69 лет и более чем на 50% — в возрасте от 70 до 80 лет. В целом частота встречаемости ЭД составила 19,2% (возраст от 30 до 80 лет). Сходные результаты были получены в ходе исследований, которые проводились в Англии и во Франции (Spector and Boyle, 1986; Giuliano et al., 1996). По прогнозам Aytac et al. (BJU, Int 1999; 84:450–456), число пациентов с ЭД возрастет со 152 млн человек в 1995 г. до 322 млн к 2025 г. (в том числе составит в Европе более 11,9 млн человек, в Северной Америке — более 9,1 млн, в Африке – более 19,3 млн, в Азии – более 113 млн человек).
В прошлом считалось, что ЭД в основном обусловлена психогенными факторами, однако сегодня ученым стало известно, что она чаще развивается в результате органических причин, по крайней мере, у мужчин в возрасте старше 50 лет (Kaiser, 1999).
В литературе встречаются сообщения, авторы которых утверждают, что терапия ЭД, развившейся на фоне основного заболевания, повышает результаты его лечения. Например, C. Hultling (2000) показал, что лечение ЭД значительно улучшает качество жизни пациентов с травмами спинного мозга. E. Althof et al. (2000) сообщили, что терапия ЭД облегчает течение болезни, для которой характерны чувство краха, состояния угнетенности, неуверенности, отчаяние и волнение. E. O. Laumann et al. (1999) установили, что ЭД более чем в 4 раза повышает физическую неудовлетворенность пациентов и более чем в 2 раза эмоциональную.
Кроме того, следует отметить, что ЭД может быть не только причиной, но и симптомом других серьезных заболеваний, например диабета, ИБС и депрессии (I. Goldstein et al., 1998), которые уже сами по себе снижают эффективность лечения ЭД (S. Duttagupta et al., 2001). Недавнее исследование Montorsi et al. (2002) показало, что из 90 пациентов, страдающих ЭД, за которыми велось наблюдение в течение 4 лет, у 36 (40%) развилась ИБС, а у 36 из 49 больных (73%) с острыми коронарными болями или инфарктом миокарда ЭД имелась до сердечного приступа (Montorsi et al., 2002). T. Roumeguere et al. сообщили о наличии у 13% их пациентов с ЭД стенокардии, у 20% — диабета, у 26% — гипертонии, а 77% больных страдали дислипидемическими расстройствами (T. Roumeguere et al., 2001).
Авторы целого ряда работ рекомендуют проводить обследование пациентов с ЭД, чтобы исключить наличие у них заболеваний органов сердечно-сосудистой системы. Другие специалисты считают, что пациенты, не страдающие ЭД, но имеющие факторы риска развития сердечно-сосудистых заболеваний, например повышенное артериальное давление и гиперлипидемию, а также курящие, должны быть предупреждены о необходимости врачебного контроля, с тем чтобы предотвратить развитие ЭД.
Основные факторы, влияющие на возникновение эрекции, следующие:
Эротические стимулы создают в базальных ганглиях коры головного мозга процессы проэректильной направленности. Возбуждение, сформированное в центральной нервной системе, реализуется благодаря периферическим механизмам эрекции. Основным из них является расслабление гладкомышечных элементов пещеристых тел и кавернозных артерий. Причиной возникновения последнего служит концентрация свободного саркоплазматического кальция. Медиаторы эрекции действуют через ее снижение, а их антагонисты, напротив, вызывают ее повышение. Основным проэректильным медиатором является оксид азота (NO), эффект которого опосредован системой гуанилатциклаза — цГМФ. Вазоактивный интестинальный пептид и простагландин Е1 играют дополнительную роль посредством аденилатциклазной системы. Среди их антагонистов необходимо назвать эндотелии, вазопрессин, кальцитонин и нейропептид Y. В развитии детумесценции принимают участие также фосфодиэстеразы (ФДЭ) — ферменты, разрушающие циклические мононуклеотиды (цГМФ и цАМФ). Наибольшее значение в гладкомышечных структурах полового члена имеет фосфодиэстераза-5. Интерес представляют механизмы регуляции кальциевой чувствительности, а также функционирование особых межклеточных контактов — нексусов. Фазные изменения в деятельности системы регуляции и соответственные колебания гладкомышечного тонуса обеспечивают ритмичное течение эрекции.
Наступление эрекции является результатом взаимодействия нейрогенных, нейрохимических и эндокринологических механизмов (Sachs, 2000). Тонус гладких мышц кавернозных тел и сосудов находится под контролем сложных биохимических механизмов, кото-рые регулируются периферической и центральной нервной системой. Этот контроль обеспечивается за счет нейроанатомических соединений, которые являются частью иннервации нижних отделов мочеполовых путей (Moreland et al., 2001).
У здоровых мужчин сексуальная стимуляция вызывает высвобождение медиатора оксида азота из неадренергических нехолинергических нейронов, которые иннервируют кавернозное тело полового члена. NO вызывает внутриклеточную активацию гуанилатциклазы, которая катализирует превращение 5-ГТФ в 3’5′-цГМФ. Последний опосредует внутриклеточную передачу сигнала, который приводит, за счет активации белковых механизмов, к снижению внутриклеточной концентрации кальция и расслаблению гладких мышц полового члена, расширению сосудов и развитию эрекции (Moreland et al., 2001).
К основным факторам риска развития ЭД относятся:
В большинстве случаев ЭД обусловлена несколькими причинами. Исследования C. B. Johannes et al. (J. Urol. 163.460) показали, что в возрасте 40–49 лет эректильная дисфункция была выявлена у 12,4% пациентов; в возрасте 50–59 лет – у 29,8%, а в 60–69 лет – уже у 46,6% больных. Таким образом, с 40 до 70 лет риск развития ЭД возрастает почти в 4 раза. Наиболее важное значение имеют сердечно-сосудистые факторы риска. По данным немецких авторов (Braun et al., 2000), 20% больных ЭД страдают сахарным диабетом, 30% — артериальной гипертензией, 30% — курят и 38% — регулярно употребляют алкоголь. Сходные результаты были получены Pritzker (1999). В ходе исследований, выполненных этим автором, удалось установить, что у 20% больных ЭД имелся недиагностированный сахарный диабет, у 48% — артериальная гипертония и у 70% — гиперхолестеринемия. Roumeugere et al. (2001) диагностировали сахарный диабет у 20% больных ЭД, артериальную гипертонию у 26% и гиперлипидемию у 76%.
Диагностика ЭД включает установление факта наличия ЭД (выяснение истории заболевания, включая опросники IIEF и QoL; осмотр и пальпация наружных половых органов; rigiscan-тест; ригидометрия) и выяснение причины развития ЭД (цветная ультразвуковая доплерография; исследование гормонального статуса; психологическое обследование; лабораторные тесты; нейрофизиологическое обследование; кавернозография; УЗИ полового члена; электромиография мышц тазового дна).
Лечение ЭД
Так как многие пациенты и даже врачи уверены в том, что ЭД не болезнь, а естественный процесс, сопровождающий старение мужского организма, а также вследствие особой деликатности проблемы к врачебной помощи прибегают лишь немногие больные, страдающие этим недугом. M. Sand et al. (ISSIR, 2002) установили, что лекарственные препараты принимали 21% пациентов, страдающих эректильной дисфункцией, тогда как в группе больных сахарным диабетом этот показатель составил 74%, при ишемической болезни сердца – 54%, а при депрессии – 37%.
При назначении лечения ЭД пациент должен активно участвовать в выборе вида терапии. При этом в принятии решения, помимо традиционных критериев эффективности и безопасности, определенную роль играют культурные, религиозные, социальные мотивы, а также следующие факторы:
У больных ЭД в первую очередь следует установить этиологию и по возможности устранить причины развития заболевания, вместо того чтобы проводить сугубо симптоматическое лечение (Wespes et al., 2002). Однако показано, что воздействие только на органические факторы риска не приводит к значительному улучшению эректильной функции (Montorsi et al., 2002).
Методы симптоматического лечения эректильной дисфункции включают в себя использование пероральных лекарственных препаратов, вакуумных устройств и/или проведение психотерапии (Montorsi et al., 2002). Если ни один из этих методов не позволяет добиться успеха, можно использовать вазоактивные средства, вводимые различными способами (Montorsi et al., 2002): перорально, буккально, трансдермально, интрауретрально, интракавернозно, подкожно, трансректально.
Наиболее распространенными являются пероральное и интракавернозное введение.
Препараты, вводимые интракавернозно, и их действие:
Однако большинство больных испытывают значительный дискомфорт и болезненные ощущения при инъекциях. Поэтому 74% пациентов в качестве препаратов первого ряда выбирают пероральные.
К лекарственным средствам разных групп, применяемым при ЭД, относят адреноблокаторы (йохимбин, фентоламин), антагонисты рецепторов допамина (апоморфин), блокаторы поглощения серотонина (тразодон), нейролептики (сонапакс), андрогены (тестостерон, андриол, местеролон (провирон)), адаптогены (пантокрин, элеутерококк), периферические вазоактивные препараты (нитромазь), доноры NO (L-аргинин), фитопрепараты (гербион урологические капли, копривит, лаверон, милона 11, пермиксон, простамол уно, простанорм) и др. В целом эффективность лекарственных средств разных групп не превышает 30% и оказывается ненамного выше, чем при использовании плацебо (I. Iribarren et al., 1999).
Лекарственные средства, предназначенные для приема внутрь, могут оказывать центральное и периферическое действие. К препаратам центрального действия относятся агонист допаминергических рецепторов апоморфин, тестостерон и селективный блокатор α2-адренорецепторов йохимбин. Последний является агонистом центральных адренергических рецепторов и блокатором периферических α2-адренорецепторов (Hatzichristou, 2001). В ходе контролируемых исследований установлено, что по эффективности он существенно не отличался от плацебо. Возможные побочные эффекты: повышение артериального давления (АД), тревога, учащенное мочеиспускание (S.Tam et al., 2001). В связи с этим в рекомендациях Американской урологической ассоциации по лечению органической ЭД указано, что йохимбин недостаточно эффективен (Montague et al., 1996).
Препараты периферического действия включают простагландины Е1, фентоламин, а также ингибиторы фосфодиэстеразы 5-го типа.
Селективный ингибитор обратного захвата серотонина антидепрессант тразодон (азона, триттико) также улучшает эректильную функцию за счет прямого α1-адреноблокирующего действия; не случайно среди побочных действий препарата описан приапизм. R. Lance et al. (1995) сообщили об улучшении эрекции у 78% пациентов моложе 60 лет, однако другие авторы не выявили значимого влияния тразодона на эректильную функцию по сравнению с плацебо (R. Costabile et al., 1999; RLance et al., 1995).
Ингибиторы ФДЭ – силденафил (виагра), варденафил (левитра) и тадалафил (сиалис) — являются селективными конкурентными ингибиторами ФДЭ5 — фермента, который разрушает цГМФ в различных тканях. Последний представляет собой вторичный меди-атор NO (Bolell et al., 1996). Препараты этой группы усиливают расслабляющее действие NO на гладкие мышцы и проявляют активность только при активации синтеза цГМФ (за счет NO) (Ballard et al., 1998; Jeremy et al., 1997). При сексуальной стимуляции происходит высвобождение NO в нервах кавернозного тела, эндотелии сосудов и гладкомышечных клетках, что приводит к расширению сосудов полового члена и кавернозного тела и наступлению эрекции (Burnett, 1997). Препятствуя разрушению цГМФ, ингибиторы ФДЭ5 усили-вают сосудорасширяющий эффект NO и восстанавливают эрекцию у больных ЭД. В настоящее время известны 11 групп изоферментов ФДЭ (ФДЭ1-11), которые, в свою очередь, разделяют на 21 подгруппу и примерно 53 варианта.
Изоферменты ФДЭ участвуют в осуществлении различных функций организма (Francis et al., 2001; Osteloh, 2001), в частности:
Результаты проведенных исследований подтвердили эффективность всех трех ингибиторов ФДЭ5 (в эквипотентных дозировках левитра и сиалис по эффективности примерно сопоставимы с виагрой). Прямые сравнительные исследования их не проводились. Сравнивать эффективность этих препаратов на основании данных различных (напрямую не сопоставимых) исследований затруднительно, учитывая различия в критериях эффективности и отборе больных. Например, из некоторых исследований варденафила и тадалафила исключали пациентов, не отвечавших на силденафил (Porst et al., 2001; Brock et al., 2001; Brock et al., 2002), что делает невозможным сравнение количества ответивших на лечение.
Известно, что, в силу своего влияния на NO/цГМФ, эти препараты потенциируют вазодилатирующий эффект и антикоагулянтное действие нитратов и донаторов NO (Angulo et al., 2001; Bischoff et al., 2001). Например, варденафил (левитра) оказывает слабое гипотензивное действие и снижает АД максимум на 5–10 мм рт. ст. (Sache and Rohde, 2000), а также увеличивает частоту сердечных сокращений при применении в дозе 40 мг (Sachse and Rohde, 2000). По этим причинам ингибиторы ФДЭ5 не следует назначать при выраженной артериальной (в том числе ортостатической) гипотонии. Лечение пожилых пациентов ингибиторами ФДЭ5 необходимо начинать с малых доз вследствие повышения у этих больных максимальных концентраций препарата в плазме и длительности периода полувыведения (Porst et al., 2001).
Наряду с ингибиторами ФДЭ5 при лечении органической и психогенной ЭД в последние годы широко применяются аффинно очищенные антитела к эндотелиальной NО-синтазе (eNOS) в сверхмалых дозах — препарат импаза. Препарат отличается хорошей переносимостью, безопасностью и отсутствием побочных эффектов и существенно превосходит плацебо: эффективен у 60 — 85% пациентов, повышает интегральные по-казатели международного индекса эректильной функции («эректильная функция», «удовлетворенность половым актом», «оргазм», «либидо», «общая удовлетворенность») до 72 — 78%.
Для лечения ЭД применяется также множество средств природного происхождения, таких как, например, тентекс форте, лаверон, эректин, тесталамин. Интерес к методам так называемой биологической медицины во всем мире велик. Это обусловлено тем, что данные препараты имеют значительно меньше побочных эффектов по сравнению с химиопрепаратами, не вызывают привыкания и синдрома отмены. Многие из них не являются лекарствами, а относятся к биологически активным добавкам.
Проблема диагностики и лечения ЭД сложна и многогранна. По мере проведения научных исследований и накопления практического опыта лечения сексуальных нарушений у мужчин вскрываются все новые, неизвестные ранее этиологические, патогенетические, патофизиологические и другие факторы, что, в свою очередь, ставит перед исследователями новые вопросы. Возможно, XXI век пройдет под знаком окончательного решения этой проблемы. n
Литература
А. А. Камалов, доктор медицинских наук, профессор
С. Д. Дорофеев, кандидат медицинских наук
Е. А. Ефремов
НИИ урологии, Москва