Тимомегалия у детей до года что это такое
К вопросу о тимомегалии у детей раннего возраста
Тимус (вилочковая железа) относится к центральным органам иммунной системы. Физиологическая роль тимуса заключается в дифференцировке и клональной селекции Т-лимфоцитов. В результате длительного (3-4 недели) поэтапного процесса «обучения» в тиму- се созревают аутотолерантные Т-лимфоциты (менее 10%) способные к взаимодействию с клетками иммунной системы, которые, попадая в общий кровоток, заселяют периферические органы иммунной системы (т.н.положительная селекция).
Остальные лимфоциты, не распознающие собственные ГКГС-белки и аутореактивные, подвергаются апоптозу и уничтожаются собственными макрофагами (отрицательная селекция).
Исследованиями последних лет выделено и охарактеризовано более 40 биорегуляторов пептидной, гликопротеидной и стероидной природы, вырабатываемых клетками тимуса. Большинство из них являются цитокинами паракринного действия. Однако, 8 субстанций действуют системно и могут считаться специфическими тимическими гормонами.Системное влияние тимических гормонов на нейроэндокринную систему проявляется через регуляцию адренокортикарных функций. Особенно важно, что указанное воздействие проявляется еще в преиммунном ответе. В свою очередь, активация тимуса осуществляется по цепочке гипоталямус- гипофиз –соматотропин, а также, тиреоидными гормонами.
Таким образом, тимус является важнейшим связующим звеном и как бы коммутатором взаимоотношений нейроэндокринной и иммунной систем организма. Все это свидетельствует о многогранных функциях тимуса как эндокриннолимфоидного органа и широте его воздействия на различные обменные процессы в физиологических и патологических условиях.
Формирование иммунного ответа начинается во 2-й половине внутриутробного развития. Эмбриональные лимфоциты вследствие воздействия плацентарных цитокинов и гормонов, а возможно и аллергенов смещаются в сторону Тh2 профиля ответа. Такой сдвиг в сторону Тh2 системы «мать-плод» во время беременности обеспечивает благоприятное течение внутриутробного периода.
В постнатальный период, вследствие стимуляции иммунной системы компонентами инфекционных агентов, у большинства детей происходит переключение с Тh2 типа на Тh1 тип. Програмирование двух противоположных типов аллерген-специфических клеток, продуцирующих цитокины Тh1 и Тh2, начинается в раннем детском возрасте в незрелой иммунной системе. К 2-летнему возрасту формируются основные механизмы определяющие характер, интенсивность и эффективность Т-клеточной реакции на аллергены, в пер-вую очередь, окружающей среды. Окончательное формирование фенотипа происходит к 5-6 годам.
На процесс формирования фенотипа Т-клеточной реакции влияют многочисленные факторы, причем генетические факторы имеют важное, но не решающее значение. Немаловажную роль в этом процессе играет морфо-функциональное состояние тимуса.
При рождении тимус весит 15 г, к пубертату достигает максимальной массы в 50 г. Однако,если измерять массу паренхимы тимуса без учета жировой ткани, то максимум в 38 г. достигается уже в возрасте 2-5 лет, далее идет прогрессивное ее уменьшение.Очевидно, что максимальной функциональной массы тимус достигает в период оформившегося Т-лимфоцитарного иммунного ответа. Одновременно с прибавкой массы паренхимы происходит дальнейшая дифференцировка и усовершенствование собственно функциональных регуляторных механизмов тимуса.
Патология тимуса формируется в виде гипопластических, гиперпластических или диспластических процессов. В детском возрасте наиболее часто встречаются гиперпластические процессы приводящие к увеличению массы органа-тимомегалии.
Актуальность проблемы обусловлена высокой распространенностью тимомегалии у детей с постоянным ростом ее частоты, большей подверженностью этих детей инфекционным и аллергическим заболеваниям, особенно в раннем возрасте, осложненным их течением, заканчивающихся иногда неожиданным летальным исходом.
Раскрытие патогенеза тимомегалии имеет большое теоретическое значение как для понимания механизмов развития иммунной и нейроэндокринной систем и, соответственно, различных обменных процессов в раннем детском возрасте, так и механизмов их возможных отклонений. Оно важно и в клиническом аспекте в каждом конкретном случае, так как увеличение тимуса является неблагоприятным фактором преморбитного состояния, с возможными ближайшими и отдаленными последствиями.
Регуляция функциональной активности тимуса, в первую очередь, осуществляется непосредственно антигенами и различными цитокинами. Способность реагировать на антигенную стимуляцию тимус приобретает примерно с 20 нед. внутриутробного периода. Поэтому, при отягощеной беременности различной этиологии, при внутриутробных инфекциях,в условиях нарушения плацентарной проницаемости, особенно в сочетании с хронической гипоксией, в большинстве случаев развивается внутриутробная тимомегалия.
В постнатальном периоде антигенная нагрузка тимуса резко возрастает.Антигены поступают во внутреннюю среду через кожу и слизистые, из коих важнейшей является слизистая ЖКТ.
Поток антигенов и токсинов из ЖКТ зависит от факторов питания, микробиоциноза кишечника и морфофункционального состояния слизистой. Заселение кишечника микрофлорой начинается автоматически с момента прохождении через родовые пути матери. Принципиально важно какие микробы первыми попадают и размножаются в тракте. Колонизация бифидо и лактобактериями является физиологической и способствует становлению процессов нормального пищеварения и интенсивного морфофункционого развития слизистой кишечника уже в периоде адаптации организма новорожденного. При первоначальном росте условно и патогенной микрофлоры указанные процессы, особенно развитие и целостность слизистой, нарушаются.
Поэтому, первоначальная колонизация кишечника является для иммунной системы и организма в целом событием, которое нужно расценивать как одно из ключевых событий за всю жизнь.
И не случайно природа предопределила питание в первые дни жизни такой универсальной пищей, каковой является молозиво. Оно содержит все необходимые пищевые ингридиенты в таком химическом виде, что большинство из них почти без расщепления попадают во внутреннюю среду организма ребенка. Кроме того, оно содержит многочисленные факторы играющие важную роль в защите ЖКТ, активизации местного и общего иммунитета, стимуляции роста бифидо и лактобактерий. Поэтому, принципиально важно раннее прикладывание новорожденного к груди, состояние матери и ребенка, совместное их пребывание.
В наши дни в связи с урбанизацией увеличивается число новорожденных с нарушением
процесса первичной колонизации слизистой кишечника за счет снижения количества бифидо и лактобактерий и нарушения взаимообмена микробами между матерью и ребенком. Неблагоприятным фактором для процесса первичной колонизации является широкое, зачастую необоснованное применение антибиотиков у новорожденных. Отрицательно сказывается на этом процессе и кесарево сечение у большинства таких детей развиваются стойкие дисбиотические изменения флоры кишечника.
Другим важным фактором влияющим на состояние тимуса являются роды.Тяжелая гипоксия головного мозга ребенка, особенно гипоталямической области, в родах и в послеродовый период зачастую приводят или усиливают развитие тимомегалии.
Впоследствии увеличение тимуса развивается и прогрессирует вследствии постоянного повышенного его раздражения антигенами и цитокинами поступающими, в основном, из ЖКТ. Ответная реакция тимуса и всей иммунной системы зависят как от дозы и типа антигенов и цитокинов, времени их экспозиции, так и от генетических вариаций индивидуальной способности к ответу. Не случайно, наиболее часто тимомегалия встречается у детей с экссудативно-катаральным и, особенно, лимфогипопластическим диатезами.
Этот факт обьясняет и генетическую предрасположенность к тимомегалии, особенно II и III степени. Принципиально важно, что все эти процессы происходят в период становления и дифференцировки функций незрелой иммунной системы с окончательным развитием фенотипа.
Размеры тимуса в определенной степени обьективно согласуются с его функциональным состоянием. Так, с большой вероятностью можно предположить, что при 10 тимомегалии функции тимуса компенсированы, при II0 – уже развивается стадия суб, а при III0 – стадия декомпенсации. Поэтому, видимо следует согласиться с П.Д.Вагановым, который классифицировал 10 тимомегалии как синдром увеличенной вилочковой железы, а II и III0 – как собственно тимомегалию.
Морфологические изменения тимуса разнообраны и, в какой то мере, соответствуют степени увеличения органа. В начальной стадии отмечается увеличение количества и активности тимоцитов, кровенаполнения, в первую очередь артериального, что следует расценивать как физиологическую реакцию на повышенную антигенную нагрузку организма. Дальнейшее течение процесса характеризуется уменьшением числа тимоцитов, тимические тельца немногочисленны, мелкие, в корковой зоне определяется пролиферация макрофагов и лимфоцитов. Скопления лимфоцитов, отсутствующие в норме, могут развиваться в виде фолликул. Увеличивается доля жировой ткани и соединительнотканных элементов.
Соответствующие изменения развиваются в железах эндокринной системы и периферических лимфатических образованиях. Особенно значимы с патогенетической и клинической точек зрения морфофункциональные изменения надпочечников, проявляющихся в виде гипокортицизма, гипоадренализма. Нарушены, также, функции щитовидной железы.
Таким образом, у детей с тимомегалией в периоде становления и интенсивного развития незрелой иммунной системы, в условиях генетически детерменированных и индивидуальных особенностей формирующегося фенотипа, возможны вариации как иммунного отве –та в частности, так и организма в целом на различные антигены.В одном случае, на фоне плохо отрегулированного и усиленного иммунного ответа, происходит усиленный (гипер-ергический) и плохо отрегулированный процесс воспаления с выраженным аллергическим компонентом. И, наоборот, на фоне плохо отрегулированного и слабого ответа развивается слабый и плохо регулируемый процесс воспаления со склонностью к затяжному течению.
Фактором риска увеличения тимуса у детей до 6 мес. является раннее искусственное вскармливание. Увеличение тимуса обнаружено и у впервые заболевших детей находившихся на грудном вскармливании. У 70% их матерей были выявлеы симптомы нерезко выраженного нарушения пищеварения (метеоризм, неустойчивый стул, чаще в виде запоров, дискомфорт и боли в животе), анемия, признаки полигиповитаминоза.
Дети с увеличением тимуса уже на первом году жизни чаще болеют ОРВИ, острыми и хроническими нарушениями пищеварения и питания, рахитом, анемией, у них чаще развиваются аллергические проявления. В возрасте до 3 лет более половины детей с увеличенным тимусом относятся к группе часто болеющих детей, с более тяжелым и длительным течением ОРИ (обструктивный бронхит, пневмонии, отиты, фебрильные судороги, кишечный синдром). Эта группа детей отличается и высокой частотой развития ЛОР патологии: аденоидные вегетации и гиперплазия небных миндалин с последующим развитием хронического тонзиллита. Эти дети отличаются лабильностью и возбудимостью ЦНС, у них чаще отмечаются стоматиты, признаки полигиповитаминоза, особенно гиповитаминоза А, сидеропенический синдром.
По мнению проф. П.Д. Ваганова раннему выявлению синдрома увеличения вилочковой железы подлежат дети:
1. имеющие в анамнезе отягощенные антенатальные факторы и перинатальное поражение ЦНС,
2. рожденные от матерей, у которых в детстве было выявлено увеличение тимуса,
3. имеющие затрудненное дыхание при отсутствии катаральных явлений,
4.с высоким инфекционным индексом.
Этим детям рекомендуется провести УЗИ тимуса с определением ее массы в граммах.
При выявлении увеличения тимуса необходимо провести тщательный сбор анамнеза и обследование ребенка с целью выявления причин длительной антигенной и токсической нагрузки организма больного ребенка.
Лечебные мероприятия включают в себя коррекцию питания, обменных и гормональных нарушений, иммунологического статуса, лечения сопутствующих заболеваний.
Коррекция питания является принципиально важной задачей лечения. У детей находящихся на грудном вскармливании зачастую необходимо провести коррекцию питания матери. Диета матери должна быть сбалансированной, содержать достаточное количество белка, овощей и фруктов, богатой витаминами и микроэлементами. При выявлении заболеваний у матери следует провести их лечение. Детям на искусственном вскармливании и старше 6 мес. следует назначить питание не столько по возрасту, сколько исходя из функционального состояния ЖКТ. Питание этих детей должно быть как полноценным, так и наиболее легкоперевариваемым и способствующим перистальтике кишечника, назначается дробно, относительно малыми порциями, чаще. При необходимости следует назначить эти пробиотики, ферментативные препараты.
С целью улучшения обменных процессов назначается комплекс витаминов:
А, Е, Д, В-комплекс, препараты кальция. При сидеропенических проявлениях после определения ферритина крови препараты железа. Витаминотерапия проводится не менее 1 мес., препараты железа и кальция – 1,5-2 мес. и более. При необходимости назначаюся гепатопротекторы коротким курсом.
При 10 увеличения тимуса лечение лечение ограничиваеся коррекцией питания, назначением эубиотиков, реже – короткого курса витаминотерапии. При увеличении тимуса II-Ш0, помимо вышеуказанных задач возникает необходимость иммуннокорегирующей терапии ( тактивин, реже элеутерококк ). Тактивин назначается в дозе 2 мкг/кг, подкожно, курс 5-7 иньекций.
Особую актуальность в практике педиатра приобретает проведение профпрививок детям с увеличенным тимусом. При проведении прививок этим детям следует учитывать степень увеличения тимуса, анамнез, характер питания и индивидуальные особенности организма ребенка.
Дети с увеличенным тимусом 10 чаще переносят прививки бессимптомно и без особых отклонений от инструкций по проведению прививок здоровым детям (по частоте местных и общих реакций). Детям с увеличением тимуса II0 рекомендуется проводить вакцинацию на фоне гипоаллергенной диеты, курса витаминотерапии,. приема эубиотиков. Назначение гипосенсибилизирующей терапии решается индивидуально с учетом аллергического фона организма ребенка. Практически все дети с увеличением 10 и большая часть II0 имеют теже показания и противопоказания профпрививок что здоровые дети при условии клинического здоровья.
При тимомегалии Ш0 рекомендуется отложить проведение прививок до 6 мес. при условии назначения коррегирующего лечения.
Нарушения гормонального статуса у детей с тимомегалией II и, особенно, Ш0 зачастую сопровождаюся осложненным, тяжелым течением острых заболеваний, что диктует необходимость назначения глюкокортикоидов (дексаметазон, преднизолон) в течении всего периода тяжелого состояния ребенка – обычно не более 3-5 дней.
З. Б. Мелконян
кафедра педиатрии ЕрГМУ
ТИМОМЕГАЛИЯ И СИНДРОМ ПЛАТТЕРА
История относительно интенсивного изучения вилочковой железы ( glandula thymus, thymus ) насчитывает около 400 лет. Начало его относится к 1614 г., когда профессор Базельского университета Феликс Платтер описал происшедшую у него
В середине XIX в. профессор Венского университета Карл Рокитанский высказал предположение об инкреторной функции вилочковой железы. Данная концепция была положена в основу представлений о тимико-лимфатическом статусе [1, 2] как врожденной особенности конституции, предрасполагающей к внезапной смерти от незначительных причин. В симптомокомплекс тимико-лимфатического статуса включались первичная гиперфункция вилочковой железы, гипоплазия надпочечников, сердца и аорты [1–5]. С этого времени причиной тимической смерти стали считать острую надпочечниковую недостаточность [3, 4]. Однако отсутствие характерных для тимико-лимфатического состояния признаков во многих случаях при такой смерти, в том числе и симптомов надпочечниковой недостаточности, позволило поставить под сомнение и данную концепцию.
В начале 1960-х гг. было доказано, что тимус является центральным органом иммунной системы. С этого времени вилочковая железа рассматривается в качестве железы внутренней секреции, действие гормонов которой направлено на дифференцировку тимических лимфоцитов. Открытие основной функции вилочковой железы — продукции Т-лимфоцитов и регуляции иммунитета, а также принадлежность ее к системе эндокринных желез позволяют рассматривать данный орган как коммутатор иммунной и эндокринной систем. В серии работ отечественных исследователей последних 20 лет доказывается, что дети с большой вилочковой железой относятся к числу иммунодефицитных лиц.
В 1970 г. проф. Т. Е. Ивановской [6] для обозначения увеличенной вилочковой железы вместо вышеуказанных терминов был предложен термин «тимомегалия». Под тимомегалией российские морфологи понимают увеличение объема и массы тимуса выше предельных возрастных значений с сохранением нормальной гистоархитектоники органа. Начиная с 1970 г., этот термин стал широко использоваться как морфологами, так и клиницистами.
Однако проведенные исследования показали, что тимомегалия является лишь одним из симптомов того состояния, которое существует у детей, имеющих увеличенную вилочковую железу [7]. В связи с отсутствием другого термина, отражающего сущность состояния, которое имеет место у детей с увеличенной вилочковой железой (соответствующей тимомегалии в понимании патологоанатомов), предлагаем называть его синдромом Платтера.
Термином «синдром Платтера» следует обозначать состояние, при котором клинические и параклинические методы обследования позволяют выявить у детей и подростков ряд специфических изменений организма, сочетающихся с первичной длительно сохраняющейся тимомегалией. Клиническое понимание тимомегалии при синдроме Платтера отражает морфологическое состояние вилочковой железы, при котором масса и объем тимуса превышают предельные возрастные значения при сохранении нормальной гистоархитектоники органа.
Диагностика тимомегалии в клинической практике
Ориентировочная диагностика тимомегалии может быть проведена с помощью объективного исследования: осмотра, пальпации, перкуссии. Однако оценка результатов во многом субъективна и зависит от опыта исследователя [7].
Из инструментальных методов, позволяющих объективно выявить тимомегалию, используются рентгенодиагностика и ультразвуковое исследование (УЗИ).
Рентгенодиагностика. Методологической основой рентгенодиагностики увеличенного тимуса является следующее положение: в норме у детей любого возраста на стандартных рентгенограммах грудной клетки в прямой проекции тень тимуса не должна выходить за пределы тени сосудистого пучка и сердца.
В целях диагностики тимомегалии на рентгенограммах грудной клетки в прямой проекции мы применяли кардио-тимико-торакальный индекс (КТТИ) по J. Gewolb [8] и вазокардиальный индекс (ВКИ) [7]. Оба индекса определяются на стандартных рентгенограммах грудной клетки в прямой проекции. КТТИ представляет собой частное от деления ширины сосудистого пучка на уровне бифуркации трахеи (точка carina) на ширину грудной клетки на уровне купола диафрагмы. ВКИ представляет собой частное от деления ширины сосудистого пучка на уровне бифуркации трахеи (точка carina) на максимальную ширину тени сердца. Максимальная ширина тени сердца определяется как сумма двух перпендикулярных отрезков, опущенных на вертикальную линию (проведенную через середину позвоночного столба) из максимально удаленных от нее точек сердца слева и справа (рис. 1).
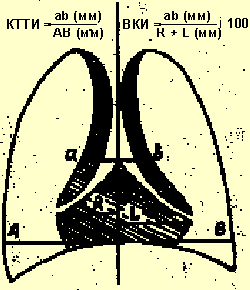 |
| Рисунок 1. Схема вычисления индексов КТТИ и ВКИ |
Выявление в средостении характерной овальной, треугольной или лентовидной тени с прямым, волнообразным или неровным контуром, расположенной с одной или обеих сторон сосудистого пучка, искажающей линию «сердечной талии» слева и/или вазокардиальный угол справа, позволяет сделать заключение о существовании у пациента тимомегалии. Наличие увеличенных значений КТТИ и ВКИ подтверждает данный диагноз. Рентгенологический метод, однако, информативен только для детей грудного и раннего возраста, поскольку у детей в возрасте старше 3 лет, как правило, тимус располагается за тенью сосудистого пучка и сердца. В таблице 1 приведены значения КТТИ и ВКИ у детей первых 3 лет жизни при разных степенях увеличения тимуса.
УЗИ. УЗИ тимуса в нашей стране впервые было проведено у новорожденных детей С. М. Воеводиным [9]. Путем клинико-морфологических сопоставлений нами были разработаны коэффициенты пересчета линейных параметров тимуса в более привычные для клиницистов формы (объема и массы органа). Округленные величины указанных коэффициентов, по нашим данным, равны 0,7 (для массы) и 0,5 (для объема). Таким образом, величины массы и объема тимуса при ультразвуковом сканировании вычисляются следующим образом:
М = 0,7 в a в b в c;
V = 0,5 в a в b в c,
где a, b, c — линейные параметры тимуса (ширина, длина, передне-задний размер, выраженные в см); 0,7 и 0,5 коэффициенты пересчета линейных параметров на массу и объем органа соответственно [10]. Для практических целей массу и объем вилочковой железы достаточно определять так, как это указано выше: без вычисления объема и массы отдельных долей.
Методом центильного распределения нами были определены нормальные значения массы и объема тимуса для детей в возрасте 1–24 мес (табл. 2). При превышении массы и объема тимуса выше верхних предельных значений нормы состояние ребенка следует расценивать как тимомегалию.
На основании анализа более 5000 рентгенограмм, выполненных у детей грудного возраста при подозрении на пневмонию, диагноз которой рентгенологически не был подтвержден, тимомегалия нами была выявлена у 35% пациентов 1 — 3 мес, у 15% детей в возрасте 3–6 мес, у 8% — в возрасте 7–15 мес, у 2% — в возрасте 16 — 36 мес, а в популяции детей старше 3 лет частота выявления тимомегалии не превышала 0,5% [8].
Наблюдение за одними и теми же детьми на протяжении длительного отрезка времени позволило нам сделать вывод, что тимомегалия в детском возрасте может быть как транзиторной, так и стойкой.
В 1993 г. нами совместно с О. В. Зайратьянцем была предложена классификация тимомегалии в детском возрасте на основе клинико-морфологических данных. Несколько измененный вариант указанной классификации приведен в табл. 3 (см. рубрику «Под стекло»). Наиболее частым вариантом тимомегалии в детском возрасте является синдром Платтера.
Анализ родословных позволил выявить у родственников первой и второй линии родства детей с синдромом Платтера высокую частоту встречаемости злокачественных новообразований, аутоиммунных заболеваний и заболеваний системы эндокринных органов. Так, злокачественные новообразования встречаются в каждой третьей семье, где есть дети с синдромом Платтера, с такой же частотой в этих семьях регистрируются эндокринные заболевания (преимущественно сахарный диабет и заболевания щитовидной железы). В семьях детей с синдромом Платтера статистически чаще, чем в семьях детей из выборки общей популяции, распространены аутоиммунные заболевания (диффузные болезни соединительной ткани) и туберкулез. Помимо этого, многие родители детей с указанным синдромом в дошкольном и младшем школьном возрасте относились к группе часто болеющих, т. е. к группе детей имевших повышенную склонность к острым респираторным вирусным инфекциям (ОРВИ).
Характер перечисленных заболеваний (склонность к вирусным, аутоиммунным, онкологическим заболеваниям, туберкулезу) может указывать на существование у близких родственников детей с синдромом Платтера недостаточной активности клеточного звена иммунной системы, поскольку, согласно современным воззрениям, все перечисленные заболевания находятся под контролем Т-клеточного иммунитета, формируемого вилочковой железой. При этом не совсем ясно, чем объясняется высокая отягощенность родственников детей с синдромом Платтера болезнями системы эндокринных органов. Однако не следует забывать о том, что эндокринные заболевания (в том числе сахарный диабет, диффузный токсический зоб, гипотиреоз) могут иметь аутоиммунный генез.
В таком случае у близких родственников детей с синдромом Платтера отчетливо просматривается тенденция к заболеваниям, связанным с иммунными механизмами клеточного типа, контролирующимися вилочковой железой. Это позволяет предполагать возможность передачи детям, у которых развился синдром Платтера, какого-то дефекта Т-звена иммунной системы.
Антенатальный период у большинства детей с синдромом Платтера осложняется хронической гипоксией, обусловленной острыми инфекционными заболеваниями или обострением хронических экстрагенитальных заболеваний матерей, наличием у них сосудистой дистонии, анемии, гестозов.
Осложненное течение интранатального периода отмечается не менее чем у 2/3 детей с синдромом Платтера. Наиболее частыми осложнениями этого периода явились стремительные или затяжные роды, приведшие к наложению щипцов или экстренному кесареву сечению.
Группа детей с указанным синдромом по фенотипу гетерогенна. 90% детей имеют мягкие округлые формы тела, некоторую пастозность тканей, относительно крупные черты уплощенного лица, прямой тип лба, широкоовальные глаза, относительно короткий нос с низким переносьем, средней величины или толстые губы, слабый изгиб профиля, короткую шею. Дети этой группы имеют как бы увеличенные поперечные размеры тела: широкое лицо, широкая грудная клетка, широкие плечи, широкие ладони и стопы, относительно короткие и широкие пальцы. Около 3/4 детей-европеоидов этой подгруппы имеют нежную, но несколько утолщенную, слабопигментированную белую кожу, для которой характерно быстрое развитие ожога после инсоляции, светлую окраску волос и глаз, слабое развитие мускулатуры, сниженную физическую активность. Дети данной подгруппы отличаются хорошим (и даже избыточным) аппетитом и высокими темпами роста.
В дошкольном и младшем школьном возрасте у них отмечаются хорошее развитие подкожного жирового слоя, слабое развитие мускулатуры, снижение общего тонуса и тургора тканей, а также физической активности, замедленная реакция на внешние раздражители, замедленное образование новых условных рефлексов, ослабление процессов внутреннего торможения с преобладанием реакций внешнего торможения.
Клиническая характеристика детей с синдромом Платтера включает характеристику системы лимфоидных органов, которая, согласно мнению большинства исследователей, отличается генерализованной гиперплазией системы лимфоидных органов: лимфатических узлов, лимфатических фолликулов корня языка, задней поверхности глотки, поверхности надгортанника, гипертрофией небных и глоточной миндалин. Наши наблюдения, однако, показали, что состояние периферических лимфоидных органов зависит от воздействия антигенного стимула — при отсутствии такого воздействия генерализованная гиперплазия периферического лимфоидного аппарата не развивается [7].
К числу особенностей физического развития детей грудного и раннего возраста относятся: высокие темпы увеличения длины тела, слабое развитие скелетной мускулатуры, несвоевременность и неправильный порядок прорезывания молочных зубов, относительно позднее начало самостоятельной ходьбы.
В эмоциональной сфере в первые 2–3 мес жизни обращает внимание менее выраженный комплекс оживления (за счет снижения двигательной активности).
Начало становления речи у детей с синдромом Платтера не отличалось от такового у детей соответствующего возраста в популяции в целом: гуление, слоги и первые слова у них появлялись своевременно.
К возрасту 10–11 мес они начинали произносить первые одно- и двусложные слова, к 1 году количество активно произносимых слов достигало 10–12. В дальнейшем 8% детей данной группы до 2-летнего возраста продолжали пользоваться только этими 10–12 словами. В возрасте 4,5–6 лет 25% детей этой группы страдали дислалией, требующей проведения корригирующих логопедических занятий в условиях детской поликлиники или в условиях специализированного детского сада. У отдельных пациентов нарушение, связанное с произношением звуков, сохранялось и в подростковом возрасте.
Состояние здоровья детей с синдромом Платтера. Здесь рассматриваются только те заболевания и патологические состояния, которые достоверно чаще встречались у детей с указанным синдромом, по сравнению с детьми из общей популяции. При анализе структуры выявленных заболеваний наибольшую по численности группу составили аномалии развития (выявлены у 80% наблюдавшихся пациентов) — пороки развития, множественные стигмы дизэмбриогенеза, биохимические дефекты. Пороки развития чаще проявлялись гипоплазией органов и тканей: широкие отверстия паховых каналов и пупочного кольца, септальные дефекты в сердце, гипоплазия аорты, сердца, легких, почек, щитовидной железы и др.
Вторая группа заболеваний была представлена патологическими состояниями нервной системы. Наряду с заболеваниями нервной системы, обусловленными биохимическими дефектами (синдром Менкеса; ганглиозидоз Gm1; фенилкетонурия; галактоземия), обращали на себя внимание такие синдромы, как гипертензионно-гидроцефальный (у 49%), фебрильных судорог (у 20%), мышечной гипотонии (у 18%) и вегетативно-висцеральной дисфункции (у 12,5%). Включение в комплекс обследования электрофизиологических методов, компьютерной и ядерно-магнитно-резонансной томографии привело к существенному увеличению частоты выявления гипертензионно-гидроцефального синдрома (выявлен у 90%). Указанный синдром у 2/3 детей сочетался с синдромами фебрильных судорог и вегетативно-висцеральных дисфункций, однако последние два синдрома у части детей встречались и изолированно.
Изолированный синдром вегетативно-висцеральных дисфункций характеризовался крайне выраженным полиморфизмом проявлений: нарушение терморегуляции, дыхания, сердечной деятельности, функции желудочно-кишечного тракта, пароксизмальное повышение артериального давления и другие расстройства. Мы склонны считать, что синдром вегето-висцеральных дисфункций у детей с синдромом Платтера встречается значительно чаще, чем у указанных 12,5% пациентов. На существование гиподиагностики синдрома вегето-висцеральных дисфункций могут указывать выявленные нами фенотипические особенности детей, в том числе очень хороший (скорее избыточный) аппетит, склонность к задержке жидкости, как бы немотивированный субфебрилитет. Наши наблюдения показали, что у большинства детей с якобы немотивированным субфебрилитетом последний хорошо контролировался мочегонными средствами, что явно указывает на связь этого симптома с ликворной гипертензией, в том числе с повышением давления в области третьего желудочка мозга — месте локализации центра терморегуляции.
У детей с синдромом Платтера обращал на себя внимание и синдром мышечной гипотонии, который у ряда пациентов был настолько сильно выражен, что специалисты высказывали предположение о наличии у них болезни Верднига–Гоффманна или миелодисплазии.
Таким образом, частое выявление у детей с синдромом Платтера внутренней гидроцефалии, изолированного синдрома вегето-висцеральных дисфункций, наличие вегетативных нарушений указывает на возможность нарушения функции диэнцефальной области. Изменения со стороны скелетной мускулатуры трактовать сложнее. Однако если учесть, что средний мозг, примыкающий к области сильвиева водопровода, контролирует регуляцию мышечного тонуса и сигналы к мышцам поступают через ретикулярную формацию по двум ретикулоспинальным путям [11], то это нарушение может быть рассмотрено с позиции существования у данного контингента детей внутренней гидроцефалии и расстройства ликвородинамики, поскольку гипоталамус, таламус и ретикулярная формация являются звеньями единой суперфункциональной системы, корригирующей гомеостатические программы наиболее сложных вегетативных, эндокринных, трофических и психических функций [12].
У 9% пациентов школьного возраста с синдромом Платтера зарегистрированы заболевания нейроэндокринной и эндокринной системы (диэнцефальный синдром, несахарный диабет, транзиторный несахарный диабет, транзиторный гипопаратиреоз, инсулинозависимый сахарный диабет, поликистоз яичников, эутиреоидная струма, диффузный токсический зоб, субкомпенсированный гипокортицизм). У детей с синдромом Платтера, отмечается тенденция к высоким показателям роста и слабой пигментации кожи, что может также указывать на дисфункцию гипоталамо-гипофизарной системы. Кроме того, у этих детей существует ряд симптомов, которые мы назвали торакальными и к числу которых относится синдром сдавления средостения. Этот синдром мы наблюдали только у детей первых 2–2,5 мес жизни при значительном увеличении тимуса.
Все исследователи, занимавшиеся изучением особенностей лиц со стойкой тимомегалией (а основную группу в них, вне всякого сомнения, составляют дети с синдромом Платтера), обращали внимание на их пониженную физическую активность.
При специальном опросе 72 пациентов в возрасте 10–24 лет с синдромом Платтера у 46% из них было отмечено негативное отношение к физическим нагрузкам, особенно к бегу на длинные дистанции и езде на велосипеде. Подростки и лица молодого возраста, способные передать ощущения, появлявшиеся при физической нагрузке, отмечали на ее фоне чувство слабости, ощущение нехватки воздуха.
Когда у 30 подростков с синдромом Платтера, не имевших органических заболеваний сердца, было проведено эхокардиографическое исследование сердца на аппарате 128 х Р — ACUSON (США) с определением массы миокарда левого желудочка сердца, у 27 из них индексированная (относительно массы тела) масса миокарда левого желудочка сердца оказалась достоверно меньше (р
Л. Г. Кузьменко, доктор медицинских наук, профессор
РУДН, Москва