Точка венкебаха что это
Внутрисердечное электрофизиологическое исследование (ЭФИ)



Второй четырехполюсный электрод-катетер устанавливают в высоком боковом отделе ПП, близко от расположения СА-узла. Этот электрод используют для программируемой стимуляции ПП, а также для регистрации электрограммы верхних отделов ПП (НRА).
Третий четырехполюсный электрод помещают в полость ПЖ. Он используется для программируемой стимуляции ПЖ, а также для регистрации электрограммы ПЖ.
Наконец, четвертый электрод-катетер проводят через правую подключичную вену в ПП, а затем — в устье коронарного синуса. Регистрируют электрограмму коронарного синуса, отражающую электрическую активность ЛП (не показана на рисунке).
Описанное расположение электродов-катетеров может быть использовано для записи эндокардиальных электрограмм (ЭГ), в частности, для записи ЭГ пучка Гиса, различных отделов предсердий и правого желудочка (рис. 3.19).
Эти данные используют для оценки скорости проведения электрического импульса в различных отделах сердца как в период спонтанного синусового ритма, так и во время искусственной стимуляции ПП.
Электрограмма пучка Гиса
Электрограмма пучка Гиса (ЭПГ или НВЕ), зарегистрированная синхронно с поверхностной ЭКГ, позволяет оценить скорость проведения возбуждения по правому предсердию, АВ-соединению, общему стволу пучка Гиса, а также ножкам и ветвям пучка Гиса. ЭПГ используется, например, для точной топической диагностики АВ-блокад.
На рис 3. 20. представлена нормальная электрограмма пучка Гиса (HBE), которая состоит из трех групп осцилляций, каждая из которых соответствует активации определенного отдела проводящей системы (рис. 3.21): 1) группа осцилляций А, отражающих деполяризацию нижней части предсердий; 2) группа осцилляций H, обусловленных активацией общего ствола пучка Гиса и 3) группа осцилляций V, вызванных деполяризацией миокарда желудочков.
| Рис. 3.20. Нормальная электрограмма пучка Гиса (НВЕ). Объяснения и обозначения в тексте | 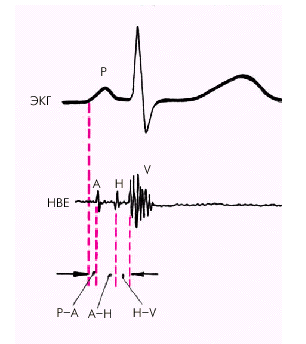 |
| Рис. 3.21. Соответствие осцилляций электрограммы пучка Гиса проведению возбуждения по предсердиям, АВ-соединению, пучку Гиса, его ветвям и волокнам Пуркинье | 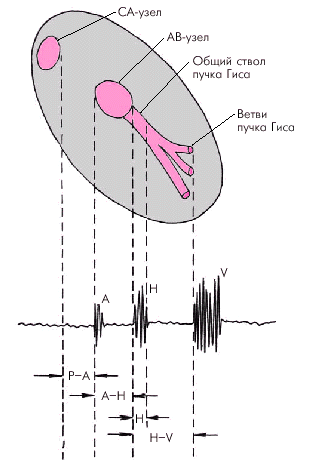 |
Сопоставление электрограммы пучка Гиса с зубцом Р стандартной ЭКГ позволяет количественно оценить ряд временных интервалов.
1. Интервал Р – А (от начала зубца Р ЭКГ до начала группы осцилляций А на НВЕ) отражает время проведения электрического импульса по предсердиям.
2. Интервал А – Н (от начала осцилляций А до начала осцилляций Н) соответствует времени проведения по АВ-соединению.
3. Интервал Н (продолжительность осцилляций группы Н) отражает время проведения по общему стволу пучка Гиса.
4. Интервал Н – V (от начала осцилляций Н до первых отклонений желудочкового комплекса) соответствует проведению импульса по пучку Гиса, его ветвям и волокнам Пуркинье.
В табл. 3.4. представлены нормальные значения указанных интервалов.
Таблица 3.4
Нормальные значения интервалов электрограммы пучка Гиса
Увеличение продолжительности того или иного интервала ЭПГ позволяет диагностировать преимущественные нарушения проведения по АВ-соединению, общему стволу или ножкам пучка Гиса.
Проведение в ножках и ветвях пучка Гиса может быть оценено по ЭПГ при использовании техники нарастающей по частоте стимуляции предсердий. Ухудшение проводимости по ножкам пучка Гиса сопровождается удлинением интервала Н–V.
Примеры патологических ЭПГ приведены в разделе 3.4.
Определение “точки Венкебаха”
Для оценки функции проводимости в АВ-соединении часто применяют технику нарастающей электрической стимуляции предсердий, которая у каждого человека (здорового или больного) закономерно приводит к возникновению узловой АВ-блокады II степени (типа I по Мобитцу). Критическая частота предсердной стимуляции, вызывающая АВ-блокаду, получила название “точки Венкебаха”. Она также характеризует функцию проводимости по АВ-соединению. В норме у большинства здоровых людей “точка Венкебаха” соответствует 140–150 стимулам в мин, а при ухудшении проводимости по АВ-соединению снижается до 130 стимулов в мин и менее.
Оценка функции проводимости в предсердиях
Скорость проведения в ПП оценивают по интервалу между осцилляциями, полученными в верхнем и нижнем отделах ПП (НRА–LRА), а также по времени между моментом нанесения искусственного экстрастимула (St) и началом предсердного ответа. При использовании электрода-катетера, расположенного в коронарном синусе, можно оценить время межпредсердного проведения (рис. 3.22).
| Рис. 3.22. Схема оценки функции проводимости по предсердиям. Обозначения те же, что и на рис. 3.19. 1 — время проведения по ПП; 2 — время межпредсердного проведения | 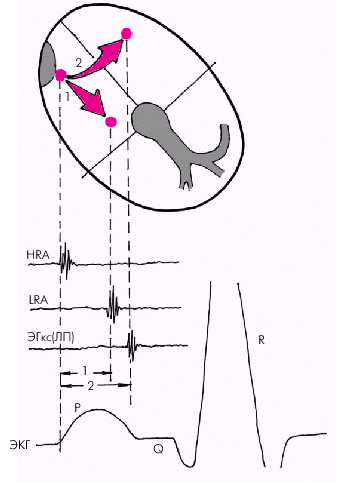 |
Выявление ретроградного проведения по АВ-соединению
Возможность ретроградного проведения по АВ-соединениюможет быть оценена при регистрации ЭПГ. При электростимуляции ПЖ (через электрод-катетер, помещенный в ПЖ) на ЭПГ и ЭГ предсердия после появления желудочковых осцилляций (V), вызванных экстрастимулом, можно зарегистрировать осцилляции, отражающие возбуждение пучка Гиса (Н) и предсердий (А). Это свидетельствует о ретроградном (от желудочка к предсердиям) проведении электрического импульса в АВ-соединении.
Программированная электрическая стимуляция сердца
Программированная электрическая стимуляция сердца является важнейшим этапом проведения внутрисердечного ЭФИ, особенно у больных с рецидивирующими пароксизмальными тахиаритмиями или у пациентов с брадиаритмиями. В большинстве случаев она позволяет составить представление о характере и механизмах пароксизмов и локализации источника эктопических ритмов, решить вопрос о показаниях и способе хирургического лечения аритмии и, при необходимости, купировать возникшее нарушение ритма или проводимости.
Нанося по специальной программе серию экстрастимулов, приходящихся на различные участки сердечного цикла, а также меняя частоту навязанного ритма и место стимуляции, определяют продолжительность рефрактерных периодов отдельных участков проводящей системы сердца как в антероградном, так и в ретроградном направлении. У больных с пароксизмальными тахиаритмиями добиваются воспроизведения приступа аритмии, что позволяет по способу индукции и купирования аритмии составить наиболее полное суждение об основных механизмах ее возникновения и, соответственно, об оптимальных способах лечения аритмии, в том числе хирургических.
Эндокардиальное и эпикардиальное картирование
Эндокардиальное и эпикардиальное (интраоперационное) картирование также является одним из этапов внутрисердечного ЭФИ. Оно проводится с целью определения локализации областей, требующих хирургической деструкции, и чаще всего используется у больных с синдромом WPW для определения точного местоположения дополнительных (аномальных) путей АВ-проведения.
Эндокардиальное картирование проводят с помощью электродов-катетеров, устанавливаемых в нескольких точках по окружности правого и левого АВ-колец. При интраоперационном картировании чаще используется техника эпикардиального картирования. При нанесении экстрастимулов в области предсердий определяют место самой ранней желудочковой активации, которая соответствует локализации дополнительного (аномального) пути.
Следует также иметь в виду, что техника ЭФИ может быть использована для купирования тяжелых тахиаритмий, не поддающихся консервативным методам лечения.
Таким образом, с помощью внутрисердечного ЭФИ можно получить наиболее полную информацию о характере и электрофизиологических механизмах разнообразных нарушений ритма и проводимости. В то же время инвазивный характер этой методики, выполнение которой требует применения дорогостоящей аппаратуры и небезопасно для больного, существенно ограничивает использование внутрисердечного ЭФИ в клинической практике. К этому методу обращаются, как правило, в тех случаях, когда речь идет о необходимости хирургического лечения аритмий.
Точка венкебаха что это
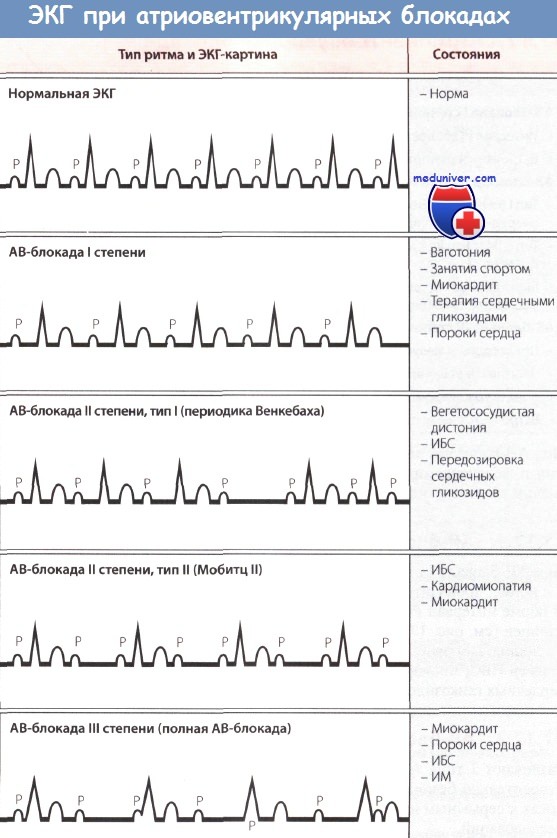
При АВ-блокаде II степени наблюдается периодическое прерывание проведения предсердных импульсов на желудочки. Поэтому после отдельных зубцов Р комплексы QRS отсутствуют.
АВ-блокада II степени подразделяется на два типа: тип Мобитц 1 (именуемый также АВ-блокадой Венкебаха) и тип Мобитц 2.
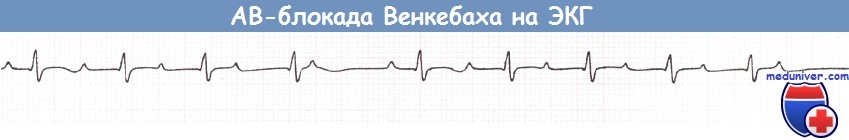
При АВ-блокаде II степени типа Мобитц 1 (АВ-блокаде Венкебаха) задержка АВ-проведения нарастает с каждым последовательным предсердным импульсом до тех пор, пока проведение на желудочки одного из очередных предсердных импульсов не прерывается. На ЭКГ при этом наблюдается прогрессирующее удлинение интервала PR с последующим «выпадением» очередного комплекса QRS.
После зубца Р, не проведенного на желудочки, АВ-проводимость восстанавливается и события повторяются в той же последовательности. Типичным является то, что степень прироста PR во время такой последовательности прогрессивно сокращается от цикла к циклу, в связи с чем интервал между соседними комплексами QRS прогрессивно укорачивается.
Причиной АВ-блокады Венкебаха обычно является нарушение проведения в АВ-узле. Как и АВ-блокада I степени, она может быть доброкачественной (особенно если выявляется во время сна), будучи обусловленной повышенным тонусом блуждающего нерва. АВ-блокада Венкебаха, которую нельзя объяснить повышенным тонусом блуждающего нерва (например, у пожилых лиц в часы бодрствования), имеет такое же прогностическое значение, что и АВ-блокада II степени типа Мобитц 2.
В отличие от приводимых в учебниках примеров, на практике запись ЭКГ у пациента с АВ-блокадой Венкебаха чаще всего начинается не с наиболее короткого интервала PR. Если с первого взгляда ясно, что на ЭКГ имеются непроведенные зубцы Р, однако тип АВ-блокады неочевиден, задайте себе вопрос: «Это АВ-блокада Венкебаха?».
Ищите наиболее короткий интервал PR, а затем смотрите, имеется ли его прогрессивное нарастание.
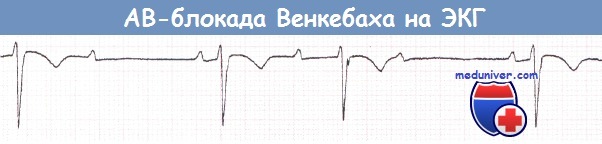
Не как в примере из учебника, а как это часто бывает на практике, запись начинается не с наиболее короткого интервала PR.
Учебное видео выявления АВ-блокады и ее степеней на ЭКГ
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Нарушение проводимости при инфаркте миокарда нижней стенки

Одной из проблем, не теряющих актуальности, остается тактика ведения больных с острым ИМ нижней локализации и нарушениями атриовентрикулярного проведения. До настоящего времени коррекция гемодинамических нарушений в данной группе больных остается неудовлетворительной, что и поддерживает исследовательский поиск в этом направлении.
Разнообразие гемодинамических нарушений, возникающих из-за разной площади миокарда правого и левого желудочка, включенного в зону ишемического поражения, трудоемкость и отсутствие закрепленной рекомендации проведения ЭКГ- диагностики инфаркта миокарда правого желудочка мешают правильной оценке состояния больного.
Несмотря на то, что многие пособия и руководства в разделах ЭКГ-диагностики ОИМ рекомендуют проводить регистрацию электрокардиограммы правых грудных отведений при ОИМ нижней стенки сердца, врачи догоспитального и госпитального этапа крайне редко используют их для оценки поражения миокарда правого желудочка (ПЖ).
Даже в крупном исследовании GUSTO-I, целью которого являлась оценка исходной ЭКГ для стратификации краткосрочного риска после инфаркта миокарда, при нижнем инфаркте миокарда не проводилась оценка сегмента ST в правых грудных отведениях. В ЭКГ-заключении очаговые изменения в отведениях II, III, AVF описываются только как поражение левого желудочка.
Правая коронарная артерия
Напомним, что кровоснабжение сердца у человека в 62% случаев представлено правым типом, в 11% — равномерным, остальные 27% поделены между среднеправым, среднелевым и левым типами кровоснабжения.
У большинства людей (82%) в бассейн правой коронарной артерии (ПКА) включены такие структуры сердца, как синоаурикулярный (СА) узел, ПЖ, задняя стенка ЛЖ и ПЖ, атриовентрикулярное (АВ) соединение, межпредсердная перегородка, верхняя часть ствола пучка Гиса и задненижняя ветвь левой ножки пучка Гиса.
Из этого следует, что очаговые изменения в нижних ЭКГ- отведениях (II, III, AVF) являются в большинстве случаев следствием поражения ПКА и более корректно описывать эти изменения как поражение нижней стенки сердца, а не только левого желудочка.
Брадиаритмии, осложняющие течение ОИМ, также чаще являются следствием поражения ПКА, которая в 50-60% случаев кровоснабжает синусный узел и в 90% — атриовентрикулярное соединение.
Нарушения АВ-проведения при нижнем ИМ в большинстве своем имеют быстро обратимый характер в отличие от нарушений АВ-проведения при поражении ЛКА. Лабильность АВ-нарушений при поражении ПКА может быть объяснена тремя составляющими: топографическим уровнем поражения проводящей системы, гемодинамическими особенностями работы правого сердца и степенью сердечной недостаточности, развивающейся в ответ на снижение систолической функции правого желудочка.
Структуры проводящей системы, попадающих в зону ишемии
Максимальное количество импульсов, вырабатываемое синусным узлом, не превышает 210 в минуту и является ответом на активацию симпатического отдела вегетативной нервной системы при физической нагрузке, эмоциональном, болевом воздействии, снижении минутного объема кровообращения (МОК). Главенствующее значение в регуляции МОК отводится частоте сердечных сокращений.
Синусовые импульсы проникают в АВ-соединение через два входа: 1) передний — из основания межпредсердной перегородки, 2) задний — со стороны пограничного гребня.
Структура и электрофизиологические особенности АВ-соединения обеспечивают физиологическую задержку импульсов. Верхняя граница нормальной физиологической проводимости через АВ-соединение — 180-220 импульсов в минуту.
Максимальное количество импульсов, проходящее через АВ-соединение на желудочки с кратностью 1:1, называется точкой Венкебаха и характеризует пропускную способность АВ- соединения. Точка Венкебаха является индивидуальной характеристикой, имеет тенденцию к снижению с увеличением возраста, на фоне склеро-дегенеративных процессов, ишемии, постинфарктного фиброза и др.
В частности, ишемическое поражение АВ-соединения вызывает изменение его электрофизиологических свойств, приводит к торможению передачи импульса и снижению точки Венкебаха. Увеличение числа наджелудочковых импульсов выше точки Венкебаха нарушает их проведение через АВ- соединение на желудочки, что проявляется различной степенью блокады АВ-проведения.
Первая степень АВ-блокады в 79% случаев возникает на узловом уровне, но может развиваться при блокировании проведения на всех уровнях.
Вторая степень АВ-блокады I типа (с периодикой Самойлова-Венкебаха) может быть на узловом (72%), стволовом (9%) уровне (бассейн ПКА) и в области ножек пучка Гиса (19%). Вторая степень АВ-блокады II типа может развиваться на уровне ствола пучка Гиса (35%) (бассейн ПКА) или ножек пучка Гиса (65%) (бассейн ЛКА и ПКА).
АВ-блокада III степени, или полная АВ- блокада, может развиваться при блокировании проведения на всех уровнях.
Разделение по степени блокирования импульсов не позволяет оценить уровень блокирования (проксимальный или дистальный), определение которого влияет на прогноз и выбор тактики ведения больного. Например, дистальная АВ-блокада III степени, кроме нарушений гемодинамики, является фактором риска развития фибрилляции желудочков.
Электрокардиографический метод является самым практичным в определении уровня блокады, особенно в ситуациях, когда нет возможности провести внутрисердечное электрофизиологическое исследование (ЭФИ).
В 1980-х годах предложили выделять типы АВ-блокад:
Следует сказать, что продолжительность желудочкового комплекса не является основным ориентиром в определении уровня блокады, необходимо, прежде всего, ориентироваться на частоту желудочкового ритма. Так, при проксимальной АВ-блокаде III степени частота желудочкового ритма, как правило, находится в диапазоне от 40 до 60 в минуту, а при дистальной — от 25 до 40 в минуту.
Гемодинамика работы правого сердца
По законам гидродинамики объемная скорость кровотока прямо пропорциональна градиенту давления. Для правого сердца градиент давления равен разнице между давлением на периферии венозной сети и на ее центральном конце, которым является правое предсердие (ПП).
Правое сердце функционирует как общая камера, в период диастолы давление в ПП равно давлению в правом желудочке (ПЖ). Давление в ПП в норме может быть равно нулю, но может повышаться до 6 мм рт. ст. Давление в ПП совпадает с центральным венозным давлением (ЦВД).
На давление в ПП влияет внутрисосудистый объем, снижение которого ведет к снижению давления в ПП. Повышение давления в ПП развивается при недостаточности правого желудочка, клапанных пороках, легочной гипертензии различной этиологии, тампонаде сердца и др.
Количество крови, притекающее к правому сердцу, или венозный возврат, оказывает прямое влияние на ЦВД и МОК. На венозный возврат влияют такие факторы, как градиент давления, сопротивление току крови в венах, дыхание, положение тела, тонус артериол и сокращение скелетной мускулатуры при физической нагрузке. При сохраненной сократительной функции сердца ВВ равен сердечному выбросу (СВ).
На СВ влияют ВВ, физическая нагрузка и увеличение ЧСС, сократимость миокарда. Более точным показателем общего количества крови, которое выбрасывает сердце за единицу времени, является сердечный индекс (СИ). СИ — это показатель, равный СВ, отнесенному к площади поверхности тела (в м2). Средние значения СИ в норме составляют >2,5 л/мин на м2.
Сердечная правожелудочковая недостаточность
При развитии ИМ с вовлечением ПЖ происходит снижение его сократительной функции, что приводит к повышению давления в правом сердце до 12-20 мм рт. ст., уменьшению градиента давления, снижению ВВ и СИ.
При сохраненной сократительной функции ЛЖ снижение СИ менее 2,0 л/мин на м2 приводит к развитию СН по правожелудочковому типу и включению компенсаторных механизмов, направленных на поддержание МОК. Компенсация происходит за счет увеличения ЧСС.
При сохраненной функции СУ частота его импульсов является показателем выраженности сердечной недостаточности.
Таким образом, наличие АВ-блокады при нижнем ИМ имеет высокую предсказательную точность (около 80%) в отношении поражения правого желудочка и развития правожелудочковой недостаточности.
В остром периоде ИМ правожелудочковая недостаточность проявляется гипотензией и тахикардией. Преимущество в лечении нарушений гемодинамики у больных с АВ-блокадами и нижним ОИМ отдается трансвенозной эндокардиальной электростимуляции сердца.
Разделение правожелудочковой недостаточности и нарушений АВ- проводимости приводит к тому, что врач при выборе лечебной тактики не учитывает один из патогенетических механизмов развития нарушения ритма и проводимости.
И. Ю. Лукьянова, Ю. В. Соколов, И. А. Короткевич, С. П. Катасонов
Проверка и настройка электрокардиостимулятора

Данная услуга в себя включает:
опрос и осмотр пациента с последующим анализом изученных симптомов;
оценка состояния места имплантации стимулятора на предмет дислокации, повреждения ЭКС, воспаления ложа ЭКС;
снятие и общий анализ первичной ЭКГ пациента (в т.ч. оценка коронарного кровообращения и спонтанного ритма);
проведение функциональных тестов и проб, определяющих срок службы и эффективность работы стимулятора.
— определение и оценка текущего состояния источника питания – приблизительный срок службы батареи и электрода
— определение и оценка сопротивления на конце электрода
— определение порога стимуляции (необходимой силы тока и длительности импульса для продолжения эффективной стимуляции сердца)
— определение и оценка порога восприятия кардиостимулятором собственного ритма
определение и оценка ЭКС зависимости пациента
оценка адекватности заданных лечебных параметров и диагностических функций;
перепрограммирование текущих параметров на основе полученных после обследования данных.
— программирование базового ритма ЭКС, ритма во время сна и отдыха, ритма во время физических нагрузок
— программирование необходимой силы тока и длительности импульса для эффективной кардиостимуляции
Для двухкамерных ЭКС дополнительно
Программирование рефрактерного периода AP-VP
Программирование максимальной активности сенсора
Программирование точки Венкебаха
Программирование функции ModeSwitch
снятие и анализ ЭКГ после выполнения программации и настройки ЭКС
выдача заключения об исправности ЭКС или рекомендаций о замене ЭКС и/или электродов
беседа с пациентом об особенностях изменения образа жизни у людей с имплантируемым кардиостимулятором
Оценка состояния проводимости в предсердиях

Другой признак, характеризующий состояние проводимости в мышце правого предсердия — величина латентного периода между экстрастимулом (артефактом) и началом предсердного ответа, т. е. предсердной ЭГ (в норме 15—20 мс). Выраженное удлинение периода латенции служит указанием на угнетение проводимости в каком-либо участке правого предсердия. Что же касается времени межпредсердного проведения, то, согласно измерениям нашего сотрудника А. Ю. Пучкова (1985), оно в среднем равняется 50 мс. Э. Римша и соавт. (1987) приводят величину 75 ±45 мс, А. А. Киркутис (1988) — 74,1±3 мс (интервал между ЭППВ и ЭГ дистальной части коронарного синуса).
Проведение в АВ узле. У здоровых людей в период физической нагрузки происходит небольшое укорочение интервала А—Н (Р—R). Во время нарастающей по частоте электрической стимуляции предсердий интервал А—Н (Р—R) удлиняется с формированием АВ узловой блокады I степени. Стимуляцию осуществляют короткими сериями длительностью в 10—15 с с увеличением частоты в каждой серии на 10 имп/мин.
Для каждого человека существует «критическая» частота предсердной стимуляции, при которой АВ блокада I степени переходит в АВ узловую блокаду II степени типа I («точка Венкебаха»). У 70% здоровых людей «точка Венкебаха» соответствует частоте предсердной стимуляции ниже 190 в 1 мин, обычно 140—150 стимулам в 1 мин. У детей без заболеваний сердца «точка Венкебаха» смещена до уровня выше 200 стимулов в 1 мин.
Слишком раннее возникновение периодики Венкебаха (130 в 1 мин) отражает ухудшение проводимости в АВ узле. Однако окончательное заключение об этом можно сделать лишь в том случае, если низкое значение «точки Венкебаха» сохраняется и после внутривенного введения 1мг атропина сульфата. При увеличении частоты предсердной стимуляции периодика Венкебаха сменяется АВ узловой блокадой 2:1, иногда можно наблюдать чередование АВ блокад 3:2 и 2:1. Интервал А—Н проведенного импульса при блокаде 2: 1 длиннее интервала А—Н при проведении 1:1, что связано с влиянием скрытого АВ узлового проведения блокированного импульса.
Способность АВ узла проводить импульсы в ретроградном направлении. Ее проверяют с помощью нарастающей по частоте стимуляции желудочков (через электрод, помещенный в правом желудочке). Интервал V—А (фактически, Н—А) постепенно удлиняется с переходом в ретроградную ВА узловую периодику Венкебаха. Она возникает у лиц с нормальным узловым проведением при стимуляции правого желудочка с частотой от 80 до 150 в 1 мин [Akhtar M. et al., 1986].