Топамакс или топирамат что лучше
Опыт применения топирамата у детей и взрослых
В последнее десятилетие синтезировано много новых оригинальных антиэпилептических препаратов (АЭП), которые входят в повседневную клиническую практику как детских, так и взрослых эпилептологов. Основная цель современной фармакологии в лечении эпилепсии —
В последнее десятилетие синтезировано много новых оригинальных антиэпилептических препаратов (АЭП), которые входят в повседневную клиническую практику как детских, так и взрослых эпилептологов. Основная цель современной фармакологии в лечении эпилепсии — создание «идеального» препарата, подавляющего не только припадки, но и обладающего истинным антиэпилептогенным действием с максимальным соотношением эффективность/переносимость. Увеличение числа АЭП существенно расширяет возможности в лечении эпилепсии, особенно при фармакорезистентных формах, и в то же время ставит врача в трудное положение выбора адекватного препарата. Положение усугубляется с появлением каждого нового препарата, поскольку у больных с фармакорезистентной эпилепсией может наблюдаться преходящее улучшение после приема каждого из вновь назначенных АЭП, и это создает иллюзию их эффективности. В то же время только накопление опыта применения этих препаратов дает возможность расширять группу АЭП. Новые препараты показали лучшую переносимость, более низкий потенциал взаимодействия с другими АЭП; кроме того, они проще в применении. Одним из таких препаратов является топирамат (Топамакс).
Топамакс относится к классу сульфаматзамещенных моносахаридов. Действие препарата осуществляется благодаря нескольким механизмам: блокада вольтажзависимых кальциевых и натриевых каналов (препятствующая активации ГАМКергической трансмиссии), подавление медиаторов возбуждения (глутамат), угнетение карбоангидразы. Таким образом, происходит коррекция нарушенного баланса тормозной ГАМКергической и возбуждающей глутаматергической систем. Благодаря такому действию расширяется спектр применения препарата при различных формах эпилепсии как в виде моно-, так и в составе комплексной терапии.
Топамакс характеризуется линейной фармакокинетикой, быстрой абсорбцией; в дозе до 200 мг/сут не метаболизируется в печени. Поскольку период полувыведения составляет примерно 21 ч, оптимальный прием препарата 1–2 раза в сутки, независимо от приема пищи. У Топамакса отсутствует влияние на концентрацию других АЭП, которые, в свою очередь, не действуют на его терапевтическую активность. К недостаткам Топамакса можно отнести медленную титрацию. «Терапевтическое окно» препарата очень широко — от 2 до 10 мг/кг/с. У детей показатели клиренса топирамата повышены, а период полувыведения более короткий. Следовательно, при одной и той же дозе в расчете на 1 кг массы тела концентрации Топамакса в плазме у детей могут быть ниже. В связи с этим необходим подбор более высоких доз по сравнению с взрослыми — до 15 мг/кг/с. Следует подчеркнуть, что Топамакс отнесен к третьей группе АЭП по потенциальному тератогенному влиянию, т. е. обладает минимальной тератогенностью (L. E. Leppic, 2001).
В публикациях отечественных авторов отмечены перспективность применения препарата в терапии детей и взрослых. Зарубежные врачи имеют большой опыт применения Топамакса в виде моно- и add-терапии с достаточным объемом наблюдения пациентов детского и взрослого возраста. Также за рубежом были проведены двойные слепые исследования по сравнению эффективности применения Топамакса, карбамазепина и вальпроатов (Privitera M. et al., 2003; и др.).
Цель данного исследования заключалась в оценке эффективности и безопасности применения Топамакса у детей и взрослых в качестве стартовой терапии, моно- и политерапии.
Открытое рандомизированное исследование включало 199 больных (100 мужчин и 99 женщин) в возрасте от 2 до 50 лет, получавших Топамакс в течение 6–36 мес (табл. 1). Все пациенты подвергнуты динамическому клиническому наблюдению, ЭЭГ, МРТ (в нескольких случаях КТ), при необходимости проводилась полиграфическая регистрация сна.
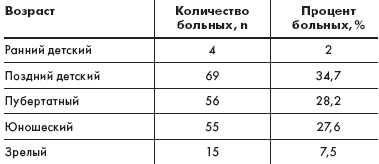 |
| Таблица 1. Распределение пациентов по возрасту |
У большинства больных заболевание дебютировало в детском возрасте — 66,7 % (табл. 2).
При анализе факторов риска получены следующие данные. Наследственная отягощенность отмечена у 15 больных, перинатальная патология — у 79, черепно-мозговая травма — у 19 пациентов, нейроинфекции — у 12, церебральные дисплазии — у 22, кисты — у 7, опухоли головного мозга — у 4, мезиальный темпоральный склероз — у 4, сосудистые заболевания — у 3, туберозный склероз — у 1, другие (болезнь Штурге–Вебера, Рандю–Ослера и др.) — у 6; факторы риска не были установлены у 27 пациентов. Приведенные данные показывают, что перинатальная патология является одним из основных факторов риска возникновения эпилепсии.
 |
| Таблица 2. Распределение пациентов по дебюту заболеваний |
По формам заболевания больные распределялись следующим образом: симптоматическая/криптогенная эпилепсия — 159 пациентов, идиопатическая: роландическая эпилепсия — 3, эпилепсия с генерализованными судорожными припадками — 2, детская абсансная эпилепсия — 4, юношеская абсансная эпилепсия — 4, ювенильная миоклоническая эпилепсия — 7 больных. Не удалось классифицировать форму заболевания у 20 человек.
Психические нарушения пароксизмального характера наблюдались в анализируемой группе до приема Топамакса у 9 больных, задержка психоречевого развития диагностирована у 10 детей, дисфории отмечены в 18 случаях, депрессия — у 16, когнитивные нарушения имели 23 пациента, нарушение интеллекта различной степени выраженности отмечено в 15 случаях.
У женщин, включенных в данное исследование, выявлены следующие особенности: связь с приходом менструации в дебюте заболевания — у 18 пациенток, катамениальная эпилепсия диагностирована у 6. Беременность состоялась у 2, роды — в одном случае (ребенок здоров). Гормональные нарушения в виде дисменореи и/или поликистоза яичников диагностированы у 17 женщин, из них у 9 до приема АЭП и у 8 после начала лечения (7 пациенток получали одновременно вальпроаты).
Доза Топамакса колебалась от 2 до 15 мг на 1 кг массы в сутки. Монотерапия проводилась 48 больным; в 151 случае препарат использовался как дополнительный.
У 40 больных (20,1 %) препарат был отменен в связи с неэффективностью или отрицательными эффектами: аггравацией припадков в виде их учащения и/или утяжеления, появления приступов другого типа, присоединения к приступам сна приступов бодрствования (всего 14 случаев — 7 %). В 12 случаях (6 %) прием препарата прекращен из-за выраженных побочных эффектов в виде возбудимости, заторможенности, нарушения речи в связи с образованием камней в почках, развитием цистита с гематурией, потерей массы тела более 10 кг, а также неординарными нарушениями: тяжелой инсомнией, психоэмоциональными расстройствами (тоска), пигментацией кожи.
Топамакс продолжали получать 133 пациента; из них в качестве монотерапии — 54 (40,6 %) и политерапии — 79 (59,4 %). В 65 случаях (48,9 %) достигнута ремиссия, в 22 (16,5 %) — припадки купированы на 50 % и более.
В ходе исследования выяснялись причины, послужившие основанием для продления приема Топамакса у 46 больных (34,6 %), у которых по общепринятым критериям значимого улучшения (прекращение или существенное урежение припадков) не наблюдалось. Было установлено позитивное влияние препарата на другие факторы, а именно: устранение вторичной генерализации приступов или переход сложных парциальных приступов в простые (17 больных), более легкий выход из припадка (10 человек), либо сочетание нескольких факторов (19 пациентов).
Побочные эффекты, носившие транзиторный характер, отмечались у 36 пациентов (27 %) в виде возбудимости (11 больных), заторможенности, замедления речи (6 больных), снижения массы тела на 3–10 кг (17 человек), парастезий (2 пациента). Они прекращались самостоятельно или при коррекции дозы Топамакса.
Топамакс является АЭП с разными механизмами действия: подобно карбамазепинам он влияет на натриевые каналы, подобно вальпроатам — на кальциевые каналы, как бензодиазепины и вальпроаты, оказывает ГАМКергический эффект, подобно ацетазоламиду ингибирует угольную ангидразу; не исключается также его антиглутаматное действие. Благодаря этим механизмам препарат оказывает противоэпилептическое действие широкого спектра. Неслучайно наибольшее внимание на последнем европейском (Вена, 2004) и международном (Париж, 2005) конгрессах по проблемам лечения эпилепсии основное внимание было уделено Топамаксу наряду с окскарбазепином и леветирацетамом. Значительный опыт применения Топамакса имеется уже и в России. По нашим данным, лечение Топамаксом проводится не менее чем у 600 пациентов. Большое количество исследований касается детской эпилепсии. В нашем наблюдении 25 % пациентов были в допубертатном возрасте, а начало развития заболевания в этом возрасте отмечено у 75 % больных. И хотя мы не располагаем опытом применения Топамакса у детей младшей возрастной группы, в литературе есть сообщения об успешном применении Топамакса с четырехмесячного возраста (A. Grinspan et al., 2005).
Эффект от применения Топамакса, определяемый в литературе количеством респондентов, отвечающих на терапию прекращением или урежением припадков более чем на 50 %, оценивается по-разному. Например, по исследованию M. Bujand и соавторов (2004), полное прекращение припадков отмечено в 39 %, а по данным J. Kruja и соавторов (2004) — всего лишь у 4,3 %, Y. H. Yi и соавторов (2005) — у 22,2 %. В то же время количество больных, у которых число припадков сократилось более чем на 50 %, составило 56–58 %. В целом столь высокий процент позитивных результатов не соответствует современным данным, согласно которым несмотря на введение новых АЭП, количество фармакорезистентных больных составляет не менее 1/4 — 1/3 наблюдений (W. Loscher, D. Schmidt, 2002; D. Schmidt, W. Loscher, 2004). Такое расхождение требует специального анализа и скорее всего для объективной оценки необходимо длительное проспективное наблюдение. Что касается разброса приведенных данных, то результат может зависеть от того, применялся ли Топамакс при резистентных формах как первый препарат или как дополнительный. Однако и в последнем случае результат (полное прекращение припадков) колеблется от 4,3 % (J. Kruja et al., 2004) до 39 % (M. Bujand et al., 2004). Значение могут иметь только длительные проспективные наблюдения, так как эффективность препарата с течением времени часто снижается. Но сведения о длительности проспективного наблюдения приводятся не всегда. Возможно влияние других факторов или их сочетаний. Так, по некоторым данным, Топамакс, примененный в качестве первого препарата у пожилых, вызывал прекращение припадков у 77,3 % пациентов, улучшение не зарегистрировано лишь в 9,1 % случаев (Y. Chinvarun et al., 2005).
Результаты наших наблюдений подтверждают эффективность Топамакса в терапии эпилепсии. По крайней мере это очевидно для симптоматической/криптогенной эпилепсии, поскольку именно данная группа пациентов была достаточно репрезентативной — 159 человек. Обращает на себя внимание тот факт, что действенность Топамакса была высокой как при моно-, так и при политерапии (соответственно 40,6 % и 59,4 %), тем более что Топамакс не во всех случаях был препаратом первого выбора. Так, у 12 пациентов он заменял назначенные ранее вальпроаты в связи с планируемой беременностью или наличием таких побочных явлений, как дисменорея и поликистоз яичников. При этом у 4 пациенток, у которых припадки не были полностью купированы с помощью вальпроатов, лечение стало успешным после перевода их на Топамакс. S. Rielke и A. Schreinea (2005), располагающие опытом перевода терапии с вальпроатов на Топамакс 65 пациентов в возрасте 12 лет и старше, отметили положительные результаты у 73 % пациентов, в том числе у 48 % прекращение припадков.
В последнеее время в связи с возросшим вниманием к терапии эпилепсии у женщин значимость проблемы замены вальпроатов на современные АЭП, видимо, будет возрастать. Одна из сложных методологических проблем — оценка эффективности лекарств, в частности АЭП. Нами проанализированы данные о пациентах, которые не отказались от Топамакса, хотя частота приступов у них не изменилась. Впервые в качестве критерия эффективности рассматривался не показатель снижения частоты припадков, а возможность упрощения и облегчения выхода из приступа. Таким образом, Топамакс был эффективен в 43,7 % случаев в соответствии с общепринятыми методами и в 66,8 % — с учетом данного фактора.
Эффективность АЭП, в частности Топамакса, по результатам данного исследования составила 66,8 %, у 40,6 % — в качестве монотерапии и у 59,4 % — аддитивной. Топамакс может не только снижать частоту приступов, но и способствовать облегчению их течения и выхода из припадка. У детей доза на 1 кг массы тела требуется большая, чем у взрослых. Препарат обладает высоким показателем эффективность/переносимость как у детей, так и у взрослых.
Литература
В. А. Карлов, доктор медицинских наук, профессор, член-корреспондент РАМН
Н. В. Фрейдкова
МГМСУ, Детская городская Морозовская клиническая больница, Москва
Мировой опыт применения топирамата (обзор литературы)
ПНД № 21, г. Москва
Топирамат относится к последнему поколению антиконвульсантов, пришедших на смену или существенно дополнивших действие препаратов предыдущих лет. К перечню этих препаратов традиционно относятся барбитураты (фенобарбитал, бензонал, гексамидин), гидантоины (дифенин), карбамазепины (финлепсин, тегретол) – первое поколение; производные вальпроевой кислоты (депакин, вальпарин, конвулекс) – второе поколение; ламотриджин (ламиктал), левитирацетам (кеппра), окскарбамазепин (трилептал) и, наконец, собственно топирамат – третье поколение.
Среди препаратов последнего поколения топирамат является, пожалуй, самым изученным, и, тем не менее, наиболее интригующим средством, благодаря необычной сульфат-замещённой моносахаридной структуре и уникальному спектру механизмов биохимического действия, включающего практически все известные виды антиэпилептического влияния на нейроны. В основном это влияние проявляется в активации ГАМК-эргической и блокаде глутамат-эргической систем, отвечающих, соответственно, за базовые процессы торможения и возбуждения центральной нервной системы [1–10].
Так, топирамат, является активатором оборота биогенной аминокислоты ГАМК (γ-аминомасляная кислота – GABA) – основного тормозного медиатора нейронной системы, посредством положительной селективной модуляции рецепторов GABAA. Топирамат открывает потенциал зависимые каналы проникновения ионов хлора и бикарбонатов, что активирует бензодиазепиновый и барбитуратный сайты GABAA, действуя подобно бензодиазепинам и барбитуратам. Одновременно препарат ингибирует действие глутамата (заменимая аминокислота) – базового возбуждающего нейромедиатора. Топирамат блокирует потенциал зависимые каналы проникновения ионов натрия и кальция, инактивируя тем самым два основных глутаматных рецептора – каинатного (аффинитетного к каинатной кислоте) и AMPA (аффинитетного к α-амино-3-гидрокси-5- метил-4-изоксазол-пропионовой кислоте), отвечающих за процессы возбуждения в синаптической системе. Вместе с тем, топирамат не увеличивает или слегка понижает активность третьего вида глутаматных рецепторов – NMDA (N-метил-D-аспартат зависимого), опосредующего возбуждающее действие глутамата и являющегося пролонгатором процессов возбуждения в нейронах. Тормозящее действие на обмен глутамата, как и у топирамата, является основой нейромодуляторного действия карбамазепина и производных вальпроевой кислоты.
Кроме отмеченного действия, топирамат селективно влияет на систему карбоангидразных энзимов (СА), блокируя СА II (цитоплазматическая карбоангидраза) и СА IV (цитоплазматическая мембранная карбоангидраза). Эти энзимы обладают неспецифическим диуретическим действием за счёт деактивации карбоангидраз почек, снижают образование ликвора и внутричерепное давление и осуществляют подавление активности глутаматных рецепторов путём элиминации межнейрональных ионов натрия и кальция, что способствует ослаблению возбуждающих процессов в ЦНС. Подобный механизм действия, в более резкой форме, присущ препарату ацетазоламид (диакарб), который блокирует все карбоангидразы.
Стоит отметить, что ГАМК образуется из глутамата посредством глутаматдекарбоксилазы, а сам глутамат является производным от глутамина, одной из двадцати аминокислот, поступающих в организм с пищей. Однако глутамин и его производные не проникают через гематоэнцефалический барьер, и весь глутамат в ЦНС синтезируется в нейронах.
Клиническое применение топирамата началось в 1995 г., сначала как дополнительного препарата, а затем основного средства для лечения и предотвращения эпилептических припадков практически при всех видах пароксизмальных состояний. Этому способствовали особенности фармакокинетики топирамата: биодоступность 81 % вне связи с приёмом пищи, линейная зависимость концентрации в крови от суточной дозировки, постоянный плазменный клиренс не зависящий от дозы, стабильное время выравнивания концентрации за 5–8 дней. Время полувыведения (Т1/2) составляет 21 ч, при утилизации ферментами печени топирамат образует неактивные метаболиты, которые выводятся в основном через почки. Такие особенности означают возможность применения в любом возрасте с одно- или двукратным приёмом в сутки, простоту подбора дозы без использования плазменного мониторинга, отсутствие эффекта кумуляции и возможность быстрого очищения организма путём гемодиализа [10–12].
Начало исследований эффективности топирамата при его монотерапии было положено рядом работ 1997–2002 гг. На разных группах больных от 22 до 292 человек был назначен топирамат в дозе от 100 до 1 600 мг для лечения парциальных и генерализованных припадков в течение 3–13 месяцев. Оказалось, что через 6 месяцев лечения доля респондентов (ДР) с редукцией приступов > 50 % составила 46–58 %, ДР с редукцией > 75 % – 25–37 %, ДР с редукцией 100 % – 11–13 %. При этом обнаружился более выраженный терапевтический эффект топирамата у первично выявленных больных – ДР с редукций 100 % припадков до 60 %, а в случаях резистентности к ранее проводимому лечению генерализованных приступов – ДР с редукцией 100 % достигала 35 %. Причём дозировка в 1 000 мг была заметно эффективнее 100 мг [13–18].
Дальнейшее изучение эффективности топирамата получило развитие в применении препарата при детской эпилепсии, особенно при наиболее тяжёлых её формах. К последним относится синдром Веста (West – «младенческий» спазм или «сааламовы» судороги с характерными парциальными пароксизмами в виде «кивков»), Леннокса–Гасто (Lennox-Gastaut – полимофные припадки с выраженной энцефалопатией и задержкой развития), Ретта (Rett – генерализованные тонико-клонические судороги, моторные стереотипии, выраженный психофизический регресс, дыхательные нарушения у девочек), Ландау–Клеффнера (Lan-dau–Kleffner – парциальные моторные приступы, афазия, аутизм с агрессивностью), синдром Драве (Dravet – тяжёлая миоклоническая эпилепсия младенческого возраста). У большей части детей (60–86 %) топирамат уменьшал количество приступов в > 50 %, а D. Ormrod и K. McClellan добились ремиссии в 31 % случаев. Лучший контроль был достигнут над атипичными абсансами, атоническими, клоническими и генерализованными тонико-клоническими судорогами, а также над расстройствами дыхания [19–27].
Дальнейшее изучение эффективности топамакса прошло в долгосрочных исследованиях с применение двойного слепого рандомизированного метода у взрослых пациентов с парциальной и генерализованной эпилепсией.
При парциальной эпилепсии длительное лечение топироматом на протяжении от 1 до 5 лет приводило к сокращению приступов на > 50 % в 27–52 % случаев, а полная редукция происходила только у 0–10 % пациентов [28–31].
Более значимые результаты были достигнуты в случаях применения топирамата у взрослых пациентов с генерализованными припадками. Уменьшение числа пароксизмальных состояний с развёрнутыми судорожными состояниями на > 50 % наблюдалось в 45–60 % случаев, стойкая ремиссия с полным исчезновением судорог была достигнута у 20–35 % пациентов. Во всех наблюдениях было характерно упрощение и уменьшение продолжительности продромальных признаков, редукция структуры и сокращение времени пароксизмальных состояний, исчезновение послесудорожных расстройств, а также купирование сопутствующих продуктивных психических нарушений. Особенно топирамат был показан к применению в тяжёлых состояниях, таких как юношеская миоклоническая эпилепсия, идиопатическая генерализованная эпилепсия [32–38].
Топирамат применяется и в сочетании с другими противоэпилептическими препаратами, причём сам топирамат не влияет на эти препараты, но сочетание его с карбамазепином, фенитоином (дифенин), фелбаматом ведёт к снижению концентрации топирамата в крови. Это связано с активизацией карбамазепином и другими указанными лекарствами ферментов печени, ускорением утилизации топирамата и снижению концентрации в крови более, чем на 50 %. В подобных случаях рекомендовано повышение дозы топирамата до 400 мг [34, 39].
Помимо противосудорожного действия топирамат обнаруживает и другие эффекты. К ним относится нейропротективное действие, психотропная активность, влияние на массу тела, лечение мигрени и возможность использования при наркозависимых состояниях.
Нейропротективный эффект был выявлен на моделях различных поражений ЦНС, таких как эмболия средней мозговой артерии, перинатальная гипоксия, нетравматическое сдавление грудной клетки, билатеральная окклюзия сонных артерий, что связывают с активацией ГАМК-эргической системы. Топирамат успешно применялся для лечения эссенциального тремора, а у больных эпилепсией, принимающих препарат, было отмечено замедление темпов эпилептических изменений личности и интеллектуально-мнестического снижения [40–44].
Психотропное действие топирамата также обусловлено воздействием на ГАМК-эргическую и глутамат-эргическую системы и определяется общим неспецифическим сбалансированным седативно-активизирующим влиянием, действующим, прежде всего, на дистимические расстройства при эпилепсии. Выявлена также способность топирамата сглаживать биполярные аффективные расстройства, особенно при быстрой их цикличности и он, ещё пока в редких случаях, используется как нормотимик и при депрессии, и при мании [39, 45–48].
Особым свойством топирамата является снижение массы тела. Этот феномен основан на селективном уменьшении образования и накопления липидов в жировой клетчатке и наблюдается примерно у 17 % больных при больших дозировках препарата. Так, приём топирамата в дозе 200 мг вызывал снижение массы тела на 1 кг, в в дозе 800 мг – на 6 кг. Снижение массы воспринимается неоднозначно и трактуется одними авторами как нежелательный побочный эффект, а другими – как положительное действие в случаях наличия сопутствующих эндокринных заболеваний, сопровождающихся ожирением. Способность снижать массу тела топирамата является дозозависимой и полностью обратима при уменьшении приёма препарата [24, 49–51].
Наряду с этим, имеются сообщения о неспецифическом использовании топирамата у здоровых людей без эпилептических расстройств в качестве средства для похудения. В частности, его начали использовать спортсмены для быстрого уменьшения массы тела перед соревнованиями [www.SciTecLibrary.ru, www.Ironworld.ru].
Имеются указания на возможность применения топирамата при мигрени. Так, было проведено 26-недельное рандомизированное двойное слепое плацебо-контролируемое исследование 487 больных. Топирамат в дозе 100–200 мг более чем у половины пациентов снижал частоту приступов мигрени на > 50 % [52].
Топирамат оказывает положительное воздействие на наркозависимые состояния, что было показано в ряде исследований. Так, на 127 больных с алкогольным абстинентным синдромом было проведено изучение действия топирамата в дозе 100 мг, по 25 мг 4 раза в сутки. Топирамат статистически достоверно редуцировал тревогу, депрессивную симптоматику, расстройства сна, снимал влечение к алкоголю, а также купировал тремор и астено-вегетативные нарушения. В основе, по мнению исследователя, лежал антиглуматоэргический механизм действия топирамата [53, 54].
Имеются сообщения и на способность топирамата снижать влечение к алкоголю не только в периодах между приёмами алкоголя, но и во время запоев. B. Johson (2003), руководитель исследований по алкоголизму и наркомании Техасского университета, отметил значительную эффективность топирамата, опережающую эффект налтрексона и акапрозата [www.Inopressa.ru].
На территории России топирамат представлен следующими торговыми наименованиями: Тореал – таблетки 25 и 100 мг № 28 (ЗАО Лекко ФФ, Россия), Макситопир – таблетки 50 и 100 мг № 10 (Actavis hf, Исландия), Топсавер 25 и 100 мг № 28 (Pliva Hrvatska d.o.o., Хорватия) и Топамакс капсулы 15, 25 и 50 мг № 60, таблетки 25 и 100 мг № 28 (Janssen Cilag Pharmaceutica N.V., Бельгия).
Важно учитывать, что назначение противоэпилептического средства, как правило, является постоянным, иногда пожизненным фактором, при котором экономические характеристики выступают на передний план.
Если сравнить наиболее распространённые препараты – Топсавер и Топамакс – по их фармако- экономическому показателю при условиях, что ежедневная эффективная поддерживающая доза топирамата составляет 200 мг в сутки, а наиболее удобной формой является таблетированная 100 мг № 28, то получаются следующие результаты. Стоимость суточной дозы Топсавера составляет от 73,98 до 93,57 руб., в среднем 83,78 руб. – первые десять предложений по аптечной сети г. Москвы, а месячной от 2 219,40 до 2 807,10 руб., в среднем 2 513,40 руб. Для Топамакса эти цифры составят от 165,21 до 185,00 руб., в среднем 175,11 руб. – суточная доза, от 4 956,30 до 5 550,00 руб, в среднем 5 253,30 руб. – месячная (www.apteka.mos.ru).
Разница более чем в двое, несомненно, говорит в пользу Топсавера, который может стать ведущим лекарственным средством не только при эпилепсии, но и при других состояниях. Особенно значим тот факт, что стоимость месячной дозы хорватского препарата ниже психологически приемлемой суммы в 3 000 руб./мес.
Что касается побочных явлений, то на начальных этапах начала приёма топирамата чаще всего появляются головокружение, утомляемость, затруднения мышления, головная боль и спутанность сознания. В большинстве случаев это наблюдается при быстром наращивании доз топирамата.
В связи с этим лечение следует начинать с 25–50 мг в сутки и далее медленно титровать дозу на 25–50 мг с шагом в одну неделю до достижения 200 мг в день. Обычно эта доза делиться на два приёма по 100 мг. При монотерапии эффективная доза составляет 200 мг, хотя у отдельных больных может быть и 100 мг в сутки. В случаях сочетания топирамата с другими антиконвульсантами, особенно с карбамазепином и фенитоином эффективная доза составляет не менее 400 мг в день.
Для большинства больных суточная эффективная доза находится в диапазоне 200–600 мг, а максимально допустимая доза у некоторых больных составляет 1 600 мг в день [55].
Важно отметить, что топирамату не свойствен ряд серьёзных побочных эффектов, характерных для других противоэпилептических препаратов. Так, отсутствие какого-либо влияния на гормональную сферу у женщин и риска развития поликистоза яичников, характерных для вальпроатов, существенно расширяет возможности применения топирамата у женщин, особенно репродуктивного возраста. Данный препарат также практически лишен риска развития аллергических реакций, которые могут стать серьёзной клинической проблемой при терапии ламотриджином [55–58].
В заключение можно подчеркнуть главные особенности препарата топирамат.
1. Топирамат обладает всем спектром антиэпилептической активности и включает в себя действие всех известных противосудорожных препаратов.
2. Топирамат может использоваться в качестве монотерапии при любом типе припадков и в любом возрасте.
3. Топирамат эффективен даже в наиболее неблагоприятных вариантах эпилепсии и при резистентности к большинству противосудорожных препаратов.
4. Топиромат прост в назначении и имеет линейную фармакокинетику, хотя и требует осторожности при постепенном наращивании (титровании) дозировки.
5. Побочные явления при терапии топироматом не бывают слишком серьёзными и являются дозозависимыми, что позволяет избавиться от нежелательных явлений путём коррекции дозировки препарата.
6. Топиромат, наряду с противоэпилептическим действием, обладает рядом соматотропных, нейротропных и психотропных свойств, что не только облегчает течение заболеваний с пароксизмальными состояниями, но и позволяет использовать его при расстройствах, далёких от эпилепсии.