Трава панцерия шерстистая для чего
Опыт комбинированной терапии бактериального вагиноза
Клинические симптомы бактериального вагиноза состоят в появлении серовато-белых выделений из влагалища с неприятным «рыбным» запахом. Примерно у половины женщин нет клинически выраженных симптомов, они ощущают лишь повышенную влажность в области половых органов. При длительном течении бактериального вагиноза возможно изменение характера выделений, они становятся более густыми, липкими, меняется их цвет, переходя из серовато-белого в желто-зеленый. В ряде случаев можно наблюдать осложнения после гинекологических процедур, после медицинского аборта, вызванные бактериями, главным образом анаэробами, составляющими при бактериальном вагинозе основную часть вагинальной микрофлоры. При беременности возможно восходящее инфицирование околоплодных вод, преждевременное их излитие и развитие хориоамнионита, колонизация плода бактериями и возникновение заболевания плода и новорожденного ребенка. [9,10]
Лечение бактериального вагиноза направлено на устранение анаэробных бактерий и предупреждение восходящего инфицирования внутренних половых органов, а при беременности – восходящего инфицирования околоплодных вод с последствиями такого инфицирования для матери и ребенка. Традиционно для лечения бактериального вагиноза используют лекарственные препараты, подавляющие анаэробные микроорганизмы. В лечении бактериального вагиноза обычно используют метронидазол или клиндамицин. Однако, часто (в 30-40% случаев) такое лечение оказывается неэффективным, не всегда происходит элиминация анаэробных бактерий, последующее восстановление нормальной лактобациллярной микрофлоры влагалища и нормализация клинической картины заболевания. Предложен двухэтапный способ лечения бактериального вагиноза. На первом этапе с помощью нитраимидазолов устраняют анаэробную микрофлору, на втором – восстанавливают нормальную лактобациллярную микрофлору с помощью лактобациллярных препаратов. Однако виды лактобацилл, входящие в состав таких препаратов, не всегда приживаются во влагалище.[5]
Поиск средств, способных создавать и поддерживать условия для жизнедеятельности лактобацилл, оправдан в связи с распространенностью заболевания. В этом плане особого внимания заслуживает препарат «Эпиген интим», содержащий в своем составе активированную глицирризиновую кислоту и ряд дополнительных органических кислот (малеиновую, фумаровую, аскорбиновую, фолиевую), применяется местно в виде спрея и рекомендуется как иммуностимулирующее, противовоспалительное и противовирусное средство. Препарат не оказывает побочного действия, хорошо переносится и может быть применен для комплексной терапии бактериального вагиноза. Положительный опыт применения препарата «Эпиген интим» побудил нас использовать этот препарат в комплексной терапии бактериального вагиноза.
Целью нашего исследования было оценить лечебную эффективность и безопасность препарата «Эпиген интим» спрей 0,1% для местного и наружного применения в комплексной терапии бактериального вагиноза.
Клинические материалы и методы исследования
Исследование проводилось на базе Научно-исследовательского института акушерства и гинекологии им. Д.О. Отта СЗО РАМН и женской консультации №34 Санкт-Петербурга. Исследование было слепым, плацебо-контролируемым, рандомизированным.
Обследовано 90 небеременных женщин в возрасте от 18 до 45 лет, средний возраст – 28,3 года с установленным диагнозом бактериального вагиноза согласно критериям Амселя.
Все пациентки были разделены на три группы. Первая группа, состоящая из 30 человек, получала стандартную терапию в виде препарата «Клиндамицин» 2% вагинальный крем на ночь 3-7 дней в сочетании с использованием препарата «Эпиген интим спрей» 0,1% 2 раза в день 14 дней. Вторая группа (группа сравнения) также состояла из 30 человек и получала стандартную терапию в виде препарата «Клиндамицин» 2% вагинальный крем на ночь 3-7 дней в сочетании с плацебо 2 раза в день 14 дней. Третья (контрольная) группа, состоящая из 30 человек, получала только стандартную терапию в виде препарата «Клиндамицин» 2% вагинальный крем на ночь 3-7 дней. Рандомизация проводилась с помощью таблицы случайных чисел.
Наблюдение за пациентками проводилось во время 4 визитов: до начала терапии, на 14 день от начала терапии, на 30 и на 90 день от начала лечения. Эффективность терапии оценивалась по наличию или отсутствию жалоб со стороны пациенток, по оценке объективных клинических симптомов заболевания, по оценке лабораторных показателей, таких как количество лейкоцитов, соотношение лейкоцитов и эпителия, наличие ключевых клеток, качественный и количественный состав влагалищной микрофлоры при микроскопическом и бактериологическом исследованиях, по наличию лактобацилл в вагинальном отделяемом. Кроме того, проводилась оценка аминового теста и уровня рН. Безопасность и переносимость препарата оценивалась на основании регистрации побочных эффектов, связанных с применением препарата «Эпиген интим».
Результаты
При микробиологическом исследовании отделяемого влагалища получены следующие результаты. При микроскопии вагинальных выделений выявлены единичные лейкоциты (1-3-5 в поле зрения микроскопа, отношение лейкоцитов к эпителию менее чем 1:1), наличие «ключевых клеток», отсутствие лактобацилл. Назначено лечение по схемам, приведенным выше.
При клиническом осмотре женщин врачом на 14 день от начала лечения патологические выделения отмечены у 25% женщин I группы, у 74% женщин II группы и у 57,7% женщин III группы (рис. 2).
На 30 день и на 90 день от начала терапии отмечалась одинаковая тенденция к исчезновению жалоб. Что касается патологических выделений из половых путей, отмеченных врачом, то следует подчеркнуть, что в I группе они были у 30,4% и 21,7% женщин на 30 и 90 день, соответственно. Во II группе патологические выделения были отмечены у 45% и 55,5% женщин, соответственно, в III группе – у 43,8% и 57,1% женщин.
На рис 3 представлено количество пациенток, влагалищные выделения у которых имеют значение рН более, чем 4,5. В первой группе было 73,3% таких женщин, во второй группе – 26,6% и в третьей – 33,3%. На 14, 30 и 90 дни от начала лечения происходило снижение количества женщин с высоким (более 4,5) водородным показателем.
Один из основных признаков бактериального вагиноза – появление ключевых клеток, которые видны при микроскопическом исследовании вагинального отделяемого в виде клеток плоского эпителия с массой бактерий, адгезированных на поверхности. До лечения у всех пациенток были выявлены ключевые клетки. В I группе женщин на 14, 30 и 90 день терапии ключевые клетки не были выявлены ни в одном случае. Динамика наличия ключевых клеток на 14, 30 и 90 день терапии во II группе была следующей: 7,4%, 8,7%, 4,35%, соответственно. В III группе ключевые клетки были выявлены у 15,4% женщин на 14 день и у 4,35% на 30 день (рис. 4).
Микробиологические исследования, проведенные на 14, 30 и 90 день от начала терапии, и их результаты представлены на рис 5 и 6.
Обсуждение
В результате спринцевания, применения противозачаточных средств, содержащих 9-ноноксинол, использования внутриматочных контрацептивов, смены половых партнеров, применения антибиотиков широкого спектра действия уменьшается доля лактобацилл в составе микрофлоры влагалища. Одновременно возрастает доля Gardnerella vaginalis, Mycoplasma hominis, анаэробных бактерий и развивается дисбактериоз влагалища – бактериальный вагиноз [4, 5].
БВ регистрируется у 5-17% практически здоровых женщин и у 30–38% пациенток, предъявляющих жалобы на выделения из половых путей. Эти женщины посещают как женские консультации, так и специализированные клиники для лечения ИППП. БВ достоверно чаще встречается у женщин моложе 25 лет. Данные о заболеваемости БВ широко расходятся вследствие отсутствия единого подхода к критериям диагностики: от изоляции G. vaginalis в ранних исследованиях до обнаружения смешанной микробной флоры при микроскопии в современных работах. Различия в частоте выявления бактериального вагиноза зависит от исследования различных групп женщин как посещающих сеть первичной медицинской службы, так и тех, которые обращаются в кожно-венерологические диспансеры. У части женщин (5-25%) БВ протекает бессимптомно [10, 13, 14], вследствие чего признаки заболевания легко перепутать с нормальными выделениями.
Что касается диагностики бактериального вагиноза, то наиболее часто используются критерии Амселя. В 1983 году R. Amsel и соавторы предложили диагностировать бактериальный вагиноз на основе 4 критериев: наличия специфических жидких гомогенных выделений из влагалища, значения рН вагинальных выделений выше 4,5, положительного аминового теста и наличия ключевых клеток при микроскопическом исследовании вагинальных выделений [6]. Именно на основании этих критериев проводился отбор пациентов для представленного исследования. На сегодняшний день известно еще несколько методов диагностики бактериального вагиноза, описанных Nugent R.P. и соавт., K. Ison и соавт., A. Hallen, Е.Ф. Кира, в наших методических рекомендациях [2-5, 8,11].
При использовании микроскопических методов диагностики бактериального вагиноза необходимо обращать внимание не только на наличие ключевых клеток, но на такой показатель как отношение лейкоцитов к клеткам плоского эпителия, а также на наличие или отсутствие лактобацилл. При физиологическом микробиоценозе влагалища отношение лейкоцитов к эпителию равно 1:1. При бактериальном вагинозе лейкоцитов меньше, чем эпителия, соответственно, это отношение меньше 1 [2-4, 7], что мы использовали в нашем исследовании как один из объективных показателей заболевания.
Для лечения бактериального вагиноза большинство международных руководств, таких как CDC, IUSTI и др. рекомендует использовать исключительно метранидазол в разных дозах и клиндамицин [15]. Наши собственные исследования по использованию клиндамицина в лечении бактериального вагиноза у женщин с сахарным диабетом 1 типа показали хорошие результаты [1]. Поэтому в качестве основного препарата для лечения бактериального вагиноза мы выбрали именно клиндамицин вагинальный крем. Этот препарат назначался всем пациентам с установленным диагнозом.
Большинство современных публикаций свидетельствует о неэффективности противоанаэробной терапии бактериального вагиноза, т.к. она сопровождается более чем в 30% случаев рецидивами. Ряд отечественных и зарубежных исследователей поддерживает идею двухэтапного лечения этого состояния. На первом этапе применяется специфический антибактериальный препарат, а на втором этапе назначаются пробиотики или препараты, способствующие восстановлению нормальной физиологической микрофлоры, в частности, лактобацилл. В вагинальном отделяемом женщин репродуктивного возраста идентифицировано более 150 видов лактобацилл. Поэтому важно подбирать препараты, которые создают условия для размножения собственных эндогенных лактобацилл.
В данном исследовании мы применяли препарат «Эпиген интим», содержащий активированную глицирризиновую кислоту. Исследование было двойным слепым плацебо контролируемым. Рассмотрение динамики изменения использованных в работе показателей позволяет говорить о благоприятном влиянии препарата «Эпиген интим» в комплексном лечении бактериального вагиноза: в более короткий срок прекращается неприятный запах влагалищных выделений, жалобы пациенток на дискомфорт в области влагалища, быстрее снижается значение рН влагалищных выделений и присутствие в них «ключевых» клеток. Микроскопическое и культуральное исследование выявляет значимое увеличение лактобацилл у женщин, которым проведено комбинированное лечение препаратом «Эпиген интим», в сравнении с теми пациентами, которым заменен этот перпарат на плацебо и с теми, которые получали только клиндамицин.
Полученные результаты дают основание рекомендовать препарат «Эпиген интим» для включения его в схемы комплексного лечения бактериального вагиноза как беременных, так и небеременных женщин, т.к. он способствует улучшению микроэкологии влагалища..
Заключение
Проведенное исследование свидетельствует о клинической и микробиологической эффективности препарата «Эпиген интим» спрей для местного и наружного применения в терапии бактериального вагиноза 2 раза в день в течение 10 дней в сравнении с плацебо и с традиционной терапией. Отмечено более быстрое исчезновение жалоб и клинических проявлений заболевания после окончания терапии, а также на 30 и 90 день терапии в группе женщин, которым кроме стандартной терапии был назначен «Эпиген интим» спрей, по сравнению с группой, получавшей плацебо, и с контрольной группой, получавшей только стандартную терапию. У всех женщин основной группы после лечения в выделениях влагалища исчезли ключевые клетки и в составе вагинального микробиоценоза появились лактобациллы. Это свидетельствует о положительном влиянии препарата «Эпиген Интим» спрей для местного и наружного применения на микробиоценоз влагалища, в частности, на размножение лактобацилл, входящих в состав физиологического микробиоценоза каждой женщины.
Таким образом, препарат «Эпиген Интим» спрей для местного и наружного применения может быть включен в комплексную схему терапии бактериального вагиноза.
Данная статья предоставлена специалистом нашей клиники:
Менуховой Юлией Николаевной


Эрвы шерстистой трава, 1 шт., 30 г, сырье растительное измельченное
Эрвы шерстистой трава: инструкция по применению
Состав
Эрвы шерстистой трава
Описание лекарственной формы
Кусочки листьев, стеблей, корней и части соцветий, цельные семена. Цвет зеленовато-серый с зелеными, светло-коричневыми, беловато-желтыми и редко белыми вкраплениями. Запах слабый. Вкус водного извлечения горьковатый с ощущением слизистости.
Фармакологическое действие
Настой травы эрвы шерстистой оказывает диуретическое, а также умеренное противовоспалительное действие. При этом отмечено выведение ионов натрия и кальция и, в некоторой степени, ионов калия. При применении препарата отмечается также тенденция к снижению содержания мочевины в сыворотке крови.
Показания
В составе комплексной терапии у взрослых в качестве диуретического средства при умеренно выраженном отечном синдроме, инфекционно-воспалительных заболеваниях почек (пиелонефрит).
Противопоказания
Повышенная чувствительность к препарату; остеопороз; заболевания, сопровождающиеся повышенным выведением кальция из организма, в том числе гипопаратиреоз, рахит, почечная остеодистрофия. Беременность, период грудного вскармливания, детский возраст (до 18 лет).
Способ применения и дозы
Около 5 г (2 столовые ложки) эрвы шерстистой травы помещают в эмалированную посуду, заливают 200 мл (1 стакан) горячей кипяченой воды, закрывают крышкой и нагревают на кипящей водяной бане 15 минут, охлаждают при комнатной температуре 45 минут, процеживают, оставшееся сырье отжимают. Объем полученного настоя доводят кипяченой водой до 200 мл.
Возможно приготовление настоя в термосе: около 5 г (2 столовые ложки) эрвы шерстистой травы заливают 200 мл (1 стакан) кипятка и настаивают 1 час.
Принимают внутрь в теплом виде по 1/4-1/2 стакана 2-3 раза в день за 15 минут до еды. Курс лечения от 10 до 30 дней.
Перед применением настой рекомендуется взбалтывать.
Категории
Галлерия Мелонелла Ренни
Состав: экстракт восковой моли, рябина красная, сахарный сироп.
Способ применения: Только для приема внутрь. Взрослые по 1 чайной ложке 2-3 раза в день за 20 мин.
Кол-во в упаковке: 10 ампул с капсулой в среде-активаторе
Состав капсулы препарата Сусталь: биомасса гидролата пантов марала алтайского, концентрат моллюсков, концентрат ДНК молок лососевых, кордицепс, артемия, концентрат овечьей шерсти, нативный концентрат корневищ сабельника болотного, нати.
Особенности применения панцерии шерстистой и ее целебные свойства
Сегодня применение растительных средств в лечении множества заболеваний широко распространено, поскольку растения обладают массой полезных для здоровья человека качеств, имеют относительно небольшое количество вероятных негативных последствий при приеме и более доступны, чем готовые фармацевтические препараты. И растение, произрастающее в южных районах Забайкалья и в Приморском крае, панцерия шерстистая применение имеет широкое, благодаря своим свойствам став одним из наиболее частых компонентов в лекарственных сборах при лечении сердечных патологий, заболеваний желудочно-кишечного тракта, а также являясь общеукрепляющим средством ввиду своего богатого состава.
Общее описание растения
Представляя собой растение из семейства многолетников губоцветных с четырехгранным полым стеблем, панцерия шерстистая применение имеет как в лечебных, так и в профилактических целях. Входящие в состав ее листьев, цветков и плодов вещества обладают противовоспалительными, стимулирующими, кровоостанавливающими свойствами, потому препараты на основе рассматриваемого растения считаются одними из наиболее действенных. Использование панцерии шерстистой обусловлено также ее способностью устранять негативное воздействие на организм человека свободных радикалов, которые вызывают старение всех органов и систем, усложняют процессы излечения заболеваний.
Трава панцерия шерстистая преимущественно хорошо переносится организмом как взрослых людей, так и детей, имея минимальное количество побочных эффектов. Однако для получения выраженного положительного эффекта от ее применения рекомендуется перед началом ее использования проконсультироваться с лечащим врачом, учесть индивидуальные особенности организма больного и постоянно контролировать реакцию на применение средств на основе этого растения.
Знание полезных свойств, которыми обладает панцерия шерстистая, поможет составить наиболее действенную схему лечебного воздействия. Все качества, применяемые при воздействии на организм при диагностировании заболеваний, основаны на составе и особенностях воздействия растения.
Полезные качества
Трава панцерия шерстистая применяется при лечении следующих органических патологий:
Также трава панцерия шерстистая способна выводить из организма лишнюю жидкость, что позволяет использовать ее в комплексной терапии при лечении водянки, сопровождающейся образованием отеков. Наиболее выраженный положительный эффект от использования рассматриваемого растения отмечается при комплексном воздействии, потому при выявлении любого из перечисленных выше заболеваний рекомендуется составить схему воздействия, которая предполагает наиболее массированное воздействие на организм больного.
Пенцерия шерстистая имеет преимущественно положительные отзывы по использованию. Это обусловлено ее богатым уникальным составом, делающим рассматриваемое растение одним из наиболее часто использующихся в лечебных и профилактических целях.
Полезные вещества, входящие в состав растения
Панцерия шерстистая применение имеет широкое благодаря своему уникальному составу. Являясь неядовитой и по многим параметрам полезным растением, она используется в виде настоев, отваров, в сушеном и свежем виде. Ее лечебные качества обусловлены вхождением в состав листьев, цветков и плодов, которые представляют собой маленькие шишечки, образующиеся в верхней части растения, следующих полезных для организма веществ:
Большое количество разнообразных минеральных веществ и витаминов, некоторое количество растительного белка позволяют назвать такое растение, как панцерия шерстистая, одним из наиболее полезных для человеческого организма. Его можно применять и для лечения взрослых людей, и для устранения основной симптоматики заболеваний в детском возрасте. Комплексный подход дает наиболее выраженный положительный результат от проводимого воздействия.
Области применения
Панцерия шерстистая имеет достаточно широкое применение, что обусловлено ее составом и быстротой воздействия. Наиболее часто растение используется в лечении поражений кожи в виде обмываний, наложении повязки с тканью, обильно смоченной в отваре или настое растения. Панцерия шерстистая используется и в готовых лекарственных препаратах для наружного применения, устраняя признаки воспаления, способствуя более быстрой регенерации поврежденных тканей. Прием их внутрь позволяет стимулировать иммунную систему, способствует общему омоложению организма.
Поскольку препараты на основе этого растения обеспечивают выраженный сосудорасширяющий эффект, средства с содержанием в них экстракта травы хорошо подходят для стабилизации работы сердечно сосудистой системы. Устраняя аритмию, нормализуя артериальное давление и уменьшая проявления многих сердечных патологий, трава пацерии шерстистой позволяет быстрее устранять симптоматику врожденных и приобретенных пороков работы сердечной мышцы. Укрепляя ее, делая ритм сердечных сокращений более здоровым, панцерия шерстистая обеспечивает более качественным процесс перекачивания крови по тканям, усиливая кровообращение, снимая болезненность при застойных процессах и устраняя их.
Отзывы об использовании
Панцерия шерстистая достаточно широкое применение, растение не рекомендуется к использованию только в случае индивидуальной непереносимости составляющих компонентов. Когда врачом прописывается панцерия шерстистая отзывы пациентов преимущественно положительные: быстро устраняя болезненность, характерную для основного заболевания симптоматику, препараты на основе растения не вызывают появления новых проявлений болезни, повышают степень сопротивляемости организма внешним негативным воздействиям.
В качестве профилактического средства при авитаминозе, склонности к простудным заболеваниям и общем понижении работы иммунитета панцерия шерстистая отзывы имеет также хорошие. Регулярный прием средств на основе этого растения позволяет повысить сопротивляемость организма, уменьшить частоту случаев заболеваний различного характера.
Клинический случай нефропатии обусловленной приемом репешка обыкновенного (agrimonia eupatoria)
1 Кафедра внутренних болезней с основами физиотерапии №2, Нефрологическое отделение ГБОУ ВПО РостГМУ Минздрава России, г.Ростов-на-Дону
2 Ростовское областное патологоанатомическое бюро Министерства здравоохранения Ростовской области, г.Ростов-на-Дону
Адрес: 344022, г. Ростов-на-Дону, пер. Нахичеванский, 29, тел. (863)2014423 Эл.почта: batjushin-m@rambler.ru, sadovnichaya@list.ru, nephr-roon@rambler.ru
За прошедшее десятилетие отмечен значительный рост популярности «нетрадиционной медицины». Это объясняется такими факторами, как неудовлетворенность методами и эффективностью ранее проводимого лечения, бесконтрольным использованием информации о неблагоприятных побочных действиях фармацевтических препаратов, ростом цен на фармакопейные лекарственные средства и низким уровнем общей культуры населения. В отношении использования сбора лекарственных растений в литературе имеются указания на ограничения их применения, так как их прием при определенных заболеваниях может вызывать нежелательные побочные эффекты. В Европе, США и Канаде постоянно увеличивается доля населения, регулярно использующего фитотерапевтические средства и биологически активные добавки, в странах Азии и Африки более 30% всех случаев острого почечного повреждения развивается как осложнение лечения растительными препаратами [1, 2]. По данным исследования импортированных патентованных азиатских аюрведических растительных продуктов в Калифорнии, было установлено, что 32% из них содержали не декларированные фармацевтические средства и тяжелые металлы (свинец, ртуть, кадмий, мышьяк). Среди не декларированных веществ наиболее часто встречаются: эфедрин, хлорфениламин, колхицин, метилтестостерон, глюкокортикостероиды, нестероидные противовоспалительные препараты [3, 4, 5, 6, 7, 8]. Сегодня в Европе зарегистрировано более 100 препаратов, содержащих растительные флавоноиды. Они обладают антиоксидантной активностью и применяются в основном в лечении нарушений периферического кровообращения.
Потенциальное значение этой проблемы чрезвычайно велико, в частности остается неясной степень взаимодействия фармацевтического препарата с травами и растительными продуктами [9, 10]. Неконтролируемый прием лекарственных трав может превышать потенциальный положительный эффект, особенно среди лиц с заболеваниями почек [11, 12, 13, 14], что связано с непосредственным воздействием растительных препаратов на клетки канальцев и их активной реабсорбцией с достижением высокой концентрации в мозговом слое. Результатом такого воздействия на почки является острое канальцевое повреждение, папиллярный некроз, острый и хронический интерстициальный нефрит, синдром Фанкони, нефролитиаз, артериальная гипертензия, рабдомиолиз [15, 16].
К фитотоксинам, обладающим прямым нефротропным действием относят аристохолиевую кислоту, сапонины, метилсалицилат, флавоноиды, ореллаин, алкалоиды эфедры, охратоксин [17]. На территории России наиболее часто с целью лечения и профилактики заболеваний почек применяются такие лекарственные травы как: пижма, барбарис, берѐза, бессмертник песчаный, брусника, бузина, календула, кукуруза (рыльца), можжевельник, толокнянка, хвощ, шиповник, репешок обыкновенный (Argimonia Eupatoria), а также марена красильная грузинская (Rubia tinctorum var. iberica), дикорастущая трава.
Репешок обыкновенный (Argimonia Eupatoria) – многолетнее травянистое растение, широко распространенное в европейской части России, на территории Западной и Восточной Сибири, Дальнего Востока [18]. В народной и традиционной медицине все части растения применяются при широком спектре заболеваний в качестве желчегонного, противовоспалительного, антиаритмического, гипогликемического, антигельминтного, анальгетического, гемостатического, антигипертонического, антитоксического и антиканцерогенного средства. В европейских странах некоторые виды Agrimonia являются официальными лекарственными растениями и используются в практической медицине как вяжущее, противовоспалительное средство [19]. При проведении биохимического анализа структуры растения в надземной части A.Eupatoria обнаружены вещества фенольной природы (филавоноиды, дубильные вещества, кумарины, изокумарины, оксикоричные кислоты), тритерпеноиды, эфирное масло, полисахариды и др., а в подземных органах растения обнаружены медь, цинк, железо, ванадий, никель, хром, титан, марганец, стронций, цирконий, серебро [20].
Токсические эффекты А. Eupatoria в большей степени связаны не со специфическими токсикантами, а с наличием в нем большого количества гликозидов кумарина и его метаболитами. В 1994 г. на основании углубленного анализа токсикологических исследований экспертами Европейского Совета сделаны рекомендации о снижении допустимого уровня содержания кумарина в продуктах питания до 0,5 мг/кг вследствие его канцерогенного и мутагенного действия.
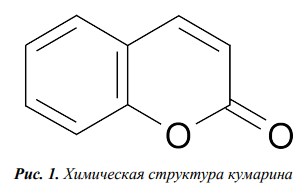
КУМАРИН (2-хроменон) имеет молекулярную массу 146,14 и представляет собой бесцветные кристаллы с запахом свежего сена и горьким вкусом (рисунок 1).
Рис. 1. Химическая структура кумарина
Сообщения о гепатотоксических эффектах для человека, развивающихся вследствие приема кумарин-содержащих лекарственных препаратов, часто противоречивые, вызвали значительный интерес исследователей к изучению его метаболизма и механизма токсического действия [20, 21].
Современные представления о метаболизме кумарина предполагают наличие двух основных путей трансформации данного соединения в организме млекопитающих. Первый этап трансформации кумарина реализуется по двум направлениям: в результате 7-гидроксилирования кумарина образуется малотоксичный 7-гидроксикумарин, элиминирующийся из организма млекопитающих с мочой; в процессе 3-гидроксилирования образуется 3-гидроксикумарин, промежуточным метаболитом в данном процессе является токсичный 3,4-эпоксид, подвергающийся дальнейшей трансформации с образованием о-гидроксифенилальдегида, окисляющегося до о-гидроксиэтанола и о-гидроксифенилуксусной кислоты. Рядом авторов было показано, что доминирование одного из двух направлений метаболизма кумарина в организме обусловливает межвидовые различия в проявлении гепатотоксических свойств данного соединения [22, 23]. Риск осложнений при приеме кумарина возрастает при сочетанном приеме НПВС, антикоагулянтов прямого и непрямого действия.
В экспериментальных работах [24, 25] установлено, что кумарин при однократном введении в больших дозах крысам вызывает центрилобуллярный некроз гепатоцитов. Это свидетельствует о том, что метаболизм кумарина [3-l4C] в данном случае проходил с образованием более токсичных метаболитов. Исследования in vitro показали, что химически активные [3-l4C]-кумариновые метаболиты, образующиеся при участии цитохром P450-зависимых энзимов, способны ковалентно связывать микросомальные протеины [26]. Было сделано предположение, что токсическим метаболитом в данном случае может выступать 3,4-эпоксид.
Нами представлен случай нефротоксического действия алкалоидов кумарина и его метаболитов при употреблении отваров и настоев Репешка обыкновенного.
Пациентка А. 43 лет, поступила в нефрологическое отделение клиники РостГМУ с жалобами на легкую ноющую боль в поясничной области с обеих сторон, усиливающуюся при физической нагрузке, пастозность голеней и стоп, периодически повышающееся артериальное давление до 220/140 мм рт. ст., не связанное с психоэмоциональными и/или физическими нагрузками, сопровождающееся головной болью и головокружением. Из анамнеза известно, что в 1990 году в течение всего периода первой беременности выявлялась протеинурия до 3,3 г/л, не сопровождающаяся отечным синдромом и артериальной гипертензией, в течение 5 лет после родов протеинурия сохранялась на уровне 0,5-1,0 г/л. В 1995 г. впервые зарегистрирован высокий уровень артериального давления (АД) – 150/100 мм рт. ст. Антигипертензивную терапию не получала, однако с 1999 г. артериальная гипертензия приобрела злокачественный характер, с повышением уровня системного АД до 200/120 мм рт. ст., по поводу чего в 2000 году проходила обследование в стационаре, где был поставлен диагноз гипертонической болезни II стадии, 3 степени, риск 3 (высокий), тогда же была подобрана антигипертензивная терапия, позволявшая контролировать АД на уровне 130-150/80-90 мм рт. ст., но пациентка данные рекомендации не соблюдала, а самостоятельно приобрела фитопрепарат (Репешок обыкновенный), отвар и настои которого, принимала более полугода непрерывно по несколько раз в сутки. В 2001 году, во время прохождения планового медицинского осмотра выявлен нефросклероз справа, дальнейшего наблюдения и лечения не проходила. В 2008 году при выполнении ультразвукового исследования почек выявлен конкремент правой сморщенной почки, по данным реносцинтиграфии функция правой почки отсутствует.
Помимо приема фитопрепаратов постоянно использует дипиридамол в дозе 75 мг/сутки, эналаприл 10 мг/сутки с 2001 года, в 2011 году уровень протеинурии составил 0,044 г/л, уровень артериального давления до 240/140 мм ртутного столба.
По данным клинико-лабораторного обследования в нефрологическом отделении клиники РостГМУ со стороны ОАК на себя обращали внимание ускорение СОЭ до 32 мм/час, признаки анемии легкой степени тяжести (эритроцитов 2,52х1012/л, гемоглобин 100 г/л), снижение количества тромбоцитов (75х103 /л), со стороны свертывающей системы крови по данным коагулограммы выявлены признаки гипокогуляции, характеризующиеся снижением АПТВ до 20 сек., протромбиновое время 10 сек., МНО 0,5, тромбиновое время 6 сек., фибриноген 1,98 г/л, со стороны биохимических показателей крови отмечалась гиперхолестеринемия до 10,79 мМ/л, гиперазотемия (креатинин крови 129 мкМ/л, мочевина 14,9 мМ/л), уровень АСТ достигал 68 Ед/л, АЛТ – 51 Ед/л. В ОАМ – протеинурия, характерная для нефритического синдрома (до 0,4 г/л). Снижение концентрационной функции почек, проявляющееся снижением СКФ до 45,5 мл/мин (по формуле MDRD), изостенурией (по данным пробы Фольгарда). Суточная протеинурия не превышала 0,495 г/сутки, по данным суточной экскреции солей с мочой отмечается высокая экскреция кальция до 9,73 мМ/сутки, и мочевой кислоты до 9,13 мМ/сутки. За все время наблюдения состояние пациентки оставалось стабильным, уровень АД в пределах 130-140/70-80 мм рт. ст., суточный диурез около 1500-1700 мл. По данным УЗИ почек отмечаются диффузные изменения паренхимы почек, уменьшение размеров, микролит правой почки.
Таким образом, клиническая картина болезни соответствовала аутоиммунному заболеванию почек, на что указывали наличие протеинурии, мочевой синдром, характеризующийся микрогематурией, снижением азотвыделительной функции почек, наличием артериальной гипертензии, тем не менее, нельзя было исключить наличие хронического повреждения канальцевого эпителия, преимущественно в проксимальных отделах, с нарушением реабсорбции, без формирования клиники острого канальцевого некроза, что позволило заподозрить наличие специфического патологического процесса, связанного с токсическим влиянием метаболита кумарина на канальцевый эпителий почек. Следует также учесть наличие процесса нефросклероза в правой почке, вероятно, обусловленного мочекаменной болезнью в анамнезе.
Пациентке была выполнена пункционная нефробиопсия левой почки с последующим морфологическим исследованием биоптата с целью верификации патологического процесса и определения тактики терапии. В результате получены следующие данные.
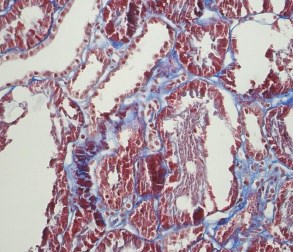
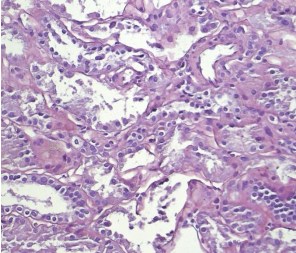
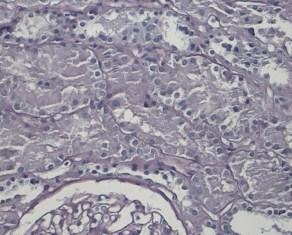
Светооптически 1 из 9 клубочков склерозирован полностью, остальные гипертрофированы. В одном клубочке выраженная интракапиллярная гиперклеточность и пролиферация базальных мембран. Остальные клубочки не имеют признаков выраженных пролиферативных изменений, за исключением сегментарного расширения парамезангиальных зон. Сегментарного склероза капиллярных пучков не наблюдается. В интерстиции слабый диффузный и мелкоочаговый фиброз. Резко выраженная гидропическая дистрофия эпителия канальцев вплоть до вакуолизации (рисунки 2, 3, 4).
Рис. 2. Х20 массон1 – резко выраженные дистрофические изменения эпителия канальцев, его слущивание
Рис. 3. Х20 ШИК – резко выраженные повреждения эпителия канальцев – слущивание фрагментов цитоплазмы и целых клеток в просвет канальцев
Рис. 4. Х20 ШИК – расширение и гиперклеточность мезангиальных зон
Окраска на амилоид отрицательна. Иммуноморфологически: IgA в клубочках: отрицательно, в канальцах: отрицательно, IgG в клубочках: отрицательно, в канальцах: отрицательно, IgM в клубочках: единичное редкое пунктирное, в канальцах: единичные цилиндры, C3 комплимент: единичные зерна в клубочках и в капсуле, а также зернистое в стенках артериол, C1q комплимент: отрицательно. Каппа: отрицательно в клубочках, единичные очаги в интерстиции. Лямбда: отрицательно в клубочках, единичные очаги в интерстиции. Электронномикроскопически: толщина и структура базальных мембран в пределах нормы, депозитов не обнаружено. Имеются протяженные очаги распластывания малых отростков подоцитов, пролиферация мезангиальных клеток отсутствует. Результаты были интерпретированы как очаговое распластывание малых отростков подоцитов, а также тубулопатия неясного генеза. Особое внимание в клинической картине на себя обращало постепенное нарастание протеинурии, артериальной гипертензии на фоне снижения фильтрационной функции почек и канальцевой дисфункции. Подобная двойственность клинических проявлений препятствовала пониманию сути патологического процесса в почках, и не позволяла в полной мере проводить медикаментозную терапию, отвечающую патогенетическим и этиологическим принципам. Указание в анамнезе на длительный прием фитопрепаратов позволило предположить токсическое воздействие метаболитов кумарина на функциональное состояние почек, однако в доступной литературе нет прямых указаний на прямое нефротоксическое действие кумарина. Исследователи ограничивают область токсических влияний кумарина и его метаболитов на функцию печени и гемостаза. Действительно, в рассматриваемом клиническом примере отмечаются как нарушения гемостаза, характеризующиеся гипокоагуляцией, так и печеночная дисфункция. Однако по данным нефробиопсии отмечаются признаки токсического процесса на уровне канальцев почки, характеризующегося резко выраженной гидропической дистрофией эпителия канальцев вплоть до вакуолизации, слабым диффузным и мелкоочаговым фиброзом интерстиция. Эти изменения соотносятся с изменениями клубочков, характеризующимися выраженной интракапиллярной гиперклеточностью и пролиферацией базальных мембран, сегментарным расширением парамезангиальных зон, наличием очагов распластывания малых отростков подоцитов.
Таким образом, впервые в литературе описан случай прямого нефротоксического воздействия кумарина и его метаболитов. Повреждение канальцевого эпителия почек метаболитами кумарина обуславливается во многом изначальным повреждением гломерулярной базальной мембраны, а также дисморфизмом подоцитов, что обуславливает повышенную готовность канальцевого эпителия к повреждению на фоне усиления процессов реабсорбции в связи с дефектами гломерулярной базальной мембраны и подоцитов. В свою очередь, низкая молекулярная масса кумарина и его метаболитов позволяет свободно проникать через гломерулярный фильтр, что, в условиях повреждения базальной мембраны и подоцитов, приводит к критическому повышению его в первичной моче и обуславливает токсическое действие на уровне канальцев почки.
Литература
1. Ермоленко, В.М. Острая почечная недостаточность / В.М. Ермоленко, А.Ю. Николаев – М.: Гэотар-Медиа, 2010. – 400 с.
2. Angell, M. Alternative medicine – the risks of untested and unregulated remedies / M. Angell, J.P. Kassirer // N. Engl. J. Med. – 1998. – V.339. – P.839-841.
3. Fugh-Berman, A. Herb-drug interactions / A. Fugh-Berman // Lancet. – 2000. – V.355. – P.134-138.
4. Recent patterns of medication use in the ambulatory adult population of the United States: the Spone survey / D.W. Kaufman, J.P. Kelly, L. Rosenberg et al. // JAMA. – 2002. –V.287. – P.337-344.
5. Screening methods for drugs and heavy metals in Chinese patent medicines / A. Au, R. Ko, F. Boo et al. // Bull. Environ. Contam. Toxicol. – 2000. – V.5. – P.112-119.
6. Chopra, A. Ayurvedic medicine: core concept, therapeutic principles, and current relevance/ A. Chopra, V. Doiphode. // Med. Clin. North. Am. – 2002. – V.86. – P.75-89.
7. Ernst, E. Heavy metals in traditional Indian remedies / E. Ernst // Eur. J. Clin. Pharmacol. – 2002. – V.57. – P.891-896.
8. The use and safety of non-allopathic Indian medicines / N. Gogtay, H. Bhatt, S. Dalvi, N. Kshirsagar // Drug Saf. – 2002. – V.25. – P.1005-1019.
9. Indian herbal remedies for diabetes as a cause of lead poisoning / R.W. Keen, A.C. Deacon, H.T. Delves et al. // Postgraduate Medical Journal. – 1994. – V.70. – P.113-114.
10. Ko, R.J. Adulterants in Asian patent medicines / R.J. Ko // N. Engl. J. Med. – 1998. – V.339. – P.847.
11. Arlt, V. Aristolochic acid as a probable human cancer hazard in herbal remedies: a review / V. Arlt, M. Stiborova, H. Schmeiser // Mutagenesis. – 2002. – V.17. – P.265-277.
12. Trends in alternative medicine use in the United States, 1990-1997: results of a follow-up national survey / D.M. Eisenberg, R.B. Davis, S.L. Ettner et al. // JAMA. – 1998. – V.280. – P.1569-1575.
13. Ernst, E. Adulteration of Chinese herbal medicines with synthetic drugs: a systematic review / E. Ernst // J. Intern. Med. – 2002. – V.252. – P.107-113.
14. Foote, J. Medicinal herb use and the renal patient / J. Foote, B. Cohen // J. of Renal Nutrition. – 1998. – V.8. – P.40-42.
15. International Agency for Research on Cancer (IARC). Some traditional herbal medicines, some mycotoxins, nafhtalene and styrene. In IARC Monographs on the Evaluation of Carcinogenic Risks of Chemicals to Humans. Lyon. France: IARC, 2002. – Р.82.
16. Herbs and the kidney/ C. Isnard Bagnis, G. Deray, A. Baumelou et al. // Am. J. Kidney Dis. – 2004. – V.44. – №1. – P.1-11.
17. Morris L. Side-effects of coumarin / L. Morris, P.D. Welsby // Postgrad. Med. J. – 1995. – №71. – P.701-702.
18. British Herbal Pharmacopoeia. – 1996. – 212 p.
19. Advances in research on chemical constituents and pharmacological activities of Agrimonia pilosa / G. Hong, Y.H. Dai, P.X. Liu et al.// Pharm. Care and Research. – 2008. – V.8. – № 5. – P.362-366.
20. Карташова, Г.С. Содержание дубильных веществ в Agrimonia pilosa Ledeb. / Г.С. Карташова, И.В. Гравель, Е.Г. Таран // Растительные ресурсы. – 1991. – Т.27. – №1. – С.139-143.
21. Wei, Y. Isolation of hyperoside and luteolin-glucoside from agrimonia pilosa ledeb using stepwise elution by high-speed countercurrent chromatography / Y. Wei, Y. Ito // J. of Liquid Chromatography and Related Technologies. – 2007. – V.30. – №9-10. – P.1465–1473.
22. Separation and determination of flavonoids in Agrimonia pilosa Ledeb. by capillary electrophoresis with electrochemical detection / X. Xu, X. Qi, W. Wang, G. Chen // J. of Separation Science. – 2005. – V.28. – №7. – P.647-652.
23. Analysis of the volatile components of Agrimonla Pilosa Ledeb by gas chromatography-mass spectrometry / Y.W. Li, L.F. Huang, C. Liang et al. // J. of Central South University (Science and Technology). – 2007. – V.38. – №3. – P. 502-506.
24. Фитохимическое исследование растений флоры Сибири / Д.Л. Макарова, В.В. Величко, Н.Е. Ким и др.// Фармация. – 2008. – №3. – С.19-22.
25. 500 важнейших лекарственных растений / В.К. Лавренов, Г.В. Лавренова. – М., 2003. – 510 с. 26. Comparative metabolism and kinetics of coumarin in mice and rats / S.L. Born, A.M. Api, R.A. Ford et al. // Food Chem. Toxicol. – 2003. – №41. – P.247-258.
Статья опубликована в журнале «Вестник урологии». Номер №3/2013 стр. 30-39