Тригеминальная невралгия что это
Тригеминальная невралгия
Н.В. Стуров, А.П. Переверзев, А.В. Рогожина
РУДН, Москва
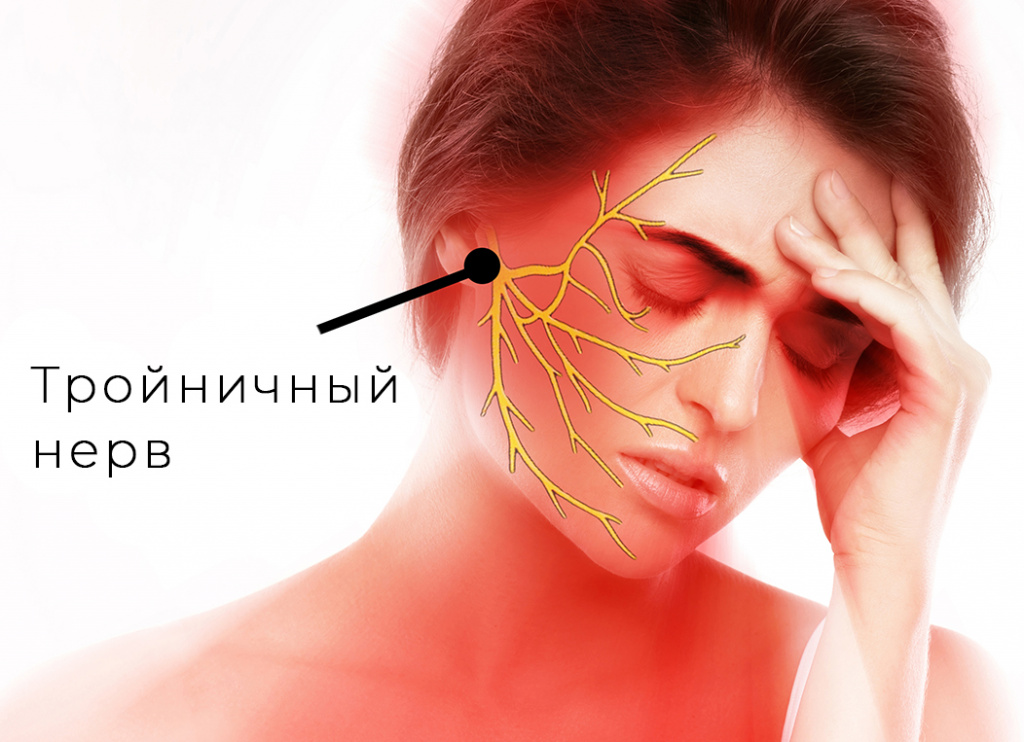
Тригеминальная невралгия (ТН, невралгия тройничного нерва) относится к числу наиболее устойчивых болевых синдромов в клинической неврологии. Заболевание обусловлено нарушением функционирования сенсорного отдела системы тройничного нерва, который представлен чувствительными нейронами и проводниками, воспринимающими и проводящими всю сенсорную информацию от зубочелюстной системы, кожных покровов лица, слизистой оболочки придаточных пазух носа и частично от твёрдой мозговой оболочки.
ТН является довольно распространенной формой невралгии и встречается в популяции с частотой 4–13 случаев на 100 тыс. популяции [1, 2], причём более 90% случаев приходятся на лиц старше 40 лет, как правило, женщин (60–70%) [3]. В Великобритании ежегодно регистрируется 27 случаев ТН на 100 тыс. жителей [4].
Одно из первых полноценных описаний ТН было дано английским философом Джоном Локом в письме, датированном декабрем 1677 года, где подробно описывается симптоматика ТН у одной высокопоставленной особы [5]. Однако исчерпывающее научное изложение клинической картины заболевания дал в 1773 году Джон Фозергилл (John Fothergill) на заседании Медицинского общества Лондона [6], поэтому долгое время болезнь называли его именем.
ТН является полиэтиологичным заболеванием. Одной из причин может выступать патология зубо-челюстной системы, поскольку довольно часто клиника ТН развивается после удаления зуба в результате повреждения нерва. Сначала появляется онемение, постоянные болевые ощущения, которые с течением времени трансформируются в типичные невралгические приступы – развивается одонтогенная невралгия [7].
Довольно редко ТН наблюдается при нарушениях кровотока в области ствола мозга, при этом патологические изменения формируются на уровне ядра нисходящего тракта.
Однако чаще всего регистрируется так называемая идиопатическая ТН, хотя её основные причины на сегодняшний день довольно хорошо изучены. У таких больных выявляется компрессия корешка тройничного нерва в области мосто-мозжечкового угла аномально расположенными сосудами (обычно верхней или нижней передней мозжечковой артерией), сосудистой аневризмой (основная причина [8]) или невриномой слухового нерва. Вклад в развитие ТН вносит туннельная компрессия ветвей тройничного нерва в костных каналах, которые могут быть деструктивно изменены [9].
Помимо это, важную роль играют центральные факторы: в области ядра тройничного нерва формируются очаги «патологически усиленного возбуждения», которые выявляются при нейрофизиологическом обследовании и от изменения активности которых происходит чередования периодов обострений и ремиссий [7].
К другим причинам относят патологические процессы на основании черепа или в костных каналах, по которым проходят иннервирующие зубы нервные волокна, разрастание интерстициальной ткани внутри нервного ствола, сращения твёрдой мозговой оболочки с костями черепа и др. Симптомы ТН могут развиваться в результате инфекционного процесса (герпетическое поражение гассерова узла, спаечные процессы с вовлечением мозговых оболочек) или демиелинизации при рассеянном склерозе [10]. Согласно эпидемиологическим данным, 1–5% больных рассеянным склерозом страдают ТН [11].
Патологический процесс может начинаться с формирования периферического очага болевой импульсации, однако по мере прогрессирования заболевания источниками боли прогредиентно становятся различные участки тройничного нерва и периферических вегетативных образований лица. Это приводит к перераздражению понтобульбоспинального тракта и ретикулярной формации, в результате формируется полинейрональный рефлекс невралгии, в который вовлекаются надсегментарные образования головного мозга с развитием доминанты в таламусе и сером веществе полушарий [8]. Всё это приобретает особое значение в силу патофизиологического и клинического сходства признаков эпилепсии и ТН: пароксизмальность, мощность проявлений, положительный эффект после приёма противоэпилептических средств.
В нескольких случаях наследственной передачи ТН, приведённых в литературе, указывается на аутосомно-доминантный тип наследования, тем не менее ТН считается заболеванием, которое возникает в популяции спорадически и не наследуется [12].
ТН протекает с периодами обострения и ремиссии, причём наибольшая частота обострений наблюдается в осенний и зимний периоды, что говорит о роли метеорологических факторов.
В межприступный период больные отвечают на вопросы односложно, почти не раскрывая рот, поскольку любое движение может спровоцировать очередной пароксизм.
Характерный признак ТН – наличие триггерных точек, при раздражении которых возникает типичный болевой приступ. В наибольшей концентрации эти точки сосредоточены в медиальных отделах лица. Боль провоцируется приёмом пищи, разговором, а также механическим раздражением (умыванием, чисткой зубов и пр.). Во время сна болевой синдром наблюдается редко [15]. Считается, что боль обычно захватывает только одну половину лица, однако описаны случаи двусторонней ТН.
При длительном течении ТН в периферическом отделе системы тройничного нерва происходят деструктивные изменения в виде очагов демиелинизации и даже асептического воспалительного процесса, что модифицирует клиническую картину заболевания: появляется постоянная межприступная боль, на фоне которой во время обострений развиваются типичные болевые пароксизмы. В области лица у больных выявляются преходящие или постоянные чувствительные нарушения по периферическому типу.
Характерная боль может наблюдаться у лиц среднего и старшего возраста при поражении вирусом Varicella zoster. При инфицировании этим вирусом чаще в патологический процесс вовлекается глазной нерв (1-я ветвь тройничного нерва) [16].
ТН наблюдается у пациентов с рассеянным склерозом, что является результатом димиелинизации области выхода тройничного нерва из головного мозга. По эпидемиологическим данным, примерно у 2,4% больных ТН при обследовании выявляются признаки рассеянного склероза [17].
Важно дифференцировать ТН от нейропатии тройничного нерва, которая характеризуется выраженной потерей чувствительности и незначительным болевым синдромом. В случае идиопатической ТН физические методы исследования не выявляют снижения чувствительности и моторной функции тройничного нерва, однако в анамнезе у больного присутствуют жалобы на типичные болевые пароксизмы.
При синдроме индуцирующего невралгию кавитационного остеонекроза, который представляет собой негнойный рентгенонегативный процесс в челюсти, болевые пароксизмы очень похожи на таковые при ТН, что предопределяет сложности в дифференциальной диагностике. С другой стороны, многие авторы ставят под сомнение само существование синдрома кавитационного остеонекроза [18,19].
Другие нозологии, от которых следует дифференцировать ТН, представлены в таблице 1.
Таблица 1. Некоторые заболевания и состояния, которые необходимо дифференцировать от ТН [20]
| Диагноз | Комментарий |
|---|---|
| Инфекционный процесс в зубе, нарушение целостности зуба | Локализация боли в зубе, локальный отек и гиперемия, характерные изменения при осмотре зуба |
| Боль в височно-нижнечелюстном сочленении | Обычно двусторонняя боль, может иррадиировать вокруг ушных раковин, в шею, виски; открывание рта может быть ограничено и сопровождаться характерным щелчком |
| Персистирующая идиопатическая лицевая боль (атипичная лицевая боль) | Боль обычно двусторонняя, продолжительная, слабой или средней степени выраженности, иногда пульсирующая, может распространяться за пределы иннервируемых тройничным нервом областей |
| Мигрень | тяжёлая односторонняя головная боль, сопровождающаяся фото- и фонофобией, тошнотой; часто предшествует аура |
| Артериит височной артерии | Чаще встречается в пожилом возрасте, боль локализуется в височной области, постоянная, может сопровождаться нарушением смыкания челюстей, лихорадкой, потерей веса; при пальпации височная артерия плотная, чувствительная, пульсация может не определяться |
Фармакотерапия является наиболее доступным методом лечения ТН. Рациональное использование современных схем позволяет значительно повысить качество жизни больных за относительно короткий период.
Согласно современным представлениям, препаратом выбора для фармакотерапии ТН является карбамазепин (Финлепсин) [21]. По обобщенным результатам 4-х рандомизированных контролируемых исследований, карбамазепин достоверно улучшает симптоматику при ТН у 72% пациентов [22]. Препарат рассматривается некоторыми авторами в качестве тестового средства: если после ежедневного приёма 500–800 мг карбамазепина анальгезирующий эффект не развивается, то диагноз типичной невралгии может быть поставлен под сомнение.
Карбамазепин блокирует натриевые каналы мембран гиперактивных нервных клеток, которые формируют эпилептоподобные очаги «патологически усиленного возбуждения», снижает влияние на нейроны возбуждающих нейромедиаторных аминокислот (глутамата, аспартата), усиливает тормозные (ГАМКергические) процессы, что эффективно купирует центральный компонент патогенеза ТН.
Карбамазепин назначают в начальной дозе 100 мг 2 р/сут. При необходимости её наращивают каждые 3–4 дня на 50–100 мг, целевым уровнем считается 400–1000 мг/сут [23]. В отечественной литературе лечение рекомендуют начинать с дозы до 50 мг/сут, постепенно повышая её до 600–800 мг/сут. В такой дозе больной получает карбамазепин в течение 3–4 недель, а затем её постепенно снижают до минимально эффективной. Приведённая схема терапии позволяет минимизировать риск развития неблагоприятных побочных реакций (НПР).
При назначении карбамазепина необходимо выяснить у больного время наиболее интенсивной боли, и в соответствии с этим распределять суточную дозу. Поскольку интенсивные приступы у большинства пациентов случаются в утренние часы, бoльшую дозу назначают утром и/или непосредственно перед сном. Во время обострения можно назначать карбамазепин в виде ректальных суппозиториев, что улучшает его всасывание и замедляет выведение.
В случае, если карбамазепин эффективно купирует болевой синдром при ТН, но плохо переносится пациентом, альтернативой может служить окскарбазепин, являющийся структурным аналогом карбамазепина. Риск перекрестной аллергии между препаратами составляет 25% [23, 24].
Габапентин широко используется при нейропатических болях, однако крупных клинических исследований, демонстрирующих эффективность препарата при ТН, недостаточно [25]. Поэтому сегодня препарат рекомендован как средство второй линии.
Ламотриджин (как и баклофен) рассматривается как альтернативный препарат ввиду недостаточной доказательной базы в плане эффективности при ТН. Существенно осложняет использование препарата необходимость длительно титровать дозу, а также ограниченное применение при ТН с выраженным болевым синдромом [26].
Потенциально возможно использование фенитоина, клоназепама, вальпроата, мексилетина и топирамата, однако также в качестве альтернативных средств и/или в комбинации с карбамазепином в случае недостаточной эффективности последнего [26].
Сводные данные обо всех препаратах, которые можно использовать при ТН, представлены в таблице 2.
Таблица 2. Препараты, которые используют для фармакотерапии ТН [27]
| Препарат | Режим дозирования | Наиболее частые НПР | Комментарий |
|---|---|---|---|
| Препараты первой линии (эффективность убедительно доказана в клинических исследованиях) | |||
| Карбамазепин (Финлепсин) | 100 мг 2 р/день; наращивают по 50–100 мг каждые 3–4 дня; целевая доза 400–1000 мг/сут | Сонливость, атаксия, тошнота, запор | Доза может быть постепенно снижена до минимально эффективной с целью минимизации НПР |
| Препараты второй линии (эффективность показана в единичных клинических исследованиях, необходимо расширение доказательной базы) | |||
| Баклофен | 10 мг 3 р/сут; наращивают по 10 мг/сут; целевая доза 50-60 мг/сут | Сонливость, гипотония, синдром отмены | Может быть полезен у лиц с рассеянным склерозом благодаря наличию антиспастического действия |
| Габопентин | 300 мг 1 р/сут; наращивают по 300 мг каждые 3 дня; целевая доза 900-2400 мг/сут в 3 приема | Сонливость, атаксия, диарея | Широко используется при ТН, несмотря на малую доказательную базу; эффективность при других видах нейропатической боли намного выше |
| Ламотриджин | 25 мг 2 р/сут; наращивают по 50 мг каждую неделю; целевая доза 200-600 мг/сут | Сонливость, головокружение, тошнота, запор | необходимо медленное титрование дозы; может рассматриваться в качестве альтернативы карбамазепину при плохой переносимости у пожилых и лиц с рассеянным склерозом |
| Окскарбазепин | 300 мг 2 р/сут; наращивают по 600 мг каждую неделю; целевая доза 600–2400 мг/сут | Головокружение, утомляемость, суетливость, гипонатриемия | Структурно похож на карбамазепин; используется как препарат первого ряда в Скандинавских странах |
| Фенитоин | 300 мг/сут; дозу можно менять под контролем терапевтических плазменных концентраций | Сонливость, атаксия, головокружение, гипертрофия десен | Первый препарат, предложенный для лечения ТН |
| Пимозид | 2 мг 1 р/сут; наращивают по 2 мг в неделю; целевая доза 2-12 мг/сут | Экстрапирамидные расстройства, аритмии | Использование осложнено в связи с высокой частотой развития экстрапирамидных расстройств и кардиотоксичности |
В случае отсутствия положительно результата от фармакотерапии и при наличии чётких показаний после проведения диагностических процедур может быть назначено хирургическое лечение ТН, однако следует помнить, что оно не является абсолютной гарантией полного излечения ввиду вероятности рецидива болевого синдрома. Используется микроваскулярная декомпрессия [28], которая заключается в трепанации задней черепной ямки, ревизии корешка тройничного нерва, верхней и нижней передних мозжечковых артерий и верхней каменистой вены и отведении того сосуда, который тесно прилегает к корешку тройничного нерва. С целью предотвращения повторного смещения между сосудом и нервом устанавливается специальная изолирующая прокладка. У больных, страдающих тяжёлой сопутствующей соматической патологией, и у пожилых проведение этой операции сопряжено с высоким риском неблагоприятного исхода. Помимо этого, используется позадигассерова ризотомия [29] и чрескожная баллонная микрокомпрессия [30]. Однако наиболее популярны стереотаксическая радиохирургическая операция («гамма-нож») [31] и чрескожная радиочастотная деструкция корешков тройничного нерва [32].
Невралгия тройничного нерва
Невралгия тройничного нерва (тригеминальная невралгия) – это очень распространенное заболевание. Оно проявляется сильными болями, а также сопутствующими нарушениями работы мимических и жевательных мышц, а также вегетативными проблемами. Поскольку оба тройничных нерва охватывают практически все лицо, боль может возникнуть в любой области.
Общая информация
Тройничный нерв состоит из чувствительных и двигательных волокон. Он берет начало в структурах головного мозга и делится на три ветви:
При невралгии поражается одна или несколько ветвей тройничного нерва, что и определяет основные симптомы патологии. Наиболее подвержены заболеванию люди после 45 лет, а женщины болеют чаще мужчин.
Причины возникновения
Причины невралгии тройничного нерва могут иметь разную природу:
Риск развития тригеминальной невралгии значительно повышается:
Симптомы
Со временем длительность каждого приступа невралгии увеличивается, а периоды затишья сокращаются вплоть до развития непрерывной ноющей боли.
Провоцирующим фактором выступает раздражение триггерных точек:
Человек нередко провоцирует приступ при выполнении гигиенических процедур (расчесывание волос, уход за полостью рта), при жевании, смехе, разговоре, зевоте и т.п.
В зависимости от места поражения боль захватывает:
Если поражение затронуло все три ветки или сам нерв до его разделения, боль распространяется на соответствующую половину лица целиком.
Болевые ощущения сопровождаются другим нарушениями чувствительности: онемением, чувством покалывания или ползанья мурашек. С пораженной стороны может отмечаться гиперакузия (повышенная слуховая чувствительность).
Поскольку тройничный нерв содержит не только чувствительные, но и двигательные пути передачи импульсов, при невралгии наблюдается соответствующая симптоматика:
Третья группа проявлений невралгии – это трофические нарушения. Они связаны с резким ухудшением кровообращения и оттока лимфы. Кожа становится сухой, начинает шелушиться, появляются морщины. Наблюдается локальное поседение и даже выпадение волос в пораженной области. Страдает не только волосистая часть головы, но и брови с ресницами. Нарушение кровоснабжения десен приводят к развитию пародонтоза. В момент приступа пациент отмечает слезотечение и слюнотечение, отечность тканей лица.
Постоянные спазмы мышечных волокон с больной стороны приводят к асимметрии лица: сужению глазной щели, опущению верхнего века и брови, перемещению уголка рта вверх со здоровой стороны или опущение с больной.
Сам пациент постепенно становится нервным и раздражительным, нередко ограничивает себя в еде, поскольку жевание может стать причинной очередного приступа.
Диагностика
Диагностикой невралгии тройничного нерва занимается врач невролог. Во время первого визита он тщательно опрашивает пациента, чтобы выяснить:
Базовый осмотр включает в себя оценку состояния кожи и мышц, выявление асимметрии и других характерных признаков, проверку качества рефлексов и кожной чувствительности.
Для подтверждения диагноза проводятся:
Лабораторная диагностика включает лишь общие исследования, позволяющие исключить другие причины болевых приступов, а также оценить состояние организма в целом (обычно назначается общий анализ крови и мочи, а также стандартный набор биохимических исследований крови). При подозрении на инфекционную природу заболевания проводятся тесты на выявления конкретных возбудителей или антител к ним.
Дополнительно назначаются консультации профильных специалистов: ЛОРа (при наличии признаков патологии носоглотки), нейрохирурга (при признаках опухоли или травмы), стоматолога.
Лечение невралгии тройничного нерва
Правильно подобранное лечение позволяет снизить частоту, интенсивность и длительность болевых волн, и в идеале добиться стойкой ремиссии.
Медикаментозное лечение
Тригеминальная невралгия требует комплексного лечения с использованием препаратов нескольких групп:
В обязательном порядке проводится лечение первопричины заболевания: устранение стоматологических проблем, прием препаратов для улучшения мозгового кровообращения и т.п.
Физиотерапия и другие немедикаментозные методики
Немедикаментозные методы хорошо дополняют лекарственную терапию и способствуют стабилизации состояния пациентов. В зависимости от состояния и сопутствующих заболеваний могут быть назначены:
Хирургическое лечение
Помощь хирургов незаменима, когда требуется устранить сдавление нерва. При наличии показаний проводятся:
Ряд операций направлен на снижение проводимости нервного волокна:
Осложнения
Без лечения тригеминальная невралгия постепенно прогрессирует. Со временем в одном из отделов мозга формируется патологический болевой очаг. В результате боль захватывает все лицо, провоцируется любым незначительным раздражителем и даже воспоминанием о приступе, а впоследствии приобретает постоянный характер. Вегетативно-трофические расстройства прогрессируют:
Ввиду постоянных болей у пациента нарушается сон и развивается выраженная депрессия. В тяжелых случаях больные могут покончить жизнь самоубийством.
Профилактика
Профилактика невралгии тройничного нерва – это комплекс несложных мер, значительно снижающих риск развития патологии. Врачи рекомендуют:
Лечение в клинике «Энергия здоровья»
Если Вас или Вашего родственника беспокоят сильные боли в той или иной части лица, неврологи клиники «Энергия здоровья» придут на помощь. Мы проведем полноценную диагностику для выявления причин патологии и назначим комплексное лечение. К Вашим услугам:
Преимущества клиники «Энергия здоровья»
Клиника «Энергия здоровья» – это многопрофильный медицинский центр, где каждому пациенту досутпны:
Невралгия тройничного нерва – это серьезная патология, которая может серьезно нарушить привычный образ жизни человека. Не позволяйте боли и страху завладеть Вашими мыслями, пройдите лечение в «Энергии здоровья».
Современный подход к лечению тригеминальной невралгии
Тригеминальная невралгия (ТН) (синонимы: tic douloureux, или болезнь Фотергилла) является одной из самых распространенных лицевых болей (прозопалгий) и относится к числу наиболее устойчивых болевых синдромов в клинической неврологии [1].
По данным ВОЗ распространенность ТН составляет до 30–50 больных на 100 000 населения, а заболеваемость — 2–4 человека на 100 000 населения. ТН чаще встречается у женщин, чем у мужчин, дебютирует на пятом десятилетии жизни и в 60% случаев имеет правостороннюю локализацию [7, 8].
Согласно Международной классификации головных болей (2-е издание), предложенной Международным обществом головной боли (2003), ТН подразделяется на классическую, вызванную компрессией тригеминального корешка извилистыми или патологически измененными сосудами, без признаков явного неврологического дефицита, и симптоматическую, вызванную доказанным структурным повреждением тройничного нерва, отличным от сосудистой компрессии [9].
Наиболее частой причиной возникновения ТН является компрессия проксимальной части тригеминального корешка в пределах нескольких миллиметров от входа корешка в мост мозга (т. н. «входная зона корешка»). Примерно в 80% случаев происходит компрессия артериальным сосудом (чаще всего патологически извитой петлей верхней мозжечковой артерии). Этим объясняется тот факт, что ТН возникает в пожилом и старческом возрасте и практически не встречается у детей. В остальных случаях таковая компрессия вызвана аневризмой базилярной артерии, объемными процессами в задней черепной ямке, опухолями мостомозжечкового угла и бляшками рассеянного склероза [1, 8, 10, 11].
На экстракраниальном уровне основными факторами, приводящими к возникновению ТН, являются: туннельный синдром — компрессия в костном канале, по которому проходит нерв (чаще в подглазничном отверстии и нижней челюсти), связанная с его врожденной узостью, присоединением сосудистых заболеваний в пожилом возрасте, а также в результате хронического воспалительного процесса в смежных зонах (кариес, синуситы); местный одонтогенный или риногенный воспалительные процессы. Развитие ТН может провоцироваться инфекционными процессами, нейроэндокринными и аллергическими заболеваниями, демиелинизацией корешка тройничного нерва при рассеянном склерозе [7, 12].
В зависимости от воздействия патологического процесса на соответствующий отдел тригеминальной системы выделяют ТН преимущественно центрального и периферического генеза. В возникновении ТН центрального генеза большую роль играют нейроэндокринные, иммунологические и сосудистые факторы, которые приводят к нарушению реактивности корково-подкорковых структур и формированию очага патологической активности в ЦНС. В патогенезе ТН периферического уровня большую роль играют компрессионный фактор, инфекции, травмы, аллергические реакции, одонтогенные процессы [7, 8, 12].
Несмотря на появившееся в последние годы большое количество обзоров литературы и метаанализов, посвященных проблеме лечения НБ [13], к которой относится и ТН, среди исследователей не существует единого мнения относительно основных принципов медикаментозной терапии этого заболевания [14]. Лечение нейропатической боли все еще остается недостаточно эффективным: менее чем у половины пациентов отмечается значительное улучшение в результате проведенного фармакологического лечения [15, 16].
Проблема терапии тригеминальной невралгии на сегодняшний день остается не до конца решенной, что связано с неоднородностью данного заболевания в отношении этиологии, патогенетических механизмов и симптоматики, а также с малой эффективностью обычных анальгетических средств и развитием фармакорезистентных форм ТН, требующих проведения хирургического лечения. В современных условиях лечебная тактика при данном заболевании включает в себя медикаментозные и хирургические методы.
Основными направлениями медикаментозной терапии являются: устранение причины ТН, если она известна (лечение больных зубов, воспалительных процессов смежных зон и др.), и проведение симптоматического лечения (купирование болевого синдрома).
Патогенетическое лечение больных с ТН включает применение препаратов нейрометаболического, нейротрофического, антиоксидантного, антигипоксантного действия. В последние годы обнаружена высокая эффективность использования метаболических препаратов в комплексном лечении НБ [8, 17]. При лечении пациентов с ТН показана высокая эффективность препарата метаболического действия Актовегина — депротеинизированного деривата из крови молодых телят. Основное действие этого препарата заключается в стабилизации энергетического потенциала клеток за счет повышения внутриклеточного транспорта и утилизации глюкозы и кислорода. Актовегин обладает также антигипоксическим эффектом, являясь непрямым антиоксидантом. Кроме того, действие Актовегина проявляется непрямым вазоактивным и реологическим эффектами за счет повышения капиллярного кровотока, снижения периферического сосудистого сопротивления и улучшения перфузии органов и тканей [17]. Такой широкий спектр фармакологического действия Актовегина позволяет использовать его в терапии ТН. В период приступа целесообразно применение Актовегина внутривенно медленно струйно или капельно в течение 10 дней в дозе 400–600 мг/сутки. В межприступном периоде препарат назначается внутрь в дозе 200 мг 3 раза в сутки на протяжении 1–3 месяцев [8]. К патогенетическому лечению больных с ТН можно отнести применение высоких доз витаминов группы B в составе поликомпонентных препаратов, что обусловлено их полимодальным нейротропным действием (влиянием на обмен веществ, метаболизм медиаторов, передачу возбуждения в нервной системе), а также способностью существенно улучшать регенерацию нервов. Кроме того, витамины группы B обладают анальгезирующей активностью. К таким препаратам, в частности, относятся Мильгамма, Нейромультивит, Нейробион, содержащие сбалансированную комбинацию тиамина (B1), пиридоксина (B6), цианокобаламина (B12). Витамин B1 устраняет ацидоз, снижающий порог болевой чувствительности; активирует ионные каналы в мембранах нейронов, улучшает эндоневральный кровоток, повышает энергообеспечение нейронов и поддерживает аксоплазматический транспорт белков. Эти эффекты тиамина способствуют регенерации нервных волокон [18–20]. Витамин B6, активируя синтез миелиновой оболочки нервного волокна и транспортных белков в аксонах, ускоряет процесс регенерации периферических нервов, проявляя тем самым нейротропный эффект. Восстановление синтеза ряда медиаторов (серотонина, норадреналина, дофамина, гамма-аминомасляной кислоты (ГАМК) и активация нисходящих тормозных серотонинергических путей, входящих в антиноцицептивную систему, приводит к снижению болевой чувствительности (антиноцицептивное действие пиридоксина) [18, 21]. Витамин B12 участвует в процессах регенерации нервной ткани, активируя синтез липопротеинов, необходимых для построения клеточных мембран и миелиновой оболочки; уменьшает высвобождение возбуждающих нейротрансмиттеров (глутамата); обладает противоанемическим, гемопоэтическим и метаболическим эффектом [18, 22]. Для быстрого купирования боли и патогенетического нейротропного воздействия при ТН целесообразно использование парентеральной формы препарата Нейробион — комбинированного препарата витаминов группы B, содержащего оптимальное количество витамина B12 как в ампулированной, так и в таблетированной форме. Нейробион применяется в дозе 3 мл в сутки внутримышечно 2–3 раза в неделю — 10 инъекций (при выраженном болевом синдроме можно применять ежедневно в той же дозировке в течение 10–15 дней). Затем для усиления, пролонгирования терапевтического эффекта и профилактики рецидива заболевания назначается Нейробион в таблетированной форме в дозировке по 1 таблетке внутрь 3 раза в день в течение 1–2 месяцев [8].
Также препаратами выбора для лечения ТН являются антиконвульсанты, а карбамазепин стал одним из первых препаратов, официально зарегистрированных для лечения этого состояния [24].
В начале 90-х годов прошлого столетия появилась новая генерация противоэпилептических препаратов, и теперь антиконвульсанты обычно делят на препараты первого и второго поколения.
К антиконвульсантам первого поколения относятся фенитоин, фенобарбитал, примидон, этосуксимид, карбамазепин, вальпроевая кислота, диазепам, лоразепам, клоназепам. Препараты первого поколения практически не рассматриваются в качестве первой линии терапии НБ (за исключением карбамазепина при ТН) из-за недостаточного уровня обезболивающего эффекта и высокого риска возникновения нежелательных реакций. К наиболее частым побочным эффектам антиконвульсантов первого поколения относятся: реакции со стороны ЦНС (сонливость, головокружение, атаксия, седативный эффект или повышенная возбудимость, диплопия, дизартрия, когнитивные расстройства, ухудшение памяти и настроения), гематологические нарушения (агранулоцитоз, апластическая анемия, тромбоцитопения, лейкопения), гепатотоксичность, снижение минеральной плотности кости, кожные высыпания, гиперплазия десен, симптомы со стороны желудочно-кишечного тракта (рвота, анорексия). К антиконвульсантам второго поколения относятся прегабалин (Лирика), габапентин (Нейронтин, Габагамма, Тебантин), ламотриджин (Ламиктал), окскарбазепин (Трилептал), топирамат (Топамакс), леветирацетам (Кеппра), тиагабин (Габитрил), зонисамид (Зонегран), вигабатрин (Сабрил), фелбамат (Талокса). Эти препараты имеют более благоприятные фармакокинетические характеристики и профили безопасности, а также низкий риск лекарственных взаимодействий по сравнению с антиконвульсантами первого поколения [24, 25].
Основные механизмы действия антиконвульсантов 1-го и 2-го поколения представлены в таблице [26].
Первым антиконвульсантом, успешно используемым для лечения ТН, был фенитоин (Дифенин) [27]. Дифенин, производное гидантоина, близкого по химической структуре к барбитуровой кислоте, противопоказан при тяжелых заболеваниях почек, печени, сердечной недостаточности.
Согласно рекомендациям Европейской федерации неврологических сообществ (2009) фармакотерапия ТН основана, прежде всего, на использовании предложенного С. Блюмом в 1962 году карбамазепина (Финлепсина, Тегретола) (200–1200 мг/сутки), который является препаратом первого выбора (уровень доказательности A) [27, 28]. Противоболевое действие этого препарата обусловлено, главным образом, его способностью уменьшать проницаемость для натрия мембран нейронов, участвующих в ноцицептивных реакциях. Обычно назначается следующая схема лечения карбамазепином. В первые два дня суточная доза составляет 200 мг (по 1/2 таблетки утром и вечером), затем в течение двух дней суточная доза увеличивается до 400 мг (утром и вечером), а после этого — до 600 мг (по 1 таблетке утром, в обед и вечером). Если эффект недостаточный, то общее количество препарата в сутки может быть доведено до 800–1000 мг. У части больных ТН (около 15% в популяции) карбамазепин не оказывает анальгезирующего воздействия, поэтому в таких случаях применяется другой антиконвульсант — фенитоин.
Проведенные около 40 лет назад три плацебо-контролируемые исследования, которые включали в себя в общей сложности 150 пациентов с ТН, показали эффективность карбамазепина в отношении как частоты, так и интенсивности пароксизмов [24]. Рядом авторов было показано, что карбамазепин может уменьшить болевую симптоматику приблизительно в 70% случаев. [29]. Однако применение карбамазепина ограничено фармакокинетическими факторами и возникающими в ряде случаев тяжелыми побочными эффектами (например, синдром Стивенса–Джонсона), особенно у пожилых пациентов.
Окскарбазепин (Трилептал) имеет структурное сходство с карбамазепином, но гораздо лучше переносится пациентами и имеет гораздо меньше побочных эффектов. Обычно окскарбазепин используется в начале лечения ТН в дозе 600–1800 мг/сутки (уровень доказательности B) [30].
В качестве дополнительной терапии ТН показана эффективность ламотриджина (Ламиктала) в дозе 400 мг/сутки [31] и баклофена в дозе 40–80 мг/сутки [32], которые относятся к препаратам второй линии (уровень доказательности C). Малые открытые исследования (класс IV) свидетельствуют об эффективности применения клоназепама, вальпроата, фенитоина [33, 34]. Указанная терапия наиболее эффективна при классической форме ТН. При ТН периферического генеза в схемы лечения предпочтительно включать ненаркотические анальгетики, а в случае развития хронического болевого синдрома (более трех месяцев) показано назначение антидепрессантов (амитриптилин) [7, 12].
Габапентин (Нейронтин) — первый в мире препарат, который был зарегистрирован для лечения всех видов нейропатической боли. Во многих исследованиях была показана эффективность габапентина у больных с ТН, не отвечающих на лечение другими средствами (карбамазепин, фенитоин, вальпроаты, амитриптилин); при этом в большинстве случаев наблюдалось полное купирование болевого синдрома [35]. Терапевтическая доза составляет от 1800 до 3600 мг/сутки. Препарат принимают 3 раза в сутки по следующей схеме: 1-я неделя — 900 мг/сутки, 2-я неделя — 1800 мг/сутки, 3-я неделя — 2400 мг/сутки, 4-я неделя — 3600 мг/сутки.
Недавно были опубликованы результаты открытого проспективного 12-месячного исследования 53 пациентов с ТН, в котором оценивалась эффективность прегабалина (Лирики) в дозе 150–600 мг/сутки. Лечение прегабалином привело к обезболиванию или, по крайней мере, к 50%-му снижению интенсивности боли у 25% и 49% пациентов соответственно [36]. В другом мультицентровом проспективном 12-недельном исследовании 65 больных, резистентных к предшествующей анальгетической терапии, лечение прегабалином в средней дозе 196 мг/сутки (в подгруппе монотерапии) и 234 мг/день (в подгруппе политерапии) приводило к уменьшению интенсивности боли ≥ 50% в среднем у 60% больных, а также уменьшало степень выраженности тревоги, депрессии и нарушений сна [37]. При лечении ТН начальная доза прегабалина может составлять 150 мг/сутки в 2 приема. В зависимости от эффекта и переносимости дозу можно увеличить до 300 мг/сутки через 3–7 дней. При необходимости можно увеличить дозу до максимальной (600 мг/сутки) через 7-дневный интервал.
Впервые об использовании леветирацетама (Кеппра) при лечении ТН сообщили в 2004 году K. R. Edwards et al. [38]. Механизм действия леветирацетама неизвестен; имеются данные, полученные в экспериментах на животных, что он является селективным блокатором N-типа кальциевых каналов [39]. Свойства этого препарата особенно подходят для лечения пациентов с ТН с тяжелой болью, нуждающихся в быстром ответе на терапию. Фармакокинетика леветирацетама линейна и предсказуема; концентрация в плазме крови увеличивается пропорционально дозе в пределах клинически обоснованного диапазона от 500 до 5000 мг [40]. В отличие от других антиконвульсантов, особенно карбамазепина, в метаболизм леветирацетама не вовлечена система печеночного цитохрома Р450 и препарат экскретируется через почки [41]. Кроме того, данный препарат характеризуется благоприятным терапевтическим индексом и имеет незначительное число неблагоприятных побочных эффектов (что является основной проблемой при использовании препаратов для лечения ТН) [42]. Побочными эффектами леветирацетама, о которых обычно сообщают, являются: астения, головокружение, сонливость, головная боль и депрессия. В 10-недельном проспективном открытом исследовании показано, что для лечения ТН по сравнению с терапией эпилепсии были необходимы более высокие дозы леветирацетама, составляющих 3000–5000 мг/день (50–60 мг/кг/день), которые, тем не менее, не вызвали значительных побочных эффектов. Это обстоятельство свидетельствует о перспективе использования этого лекарственного средства для лечения ТН [43].
В одном отечественном исследовании отмечены положительные результаты при комбинации карбамазепина и габапентина [44].
С 1970-х годов прошлого столетия для лечения ТН стали использовать антидепрессанты [45]. В настоящее время доказана эффективность использования трициклических антидепрессантов (ТЦА) при лечении ТН [46].
До настоящего времени подбор анальгезирующей терапии НБ является скорее искусством, чем наукой, поскольку выбор препаратов осуществляется в основном эмпирически. Нередки ситуации, когда применение одного препарата оказывается недостаточно эффективным и возникает потребность в комбинации лекарственных средств. Назначение «рациональной полифармакотерапии» (одновременное применение препаратов, обладающих нейротропным, нейрометаболическим и анальгезирующим механизмами действия) позволяет повысить эффективность лечения при меньших дозировках препаратов и меньшем количестве побочных эффектов [47].
Пациентам, длительно страдающим от непереносимой боли, и при неэффективности консервативной терапии в случае классической ТН рекомендуется хирургическое лечение. В настоящее время используются следующие подходы:
1) хирургическая микроваскулярная декомпрессия [48];
2) стереотаксическая лучевая терапия, гамма-нож [49];
3) чрескожная баллонная микрокомпрессия [50];
4) чрескожный глицериновый ризолизис [51];
5) чрескожное радиочастотное лечение Гассерова узла [52].
Наиболее эффективным методом хирургического лечения ТН является метод P. Janetta, заключающийся в размещении специальной прокладки между тройничным нервом и раздражающим сосудом; в отдаленном периоде эффективность лечения составляет 80% [53–55].
В заключение заметим, что лечение ТН должно носить мультидисциплинарный характер, при этом c пациентом должны быть обсуждены выбор различных методов лечения и риски возможных осложнений.
Литература
*Первый МГМУ им. И. М. Сеченова, **МОНИКИ им. М. Ф. Владимирского, Москва

.gif)