Трикуспидальная регургитация что это такое при беременности у плода
Пренатальный скрининг при беременности
Для чего необходим скрининг I и II триместров, и почему он показан всем беременным женщинам?
У любой пары существует риск зачатия ребёнка, имеющего генетическое заболевание. В данном случае не играет никакой роли образ жизни родителей, их социальное положение, состояние здоровья. Риск есть всегда.
Скрининговые исследования предлагаются всем лицам, наблюдающимися по поводу беременности. Одно из таких обследований – УЗ-обследование генетических аномалий в I триместре беременности, прохождение которого желательно каждой беременной женщине до 14 недели гестации.
Таким образом, скрининг I триместра – комплекс пренатальных исследований, осуществляемых на 11-14 неделях гестации, целью которых является предварительная идентификация женщин с повышенным риском рождения ребенка, страдающего хромосомными болезнями.
К 11-12 неделе гестации ребенок уже достигает достаточных размеров, чтобы хорошо изучить его анатомические особенности. На этом сроке уже можно выявить серьезные нарушения развития ребенка, которые могут быть несовместимы с жизнью, либо приводить к тяжелой инвалидизации. Среди всех выявляемых генетических аномалий чаще всего встречается синдром Дауна, при котором в 21 паре не две, а три пары хромосом.
Ультразвуковые маркёры, которые повышают риск генетических заболеваний
Воротниковое пространство определяется как участок скопления жидкости между кожей и тканями шейного отдела позвоночника. Выявляется и в норме, и при генетических заболеваниях, но во втором случае ТВП увеличивается до 2,6 мм (а может и больше). Принципиально важно пройти скрининг на 12 (+-1) неделе беременности, ибо на более поздних сроках беременности воротниковое пространство исчезает. Очень редко эта структура переходит в генерализованный, либо локальный отек, иногда несовместимый с жизнью.
Как измеряется ТВП?
Для измерения ТВП применяются два метода – трансабдоминальный (практически во всех случаях), либо трансвагинальный. Результаты этих исследований отличаться не будут.
Обследование проводится только в I триместр беременности, на сроке гестации от 11 до 14 недель. При этом размер ребенка для эффективного скрининга должен быть не менее 45 мм, но и не более 85 мм. Если на 11 неделе плод чуть меньше, это можно считать вариантом нормы, то тогда обследование переносится на 7-10 дней.
Измерения осуществляются в переднезаднем направлении, то есть сагиттально, а головка ребенка предлежит нейтрально.
Область на мониторе увеличивается до головы и верхней трети туловища.
Область видимости должна увеличиваться так, чтобы наименьшее перемещение курсора выдавало изменение размера на одну десятую миллиметра.
Измеряется ТВП в наиболее широком месте, при этом требуется дифференциация эхоструктуры кожи и амниона.
Во время обследования толщина воротничкового пространства измеряется несколько раз, а выбирается наибольшее из полученных значений.
Порой к мнимому увеличению ТВП приводит обвивание шеи пуповиной. Тогда измеряется с обеих сторон пуповины. Дабы оценить риск, высчитывается среднее значение из полученных.
Возможности эхокардиографии плода в I триместре беременности (11-14 недель)
УЗИ сканер HS50
Доступная эффективность. Универсальный ультразвуковой сканер, компактный дизайн и инновационные возможности.
Введение
Актуальность темы пренатальной диагностики врожденных пороков сердца (ВПС) понятна всем врачам, которые связаны с пренатальной диагностикой, неонатологией, педиатрией, кардиологией, генетикой. ВПС являются одной из ведущих причин перинатальной смертности и регистрируются с частотой 4-13 на 1000 живорожденных [1]. В связи с тем, что профилактические мероприятия по предупреждению ВПС не имеют должного успеха, представляется актуальной и необходимой их пренатальная ультразвуковая диагностика.
Однако параллельно другими учеными эти группы риска отвергались, потому что большинство ВПС встречались у плодов и детей, матери которых не входили ни в одну из предложенных групп риска. Единственными разумными критериями так называемого селективного отбора были признаны беременные, попавшие в группу риска после проведения скрининга I триместра и беременные с подозрением на ВПС при ультразвуковом исследовании (УЗИ) плода [3].
Неоспоримо, что оптимальными сроками беременности для исследования сердца плода являются 20-22 недели, однако большинство летальных и клинически значимых пороков сердца могут быть диагностированы в конце I триместра беременности. Позволим себе процитировать слова главы Fetal Medicine Foundation Кипраса Николаидеса, высказанные им на страницах сайта FMF (www.fetalmedicine.com): «Специалист ультразвуковой диагностики с 12 недели беременности должен заверить большинство родителей, что у их ребенка нет крупных врожденных пороков сердца. В случае крупных врожденных пороков сердца их раннее выявление может привести к постановке правильного диагноза или хотя бы вызвать подозрение для осуществления ультразвукового мониторинга».
На самом знаменитом сайте в мире пренатальной диагностики www.thefetus.net (Philippe Jeanty, USA) опубликовано уже более 30 случаев находок ВПС в I триместре беременности. Однако в отечественной периодике встречаются лишь единичные работы по этой теме. Все они пренадлежат «перу» специалистов пренатальной диагностики Российской ассоциации врачей ультразвуковой диагностики в перинатологии и гинекологии, хотя для многих специалистов как раньше, так и сейчас осмотр сердца плода в сроки 11-14 недель заключается лишь в констатации числа сердечных сокращений.
Цель эхокардиографии в I триместре беременности состоит в выявлении летальных и клинически значимых ВПС. Это исследование не ставит целью выявление стенозов и гипоплазий выносящих трактов, диагностику мелких дефектов перегородок, патологий дуги аорты и артериального протока. Многие из этих пороков не только технически невозможно заподозрить в I триместре, манифестируют они после 30-й недели беременности, т.е. их диагностика является прерогативой исследования III триместра.
Точность пренатальной диагностики ВПС во все сроки беременности варьирует в широком диапазоне. Причинами этого могут быть разный опыт специалистов, ожирение беременной, частота использованных ультразвуковых трансдьюсеров и класс ультразвукового аппарата, перенесенные ранее абдоминальные операции, срок беременности, количество околоплодных вод и положение плода. Однако заметим, что многие из этих факторов теряют свою актуальность именно при проведении трансвагинальной эхокардиографии в I триместре беременности. Своевременная диагностика ВПС позволяет идентифицировать плоды высокого риска по генетическим синдромам, что имеет важное значение при проведении пренатального консультирования и оказывает существенное влияние на акушерскую тактику.
Результаты
С 2006 по 2011 г. пренатально в I триместре беременности были выявлены 125 ВПС. Из них 68 (55%) ВПС сочетались с различными хромосомными аномалиями (ХА) плода, 30 (24%) входили в состав различных множественных врожденных пороков развития (МВПР), 27 (21%) ВПС были изолированными.
Рис. 1. Беременность 12 недель. Четырехкамерный срез сердца плода. Отчетливо видны камеры сердца.
Беда- не беда: трикуспидальная регургитация у плода
В программе ультразвукового скрининга 1 триместра беременности требуется (но далеко не всеми, не всегда, и не всегда как положено выполняется) исследование кровотока на трехстворчатом клапане плода.
Факт обнаружения трехстворчатой регургитации у плода (т.е. обратного естественному кровотока, и недостаточности трехстворчатого клапана) рекомендациями отечественных и зарубежных светил пренатальной и УЗИ — диагностики считается маркером риска аномалий развития плода и его хромосомных аберраций.
Действительно, при различных структурных аномалиях сердца, таких как атриовентрикулярный септальный дефект (АВК), дисплазия трехстворчатого клапана, болезнь Эбштейна, а также при стенозе или атрезии легочного клапана, стенозе и преждевременном закрытии артериального протока, при синдроме гипоплазии левых отделов сердца, при аритмиях плода, мы встречаемся с недостаточностью трехстворчатого клапана – с трикуспидальной регургитацией.
И, конечно, она встречается при фетальных кардиомиопатиях и миокардитах, сердечной недостаточности плода, различных сосудистых мальформациях плода (классический пример – аневризма вены Галена).
Но, простите, все эти перечисленные заболевания очевидны, и имеют более важные, главные проявления, а трехстворчатая недостаточность при них – лишь один из многих других симптомов, а не самостоятельная находка!
В то же время мы (как кардиологи) знаем, что практически у всех существует физиологическая трикуспидальная регургитация – и у только родившегося ребенка, и у преклонных лет пациентов. От патологической недостаточности трехстворчатого клапана ее отличает низкая степень и относительно низкая скорость потока регургитации, и, конечно же, отсутствие другой серьезной врожденной или приобретенной патологии сердца и кровообращения в целом.
Но законодатели пренатальной диагностики упрямо тиражируют совершенно настораживающие цифры:
только у 5% плодов с трехстворчатой регургитацией нет патологий, остальные 95% — носители хромосомной патологии, особенно высок риск трисомии 21 хромосомы, т.е. болезни Дауна!
Интернет — форумы кричат тысячами голосов: «Помогите, у моего будущего ребенка обнаружили трикуспидальную регургитацию! Что делать! Никто ничего не может объяснить!». Непрофессионал и не объяснит, он понятия не имеет, с чем едят эту регургитацию.
Хорошо, если изначально не перепутает потоки митральной и трикуспидальной регургитации, или (еще хуже), нормальный кровоток в магистральной артерии сердца с этой самой трикуспидальной регургитацией (а, поверьте мне, таких «находок» — завались – у половины кричащих в этих самых форумах, а сомневающихся в этом утверждении специалистов отсылаю к опубликованным УЗИ-картинкам в том же сетевом ресурсе).
Этому специалисту легче всего откреститься от вас, направив на адские круги дополнительных бесконечных исследований, дообследований и консультаций.
Мы же в своей практике при обнаружении трикуспидальной регургитации у плода
проводим ряд дополнительных диагностических мероприятий, позволяющих уже гораздо подробнее оценить как саму степень и значимость трикуспидальной регургитации, так и сердца плода и его кровообращения в целом, и по возможности, исключить врожденные пороки развития сердца плода, сердечную недостаточность плода и т.д.
При обнаружении интактного сердца, а также при отсутствии других ультразвуковых маркеров риска фетопатий и хромосомных заболеваний плода диагностическая значимость выявленной трикуспидальной регургитации у плода ничтожна.
Думаю, что качественное повторное ультразвуковое исследование сердца плода при выявлении в первом УЗИ-скрининге беременности трикуспидальной регургитации не только не помешает, а действительно необходимо. Проводят его (ЭХОКГ плода) в 20-23 недели беременности, и именно в этом сроке опытный специалист способен дотошно исследовать буквально каждый миллиметр сердца вашего будущего ребенка.
Дело за дисциплиной и исполнительностью пациенток, а она, увы, тоже далеко не всегда на высоте! Да и выбор специалиста-исследователя за вами, дорогие будущие мамы и папы!
Выбор по принципу «рядом и побыстрее» не разумен даже при покупке буханки хлеба!
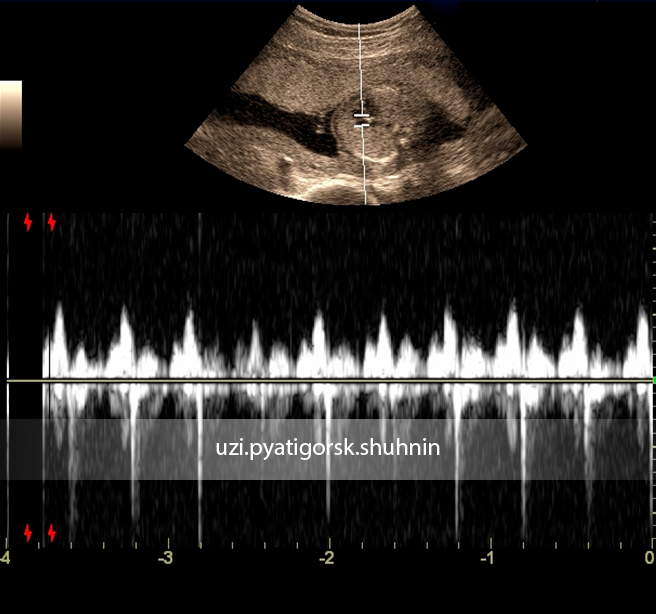
Беременность 16 нед. Эхокардиография плода. PWD – допплерография.
Отмечается физиологической направленности транстрикуспидальный кровоток наполнения правого желудочка
со скоростью 0.60м\с, и поток регургитации с максимальной скоростью 1.30м\с.
Беременность 11 нед. ТВИ. Эхокардиография плода. ЦДК – допплерография сердца.
Отчетливо визуализируется симметричный по спектру и скорости кровоток на митральном и трехстворчатом клапанах сердца (отображаются красным цветом потоки наполнения желудочков сердца).
Никакой регургитации не отмечается!
Обращаем ваше внимание на диагностические возможности оборудования: общий размер сердца менее 5 мм, желудочки сердца по 2 мм диаметром, магистральные артерии – 1 мм диаметром, но как информативно исследование!
Беременность 31 нед. Эхокардиография плода. ЦДК – допплерография сердца.
Отчетливо визуализируется поток регургитации на трехстворчатом клапане (поток красного цвета).
Физиологический кровоток наполнения правого желудочка через трехстворчатый клапан
в данном исследовании картируется синим цветом.
Трикуспидальная недостаточность (I07.1)
Версия: Справочник заболеваний MedElement
Общая информация
Краткое описание
Этиология и патогенез
Различают органическую и функциональную недостаточность трикуспидального клапана.
Органическая недостаточность характеризуется грубыми морфологическими изменениями створок трехстворчатого клапана (уплотненим, сморщиванием, деформацией и обызвествлением) и развивается чаще всего при ревматизме.
Патологическая физиология. Регургитация крови из правого желудочка в правое предсердие относительно быстро ведет к дилатации правого предсердия без существенной его гипертрофии. Компенсация порока осуществляется подобно митральной недостаточности, однако компенсирующие возможности правого предсердия меньше, поэтому рано формируются венозная гипертензия и венозный застой с депонированием крови в печени и других органах брюшной полости.
Недостаточность трехстворчатого клапана с большим объемом регургитации создает волну обратного тока, которая приводит к систолической пульсации яремных вен и печени. Среднее давление в полости правого предсердия повышено в 2-3 раза и более. Как и при недостаточности митрального клапана, вследствие большей податливости к растяжению сердечной мышцы, чем фиброзного кольца, возможно появление относительного стеноза с небольшим градиентом диастолического давления между правым предсердием и правым желудочком, манифестирующего слабым диастолическим шумом
Эпидемиология
Клиническая картина
Cимптомы, течение
Клиническая картина. Типичны жалобы на одышку, слабость, сердцебиение, тяжесть в правом подреберье. Если порок формируется у больного с ранее имевшимся митральным стенозом, застойные явления в малом круге кровообращения уменьшаются, одышка ослабевает, больной легче переносит горизонтальное положение.
Диагностика
Дифференциальный диагноз
Осложнения
Лечение
Показания к оперативному вмешательству
Оперативное вмешательство на трехстворчатом клапане обычно проводят при вмешательстве на других клапанах, если неэффективно медикаментозное лечение.
При недостаточности трехстворчатого клапана время выполнения хирургического лечения и оптимальная методика окончательно не определены в основном из-за малочисленности и противоречивости имеющихся данных (см. таблицу).
| Показания | Класс |
|---|---|
| Тяжелая недостаточность трехстворчатого клапана у пациентов, подлежащих хирургическому лечению клапанов левых отделов сердца | IC |
| Тяжелая первичная недостаточность трехстворчатого клапана с наличием симптомов, несмотря на медикаментозную терапию, без тяжелой правожелудочковой недостаточности | IC |
| Тяжелый стеноз трехстворчатого клапана (± недостаточность трехстворчатого клапана) с наличием симптомов, несмотря на медикаментозную терапию* | IC |
| Тяжелый стеноз трехстворчатого клапана (± недостаточность трехстворчатого клапана) у пациентов, подлежащих хирургическому лечению клапанов левых отделов сердца* | IC |
| Умеренная органическая недостаточность трехстворчатого клапана у пациентов, подлежащих хирургическому лечению клапанов левых отделов сердца | IIaC |
| Умеренная вторичная недостаточность трехстворчатого клапана с дилатированным кольцом (> 40 мм) у пациентов, подлежащих хирургическому лечению клапанов левых отделов сердца | IIaC |
| Тяжелая недостаточность трехстворчатого клапана с наличием симптомов после выполнения хирургического лечения на левых отделах сердца, при отсутствии миокардиальной, клапанной недостаточности левых отделов сердца или наличие правожелудочковой недостаточности при отсутствии тяжелой легочной гипертензии (систолическое давление в легочной артерии > 60 мм рт. ст.) | IIaC |
| Тяжелая изолированная недостаточность трехстворчатого клапана в сочетании с минимальными симптомами или их отсутствием и прогрессивной дилатацией или ухудшением функции правого желудочка | IIbC |
* Перкутанное вмешательство может быть применено на первых этапах, если стеноз трехстворчатого клапана изолирован
Прогноз
Профилактика
В соответствии с данными экспертов Американской кардиологической ассоциации все пациенты с ревматическим пороком сердца входят в группу умеренного риска по развитию инфекционного эндокардита. Этим пациентам при выполнении различных медицинских манипуляций, связанных с риском развития бактериемии ( экстракция зуба, тонзиллэктомия, операции на желчных путях или кишечнике и т.д.) необходимо профилактическое назначение антибиотиков.
Трикуспидальная регургитация что это такое при беременности у плода
ПРЕНАТАЛЬНАЯ ДИАГНОСТИКА ПОРОКОВ СЕРДЦА, ТЕЧЕНИЕ БЕРЕМЕННОСТИ, КЛИНИЧЕСКИЕ СЛУЧАИ СОЧЕТАНИЯ КАРДИАЛЬНОЙ ПАТОЛОГИИ ПЛОДА С АНОМАЛИЯМИ ДРУГИХ ОРГАНОВ
Сердечная патология является одной из основных причин детской смертности и находится на втором месте среди причин младенческой смертности. Частота составляет 8 случаев на 1000 новорожденных [1, 2].
Неблагоприятный прогноз для жизни представляют сложные врожденные пороки сердца (ВПС). Под термином «сложный» понимают такие сердечные аномалии, как гипоплазированные камеры сердца, атрезии клапанов, аномальное отхождение магистральных сосудов, единственный желудочек, то есть изменения в сердце, при которых невозможно выполнить полную хирургическую коррекцию [3].
Критические пороки сердца, требующие хирургического вмешательства в ранний неонатальный период, составляют 25 % от всех врожденных сердечных аномалий. В первую неделю умирает 29 % новорожденных, к концу первого года жизни – 87 % [4].
Первое ультразвуковое скрининговое обследование (11–13 недель) является важным осмотром. В случае обнаружения увеличения толщины воротникового пространства, отклонения сердечной оси, рекомендуется расширенное обследование сердца (фетальная эхокардиография). При рутинном ультразвуковом исследовании лишь в 40 % выявляются пороки сердца у плодов, при том что детальный осмотр позволяет выявлять до 90 % сердечных пороков внутриутробно. Для своевременного выявления врожденных пороков сердца необходимо детально обследовать сердце плода ультразвуковым методом при втором скрининговом обследовании (18–22 недели) [5, 6].
Применяя фетальную эхокардиографию, возможно определить структуру порока и спрогнозировать исход для плода [7]. Особенно это касается сложных пороков сердца, так как имеет место позднее выявление патологии, при осмотре неонатологом в родильном доме или после выписки домой [8].
Данная тема является актуальной. Врачи пренатальной диагностики встречаются с трудностями точного определения структуры сердечных пороков, что связано с большой вариабельностью кардиальной аномалии у плодов.
Задачей врачей-гинекологов является правильная тактика ведения беременной после установки диагноза, так как своевременная хирургическая помощь спасает жизни детей и влияет на качество дальнейшей жизни.
Цель исследования: проанализировать течение беременности при выявлении кардиальной патологии у плодов, определить точность внутриутробной диагностики, описать случаи сочетания сердечных пороков с патологией развития других органов плода.
Материалы и методы исследования
В центре диагностики матери и плода «Family» г. Бишкек с января 2019 г. по ноябрь 2020 г. было осмотрено 48 беременных женщин с пороками сердца плода, требующими хирургической коррекции после рождения. Всем новорожденным было проведено эхокардиографическое обследование после родов врачами-кардиологами для уточнения структуры пороков. В случаях прерывания беременности, для подтверждения диагноза проводилось патологоанатомическое вскрытие.
Осмотр беременных выполнялся на ультразвуковых аппаратах General Electric (GE) Voluson E8 и E10, c использованием программы fetal heart. Также использовалась программа STIC (постобработка снимков, полученных в режиме объемного сканирования), основным являлся двумерный режим с цветовым и импульсным доплеровским картированием. У всех пациентов было получено информированное согласие на участие в нашем исследовании. Результаты были обработаны путем вычисления относительных величин (в %).
Результаты исследования и их обсуждение
Среди 48 плодов с ВПС сложные пороки сердца были в 40 случаях (83,3 %). Из общего количества умерли после родов 23 ребенка (47,9 %). Прервали беременность 3 женщины (6,2 %), в двух случаях проводилось патологоанатомическое вскрытие плодов. Третья беременная после заключения медицинской комиссии прервала беременность в сроке 31 неделя, в связи с плохим прогнозом для жизни ребенка. Диагноз был подтвержден методом эхокардиографии.
Из факторов риска, по анализам обменных карт, острые респираторные вирусные инфекции (ОРВИ) до 12 недели перенесли 14 женщин (29,1 %), ОРВИ во втором триместре перенесли 4 женщины (8,3 %). Анемия легкой степени имела место в 12 случаях (25,0 %), хроническая ревматическая болезнь сердца у матери – один случай (2,0 %). Многоплодные беременности как фактор риска в нашем случае встречались в двух случаях (4,1 %), обе дихориальные, диамниотические двойни.
Количество плодов мужского пола составило – 31 (64,5 %), женского 17 (35,4 %). Маловесными (вес менее 2600 г.) родились 9 детей (18,7 %), из них 8 имели сочетание порока сердца с ненормальным развитием других органов, в одном случае порок сердца был изолированным.
При ультразвуковом исследовании фетоплацентарное нарушение кровотока 1 степени выявлено у одной беременной (2,0 %), задержка внутриутробного развития у 4 (8,3 %), маловодие у 2 (4,1 %), многоводие у 5 (10,4 %), причем избыточное количество вод во всех случаях сочеталось с множественными пороками развития.
Сложности при ультразвуковом осмотре вызывали неправильное положение плода, большой срок гестации (после 35 недель), многоводие, маловодие. Необходимо отметить, что технология STIC информативна при осмотрах четырехкамерной проекции сердца (пороки атривентрикулярных клапанов, гипоплазии желудочков, дефекты межжелудочковой перегородки). Для осмотра выходных трактов желудочков, особенно при повороте оси сердца, осмотр в двумерном режиме является предпочтительным. Также для осмотра органов других систем маловодие и неудобное положение плода являются помехами для трехмерного ультразвука.
Структура выявленных пороков оказалась многообразна. Нами были диагностированы: у 5 плодов (10,4 %) двойное отхождение сосудов от правого желудочка, аномалия Эбштейна – 1 (2,0 %), транспозиция магистральных сосудов – 3 (6,2 %), стеноз легочной артерии – 7 (14,5 %), изолированный перимембранозный дефект межжелудочковой перегородки – 3 (6,2 %), декстрапозиция аорты с дефектом межжелудочковой перегородки – 5 (10,4 %), атрезия легочной артерии – 4 (8,3 %), атриовентрикулярный канал –5 (10,4 %), тетрада Фалло – 6 (12,5 %), перерыв дуги аорты – 1 (2,0 %), атрезия трикуспидального клапана – 1 (2,0 %), атрезия митрального клапана – 4 (8,3 %), из них в двух случаях аортальный клапан был атрезирован, также в двух случаях имелось двойное отхождение сосудов от правого желудочка. Коарктация аорты составила один случай (2,0 %), единственный желудочек – 2 (4,1 %).
После рождения вскрытие проводилось в одном случае – ребенку с аномалией Эбштейна, который умер в родильном доме на вторые сутки. Согласно заключению патологоанатома, причиной смерти стала острая сердечная недостаточность, дилатация полостей сердца, острый венозный застой внутренних органов.
В двух случаях единственного желудочка диагностика оказалась затруднительной как внутриутробно, так и после родов. В первом случае трикуспидальный клапан был атрезирован и полость правого желудочка практически отсутствовала, также имелся единый сосуд, исходящий из функционально единого желудочка. После родов рекомендовалась компьютерная томография для уточнения диагноза. При телефонном разговоре с матерью мы узнали, что в возрасте 10 месяцев ребенок еще не прошел полного обследования, но в развитии значительно отставал, не мог переворачиваться и самостоятельно не сидел.
Во втором случае мы диагностировали правосформированное, праворасположенное сердце в сочетании с единым атриовентрикулярным клапаном, двойным отхождением сосудов от правого желудочка, ребенок умер в первый месяц жизни.
Среди плодов с кардиальной патологией в 6 случаях (12,5 %) было сочетание с хромосомными аберрациями и генетическим заболеванием: синдромом Дауна – 4 случая, синдромом Ди Джорджи – один случай; также наблюдался один случай редкой генетической патологии (синдром Холта – Орама, наследственное заболевание, сочетание порока сердца с отсутствием первого пальца на кистях обеих рук до аплазии лучевой кости).
После родов успешно прооперированы были двое детей с тетрадой Фалло, также двое детей со стенозом клапана легочной артерии. Один ребенок с диагнозом двойного отхождения сосудов от правого желудочка благополучно оперирован в Турции. К сожалению, в случаях транспозиции магистральных сосудов и единственного желудочка детям было отказано в проведении оперативного лечения как местными, так и зарубежными хирургами в связи с высоким риском смерти сразу после операции.
Приводим наблюдение о несовпадении нашего диагноза с эхокардиографическим заключением после родов. В нашем центре при плановом обследовании на 30 неделе беременности был установлен диагноз коарктации аорты с дефектом межжелудочковой перегородки. В родильном доме при проведении эхокардиографии был выявлен только дефект мышечной перегородки, коарктация была исключена. Ребенок умер через 2 недели после родов, от вскрытия родители отказались. Мы пришли к выводу, что портативные ультразвуковые аппараты, на которых обследуют детей в родильных домах, могут вызывать сложности визуализации и неполную диагностику, что связано с менее четким изображением, чем на стационарном оборудовании.
По данным литературы, внутриутробная диагностика пороков сердца возможна с 13 недели беременности, в частности таких сложных для выявления ВПС, как атрезия легочной артерии [9]. В нашем центре плод с атрезией легочной артерии и дефектом межжелудочковой перегородки был выявлен в 18 недель беременности. Данная беременность была прервана в связи с неблагоприятным прогнозом для жизни. Патологоанатомическое вскрытие подтвердило диагноз. По нашему мнению, 18 неделя беременности (второе скрининговое обследование) является наиболее ранним сроком для точного определения структуры порока. Связано это с тем, что магистральные сосуды сердца плода плохо видны в сроки первого скринингового обследования, что может приводить к неточной диагностике.
Из 48 случаев с ВПС 16 плодов (33,3 %) имели множественные пороки развития, причем такие изменения, как гидроцефалия, укорочение трубчатых костей, выявлялись на сроках после 30 недель. А случаи атрезии ануса были обнаружены только при рождении детей. Таким образом, выявление любых изменений в сердце является поводом для обязательного повторного ультразвукового обследования в сроки 25–30 недель (таблица).
Сочетание врожденных пороков сердца с аномалиями других органов
Название порока сердца
Сочетание ВПС с патологией других органов
Сроки выявления ВПС (неделя беременности), исход
1. Перимембранозный дефект межжелудочковой перегородки