Триперекись ацетона что это такое
Пероксид ацетона
| Пероксид ацетона | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | 3,3,6,6-тетраметил-1,2,4,5-тетраоксан (димер) 3,3,6,6,9,9-гексаметил-1,2,4, 5,7,8-гексаоксациклононан (тример) |
| Химическая формула | C6H12O4 (димер) C9H18O6 (тример) |
| Физические свойства | |
| Молярная масса | (димер) 148,157 г/моль (тример) 222,24 г/моль |
| Термические свойства | |
| Температура плавления | 91 °C |
| Температура кипения | 97–160 °C |
| Классификация | |
| Рег. номер CAS | 17088-37-8 |
| SMILES | CC1(OOC(OOC(OO1)(C)C)(C)C)C |
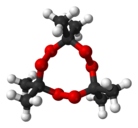
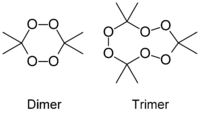
Пероксид ацетона (перекись ацетона, триперекись ацетона, диперекись ацетона, трициклоацетонпероксид, ТА, ДА, ТЦАП, киса, (3,3,6,6,9,9-гексаметил-1,2,4,5,7,8-гексаоксонан)) — инициирующее взрывчатое вещество, впервые получено в 1885 году Вольфенштейном. Существует в виде тримера и димера. Иногда можно встретить утверждения о существовании мономера и полимера, однако достоверные подтверждения этого неизвестны. В большинстве случаев образуется триперекись, иногда с небольшими примесями диперекиси. Чистая диперекись получается лишь при использовании специальных кислот. Часто можно встретить ошибку, когда триперекись называют диперекисью. Название «киса» является жаргонным, произошло, по всей видимости, от «перекись ацетона», или из-за сильной чувствительности к трению («против шерсти лучше не гладить»).
Содержание
Физические свойства
Представляет собой мелкодисперсное вещество, похожее на муку. После многомесячного хранения или перекристаллизации из растворителя образуются крупные прозрачно-белые кристаллы неправильной формы. Вещество практически нерастворимо в воде, растворимо в ацетоне, эфире. Температура плавления триперекиси — 97 °С, диперекиси — 132 °С.
При комнатной температуре улетучивается с разложением, в открытом сосуде большие количества перекиси могут полностью испариться за десятки минут. При хранении даже в приоткрытом сосуде происходит кристаллизация из паров, что ведёт к росту высокочувствительных кристаллов.
Взрывчатые свойства
Скорость детонации при плотности 0,92 г/см³ — 3750 м/с, 1,2 г/см³ — 5290 м/с. Способна к перепрессовке, то есть спрессованная под давлением около 2000 кгс/см² уже горит, а не детонирует.
По бризантности превосходит азид свинца и ГМТД, по инициирующей способности превосходит гремучую ртуть, но уступает ГМТД и азиду свинца.
Инициирующая способность для тетрила 0,09;г, для тротила 0,18;г.
Уравнение взрывчатого разложения:
Небольшие количества на открытой поверхности сгорают большим, объёмным пламенем, с глухим звуком хлопка. В количествах более 10 г и/или запрессованная в бумажный корпус оглушительно детонирует.
Не взаимодействует с большинством металлов, однако свинец является катализатором разложения перекисей и может привести к самоподрыву, поэтому контакт перекисей ацетона с ним опасен. Соли переходных металлов (железо, хром, марганец) также являются катализаторами разложения перекиси ацетона.
Получение
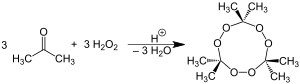
Перекись ацетона получают путём воздействия пероксида водорода на ацетон в кислой среде. Реакция отличается малой требовательностью к условиям. Для получения кислой среды используются разнообразные минеральные кислоты. Как правило, рекомендуется использование соляной кислоты, однако реакция идёт и при использовании азотной, ортофосфорной, серной, надсерной и других кислот. В случае использования серной кислоты образуется триперекись с примесями диперекиси, в случае надсерной кислоты — диперекись. В остальных случаях образуется триперекись ацетона
Применение
C 9 H 18 O 6 (тример)
C 12 H 24 O 8 (тетрамер)
222,24 г / моль (тример)
91 ° C (тример)
17 384 фут / с
3,29 миль в секунду
СОДЕРЖАНИЕ
История
Работа над этой методологией и над различными полученными продуктами была дополнительно исследована в середине 20 века Миласом и Голубовичем.
Химия
Продукт, полученный с использованием соляной кислоты, считается более стабильным, чем продукт, полученный с использованием серной кислоты. Известно, что следы серной кислоты, захваченные внутри образовавшихся кристаллов пероксида ацетона, приводят к нестабильности. Фактически, захваченная серная кислота может вызывать детонацию при температурах до 50 ° C (122 ° F), это наиболее вероятный механизм случайных взрывов пероксида ацетона, которые происходят во время сушки на нагретых поверхностях.
Трипероксид триацетона образуется в 2-пропаноле при длительном стоянии на воздухе.
Для анализа следов ТАТФ можно использовать несколько методов, включая газовую хроматографию / масс-спектрометрию (ГХ / МС), высокоэффективную жидкостную хроматографию / масс-спектрометрию (ВЭЖХ / МС) и ВЭЖХ с постколоночной производной.
Пероксид ацетона растворим в толуоле, хлороформе, ацетоне, дихлорметане и метаноле. Перекристаллизация первичных взрывчатых веществ может давать большие кристаллы, которые самопроизвольно взрываются из-за внутренней деформации.
Промышленное использование
Перекись ацетона используется в качестве отбеливателя муки для отбеливания и «зрелой» муки.
Использование в самодельных взрывных устройствах
Избыточное давление ударной волны ТАТФ составляет 70% от давления ТНТ, импульс положительной фазы составляет 55% от эквивалента ТНТ. ТАТФ при 0,4 г / см 3 имеет примерно одну треть бризантности TNT (1,2 г / см 3 ), измеренной с помощью теста Гесса.
В Европейском Союзе приняты законодательные меры по ограничению продажи концентрированной перекиси водорода до 12% и выше.
Триперекись ацетона что это такое
Что такое перекись ацетона?
Строение молекулы перекиси водорода
Перекись водорода (3% раствор)
Цистерна с перекисью водорода
Перекись водорода проявляет окислительные свойства. Некоторые горючие органические материалы (например, бумага, солома, метанол) при контакте с крепкой перекисью водорода могут воспламеняться. От действия 30% раствора перекиси водорода кожа и волосы человека становятся белыми. Разбавленные водные растворы перекиси водорода гораздо более стабильны. Трехпроцентная перекись водорода продается в аптеках как антисептик.
Другие неорганические перекиси также проявляют окислительные свойства, многие из них довольно неустойчивы и легко отщепляют кислород.
Однако, некоторые неорганические перекиси достаточно стабильны. Например, перекись натрия Na2O2 образуется при горении натрия на воздухе. Данное вещество плавится без разложения при 675°C. Более того: при нагревании оксида натрия Na2O на воздухе образуется пероксид Na2O2.
Если в перекиси водорода Н-О-О-Н заместить один или оба атома водорода на органический радикал R, то мы получим органические гидроперекиси R-О-О-Н и перекиси R-О-О-R соответственно.
Органические гидроперекиси
Органические перекиси
Органические перекиси неустойчивы и легко разлагаются, иногда разложение происходит со взрывом. Например, перекись ацетона и перекись бензоила при нагревании взрываются.
Молекулы органических перекисей способны распадаться, образуя свободные радикалы. Некоторые перекиси используют в промышленности как инициаторы радикальной полимеризации (перекись бензоила, перекись метилэтилкетона).
Органические пероксопроизводные очень разнообразны, в частности, существуют перекиси, которые являются производными карбоновых кислот RC(O)OOH (пероксокислоты или надкислоты), сложных эфиров RC(O)OOR, альдегидов.
Пероксокислоты (надкислоты)
Пероксопроизводные сложных эфиров
Диперекись и триперекись ацетона
В большинстве случаев при осаждении из водных растворов образуется триперекись ацетона, однако, нельзя исключить, что она не содержит примеси диперекиси. Диперекись ацетона получить гораздо сложнее, чем триперекись: для этого необходимо проводить синтез в строго определенных условиях (методика получения диперекиси изложена в приложении ко второй части статьи, однако она дается в основном для ознакомления).
Есть также сообщение о получении тетраперекиси ацетона (ссылка), однако относиться к таким статьям следует с большой осторожностью: много подобных открытий было со временем опровергнуто.
Перекись ацетона представляет собой белое кристаллическое вещество. Практически нерастворима в воде, растворима в ацетоне, эфире. Температура плавления триперекиси 97 °C, диперекиси 132 °C. Даже при комнатной температуре перекись ацетона легко сублимируется.
С другой стороны, перекись ацетона окружена своеобразным ореолом таинственности, в результате находится немало молодых людей, которые хотят познакомиться с этим веществом поближе, не всегда осознавая опасности.
Е929 пищевая добавка
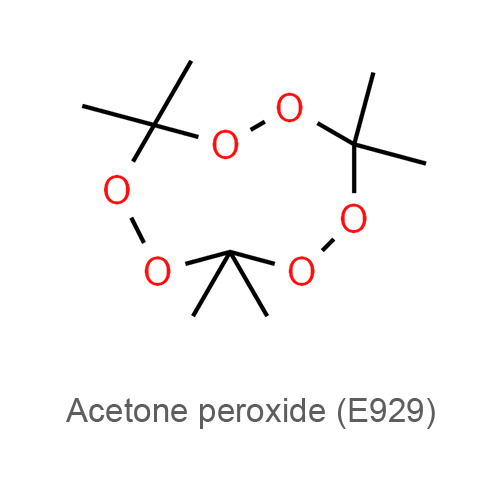
Описание
Пищевая добавка Е929 (пероксид ацетона) — относится к улучшителям муки и хлеба синтетического происхождения, используется в технологических целях в процессе производства пищевых продуктов. Пероксид ацетона — обладает высокими отбеливающими и окислительными свойствами. Внешне выглядит как мелкодисперсный порошок, после длительного хранения — кристаллы правильной формы. Имеет резкий характерный запах, вкус отсутствует. Хорошо растворим в эфире, бензоле, ацетоне, уксусной кислоте, нерастворим в воде.
Не гигроскопичен. При обычных условиях хранения не разлагается; обладает повышенной летучестью, при комнатной температуре испаряется в течение 2 часов; при нагревании с раствором серной кислоты распадается до ацетона и перекиси водорода; устойчива в кислотных и щелочных растворах; не корродирует металлы (исключение — свинец); проявляет окислительные свойства; плавится при температуре 97 °C. Взрывоопасен!
Получают при взаимодействии ацетона с концентрированным пероксидом водорода. Реакция протекает в присутствии минеральной одноосновной кислоты: серной (чаще всего), азотной, соляной. Молекула содержит обычно 2 или 3 пероксидные группы. Легче получить триперекись ацетона, но и она будет содержать димер в качестве примеси.
Польза
Научные данные о пользе применения пищевой добавки Е929 для здоровья человека в настоящий момент отсутствуют. Биологической ценности не представляет.
Вдыхание порошка и паров перекиси ацетона может вызвать отёк слизистых, поражение дыхательных путей.
При работе с перекисью ацетона необходимо соблюдать технику безопасности. Вещество отличается высокой взрывчатой силой: 5 500 кДж/кг (это почти на 20 % выше того же показателя для тринитротолуола, входящего в состав динамита). Сухой порошок может сдетонировать при лёгком нагреве (например, при сушке на батарее отопления) или от искры статического электричества, образующего на одежде.
Применение
Ранее применялся для для отбеливания и улучшения качества хлебопекарной муки. По состоянию на 2019 год пищевая добавка Е929 практически не используется с этой целью, вместо него применяются другие улучшители.
Другие сферы применения: военная промышленность.
Правовой статус
Пищевая добавка Е929 не входит в перечень разрешённых к применению в пищевой промышленности в Российской Федерации, Евросоюзе и большинстве стран мира.
Характеристика
Схема
Поделиться этой страницей
Подробнее по теме
Ознакомьтесь с дополнительной информацией о пищевой добавке E929:
Острое отравление алкоголем
Если человек выпивает слишком много алкоголя, печень не успевает его перерабатывать. Часть этанола остается в крови. Если его концентрация достигает в 3-5 г/л, наступает острое отравление. При превышении этого уровня интоксикация почти всегда приводит к летальному исходу.
Чем быстрее и больше пьет человек, тем выше риск тяжелых последствий. В статистике смертности от отравлений именно на алкоголь приходится 60% случаев. Это связано отчасти с метаболизмом этанола. Его концентрация в крови растет даже после того, как человек перестал пить, почувствовав недомогание. Алкоголь продолжает всасываться через стенки желудка, и состояние становится все более тяжелым.
Как распознать острое отравление спиртным?
Любое, даже легкое опьянение — это набор симптомов интоксикации. У человека начинает шуметь в ушах, зрение и слух искажаются, речь становится путанной, а мышление — затрудненным. Из-за спиртного может появляться тошнота, одышка, проблемы с координацией движений. Все эти проявления опасны, но не критически. Они не угрожают жизни.
Острое отравление этанолом проходит по-другому:
Важно: потеря сознания, внезапное засыпание, при котором пострадавшего не удается разбудить, опасны в сочетании с симптомами и легкого опьянения, и острой интоксикации. Нельзя ждать, пока человек «проспится», это опасно смертью. Нужно срочно вызывать скорую помощь.
Опытные врачи Наркологи. В стационаре или на дому. Круглосуточный выезд по Москве и области. Профессионально, анонимно, безопасно.
При высокой концентрации этанола в крови может развиваться алкогольная кома:
После вывода из комы или снятия острых симптомов могут развиваться осложнения:
При риске осложнений после детоксикации пациента оставляют в стационаре, чтобы контролировать его состояние.
Если есть вероятность отравления не только этанолом, но и другими формами спирта, пострадавшему нужна экстренная медицинская помощь, даже если симптоматика пока слабо выражена. Она может быстро нарастать. Особенно опасны метанол, этиленгликоль, изопропиловый спирт, которые содержатся в технических жидкостях, лосьонах, бытовой химии и т.п. Они могут вызывать остановку дыхания, потерю зрения, снижение артериального давления, рвоту (в том числе с кровью), кому.
Работаем круглосуточно, опытные врачи, 100% анонимно.
Доврачебная помощь
Больше всего смертельных случаев при отравлении алкоголем связано с несвоевременным оказанием медицинской помощи. При подозрении на тяжелую интоксикацию, нужно срочно вызвать врача.
При отравлении алкоголем люди чаще всего умирают из-за нарушений дыхания. Оно связано со скоплением рвотных масс в полости рта, трахее. Если человек не дышит, сипит, хрипит, нужно очистить верхние дыхательные пути. Для этого его кладут на бок, рвотные массы убирают пальцами, не проталкивая их глубже. Если пострадавший без сознания, он должен лежать так, чтобы язык не западал в гортань.
Медицинская помощь
До госпитализации выполняется:
После оказания первичной помощи при остром отравлении этанолом врачи клиники «НаркоДок» рекомендуют госпитализацию в стационар. В условиях клиники продолжают контролировать состояние пациента, лечат его, снимают возможные осложнения интоксикации.