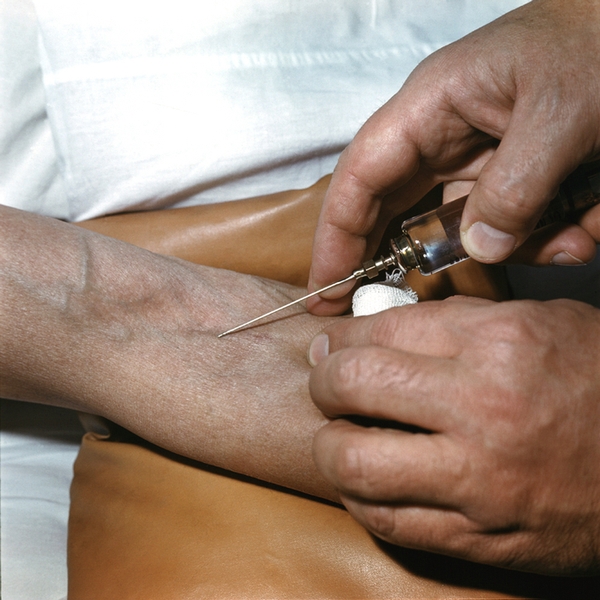
Тромбирование иглы что это
Техника забора крови вакуумной системой
На сегодняшний день вакуумный забор крови является оптимальным для взятия образцов на исследование. Забор крови с помощью шприца или иглы с большим просветом влечет за собой такие нежелательные явления, как гемолиз, тромбирование крови в просвете иглы, несоответствие объемов крови и консерванта и т.п. Поэтому большинство лечебных учреждений предпочитают вакуумный забор крови для своих пациентов.
Вакуумные системы: комплектация и назначение
Стандартная система для вакуумного забора крови состоит из трех компонентов:
Все составляющие системы предназначены только для одноразового использования.
Принцип действия системы: под действием вакуума кровь втягивается в пробирку с реагентом и сразу с ним смешивается. Определенное количество реагента и нужный для исследования объем крови обеспечивают точное соотношение компонентов для исследования.
Со стороны острия для прокалывания пробирки игла снабжена резьбой и защитной резиновой мембраной. Иглы запечатывают в два пластиковых футляра (колпачка) и проклеивают этикеткой для предотвращения их повторного использования. Цветовая кодировка колпачков помогает в выборе диаметра иглы.
Держатели для игл
Держатели, или переходники, предназначаются для безопасного и удобного введения иглы в вену и соединения иглы с пробиркой. Держатель является обязательным компонентом систему вакуумного забора крови для фиксации иглы с вакуумной пробиркой. Резьба держателя совпадает с резьбой иглы для взятия крови
Вакуумные пробирки
Пробирки для вакуумного забора крови изготавливаются из поливинилхлорида. Имеют безопасную крышку с резиновой пробкой. Крышки различаются по цветовой гамме в силу применения для того или иного исследования.
Венопункция
Полезное
Смотреть что такое «Венопункция» в других словарях:
Венопункция — Hans von Gersdorff, Feldbuch der Wundarznei, 1517 Points for blood letting Кровопускание лечебное мероприятие, заключающееся в извлечении некоторого количества (200 500см³) крови при помощи прокола (т. н. венопункция) или разреза вены (реже… … Википедия
венопункция — (venaepunctio; вена + пункция; спн. венепункция) чрескожное введение полой иглы в вену с целью извлечения крови или вливания жидкости в просвет вены … Большой медицинский словарь
венопункция — чрезкожное введение иглы в вену для взятия крови или вливаний. Источник: Медицинская Популярная Энциклопедия … Медицинские термины
ВЕНОПУНКЦИЯ — чрескожное введение иглы в вену для взятия крови или вливания в вену к. л. р ров … Ветеринарный энциклопедический словарь
Венопункция — (venaepunctio) – прокол вены специальной иглой для получения проб крови или введения лекарственных веществ … Словарь терминов по физиологии сельскохозяйственных животных
венопункция открытая — введение в вену толстой трубчатой иглы после обнажения вены оперативным путем и ее перевязки дистальнее места пункции … Большой медицинский словарь
Венепу́нкция — см. Венопункция … Медицинская энциклопедия
Вливание — I Вливание (infusio) парентеральное введение в организм лекарственных растворов, кровезаменителей, крови и ее препаратов. В отличие от инъекции, при которой подкожно, внутривенно или внутримышечно вводят небольшое количество раствора (до 10 20… … Медицинская энциклопедия
Инфузио́нная терапи́я — (лат. infusio вливание, впрыскивание; греч. therapeia лечение) метод восстановления объема и состава внеклеточного и внутриклеточного водного пространства организма с помощью парентерального введения жидкости. Показаниями к И. т. являются дефицит … Медицинская энциклопедия
Кровено́сные сосу́ды — (vasa sanguifera, vaea sanguinea) образуют замкнутую систему, по которой осуществляется транспорт крови от сердца на периферию ко всем органам и тканям и обратно к сердцу. Артерии несут кровь от сердца, а по венам кровь возвращается к сердцу.… … Медицинская энциклопедия
Тромбирование иглы что это
Тромбоэмболии. Возникают при попадании в вену сгустков различной величины, которые могут образоваться в переливаемой крови, эритроцитной массе или разноситься током крови из тромбированных сосудов пациента. Клинически характеризуются появлением симптомов легочного инфаркта. Через некоторое время после трансфузии у больного возникают боли в груди, кровохарканье, лихорадка. Если большой сгусток закупоривает легочную артерию или ее ветвь, наблюдается картина воздушной эмболии. Чаще всего причиной тромбоэмболии является неудачная пункция сосуда, неправильная техника заготовки и хранения крови и ее компонентов. Последние две причины реже способствуют возникновению тромбоэмболии, так как сгустки не могут пройти через иглу. При закупорке иглы следует немедленно прекратить трансфузию и удалить иглу. В качестве терапии применяют стрептазы (стрептодеказа, урокиназа) — активаторы фибринолиза. Их вводят через катетер в легочную артерию для местного воздействия на тромб. Также назначают гепарин внутривенно (24 000—35 000 ЕД в сутки), сердечно-сосудистые и болеутоляющие препараты.
Тромбофлебит. Возникает при многократных пункциях, при длительных вливаниях (более 7—12 ч), при неудачной пункции вены с ее проколом и образованием гематомы, при пункции тромбированного сосуда. Характеризуется уплотнением по ходу вены. Главное правило профилактики этого осложнения — соблюдение асептики при пункции вены.
Обработка места пункции. Оперирующий должен обработать руки (достаточно мытья с мылом), надеть халат, маску, перчатки. Если волосы на теле больного не закрывают доступа к вене, их можно не сбривать. Вначале кожу в месте пункции обрабатывают мьшом или детергентом, растворенным в воде, затем антисептическим препаратом. Далее место обрабатывают спиртовым раствором йода (1—2 %-ным) с последующей обработкой 70 %-ным этиловым спиртом. Кожу очищают, начиная от места пункции, и обрабатывают по направлению от места венепункции круговыми движениями.
При пунктировании глубоких вен применяют местную анестезию (1 %-ный раствор лидокаина вводится в кожу и подкожную клетчатку).
В экстремальных ситуациях оперирующий должен действовать по обстоятельствам в соответствии с реальными возможностями соблюдения стерильности.
Существует несколько приемов, позволяющих облегчить ход венепункции:
1. Наложение жгута способствует лучшему контурированию вен. При этом должна сохраняться артериальная пульсация. Применяется при венепункции поверхностных вен руки, подмышечной ямки.
2. Положение Тренделенбурга — больной лежит на столе, руки вытянуты вдоль туловища, головной конец стола опущен на 15—25°. Это увеличивает венозный приток, облегчает попадание крови в шприц даже при минимальной аспирации и уменьшает опасность воздушной эмболии. Используется при пункции и последующей катетеризации подключичной вены, внутренней яремной вены.
3. Сдавливание вены пальцем выше места пункции для дополнительного контурирования вены. Применяется при доступах к наружной яремной вене.
4. Применение пробы Вальсальвы — больного просят выдохнуть призакрытой голосовой щели, а если проводится управляемое дыхание, производят задержку дыхания на вдохе. Это увеличивает наполнение вены, уменьшает опасность пневмоторакса. Используется при пункции и катетеризации внутренней яремной вены.
Венепункция проводится иглой, отсоединенной от системы. Пункция включает в себя прокол кожи над веной и прокол ее стенки с введением иглы в просвет сосуда (приблизительно 1/2 длины иглы). После поступления из просвета иглы капель крови можно отсоединять канюлю от системы или проводить катетеризацию. При получении проб крови достаточно, чтобы только часть среза иглы находилась в вене и обеспечивала вытекание крови. При внутривенных инъекциях это недопустимо, так как через оставшийся вне просвета сосуда срез иглы вводимый раствор попадет в окружающие ткани. Поэтому при попадании кончика иглы в вену шприц прижимают к коже, что при правильном нахождении среза иглы (повернут вверх) делает безопасным продвижение ее внутрь сосуда, не опасаясь его перфорации.
Если пункция вены произведена с целью вливания каких-либо медикаментозных жидкостей, правильность попадания иглы в сосуд проверяют потягиванием поршня шприца к себе. При правильном попадании иглы струя крови свободно потечет в шприц. Перед пункцией вены следует убедиться, нет ли в шприце с набранным лекарством пузырьков воздуха. Для этого устанавливают шприц строго вертикально иглой вверх и выпускают через иглу воздух и небольшую часть вводимого раствора. При введении лекарства шприц должен быть постоянно прижат к коже, чтобы кончик иглы находился близко к ней. В этом случае попадание раствора под кожу можно сразу заметить.
Оценка тяжести кровопотери в хирургической практике. Часть II
Клиническая оценка тяжести кровопотери является исторически самым ранним способом определения нарушений постгеморрагических нарушений гомеостаза, но в настоящее время – самым распространенным способом. Описание основополагающих клинических признаков травматического повреждения с острой кровопотерей мы находим уже в дневниках Н. И. Пирогова, относящихся к периоду Крымской кампании 1854 года: «Лежит такой окоченелый на перевязочном пункте неподвижно; он не кричит, не вопит, не жалуется, не принимает ни в чем участия и ничего не требует; тело его холодно, лицо бледно, как у трупа; взгляд неподвижен и обращен вдаль; пульс как нитка, едва заметен под пальцем и с частыми перемежками. На вопросы окоченелый или вовсе не отвечает, или только про себя, чуть слышным шепотом; дыхание тоже едва приметно. ». Клиническая характеристика кровопотери, основанная на оценке уровня сознания, окраски и температуры кожных покровов, тонуса периферических вен, частоты пульса и дыхания, актуальна и в настоящее время.
Скрининговым методом оценки тяжести кровопотери является предложенный в 1967 году Алговером и Бури шоковый индекс, представляющий собой отношение частоты сердечных сокращений к систоличекому артериальному давлению. Чем выше индекс, тем массивнее кровопотеряе и хуже прогноз. В норме индекс равен 0, 5. Нарастание индекса Альговера свидетельствует о прогрессировании тяжести кровопотери:
Величина
шокового индекса
Ориентировочный
дефицит ОЦК
0, 9 – 1, 2
1, 3 – 1, 4
В связи с этим, все большему числу клиницистов представляются более физиологически обоснованными и клинически значимыми классификации кровопотери, основанные на клинически определяемой степени резистентности к ней организма. Именно уровень компенсации перенесенной кровопотери представляет несомненный практический интерес, ведь все последующие лечебные мероприятия направлены на стабилизацию функций организма, в той или иной степени нарушенных при кровотечении. Несомненно, к тому же, что в экстренной ситуации целесообразной и практически применимой является такая система оценки кровопотери, которая бы на основании минимального количества параметров позволяла адекватно и быстро определять тяжесть кровопотери не только в стационаре, но уже и на догоспитальных этапах медицинской помощи. Так, Н. А. Яицкий и соавт. (2002) разделяют острую кровопотерю на три степени только на основании величин АДсист и ЧСС (табл. 1)
Степень кровопотери
Лежа на спине
Сидя
АДсист, мм Hg
ЧСС, в мин
АДсист, мм Hg
ЧСС, в мин
Легкая
Средняя
Тяжелая
Являясь отражением состояния макроциркуляции и, весьма ориентировочно, состояния микроциркуляции, измерение АД может служит быстрым методом оценки гемодинамики и проведения простого ее мониторинга.
В современной клинической практике наибольшее распространение получили методы оценки тяжести кровопотери, имеющие в своей основе анализ комплекса клинических и рутинных лабораторных критериев.
В 1982 году Американская коллегия хирургов на основании интегрального анализа десятков тысяч случаев острых кровотечений различной этиологии, предложила дифференцировать кровопотерю на 4 класса кровотечений в зависимости от клинической симптоматики (по P. L. Marino, 1998):
класс I – при этом клинические симптомы отсутствуют или имеется тахикардия в покое, прежде всего в положении стоя; ортостатической тахикардия считается тогда, когда ЧСС увеличивается не менее, чем 20 ударов в 1 минуту, при переходе из горизонтального положения в вертикальное (соответствует потере 15% объема циркулирующей крови или менее) ;
класс II – основным клиническим признаком его является ортостатическая гипотензия или снижение АД не менее, чем на 15 мм. рт. ст при переходе из горизонтального положения в вертикальное, в положении лежа АД нормальное или несколько снижено, диурез сохранен (соответствует потере от 20 до 25% ОЦК) ;
класс III – проявляется гипотензией в положении лежа на спине, олигурией менее 400 мл/сутки (соответствует потере от 30 до 40% ОЦК) ;
класс IV – проявляется коллапсом и нарушением сознания до комы (потеря более 40% ОЦК).
В современной рациональной трансфузиологии основными ориентирами оценки тяжести кровопотери также являются адекватное сознание, достаточный диурез (> 0, 5 мл/кг/час), отсутствие гипервентиляции, показатели гемокоагуляции, динамика центрального венозного, пульсового и среднего динамического давления, изменение артерио-венозной разницы по кислороду (А. П. Зильбер, 1999; В. С. Ярочкин 1997, 2004).
Одной из последних отечественных классификаций острой кровопотери предложена А. И. Воробьевым (2002). Автор подчеркивает, что именно клинические, а не лабораторные показатели должны являться определяющими в оценке тяжести кровопотери (табл. 2).
Показатель
Степень тяжести
Пульс, в мин.
Пульсовое давление
Нормальное или повышено
ЧДД, в мин.
Почасовой диурез, мл
Состояние ЦНС
Объем кровопотери, мл
(% ОЦК)
В повседневной клинической практике мы используем классификацию тяжести кровопотери, основанную как на оценке клинических критериев (уровень сознания, признаки периферической дисциркуляции, АД, ЧСС, ЧДД, ортостатическая гипотензия, диурез), так и на оценке основополагающих показателей картины красной крови – величин гемоглобина и гематокрита (В. К. Гостищев, М. А. Евсеев, 2005). Классификация различает четыре степени тяжести острой кровопотери:
I степень (легкая кровопотеря) – характерные клинические симптомы отсутствуют, может иметь место ортостатическая тахикардия, уровень гемоглобина выше 100 г/л, гематокрит – не менее 40%. Отражает величину дефицита ОЦК до 15%.
II степень (кровопотеря средней тяжести) – из клинических симптомов определяется ортостатическая гипотензия со снижением АД более чем на 15 мм рт. ст. и ортостатическая тахикардия с увеличением ЧСС более чем на 20 ударов в минуту, уровень гемоглобина в пределах 80 – 100 г/л, гематокрит – в пределах 30 – 40%. Отражает величину дефицита ОЦК 15 – 25%.
III степень (тяжелая кровопотеря) – клинически определяются признаки периферической дисциркуляции (дистальные отделы конечностей холодные наощупь, выраженная бледность кожи и слизистых), гипотония (АДсист находится в пределах 80 – 100 мм рт. ст. ), тахикардия (ЧСС более 100 в минуту), тахипноэ (ЧДД более 25 в минуту), явления ортостатического коллапса, диурез снижен (менее 20 мл/час), уровень гемоглобина находится в пределах 60 – 80 г/л, гематокрит – в пределах 20 – 30%. Отражает величину дефицита ОЦК 25 – 35%.
IV степень (кровопотеря крайней степени тяжести) – из клинических симптомов характерными являются нарушение сознания, глубокая гипотония (АДсист менее 80 мм рт. ст. ), выраженные тахикардия (ЧСС более 120 в минуту) и тахипноэ (ЧДД более 30 в минуту), признаки периферической дисциркуляции, анурия; уровень гемоглобина находится ниже 60 г/л, гематокрита – 20%. Отражает величину дефицита ОЦК больше 35%.
В основу данной классификации положена оценка наиболее значимых клинических симптомов, отражающих реакцию организма на кровопотерю. Определение уровня гемоглобина и гематокрита представляется также весьма важным в оценке тяжести кровопотери, особенно при III и IV степени тяжести, поскольку в данной ситуации гемический компонент постгеморрагической гипоксии становится весьма существенным. Кроме того, уровень гемоглобина по-прежнему является решающим критерием для определения показаний для трансфузии эритроцитарной массы.
Следует заметить, что срок от появления первых симптомов кровотечения и тем более от его действительного начала, составляющий, как правило, не менее суток, делает показатели гемоглобина и гематокрита вполне реальными в силу успевшей развивиться за данный период гемодилюции. В случае несоответствия клинических критериев показателям гемоглобина и гематокрита оценку тяжести кровопотери следует проводить, учитывая показатели, в наибольшей степени отличающиеся от нормальных значений.
Предложенная классификация тяжести кровопотери представляется нам приемлемой и удобной именно для клиники ургентной хирургии, как минимум, по двум причинам. Во-первых, оценка кровопотери не требует проведения сложных специальных исследований. Во-вторых, возможность определения степени кровопотери сразу же в приемном отделении позволяет решить вопрос о необходимости начала инфузионной терапии и госпитализации пациента в отделение интенсивной терапии.
По нашим наблюдениям из 1204 пациентов с ОГДЯК у большей части (35, 1%) пациентов при госпитализации была диагностирована кровопотеря II степени. С кровопотерей III и I степеней были госпитализированы соответственно 31, 2% и 24, 8% пациентов. Доля пациентов с кровопотерей IV степени составила 8, 9%. Доля пациентов с кровопотерей I степени с увеличением возраста пациентов имела тенденцию к снижению с 33, 5% у больных моложе 45 лет до 2, 3% у больных старческого возраста, что может быть объяснено уменьшающейся с возрастом резистентностью организма к кровопотере и возникновением выраженной клинической манифестации при сравнительно меньших темпах геморрагии. Напротив, массивная кровопотеря для больных пожилого и старческого возраста приобретает характер фатальной уже на догоспитальном этапе, о чем свидетельствует снижение доли больных с кровопотерей III и IV степеней в возрастных группах 60 – 74 лет и старше 75 лет.
Среди больных с кровопотерей I и II ст. наибольший удельный вес имели пациенты моложе 45 лет. Доля больных в возрасте 45 – 59 лет, составлявшая при кровопотере I ст. 31, 4%, достигает 40, 3% при кровопотере III ст. Данный возрастной контингент составлял практически половину больных с кровопотерей IV ст. Доля больных 60 – 74 лет достигает максимума при кровопотере II степени и уменьшается при усугублении тяжести кровопотери. Аналогичная картина распределения отмечается и у больных старческого возраста: 15, 9% среди больных со II ст. кровопотери и совсем незначительная среди больных с III (7, 5%) и IV (5, 5%) ст.
Оценка нарушений системы гемостаза у больных с ОГДЯК. Помимо определения тяжести кровопотери принципиально важной задачей диагностики у пациентов с гастродуоденальными язвенными кровотечениями является количественная и качественная оценка нарушений системы гемостаза, поскольку расстройства гемокоагуляции являются важнейшим патогенетическим звеном синдрома острой массивной кровопотери, а их адекватная и своевременная коррекция – обязательным компонентом заместительной терапии. А. И. Воробьев и соавт. (2001) подчеркивают, что очень часто острая массивная кровопотеря происходит у больных с исходно существующими нарушениями в системе свертывания крови. Наиболее часто эти нарушения проявляются формированием гиперкоагуляционного синдрома, нередко определяющего тяжесть течения синдрома острой массивной кровопотери, трансфузиологическую тактику ее восполнения и предупреждения развития острого ДВС-синдрома.
Гиперкоагуляционный синдром характеризуется определенными клиническими проявлениями и лабораторными признаками повышенной готовности крови к свертыванию при отсутствии тромбозов. Общее состояние при гиперкоагуляционном синдроме чаще удовлетворительное, больные могут отмечать чувство «тяжести в голове» и головную боль, быструю утомляемость, слабость. Кровь при заборе из вены сворачивается прямо в игле, места венепункции легко тромбируются. Несмотря на то, что кровяной сгусток в пробирке формируется быстро, он рыхлый и нестойкий; отмечаются укорочение времени свертывания крови по Ли-Уайту и АЧТВ, повышены агрегационные показатели тромбоцитов, удлинен фибринолиз.
Принято считать, что массивная кровопотеря, сопровождающаяся выраженными нарушениями гемодинамики с расстройствами периферического кровотока, практически всегда сопровождается появлением гиперкоагуляционной фазы ДВС-синдрома. Гиперкоагуляционная фаза ДВС-синдрома часто бывает весьма скоротечной и не диагностируется. Тем не менее, при данной фазе ДВС-синдрома признаки гиперкоагуляции выражены весьма отчетливо: укорочены АЧТВ, протромбиновое время, снижены уровень фибриногена и число тромбоцитов. Скорость образования кровяного сгустка в пробирке по-прежнему ускорено, но он остается рыхлым и нестойким.
Для гипокоагуляционной фазы ДВС-синдрома характерны с одной стороны лабораторные маркеры коагулопатии потребления а с другой – наличием признаков гипокоагуляции и диффузного геморрагического диатеза (кровоточивость гематомно-петехиального типа). Приводим основные лабораторные и клинические признаки гиперкоагуляционного синдрома и фаз ДВС-синдрома (табл. 3).
Форма нарушения гемокоагуляции
Лабораторные и клинические признаки
Гиперкоагуляционный синдром
Лабораторные признаки: укорочение АЧТВ, протромбинового времени; повышение активности тромбоцитов; снижение активности фибринолиза.
Клинические проявления: тромбирование иглы при венепункции, быстрое формирование рыхлого и нестойкого кровяного сгустка в пробирке.
Гиперкоагуляционная фаза ДВС-синдрома
Лабораторные признаки: укорочение АЧТВ, протромбинового времени; повышение активности тромбоцитов при сниженном их количестве; снижение уровня фибриногена, АТ III, протеина С, активности фибринолиза.
Клинические проявления: быстрое тромбирование иглы при венепункции, появлене признаков полиорганной недостаточности.
Гипокоагуляционная фаза ДВС-синдрома
Лабораторные признаки: удлинение АЧТВ, протромбинового времени, снижение количества и активности тромбоцитов; снижение уровня фибриногена, факторов свертывания, АТ III, протеина С; ускорение фибринолиза; резкое повышение уровня продуктов деградации фибрина, D-димеров.
Клинические проявления: трудноконтролируемая диффузная кровоточивость, развернутая картина полиорганной недостаточности.
Статья добавлена 2 апреля 2016 г.
Эндоскопический гемостаз при гастро-эзофагеальных кровотечениях
Все способы эндоскопического гемостаза можно разделить на три основные группы: физические, механические и медикаментозны. Причем они могут применяться как для остановки продолжающегося кровотечения, так и профилактики его рецидива.
К физическим методам относят: диатермо-электрокоагуляцию (моно- и биполярную, гидро-диатермокоагуляцию) ; термокоагуляцию (криокоагуляцию, термо-каутеризацию) ; лазерную фотокоагуляцию; аргоноплазменную коагуляцию; радиоволновую коагуляцию.
К механическим методам относят: инъекции физиологического раствора; клипирование эндоскопическими клипсами; лигирование эластичными кольцами и эндоскопическими петлями; пери- или эндоваскулярное введение медицинского клея.
К комбинированному механическому методу можно отнести: инъекции эпинефрина/адреналина, физиологического раствора и прокоагулянтов (дицинона, адроксона, контрикала).
Характеристика основных способов эндоскопического гемостаза.
Методы
Основной механизм действия
Диатермоэлектрокоагуляци я (монополярная, биполярная, мультиполярная, гидродиатермоэлектрокоагуляция)
Заваривание, коагуляция кровоточащего сосуда, стимуляция и создание условий для тромбообразования
Инфильтрационный (инъекция физиологического раствора, медицинского клея)
Сдавление кровоточащего сосуда и создание условий для тромбообразования
Комбинированный инфильтрационный (инъекции физиологического раствора,
Сдавление кровоточащего сосуда + вазоконстрикция +
Физические методыэндоскопического гемостаза давно и достаточно широко используются в клинической практике. К ним относятся: диатермоэлектрокоагуляция (монополярная, биполярная, мультиполярная, гидродиатермоэлектрокоагуляция), термокоагуляция (термокаутеризация, криокоагуляция), лазерная фотокоагуляция, аргоноплазменная коагуляция, радиоволновая коагуляция. Основной механизм их действия заключается в заваривании кровоточащего сосуда, стимуляции и создании условий для тромбообразования. Эффективность физических методов эндоскопического гемостаза составляет 72-97%.
Область применения: кровотечение из хронических и острых гастродуоденальных язв, ангиодисплазий слизистой оболочки, кровоточащих полипов и опухолей, разрывов слизистой оболочки.
Диатермоэлектрокоагуляция— один из наиболее часто применяемых, эффективных и доступных способов эндоскопического гемостаза. При использовании этого метода гемостаз удается достичь у 72-85% больных. Различают монополярную, биполярную и мультиполярную коагуляцию.
Монополярную коагуляцию рекомендуют применять при обширных опухолевых поражениях, когда опасность перфорации небольшая в связи с инфильтрацией желудочной стенки опухолью, а площадь кровоточащей поверхности довольно велика.
Биполярный метод коагуляции заключается в поверхностном распространении тока между двумя электродами одного диатермо- зонда и является более щадящим методом. Этот метод показан при кровотечениях из острых язв и эрозий, других поражениях, при которых отсутствуют выраженные рубцовые изменения тканей, может использоваться для гемостаза при глубоких разрывах слизистой оболочки кардии, когда неповрежденной может оставаться лишь серозная оболочка, и велика опасность перфорации.
Мультиполярная коагуляция совмещает в себе достоинства монополярной и биполярной методик. При этом методе коагуляции подвергается обширная площадь при неглубоком распространении тока.
Оснащение: аппарат ЭХВЧ, диатермозонды для моно-, би- и мультиполярной коагуляции, а также гидродиатермоэлектрокоагуляции.
Гидродиатермокоагуляция (коагуляция по струе воды) лишена негативных сторон данного метода. Мощность воздействия при этом способе коагуляции значительно меньше, однако меньше и повреждающее воздействие. В связи с этим метод используется для профилактики рецидива кровотечения. Некоторые авторы рекомендуют предварительно заполнить кратер дефекта водой, а затем, погрузив активную часть электрода в жидкость, выполнить электрокоагуляцию короткими импульсами по 2-3 сек.
Осложнения. Специфическим осложнением коагуляции источника кровотечения током ВЧ является перфорация полого органа, которая наблюдается у 0, 3-0, 9% больных. Вероятность развития перфорации зависит от характера источника кровотечения, способа диатермокоагуляции, мощности тока ВЧ, продолжительности воздействия, соблюдения методики вмешательства.
Термокоагуляцияявляется более безопасным способом, нежели электрокоагуляция и может использоваться в случаях, когда электрокоагуляция неэффективна или противопоказана (кровотечение из опухоли, выстоящий сосуд в дне язвы, беременность, наличие водителя ритма и т. д. ). Высокоэффективна термокоагуляция для профилактики рецидива кровотечения. Термокоагуляция может осуществляться с помощью высокой температуры — термокаутеризация и низкой — криокоагуляция (криоэлектрокоагуляция).
Термокаутеризация производится термозондом, который состоит из покрытого тефлоном полого алюминиевого цилиндра с внутренней нагревающейся катушкой. Термоэлектрическое устройство на конце зонда поддерживает постоянную температуру. В противоположность диатермоэлектрокоагуляции, механизм коагуляции ткани заключается в прямой передаче тепла, путем непосредственного контакта нагревательного элемента зонда с источником кровотечения.
Оснащение: устройство для термокаутеризации (HPU «Olympus», Япония), термозонд.
Криоэлектрокоагуляция — способ эндоскопического гемостаза при помощи низких температур и токов ВЧ. Оснащение: криоэлектрокоагулятор, криозонд.
Коагуляция с помощью низкой температуры может осуществляться парами хлорэтила через промывочную трубку или хладоном через специальный криозонд с помощью аппарата криоэлектрокоагуляции. При этом слизистая оболочка охлаждается до температуры — 28°С. Способ более эффективен при паренхиматозных кровотечениях, менее — при струйном кровотечении «средней интенсивности». Быстрое замораживание и механи¬ческая очистка зоны кровотечения позволяют кратковременно остановить кровотечение на 60-90 сек.
Лазерная фотокоагуляция. Лазерный гемостаз является одним из наиболее эффективных способов эндоскопического гемостаза, но и, пожалуй, самым дорогостоящим. С его помощью удается остановить кровотечение у 70-94% больных.
Техника выполнения. Перед использованием лазерной фотокоагуляции необходимо промыть желудок «ледяной» водой, так как кровь и сгустки поглощают энергию лазера, в результате резко снижается эффективность коагуляции. Одним из непременных условий успешной лазерной фотокоагуляции является «удобное» расположение источника кровотечения. Лазерный луч должен попадать на ис¬точник под углом, близким к 90 гр. Фотокоагуляция осуществляется кратковременными импульсами по 1-3 сек, до остановки кровотечения
В настоящее время разработаны полупроводниковые импульсные лазеры мощностью до 25 Вт, предназначенные для эндоскопии и лишенные множества недостатков своих предшественников (Diomed, UK). При этом применяются как дистанционный, так и контактный способы гемостаза. В последнем случае необходимы специальные сапфировые наконечники для контактного гемостаза.
Техника выполнения. Принцип работы аппарата основан на создании аргоноплазменной струи с температурой до 1200° на дистальном конце используемого инструмента. Электрический ток высокой частоты создает пробой воздуха (электрическую искру), а подаваемый аргон, обдувая иглу электрода, создает плазменную высокотемпературную струю.
Для выполнения аргоноплазменной коагуляции через иструментальный канал эндоскопа проводят специальный коагуляционный зонд с наружным диаметром 2, 3 мм, соединенный с аргоноплазменным коагулятором. Дистальный конец зонда располагают в 5-10 мм от конца эндоскопа и в 5-8 мм от источника кровотечения ипроизводят аргоноплазменную коагуляцию поверхности источника кровотечения 4-5 импульсами по нескольку секунд каждый до достижения гемостаза, что определяется визуально.
Радиоволновая коагуляция— новый, перспективный и пока еще редко применяемый метод, разработанный фирмой «Ellman International» (США), основан на воздействии электромагнит¬ых колебаний при частоте 3, 8-4, 0 МГц прицельно на источник кровотечения. Техника радиохирургии полностью исключает ожог пациента. Высокочастотная энергия концентрируется на кончике электрода, и хотя сам электрод не нагревается, сильно сконцентрированная энергия повышает молекулярную энергию внутри каждой клетки и разрушает ее, вызывая нагревание ткани и фактически испаряя клетку. Более того, при применении радиоволновой коагуляции исключается эффект «приваривания» ткани к электроду.
Осложнения. Серьезных осложнений при применении мето¬да не выявлено. Можно сформулировать два основных противопо¬казания к его применению — наличие у пациента кардиостимуля¬тора и несогласие пациента на проведение вмешательства.
Область применения: продолжающееся кровотечение из хронических и острых гастродуоденальных язв, ангиодисплазий слизистой оболочки, разрывов слизистой оболочки, кровотечение из варикозно расширенных вен пищевода.
Инфильтрационный методявляется достаточно эффективным, простым и самым доступным из всех методов эндоскопического гемостаза, независимо от локализации как источника кровотечения, так и сосуда в дефекте. Остановка кровотечения происходит за счет механического сдавления кровоточащего сосуда, что способствует усилению местного тромбообразования. Эффективность остановки продолжающегося кровотечения при его применении составляет 87-96%.
Оборудование. Для выполнения инфильтрационного гемостаза используют эндоскопические инъекторы различных фирм. Принципиально инъектор представляет собой тефлоновый эндоскопический катетер с разъемом для подсоединения шприца на проксимальном конце и иглой до 3-4 мм длиной на дистальном конце. Как правило, инъектор с иглой заключен в тефлоновую оболочку, либо в металлическую оплетку, во время инъекции, игла выдвигается из оболочки.
Техника инфильтрационного гемостаза заключается в том, что игла эндоскопического инъектора любой модификации вкалывается в области кровоточащего сосуда как можно глубже. Затем вводится физиологический раствор в количестве 20-300 мл. Обычно достаточно 20-60 мл раствора для полного гемостаза или резкого уменьшения интенсивности кровотечения. При аррозии крупного сосуда в дне язвенного дефекта способ используют для временного гемостаза в комплексе предоперационной подготовки. Современная эндоскопия предусматривает выполнение инфильтрационного гемостаза с одновременной мультиполярной коагуляцией или другими физическими методами гемостаза.
Вместо физиологического раствора в область кровоточащего сосуда или непосредственно в него могут вводиться медицинские клеи. При этом клеевая инфильтрация, как правило, требует меньшего количества раствора и большего труда для его введения вследствие большей вязкости.
Комбинированный инфильтрационный метод включает в себя элементы механического метода (инъекции физиологического раствора) и медикаментозного (инъекции эпинефрина/адреналина) с добавлением в вводимый раствор прокоагулянтов (дицинона, адроксона, контрикала). Таким образом, наряду с вазоконстрикцией (эпи- нефрин/адреналин) создаются более благоприятные условия для образования тромба (прокоагулянты). Однако основным компонентом метода является сдавление (компрессия) кровоточащего сосуда за счет введения жидкости. Техника комбинированного инфильтрационного метода гемостаза практически ничем не отличается от классического инфильтрационного.
Чаще используются инъекции 1 мл 0, 1% адреналина + 2 мл этамзилата/дицинона + 1 мл адроксона + 5 мл физраствора в одном шприце и 10000 ед. контрикала на 2 мл физраствора во втором шприце. При необходимости большего объема инъецируемой жидкости дополнительно вводитсяфизиологический раствор.
Клипирование. Метод используются при видимом сосуде в дне язвы, глубоких разрывах слизистой оболочки кардиального отдела желудка и абдоминального отдела пищевода (синдром Маллори-Вейсса), кровоточащих острых язвах, ангиодисплазиях, изъзвлениях Дьелафуа. Клипирование может быть использовано при кровотечении из варикозно расширенных вен пищевода.
Устройства для установки клипс отличаются длиной (165-230 см) и диаметром, соответствующим диаметру инструментального канала эндоскопа (2, 8 или 3, 2 мм). Механизм вращения устройства позволяет ориентировать клипсу в нужном направлении. Клипсы (Hemoclip; Olympus) бывают различной длины (короткие, стандар¬тные, длинные) и наклона (90°, 130°). В устройстве эндоскопического клипирования TRICLIP (Wilson Cook) применяются трехзубчатые клипсы. Преимуществами этого устройства являются более удобный захват тканей и клипирование, наличие специального промывочного канала, позволяющего отмывать операционное поле для лучшей ориентации и визуализации источника кровотечения. Данное устройство устроено так, что может принимать любой угол наклона без необходимости его вращения.
Метод клипирования может быть применим только в случае удобного расположения источника кровотечения и видимом кровоточащем сосуде. Попытки клипирования «вслепую», в лучшем случае неэффективны, в худшем — приводят к усилению кровотечения. Велика опасность перфорации органа при неаккуратном использовании метода. Примерно у 27% больных использование эндоклипс невозможно.
Лигирование, как метод эндоскопического гемостаза, применяется, в основном, при кровотечении из варикозно расширенных вен пищевода.
Техника лигирования латексными кольцами. Эндоскоп проводится в пищевод, визуализируется кровоточащий варикозный узел. После плотного прижатия дистального конца эндоскопа к слизистой оболочке создается разрежение путем аспирации воздуха из замкнутого пространства перед варикозным узлом, при этом узел втягивается в полость цилиндра. После этого, поворотом ручки «от себя» сбрасывают кольцо, которое сдавливает узел у основания. В момент сбрасывания ощущается ослабление нити, при этом лигированый узел синеет. В зависимости от выраженности варикозного расширения вен используют 6-8 колец за сеанс.
В первые сутки после вмешательства больным рекомендуют голод, назначают ненаркотические анальгетики, антисекреторные препараты. Со вторых суток рекомендуют частый, дробный прием прохладной пищи на фон приема антисекреторных препаратов. Щадящую диету и антисекреторную терапию рекомендуют применять в течение 2-3 недель до полного отторжения лигированых вен и эпителизации эрозий. Болевой синдром купируется обычно к 3-7 суткам.
Лигирование варикозных узлов это механический способ эндоскопического гемостаза. При этом, в отличие от склерозирования варикозно расширенных вен, в кровоток не поступает каких-либо химических препаратов и в связи с этим не наблюдается серьезных системных осложнений. Вместе с тем в ранние сроки после лигирования отмечаются транзиторные боли и дисфагия, что связано с натяжением тканей и сужением просвета пищевода лигироваными узлами. В период 7-14 суток, когда происходит отторжение некротизированых узлов, возможно кровотечение из образовавшейся язвы. Значительно чаще кровотечение возобновляется в связи с соскальзыванием латексного кольца с основания варикозного узла.
Все рассмотренные методы эндоскопического воздействия на источник кровотечения могут применяться изолированно, как самостоятельные методы. Однако, чаще всего, приходится применять комбинацию методов. Опыт показывает, что именно сочетание методов дает самый высокий процент остановки продолжающегося кровотечения, наиболее эффективно оно и для профилактики его рецидива.
Медикаментозные методыявляются эффективными, экономически и технически доступными из всех эндохирургических методов. Их применение не зависит от характера, локализации источника кровотечения и локализации самого сосуда. Область применения: кровотечение из хронических и острых гастродуоденальных язв, ангиодисплазий слизистой оболочки, кровоточащих полипов, разрывов слизистой оболочки, варикозно расширенных вен пищевода. Перивазальное введение эпинефрина/адреналина предусматривает введение препарата непосредственно в область кровоточащего сосуда, что способствует вазоконстрикции в результате чего создаются более благоприятные условия для формирования тромба. Наряду с этим метод сочетает в себе и элементы механического гемостаза.
Техника инъекционного гемостаза проста, но требует опыта и навыков его выполнения. Базовым методом эндоскопического гемостаза является инъекция 1 мл эпинефрина (адреналина). Для инъекций используют смесь раствора адреналина и физиологического раствора в соотношении 1: 5 в количестве от 6 мл. При обнаружении источника кровотечения, вначале производят 2-3 инъекции перивазально как можно ближе к кровоточащему сосуду, а затем дополняют их инфильтрацией физиологического раствора дна и краев дефекта.
Эндоскопическое склерозирование варикозно расширенных вен пищевода предусматривает введение склерозирующего агента с помощью инъектора, проведенного через инструментальный канал эндоскопа. Применяются два способа введения склерозанта:
— интравазальный — препарат вводится непосредственно в просвет вены. Действие склерозанта основано на ожоге эндотелия и формировании внутрисосудистого тромба, утолщении интимы вследствие воспалительной реакции и последующим развитием соединительной ткани на месте варикозного узла;
— паравазальный — склерозирующее вещество вводится в под- слизистый слой. Паравазальное введение склерозанта вызывает отек и сдавление варикозных узлов, а развившийся вслед за этим воспалительный процесс приводит к полной замене подслизисто- го слоя соединительной тканью.
Для эндоскопического склерозирования варикозных вен пищевода и кардии используют эндоскопы и набор специальных игл-катетеров. Для интравазального тромбирования чаще используется 10-15 мл 1-3% раствора тромбовара (Франция), действующим началом которого служит тетрадецилсульфат натрия. Склерозирующее действие этого препарата основано на ожоге эндотелия вен и образовании тромба в варикозном узле в ответ на воспаление. Обычно 1мл тромбовара достаточно для склерозирования вены на протяжении 1-1, 5 см.
Для паравазального склерозирования варикозных вен пищевода используется 20-30 мл 0, 5-1, 0% раствора этоксисклерола (Германия), действующим началом которого является полидоканол. При паравазальном склерозировании решающая роль принадлежит созданию инфильтрата вокруг вены и сдавлению варикозного узла. Облитерация сосуда и образование фиброзного рубца происходит к 7-10 суткам.
Считается, что склерозирующий эффект зависит скорее от концентрации и количества, чем от вида склерозанта. Часто ин¬екция небольшого количества склерозанта вызывает остановку кровотечения. Однако, этот эффект нестоек и чреват рецидивом кровотечения. Введение же большого количества склерозанта приводит к быстрой и стойкой облитерации, но увеличивает количество осложнений.
После эндоскопического склерозирования рекомендуют голод и постельный режим, проводят коррекцию нарушений гомеостаза, применяют зонд-обтуратор, препараты, способствующие снижению портального давления, а также антисекреторные и обволакивающие средства. Со вторых суток разрешают прием щадящей пищи.
Эндоскопическое склерозирование противопоказано больным, находящимся в состоянии печеночной комы, а также при выраженных нарушениях свертывающей системы крови. Осложнения. При интравазальном введении склерозанта выделяют общие и местные осложнения. К местным осложнениям относят: изъязвления слизистой оболочки с рецидивом кровотечения, тромбофлебит вен с возможным некрозом стенки пищевода, дисфагию, стеноз и перфорацию пищевода. К общим осложнениям относят: температурную реакцию, боль за грудиной, синдром ДВС, легочные осложнения.