Тромбофилия у детей что это
Тромбофилия у детей: какие тесты и когда необходимо проводить?
Тромбофилия – наследственное или приобретенное состояние, характеризующееся чрезмерной склонностью к тромбообразованию в кровеносных сосудах с началом в раннем возрасте [1]. В классическом понимании тромбофилия не является болезнью и может проявляться тромбозом или длительное время протекать бессимптомно. Тромбообразование, по существу, – нормальный процесс, который препятствует чрезмерному истечению крови в местах повреждения сосуда. Однако когда тромботический процесс является избыточным, тогда он становится патологическим [2]. Несмотря на то что тромботические состояния значительно чаще встречаются у лиц старшего возраста, наличие тромбофилии может иметь место в детском возрасте, начиная с периода новорожденности.
К настоящему времени выявлено около 20 разных форм тромбофилии, которые могут вносить определенный вклад в развитие тромбоза. Венозный тромбоэмболизм (ВТЭ) объединяет два связанных заболевания – тромбоз глубоких вен и тромбоэмболию легочной артерии. Он является многофакторной патологией, в развитии которой участвуют как наследственные, так и приобретенные факторы, в том числе тромбофилия. ВТЭ все чаще встречается у детей. Так, частота тромбоза у детей в первые 6 месяцев жизни составляет 5 на 100 000 новорожденных [3]. В 1990‑х годах региструемая заболеваемость ВТЭ у детей колебалась от 0,07 до 0,14 на 10 000 в год (у взрослых 10-15 на 10 000) и составляла 5,3 на 10 000 госпитализаций 6. За последние десятилетия заболеваемость ВТЭ у детей значительно увеличилась [7, 8], это увеличение наблюдается во всех возрастных категориях. ВТЭ приводит к развитию посттромботического синдрома у 12,4% пациентов и частым рецидивам тромбоза – у 8,1% [9].
История
ВТЭ впервые был описан Briggs еще в 1905 г. Изучение этой патологии продолжили (хотя и без понимания патофизиологии самого процесса) F. Jordan и A. Nandorff в 1956 г. [10]. В 1965 г. О. Egeberg [11] описал случай из своей клинической практики. Он наблюдал семью из Норвегии с наследственным дефицитом антитромбина III (АТ-III) и рекуррентным тромбозом. 45-летняя женщина и ее 12-летний сын из этой семьи были одновременно госпитализированы с тромбозом нижних конечностей. В этом случае впервые выявили связь между сниженной концентрацией природного антикоагулянта и наследственным тромбозом.
Почти 20 лет спустя была обнаружена связь между дефицитом протеинов С и S и семейным тромбозом [12, 13]. Первое описание ребенка с гомозиготным протеином С осуществили Н. Вranson и соавт. в 1983 г. [14]. В 1990-х годах обнаружение резистентности к протеину С положило начало исследованию мутации фактора V (фактор Лейдена). Данная мутация представляет собой однократную замену глутаминовой аминокислоты на аспарагиновую в положении 506. Это первый изученный тромбофильный дефект, который вызывал усиление коагуляции или, правильнее сказать, снижение антикоагулянтной активности [15, 16]. Точечная мутация в нетранслируемой области 3с гена F2 протромбина, или мутация F2 G20210A, связанная с повышенными уровнями циркулирующего протромбина, обнаружена в 1996 г. [17]. Идентификация этого и других наследственных дефектов привела к значительному увеличению количества определяемых случаев тромбофилии за последние годы [18]. В дальнейшем было открыто множество генетических мутаций, обусловливающих дисфункцию факторов гемостаза, антикоагуляции и фибринолиза и объясняющих склонность индивидуумов к тому или иному виду тромбофилии в аспекте риска развития тромбоза. Роль многих из них продолжает изучаться, так как их истинное значение в тромбообразовании до конца не ясно.
Патогенез тромбоза у детей
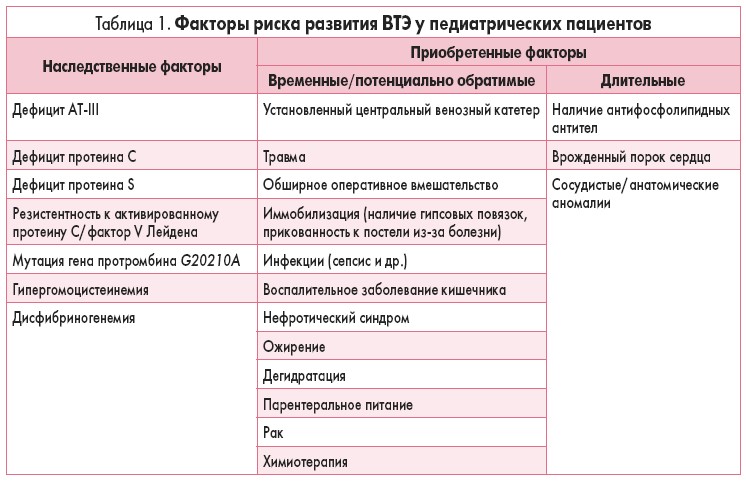
Патогенез тромбоза почти всегда комплексный. Эпизоды тромбоза у детей возникают вследствие сочетанного воздействия наследственных и приобретенных факторов (табл. 1).
Основными предрасполагающими и провоцирующими протромботическими факторами у детей являются:
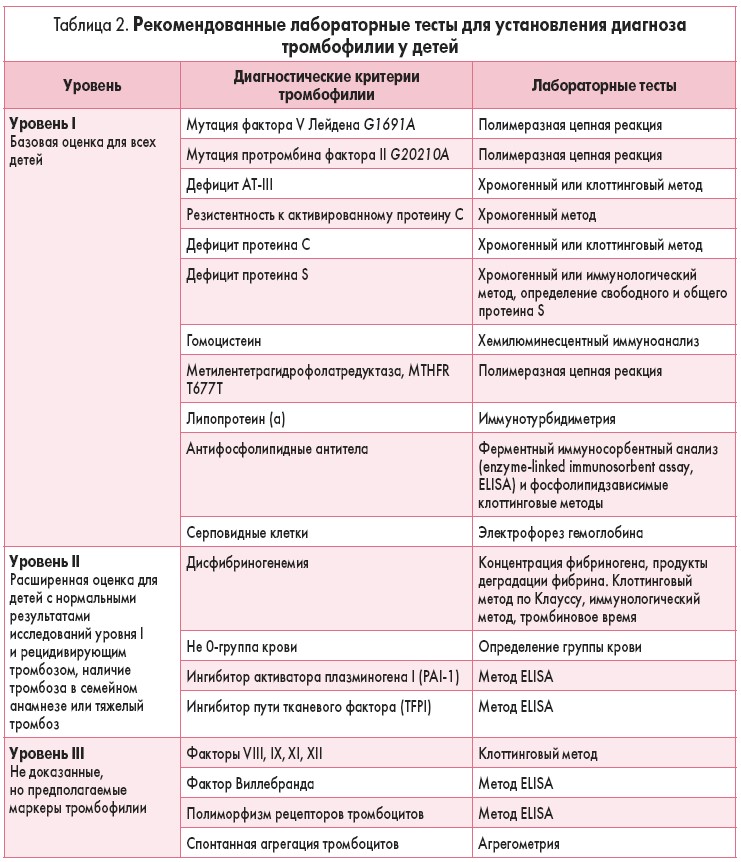
Для диагностики тромбофилии у детей используют:
Лабораторные тесты для диагностики тромбофилии у детей
Рекомендованные лабораторные тесты для установления диагноза тромбофилии у детей представлены в таблице 2.
Наследственные и приобретенные факторы участвуют в развитии клинической картины тромбоза. Риск развития тромбоза может повышаться у лиц, которые имеют один или несколько наследственных факторов тромбофилии, однако у них на протяжении жизни может не возникнуть ни одного эпизода тромбоза. Наличие длинных бессимптомных периодов между эпизодами тромбообразования и при рекуррентном тромбозе является очень важным с точки зрения доказательства того факта, что присутствие только наследственных факторов недостаточно для развития этого процесса, так как при этом играют определенную роль также приобретенные факторы 23. Было показано, что у детей приобретенные факторы чаще по сравнению с наследственными вызывают тромбоз. Как правило, приобретенные факторы включают использование катетера, злокачественные заболевания, инфекцию, заболевания сердца, нефротический синдром [25]. Наследственные факторы важны только у подростков, а также у детей, у которых ВТЭ развился при отсутствии триггерных факторов (частота 60%) [26].
Наследственные факторы тромбофилии у детей
Наследственный дефицит естественных антикоагулянтов, таких как АТ-III, протеины С и S, является доказанным фактором риска как первичного, так и повторных эпизодов венозного тромбоза у детей.
К наследственным факторам тромбофилии у детей также относятся: полиморфизм тромбоцитарных факторов, дисфибриногенемии, гиперлипопротеинемия (а), митохондриальная патология.
Выполнение тестов при наследственной тромбофилии у детей с тромбозом
При исследованиях с целью подтверждения наследственной тромбофилии наиболее распространенными тестами являются определение содержания АТ-III, протеинов С и S, фактора V Лейдена и мутации фактора II протромбина. Дефицит АТ-III, протеинов С и S или положительные результаты всех этих тестов характеризуются как тромбофилия высокого риска, а носительство фактора V Лейдена или мутации фактора II протромбина –как тромбофилия низкого риска. Было показано, что дети с дефицитом AT-III и мутацией протромбина имеют повышенный риск ВТЭ (соответственно в 8,73 и 2,63 раза).
Рекомендации. Проведение исследования с целью подтверждения наследственной тромбофилии выполняется в том случае, если тромбоз обнаружен, повторяется и встречается в абнормальных областях у педиатриических пациентов, а таже у лиц с тромбозом в семейном анамнезе.
Тем не менее, выполнение тестов по поводу наследственной тромбофилии является спорным в некоторых клинических ситуациях. Учитывая большое влияние приобретенных факторов на развитие тромбоза у детей, решение о тестировании с целью подтверждения наследственной тромбофилии должно быть принято на основании оценки клинического состояния пациента.
Приобретенные факторы тромбофилии у детей
1. Катетеризация сосудов. По данным обзора литературы за 1948-2012 гг., выполненного C. Park и соавт. [31], риск возникновения тромбоза в неонатальный период составляет 9,2%. При неонатальном тромбозе приобретенные факторы выявляют значительно чаще по сравнению с наследственными [32, 33]. У новорожденных тромбоз, связанный с установкой катетера, является редким, но представляет собой серьезную проблему. Хотя в более ранних исследованиях подчеркивалось, что 89% случаев неонатального тромбоза связаны с установкой катетера, однако в современных исследованиях показано, что связь этого фактора обнаружена у 54% пациентов с венозным тромбозом и 27% – с артериальным тромбозом [34]. Причина снижения частоты тромбоза, связанного с установкой катетера у новорожденных, объясняется введением гепарина в профилактических дозах и использованием более подходящих катетеров (риск тем выше, чем дольше катетер находится в вене) [35]. Этиология тромбоза при катетеризации может заключаться в повреждении эндотелия, присутствии инородного тела, нарушении ламинарного кровотока, воспалении и инфузии гипертонических растворов. Тромбоз у новорожденных, возникающий в связи с катетеризацией пупочной и периферических вен, составляет 80% всех случаев тромбоза. Чаще всего тромбы образуются в венах печени, правого предсердия и нижней полой вене. При лечении могут эффективно использоваться низкомолекулярные гепарины вместе с тромболитическими препаратами. Хотя введение гепарина в профилактических дозах не препятствует развитию тромбоза, тем не менее его действие продлевает время использования катетера и уменьшает возможность окклюзии [36].
Рекомендации. Не рекомендуется проведение исследования с целью подтверждения наследственной тромбофилии у новорожденных с тромбозом, который связан с катетеризацией.
2. Онкологические заболевания. Некоторые типы онкологических заболеваний у детей (например, лейкоз) связаны с более высокими показателями ВТЭ по сравнению с другими видами рака. Локализация опухоли также играет определенную роль при риске развития ВТЭ. Так, при интраторакальной локализации [37] и метастастатической болезни [38] отмечается более высокий риск возникновения ВТЭ. Возраст пациента (подростковый, молодой) является очень важным фактором риска развития ВТЭ. В целом, возраст старше 10 лет связан со значительным увеличением риска возникновения тромбоза по сравнению с таковым у детей младшего возраста [39]. Множество факторов способствуют повышению риска развития ВТЭ у подростков с раком, включая протромботические изменения системы гемостаза (снижение активности АТ-III, плазминогена, повышение активности фактора VIII, фактора Виллебранда, PAI‑1). Необходимо отметить, что некоторые подростки начинают принимать гормональные контрацептивы. В обзоре Кокрановской базы данных указано, что применение всех форм комбинированных оральных контрацептивов (эстроген + прогестерон) был связан с повышенным риском ВТЭ [40]. Ожирение является фактором, способствующим повышению риска развития ВТЭ у больных раком молочной железы [41]. Ожирение часто выступает в роли фактора риска развития ВТЭ у девушек-подростков, которые используют гормональные контрацептивы [42]. Использование некоторых химиотерапевтических агентов, таких как L-аспарагиназа и кортикостероиды, связано с увеличением тромботического риска [43]. До 2000-х годов было рекомендовано выполнять тестирование с целью подтверждения наследственной тромбофилии у пациентов с лейкозом. Однако в дальнейших исследованиях было выявлено, что тромбоз развивался в первый месяц у больных лейкозом с установленными катетерами, а наследственные факторы не были обнаружены [44].
Рекомендации. Нет необходимости выполнять исследования с целью подтверждения наследственной тромбофилии у детей с лейкозом или малигнизацией за исключением тех случаев, когда у ребенка имеются соответствующие симптомы или тромбоз в семейном анамнезе.
3. Нефротический синдром. Частота тромбоза (артериальный и венозный тромбоз различной локализации) при нефротическом синдроме составляет до 28%. У 9-36% детей с нефротическим синдромом может развиться вторичный тромбоз из-за дефицита АТ-III и протеина S. Однако гипоальбуминемия (83%) и инфекции (31%) являются более распространенными причинами развития нефротического синдрома, чем наследственная тромбофилия [45].
Рекомендации. Выполнение исследования с целью подтверждения наследственной тромбофилии у детей с нефротическим синдромом нецелесообразно.
4. Инсульт и транзиторная ишемическая атака. Частота инсульта у детей в возрасте от 1 до 18 лет колеблется в пределах 1,29-13,0 на 100 000 детского населения в год, а у новорожденных достигает 25,0 на 100 000 в год, при этом в половине случаев инсульт имеет ишемическую природу. Исследования показали, что частота инсульта и транзиторной ишемической атаки у новорожденных и детей увеличивается в 7,06 раза при дефиците АТ-ІII, 8,76 раза – при дефиците протеина С, в 3,20 раза – при дефиците протеина S, в 3,26 раза – при мутации фактора V Лейдена, в 1,58 раза – при мутации MTHFR, в 6,96 раза – в присутствии антифосфолипидных антител, в 6,27 раза – при увеличении уровня липопротеина (а) и в 11,86 раза – в присутствии комбинации наследственных факторов тромбофилии [46, 47].
Рекомендации. Целесообразно выполнение исследования с целью подтверждения наследственной тромбофилии у детей с инсультом и транзиторной ишемической атакой.
5. Дети с заболеванием сердца. У детей с заболеванием сердца может наблюдаться венозный (52,5%), артериальный (35,6%), венозный и артериальный (11,9%) тромбоз. Важнейшими факторами риска развития сердечно-сосудистых нарушений являются врожденная болезнь сердца и кардиомиопатия. Другие важные факторы риска включают хирургическое вмешательство, проведение ангиографии, установку катетера, инфекции и гипоксию. Роль наследственной тромбофилии в развитии тромбоза у детей с заболеваниями сердца довольно незначительна [48].
Рекомендации. Тестирование с целью подтверждения наследственной тромбофилии нецелесообразно у детей с врожденным заболеванием сердца.
6. Сепсис и другие инфекции. Сепсис является одной из основных причин синдрома диссеминированного внутрисосудистого свертывания (ДВС) крови. Он представляет собой большие проблемы у детей с менингококковым сепсисом и фульминатной пурпурой. При синдроме ДВС активируются пути свертывания, отмечается дисфункция природных ингибиторов и фибринолитической системы. При сепсисе бактерии и бактериальные продукты изменяют взаимодействие между эндотелием и циркулирующей кровью, что приводит к прокоагулянтному состоянию [49, 50]. В этом процессе происходит активация свертывания через фактор XI [51], увеличение уровня тканевого активатора плазминогена (tPA), комплекса плазмин/α2-антиплазмин [52], снижение содержания тромбомодулина в эндотелии и его повышение в плазме крови, снижение концентрации протеинов С и S, антитромбина [53, 54], увеличение содержания тканевого фактора и PAI‑1 [55].
При фульминантной пурпуре острый быстропрогрессирующий потенциально летальный ДВС-синдром, вызванный выработкой ингибирующих антител к природным антикоагулянтам, связан с дефицитом протеина С и S (почти 100% летальность при отсутствии патогенетической терапии). В начале заболевания кожные элементы характеризуются как мелкие экхимозы, которые в дальнейшем увеличиваются в диаметре, приобретают пурпурно-черную окраску и в их центре формируется булла, после чего наблюдаются некротические и гангренозные явления. Такие элементы, как правило, формируются на конечностях, однако могут наблюдаться на ягодицах, животе, в паху, а также на коже головы. Кроме того, пурпурозные элементы возникают в местах пункций, давления или травматизации.
Рекомендации. Детям с клинической картиной фульминантной пурпуры показано незамедлительное определение активности протеинов С и S.
Общие положения тестирования детей на наличие генетических факторов риска
Прежде чем проводить тестирование детей на наличие наследственной тромбофилии, врачам следует рассмотреть вопрос о том, может ли тестирование улучшить клинические результаты, связанные с терапией или профилактикой [56]. В обзоре Всемирной организации здравоохранения в разделе «Этические вопросы в медицине» имеется рекомендация: «Все тестирования должны быть добровольными, которым предшествует адекватная информация и информированное согласие… Тестирование детей или подростков должно выполняться только в том случае, если имеется потенциальная выгода» [57]. Выявление маркеров тромбофилии оказывает значимое психологическое воздействие на пациентов подросткового возраста и их родителей/родственников, что может нарушать нормальное развитие ребенка. Несмотря на многочисленные публикации, до сих пор нет единого мнения, какое место занимает тромбофилия в формировании риска тромбоза у детей. Зачастую необоснованное ожидание тромбоза у ребенка приводит к повышенной настороженности и необоснованному профилактическому назначению антикоагулянтных препаратов или модуляции образа жизни. Врачи, которые заказывают такое тестирование, должны основываться на индивидуальной для каждого пациента оценке риска и выгоды.
Выводы
К настоящему времени проведено немалое количество исследований, определяющих влияние тех или иных факторов тромбофилии на риск развития тромбоза у детей. Согласно данным метаанализов, наличие тромбофилии значимо и статистически достоверно повышает риск повторного тромбоза у детей. Однако до сих пор имеются лишь единичные исследования, характеризующие роль тромбофилии в формировании риска первого эпизода тромбоза у детей, причем большинство из них носят ретроспективный характер. Венозная тромбоэмболия является многофакторным заболеванием, и приобретенные факторы риска (установка центрального венозного катетера – единственный наиболее важный фактор риска) у детей играют более важную роль по сравнению с наследственными. Тестирование на наличие тромбофилии не рекомендуется проводить у детей в возрасте младше 15 лет, так как тромбоз, связанный с тромбофилией, является очень редким. При отсутствии катетеризации сосудов и активной формы рака частота возникновения ВТЭ у детей и подростков остается очень низкой (менее 1 на 100 000 человек в популяции в возрасте до 13 лет).
Консультирование и ведение пациентов с ВТЭ и выявленными маркерами тромбофилии должен осуществлять опытный гематолог или специалист в области гемостаза.
Литература
57. Wertz D.C. Ethical, social and legal issues in pharmacogenomics. The Pharmacogenom. J. 2003; 3: 194-196.
Полный список литературы находится в редакции.
Тематичний номер «Педіатрія» №1 (48), березень 2019 р.
СТАТТІ ЗА ТЕМОЮ Педіатрія
Алергічний риніт (АР) зумовлює багато симптомів та ускладнень, які серйозно впливають на якість життя дітей. Метою цього дослідження є оцінювання ефективності та безпеки медичного виробу Нарівент і порівняння їх із такими топічних кортикостероїдів (КС) у контролі симптомів АР у дітей.
Найбільш поширеною причиною розвитку негоспітальної пневмонії (НП) у дітей віком до 5 років є віруси. До того ж, у 30% випадків при ураженні вірусом слизової оболонки дихальних шляхів відбувається приєднання вторинної бактеріальної інфекції. У дітей усіх вікових груп найбільш поширеним бактеріальним збудником НП є Streptococcus pneumoniae. У дітей віком до 5 років захворювання також може виникати внаслідок інфікування Haemophilus influenzae, Streptococcus pyogenes, Staphylococcus aureus, Moraxella catarrhalis та Mycoplasma pneumoniae.
Зазвичай, коли у пацієнта виникають симетричні потовщення в ділянці міжфалангових суглобів кистей, лікарі найчастіше встановлюють діагноз артрит. Але є стани з подібними симптомами, не пов’язані з запальними процесами у цих суглобах. Пахідермодактилія (від грецького pachy – товстий, dermos – шкіра, dactylos – пальці) – один із них, у дітей зустрічається рідко, тому лікар не завжди одразу може встановити правильний діагноз.
Глава 4 ТРОМБОФИЛИИ. ЭТИОЛОГИЯ И ПАТОГЕНЕЗ. МАРКЕРЫ ТРОМБОФИЛИЧЕСКИХ СОСТОЯНИЙ
Тромбофилия, по определению Британского комитета по гематологическим стандартам, это врожденный или приобретенный дефект гемостаза, приводящий к высокой степени предрасположенности к тромбозам. Российские гемостазиологи предлагают более полное определение этого патологического состояния: тромбофилия — это нарушения гемостаза и гемореологии, которые характеризуются повышенной наклонностью к развитию тромбозов кровеносных сосудов и ишемией органов.
По данным некоторых исследований, тромбофилия, врожденная или приобретенная, выявляется более чем у 60% пациентов с венозными тромбозами. Чаще всего врожденные тромбофилические состояния клинически проявляются в виде идиопатических венозных тромбозов, возникающих в молодом возрасте [Cushman M., 2007].
Существует несколько классификаций тромбофилических состояний. Одна из них, наиболее обширная и полная, была разработана и предложена З. С. Баркаганом и его сотрудниками в 1996 г. Она включает в себя 10 больших групп, которые отражают изменения на различных уровнях системы гемостаза.
1. Гемореологические формы, характеризующиеся полиглобулинеей, повышением гематокритного показателя, повышением вязкости крови и/или плазмы (в сочетании с гипертромбоцитозом или без него).
2. Формы, обусловленные нарушениями тромбоцитарного гемостаза, связанные с гипертромбоцитозом, повышением агрегационной функции тромбоцитов (спонтанной и под воздействием основных агонистов), уровнем и мультимерностью фактора Виллебранда.
3. Формы, связанные с дефицитом и/или аномалиями первичных физиологических антикоагулянтов — протеинов С и S, антитромбина III, TFPI.
5. Формы, связанные с нарушениями фибринолиза — дефицитом или аномалией тканевого активатора плазминогена (ТПА) и самого плазминогена, избытком их ингибиторов.
6. Формы, связанные с повышением активности и недостаточной инактивацией фактора VII.
7. Аутоиммунные и инфекционно-иммунные формы, в том числе так называемый антифосфолипидный синдром; болезнь Бехчета, тиреотоксикоз, системные васкулиты, бактериальный эндокардит, сепсис.
8. Паранеопластические формы: висцеральные формы раковых опухолей различных локализаций (синдром Труссо и др.).
9. Метаболические формы — диабетические ангиопатии, гиперлипидемические формы, тромбофилия при гипергомоцистеинемии и др.
Врожденные (генетические) тромбофилии связаны с нарушением структуры генов определенных белков, которые принадлежат к системе свертывания крови.
Чтобы перейти к обсуждению врожденных тромбофилий, необходимо определить некоторые генетические понятия.
Ген — участок молекулы ДНК, в котором закодирована информация о биосинтезе одной полипептидной (белковой) цепи с определенной аминокислотной последовательностью. Ген является единицей наследственного материала, он обеспечивает формирование какого-либо признака организма и его передачу в ряду поколений. Гены контролируют все клеточные процессы на молекулярном уровне, обеспечивая биосинтез белков, в первую очередь ферментов.
Аллель (аллельный вариант) — одна из возможных форм одного и того же гена. Аллели расположены в одинаковых участках (локусах) гомологичных (парных) хромосом; определяют варианты развития одного и того же признака, контролируемого данным геном.
Генетический полиморфизм (полиморфный вариант, однонуклеотидный вариант, SNP) — представляет собой замену одного из нуклеотидов — A, C, T, G — на другой в последовательности ДНК.
Гомозигота (гомозиготный вариант) — вариант, когда два гена, определяющие какой-либо конкретный признак, одинаковы, т. е. пара аллелей — отцовский и материнский — идентичны.
Гетерозигота (гетерозиготный вариант) — вариант, когда два гена, определяющие какой-либо определенный признак, различны, т. е. пара аллелей — отцовский и материнский — не одинаковы.
«Дикий тип» — фенотип или совокупность фенотипов, присущие большинству особей природных популяций данного вида.
Итак, аллели или аллельные варианты — это различные по структуре участки одного и того же гена, расположенные в гомологичных хромосомах и определяющие альтернативные варианты проявления того или иного признака. Если аллели различны по своей структуре, то говорят о гетерозиготе, если одинаковы — это гомозиготный вариант. Различия в нуклеотидной последовательности аллельных вариантов могут быть обусловлены различными механизмами. Для изменений в генах системы гемостаза характерно появление точечных однонуклеотидных замен, или полиморфизмов, в кодирующих последовательностях генов, что обусловливает изменения в структуре РНК и, следовательно, в структуре компонента системы гемостаза из-за замены той или иной аминокислоты на другую. Изменение первичной структуры протеина может приводить к изменению его функции и функциональной активности либо оставаться незамеченным, чем объясняется неодинаковая роль однонуклеотидных замен в различных участках ДНК одного гена. Несмотря на то что некоторые генетические изменения, характерные для врожденных тромбофилий, уже описаны, в настоящее время очень интенсивно ведется поиск новых кандидатных однонуклеотидных замен, которые могли бы объяснить наличие тромбоэмболических осложнений при отсутствии известных маркеров. Молекулярнобиологически изменения в ДНК, как правило, являются миссенс-мутациями (замена аминокислоты вследствие замены нуклеотида) и значительно реже — нонсенс-мутациями (однонуклеотидная замена образует стоп-кодон и нарушается синтез фермента). В случае если происходит изменение функциональной активности компонента системы гемостаза, возможны два исхода — снижение функции вплоть до ее потери или усиление действия в точке приложения, loss-of-function и gain-of-function соответственно. При этом, очевидно, происходит дисбаланс в системе гемостаза, клинико-лабораторная манифестация которого зависит от степени его компенсации. По типу gain-of-function происходят изменения функции FV и протромбина, loss-of-function наблюдается при картине дефицита фактора гемостаза — примером являются тромбофилии, связанные с дефицитом естественных антикоагулянтов.
Врожденные тромбофилии условно можно разделить на несколько групп:
1-я группа — дефицит физиологических антикоагулянтов, в том числе дефицит антитромбина III, протеина С и протеина S;
2-я группа — повышение уровня или активности факторов плазменного гемостаза — резистентность к активированному протеину С (мутация Лейден), мутация в гене протромбина, повышение уровня VIII, IX, XI факторов свертывания крови;
3-я группа — патология системы фибринолиза;
4-я группа — гипергомоцистеинемия.
1. Гены тромбоцитарного гемостаза:
Тромбоцитарный гликопротеин 1α (интегрин-альфа-2)
Gp-1α 807 C → T — определяет структуру одного из рецепторов тромбоцитов (интегрина), благодаря которому тромбоциты фиксируются к поврежденной стенке сосуда. При замене нуклеотида C на нуклеотид Т происходит повышение активности кодируемых геном рецепторов и, соответственно, увеличение скорости фиксации тромбоцитов к сосудистой стенке, что может приводит к повышению риска развития различных сердечно-сосудистых заболеваний.
Тромбоцитарный гликопротеин IIIα, интегрин β
GpIIIα 1565 Т → C (Leu33Pro) — ген рецептора тромбоцитов для фибриногена и фактора Виллебранда. Ген определяет агрегационную активность тромбоцитов, при наличии полиморфизмов по редкому аллелю, способность к агрегации у тромбоцитов резко увеличивается, что приводит к повышению риска развития сердечно-сосудистой патологии (инфаркты, инсульты, ранняя форма ИБС).
Тромбоцитарный гликопротеин 1β
2. Гены коагуляционного гемостаза:
FGB-455G → A — детерминирует активность фибриногена благодаря кодированию аминокислотной последовательности β-цепи фибриногена. Носительство редкого аллеля А сопровождается повышенной экспрессией гена, что приводит к повышению уровня содержания фибриногена в плазме крови и повышает риск развития сердечно-сосудистых заболеваний.
VII коагуляционный фактор
FVII 10 976 G → A (Arg353Gln) — VII фактор, активирует FIX и FX, инициируя каскад коагуляции. Наличие гетерозиготного или гомозиготного полиморфизма по редкому аллелю в гене FVII является протективным фактором по риску развития сердечно-сосудистых заболеваний, тромбозов и тромбоэмболий, так как сопровождается снижением концентрации FVII в плазме крови на треть от исходного, и активности прокоагулянтных реакций.
VIII коагуляционный фактор
FVIII 10 976 G → A (Asp1241Glu) — VIII антигемофильный фактор. В активном состоянии является кофактором FIXa, который в свою очередь воздействует на FX, активируя последний. Полиморфизм по редкому аллелю приводит к снижению активности FVIII, что является протективным фактором относительно риска развития сердечно-сосудистых заболеваний. Однако при сочетании указанного полиморфизма с мутацией в Х-хромосоме, определяющей развитие гемофилии А, отмечается более тяжелое течение заболевания.
FXII коагуляционный фактор
3. Гены системы фибринолиза
PLAT тканевой активатор плазминогена
PLAT-7351 C → T — является детерминирующим геном тканевого активатора плазминогена, основной функцией которого является трансформация плазминогена в плазмин. При наличии полиморфного варианта по редкому аллелю в указанном гене происходит значительное снижение выработки PLAT, что сопровождается снижением активности системы фибринолиза, повышением риска инсультов, инфарктов и венозных тромбоэмболических осложнений.
PAI-1 ингибитор активатора плазминогена
4. Гены фолатного цикла
Фолатный цикл — цепь биохимических реакций, в результате которых происходит превращение аминокислоты гомоцистеина в аминокислоту метионин. При снижении уровня ферментов, в том числе и вследствие генетических факторов, являющихся основой биохимических превращений, происходит увеличение концентрации гомоцистеина в плазме крови, что приводит к гиперпродукции гомоцистина, смеси дисульфидов и тиолактона гомоцистеина. Данные соединения способствуют повреждению эндотелия, обнажению субэндотелиального матрикса и гладкомышечных клеток. Кроме того, избыток гомоцистеина способствует активации XII и V факторов, а также экспрессии тканевого фактора; при этом нарушается высвобождение естественных ингибиторов коагуляции и антиагрегантов — протеина С, ингибитора внешнего пути свертывания крови; снижается гликозаминогликанзависимая активация антитромбина III, подавляется активность тромбомодулина. Наряду с этим наблюдается повышенная агрегация тромбоцитов вследствие снижения синтеза эндотелием оксида азота, а также усиленного высвобождения поврежденными эндотелиоцитами фактора Виллебранда. Снижение синтеза эндотелиальной оксида азота обусловлено уменьшением экспрессии синтазы азота за счет действия продуктов перекисного окисления липидов (ПОЛ), инициируемого гомоцистеином. Обозначенные атерогенные и тромбофилические эффекты в совокупности определяют хроническую эндотелиальную дисфункцию при гипергомоцистеинемии. Частота выявления гипергомоцистеинемии в общей популяции составляет 5%.
MTR 2756 A → G (D919G) — влияет на структуру и функцию фермента метионинсинтаза, который при участии кофактора витамина В12 принимает участие в реакции фолатного цикла. Генетические нарушения приводят к повышению уровня гомоцистеина и понижению уровня S-аденозилметионина, что является определяющим фактором для развития некоторых видов акушерской патологогии, а также повышенным риском тромбообразования.
CBS 844ins68 — фермент, участвующий в реакции соединения серина и гомоцистеина, с превращением последнего в цистатион. Реакция происходит при участии в качестве ко-фактора витамина В 6. При наличии полиморфизма по редкому аллелю в гене цистатион-β-синтазы может привести не только к гипергомоцистеинемии, но и к гомоцистеинурии. Показано, что генетические отклонения в этом гене в совокупности с другими нарушениями ферментативной активности в фолатном цикле могут приводить к повышенному риску тромбообразования.
END1 G5665T Lys198Asn — вазопрессорный пептид, продуцируемый эндотелием сосудов под действием различных ферментов и белков, таких как адреналин, тромбин, вазопрессин, а также при повреждении сосудов. Возможно, что при наличии полиморфизма в гене эндотелина 1 происходит реактивное изменение активности других белков сосудистого эндотелия, в том числе протромботических, что повышает риск тромбообразования и утяжеляет течение заболевания.
NOS(e) — эндотелиальная NO синтаза
NOS(e) VNTR и C → T — основные функции фермента NOS(e) — участие в процессах ангиогенеза, снижении агрегационной способности тромбоцитов, релаксации гладкомышечных элементов сосудистой стенки. Наличие указанных вариантов полиморфизмов в гене NOS(е) влияет на повышение риска развития сердечно-сосудистых заболеваний и их осложнений, в том числе инсультов, инфарктов, ИБС.
Объем генетической диагностики не должен быть одинаковым у пациентов с различными клиническими ситуациями, в связи с чем разработаны несколько вариантов (панелей) для генетического исследования системы гемостаза:
1. Основная (базовая) панель: исследование полиморфных вариантов генов FV, FII, MTHFR. Этот вариант может быть использован в качестве скринингового, при выявлении носительства хотя бы одного редкого аллельного варианта необходимо проведение расширенного генетического исследования.
2. Стандартная панель: исследование полиморфных вариантов генов FV, FII, FGB, FXII, PAI-1, MTHFR, MTHFD, CBS. Стандартный набор генов для проведения рутинного исследования.
3. Расширенная панель: исследование полиморфных вариантов генов FV, FII, FGB, FVII, FVIII, FXII, PAI-1, PLAT, MTHFR, MTHFD, CBS, MTR, MTRR, END1, NOS(e). Расширенный вариант генетической панели рекомендуется применять для исследования у пациентов с тромбоэмболией, рецидивными тромбозами.
В 2012 г. в Институте химической биологии и фундаментальной медицины СО РАН (г. Новосибирск) был окончен очередной этап многолетнего исследования частоты встречаемости полиморфных вариантов генов системы гемостаза у пациентов Западно-Сибирского региона с венозными тромбозами и тромбоэмболическими осложнениями. Подробные результаты исследования представлены в табл. 4.3.