У кота почечная недостаточность что делать помогите
ХПН у кошек и котов

Почечная недостаточность представляет собой заболевание, отражающееся на работе всех систем организма. Но клинические проявления видны только тогда, когда 65-80% почечной ткани уже поражены. Чем раньше будет выявлено заболевание, тем дольше проживет кошка после грамотной терапии.
При почечной недостаточности почки главную свою функцию – выделительную – выполняют плохо или престают выполнять совсем. Проблемы в работе выделительной системы нарушают балансы:
Эти нарушения запускают проблемные состояния в других внутренних органах.
Почечная недостаточность чаще возникает у котов персидской и британской породы, поскольку они больше подвержены врожденной аномалии – поликистозу почек. А это заболевание провоцирует ХПН.
Кошки абессинской породы страдают от амилоидоза, который также провоцирует хроническую почечную недостаточность.
Однозначного мнения о том, кто больше предрасположен к заболеванию – коты или кошки – нет.
Лечение почечной недостаточности может дать эффект только в начальной стадии. Прогноз на выздоровление значительно уменьшается, если заболевание запущено. При появлении хоть каких-либо незначительных признаков болезни, следует немедленно обратиться к ветеринару.
Симптомы почечной недостаточности схожи с симптомами других заболеваний, поэтому кошку обязательно нужно полностью обследовать для установки точного диагноза. Нельзя давать животному какие-либо препараты самостоятельно. Лечить питомца может только специалист.
Некоторые симптомы почечной недостаточности
Виды почечной недостаточности
В зависимости от течения болезни и внешних ее проявлений различают:
Обе формы имеют схожие признаки, но развиваются по-разному.
Острая форма
ОПН развивается очень быстро. Признаки болезни выражены ярко, что позволяет начать лечение на ранней стадии, а это крайне важно для восстановления работы почек.
Острая форма имеет три типа:
Если острая почечная недостаточность возникает периодически, то у кота или кошки может возникнуть хроническая стадия, а она лечению не поддается.
Хроническая форма

Опасность хронической формы заключается в том, что на раннем этапе, когда коту или кошке еще можно помочь, симптомы болезни отсутствуют. Они появляются только тогда, когда повреждены более 2/3 части почек.
Хроническая почечная недостаточность проходит в четыре этапа:
Лечение хронической почечной недостаточности
Лечение болезни у кошек и котов, независимо от стадии болезни, является поддерживающим. Излечение недостижимо, болезнь можно только замедлить. С хронической почечной недостаточностью кошки живут определенный период. Его длительность зависит от множества факторов:
Причины возникновения ХПН
Болезнь может возникнуть по разным причинам:
Почечная недостаточность у котов и кошек – серьезное заболевание, промедление при лечении которого может привести к смерти животного. Чтобы на несколько лет продлить жизнь питомцу при появлении признаков заболевания нужно немедленно обратиться к ветеринару.
Как вылечить острую почечную недостаточность у кошек
Почечная недостаточность — одна из самых серьёзных патологий, встречающихся у братьев наших меньших довольно часто. Патология возникает в случае, когда почки по каким-либо причинам перестают выполнять свою работу как надо.
Причины
Под почечной недостаточностью понимают синдром, возникший на фоне сопутствующих заболеваний, поражающих мочеполовую систему. К таким болезням относятся нефроз, пиелонефрит, мочекаменная болезнь и другие патологии почек. Почечная недостаточность может развиваться как осложнение сахарного диабета, воспаления лёгких, васкулита, лептоспироза и т. д.
Нередки случаи, когда мочеполовая система кошки страдает из-за отравления токсическими веществами, наступившего, например, вследствие длительного приёма лекарственных препаратов. Нагрузка на почки усиливается, так как они стараются как можно скорее выполнить свою прямую обязанность — вывести токсины из организма. Это может привести к тяжёлым последствиям, вплоть до разрушения органа.
Наконец, фактором, провоцирующим почечную недостаточность, может быть генетическая предрасположенность вашего пушистика к некоторым заболеваниям, например, поликистозу, гломерулонефриту.
Для почечной недостаточности характерны две формы течения болезни — острая и хроническая.
Острая недостаточность наиболее опасна, так как в большинстве случаев заканчивается летальным исходом. Протекает стремительно и имеет ярко выраженную клиническую картину. ОПН, в свою очередь, также протекает в трёх формах: допочечной, почечной, послепочечной.
Ветеринары утверждают, что самой серьёзной формой является почечная. В отношении допочечной и послепочечной прогноз, скорее, благоприятный.
При хронической почечной недостаточности почки постепенно перестают выполнять выделительные функции. Долгое время ХПН может вообще никак себя не проявлять. Этим она и опасна. Клетки почек отмирают постепенно, нагрузка перераспределяется между здоровыми клетками, но затем и они гибнут.
Повреждённые ткани рубцуются, в результате чего почки уменьшаются в размерах и уже не справляются со своими обязанностями. Как правило, хроническая почечная недостаточность диагностируется у старых кошек.
ХПН имеет четыре стадии: скрытая, начальная, консервативная, терминальная.
Больше всего шансов на благоприятный исход имеет скрытая форма, но своевременная диагностика происходит в редчайших случаях. При терминальной, к сожалению, животному помочь уже нельзя, поэтому единственным способом прекратить страдания питомца является эвтаназия.
Какие породы наиболее подвержены
Почечная недостаточность может возникнуть у любой кошки. Чаще других патологию диагностируют у представителей некоторых пород предрасположенных к амилоидозу, поликистозу, инфантильному поликистозу. В группе риска — абиссинские, персидские кошки, а также метисы персов.
Симптомы
Если речь не идёт об острой форме почечной недостаточности, то длительный период патология протекает в скрытой форме. Постепенно клетки отмирают, но почки продолжают работать. Характерные признаки почечной недостаточности появляются, когда объём повреждённых тканей — более 70 %.
Весёлый и активный домашний питомец становится вялым, сонливым, быстро устаёт и большую часть времени лежит. Аппетит у него пропадает, жажда, наоборот, увеличивается. Несмотря на большое количество выпитой воды, кот редко ходит в туалет. Даже если ему удается пописать, то количество урины незначительное. Хозяин замечает, что пушистик постоянно лижет половые органы.
Далее возникают расстройство пищеварения — тошнота, диарея, запор.
Характерно появление резкого неприятного запаха от тела и пасти четвероногого любимца.
В тяжёлых случаях у животного наблюдаются эпилептические припадки, судороги, повышение температуры, гипертония, в результате которой происходит разрыв сосудов в глазном яблоке и потеря зрения. Интоксикация организма нарастает, состояние кота стремительно ухудшается. Почки не работают, в результате чего питомец впадает в кому и умирает.
Диагностика
Диагностика почечной недостаточности связана с определёнными сложностями. Провести её качественно возможно лишь в стационаре, используя инструментальные и лабораторные методы.
Прежде всего, проводится биохимия крови. Исследование позволяет узнать уровень фосфора, калия креатинина, мочевины.
Много информации можно получить из лабораторного анализа мочи, в частности, он указывает на изменение состава биологической жидкости, определяет уровень лейкоцитов, наличие бактерий и почечного эпителия. Урина больного кота тёмная или, наоборот, слишком светлая, имеет низкую плотность. Содержание эритроцитов и белка повышенное.
Обязательно проводится УЗИ почек. Оно показывает структуру органа, его расположение и форму, наличие кист.
Чтобы определить объём поражения почек проводится рентгенография с контрастным веществом.
Наиболее точную информацию даёт метод компьютерной томографии почек. Но ввиду высокой стоимости его применяют в редких случаях.
Лечение
Почечная недостаточность относится к числу неизлечимых патологий. Однако с помощью грамотно составленной схемы лечения возможно поддерживать качественный уровень жизни животного и добиться некоторого улучшения работы почек.
Кошка пожизненно будет находиться под наблюдением ветеринара и регулярно проходить обследования, включая сдачу анализов мочи и крови. Кроме этого, животному придётся всю жизнь соблюдать лечебную диету и принимать определённые лекарственные препараты.
Лечение зависит от формы почечной недостаточности, общего состояния и возраста животного.
Острая форма лечится по схеме, включающей в себя:
При хронической недостаточности лечебные мероприятия направлены на восстановление кислотно-щелочного, водно-солевого баланса, стабилизации артериального давления. Устранение признаков анемии. Необходимо проведение гемодиализа, использование строгой, но питательной и сбалансированной диеты.
Для повышения иммунитета целесообразно применения витаминно-минеральных комплексов.
Что делать в домашних условиях
Хозяин должен строго выполнять указания ветеринара. Самолечение, замена народными способами консервативного лечения приводят к пагубным последствиям.
Больному питомцу необходимо обеспечить качественный уход и лечебное питание. Диета продолжается не менее полугода. Из кошачьего меню на это время полностью исключаются соль, морская рыба, мясо жирных сортов, субпродукты, каши, молочная продукция. Под запретом мучные изделия и рыбий жир.
Рацион может состоять из мяса птицы (курица, индейка), бульона, овощей (капуста, морковь). Допустимых продуктов немного, поэтому ветеринары рекомендуют отдать предпочтение специальному лечебному сухому корму.
Профилактика
Любое заболевание можно предотвратить с помощью простейших мер профилактики, известных каждому владельцу.
Прежде всего, нужно уяснить, что регулярные осмотры у ветеринара позволят избежать или выявить на начальном этапе инфекционные процессы мочеполовой системы. Огромное значение в профилактике имеют правильное питание качественным кормом, предупреждение травм, контроль над весом питомца.
Интересные темы
Что ещё почитать:
© Ветеринарная клиника «Беланта», 2004—2021, Москва
8(495)150-55-58
www.belanta.vet
Наши адреса:
г.Москва, ул. Братеевская, д.16 к.3
г.Москва, ул. Подольских Курсантов, д.4Б
Ветеринарная клиника работает круглосуточно
Почечная недостаточность у кошек: симптомы, лечение, правильное питание
Если у вашего питомца появились симптомы почечной недостаточности, то сразу обратитесь к ветеринару. Без лечения, возможны серьезные осложнения.
Содержание:
Если диагноз «почечная недостаточность» оставить без должного внимания или отреагировать на него несвоевременно, у кошки резко ухудшится здоровье, и возможен даже летальный исход. Не стоит рисковать, лучше при первых же подозрениях обратиться к ветеринару. Опытный специалист точно определит стадию заболевания, назначит эффективный курс лечения, посоветует правильное питание. В общем, сделает все возможное, чтобы питомец снова был бодрым, веселым и здоровым.

Чем опасна почечная недостаточность для котов и кошек
При почечной недостаточности у кошек лечение требуется как можно скорее. И это не пустые угрозы. Каждый день мочевыводящая система будет работать хуже, а в организме будет накапливаться больше токсичных веществ. Они не выводятся наружу, отравляют внутренние органы и кровь. Также почки перестают справляться с такими задачами, как:
Бывают случаи, когда питомец угасает за несколько дней, причем такие последствия реальны и при острой, и при хронической почечной недостаточности. Еще одна проблема — неправильная диагностика. Признаки болезни нередко пересекаются с симптомами других недугов, поэтому здесь важен опыт врача.
Почечная недостаточность у кошек: симптомы и признаки
Почечная недостаточность может долго никак не проявлять себя, и лишь после того, как потеряется около 70% работоспособности почек, болезнь даст о себе знать. Ранние стадии заболевания сопровождаются изменением состава и цвета мочи животного. Есть хоть малейшие сомнения в этом вопросе? Лучше сразу провести специальный лабораторный анализ.

О почечной недостаточности у кошек помогут узнать следующие симптомы:
Чем больше организм подвергается воздействию токсинов, тем более ярко выраженными становятся признаки почечной недостаточности. Также рекомендуется заранее бить тревогу, если изначально известно о наличии таких недугов у питомца, как сахарный диабет, воспаление легких, пироплазмоз, энтерит.
Хроническая и острая почечная недостаточность у кошек: как лечить
Выбор метода лечения напрямую зависит от состояния здоровья животного и вида почечной недостаточности. Например, при хроническом недуге восстановить почки уже не удастся, так как, к сожалению, это необратимый процесс. Если диагностируется острая недостаточность, возможно полное выздоровление.
При диагнозе острая почечная недостаточность у кошек у опытного специалиста не возникает вопрос, как лечить животное? Схема лечения, реабилитации и профилактики выбирается индивидуально. Распространенные методы:
Если питомец испытывает боль, ему выписывают обезболивающие препараты, может проводиться блокада нервных окончаний. Методы лечения нельзя выбирать без данных диагностики, потому что при повышенном давлении подойдут одни лекарства, при анемии — совершенно другие, при сопутствующих проблемах с почками — третьи.
Сколько живут кошки с почечной недостаточностью?
Если речь идет об ОПН, то при правильном лечении, животное вернется к полноценной жизни. Хотя так как патология почечной недостаточности не устраняется, кошка всегда будет требовать внимательного ухода — диеты, периодических визитов к ветеринару.
Если же болезнь достигла терминальной стадии ХПН, то, к сожалению, лечение уже не поможет. Сколько проживет питомец на этой стадии незивестно. Это зависит от его возраста, состояния других органов, ухода.
В наиболее тяжелых проявлениях терминальной стадии животное усыпляют, так как ХПН сопровождается мучительными болями.

Кошка с ХПН: стадии болезни и признаки
Большая проблема хронической почечной недостаточности заключается в том, что диагностировать недуг на ранних стадиях весьма затруднительно. Особенных внешних проявлений нет, определить ХПН можно только регулярно сдавая анализы.
Поэтому чаще всего на момент фиксации диагноза почки уже более чем на половину поражены и животному требуется серьезное лечение. А при промедлении фатального исхода не избежать.
Всего же выделяют 4 стадии развития заболевания:
Несмотря на отсутствие явных симптомов ХПН на первых стадиях, есть признаки которые должны обратить на себя внимание хозяина.
Если кошка стала менее активной, у неё снизился аппетит, при этом она чаще пьет воду, то стоит сдать анализы крови. При повышенных значениях креатинина, сделайте более глубокое обследование, в том числе УЗИ почек.
На ранних стадиях ХПН может медленно прогрессировать в течение месяцев, и чем раньше хозяин начнет лечение, тем выше шансы на положительный исход.

При наличии ХПН на терминальной стадии, максимум, что вам может предложить ветеринар — гемодиализ и оперативное вмешательство. Ни то, ни другое не дает 100% гарантии выживаемости животного. Нередко врачи рекомендуют усыпить кота, дабы избавить и его, и хозяина от долгих страданий.
Хроническая почечная недостаточность у кошек: чем кормить
Почечная недостаточность у кошек — сложное заболевание, поэтому сколько живут такие питомцы, столько нужно придерживаться специальной диеты. Теперь меню должно быть таким, чтобы токсинов в организме было как можно меньше, а полезных для здоровья микроэлементов поступало достаточно. Общие рекомендации:
Питание для кошки с почечной недостаточностью играет огромную роль, ведь проблема как раз и заключается в нарушении метаболизма животного. В кровь поступают токсичные вещества, нарушая со временем деятельность печени и других внутренних органов.
Помимо натуральной еды, существуют и специальные щадящие корма при ХПН.В них содержаться все необходимые при болезни витамины и минералы: Е, В, С, Омега-3, железо, калий.
Диетические корма для кошек с ХПН — это: Royal Canin Renal, Hill’s Prescription Diet, Eukanuba Renal, Purina.
При составлении диеты для кошки лучше положиться на ветеринара, который подберет индивидуальный рацион для вашего питомца.
При определении хронической почечной недостаточности у кошек на вопрос, чем кормить, ответит лечащий врач. Он даст список допустимых продуктов и рассчитает количество необходимых минеральных добавок и витаминов.
Опыт лечения тяжелых нарушений фосфорно-кальциевого обмена при терминальной почечной недостаточности с использованием цинакалцета
Хронические заболевания почек представляют собой серьезную проблему здравоохранения. Это определяется как неуклонным ростом числа больных с хронической почечной недостаточностью, так и высокой стоимостью и относительно неудовлетворительными исходами их ле
Хронические заболевания почек представляют собой серьезную проблему здравоохранения. Это определяется как неуклонным ростом числа больных с хронической почечной недостаточностью, так и высокой стоимостью и относительно неудовлетворительными исходами их лечения [1]. Анализ Базы данных пациентов с заболеваниями почек (USRDS) и результатов исследования NHANES III в США показал, что около 26 млн взрослых, то есть примерно 14,6% от числа населения старше 20 лет, страдают хроническими заболеваниями почек [4]. За последние пять лет число больных, находящихся на заместительной почечной терапии, увеличилось более чем на 25% и на данный момент составляет более 2 млн человек. При этом наибольшее количество больных, получающих заместительную почечную терапию, зарегистрировано в Японии (2230 пациентов на 1 млн жителей) и в США (1650 больных на 1 млн жителей). Наибольший рост числа таких пациентов зафиксирован в развивающихся странах (в том числе в России) — свыше 50% за 5 лет [6].
Исходя из данных о весьма значительной распространенности хронических заболеваний почек и динамике прироста терминальной стадии хронической почечной недостаточности в течение последних 20 лет эксперты прогнозируют и в будущем дальнейший рост численности этой категории больных, тем более что, благодаря значительному техническому прогрессу, заместительная почечная терапия в настоящее время может применяться практически без ограничений [4].
Проблема лечения терминальной стадии хронической почечной недостаточности усугубляется тем, что, несмотря на значительный прогресс в заместительной почечной терапии, ее прогноз все еще остается весьма неблагоприятным. В США сохраняется высокая годичная летальность пациентов, находящихся на заместительной почечной терапии, — более 20%. Ожидаемая продолжительность их жизни значительно короче, чем в сходной возрастной группе. Так, для пациентов в возрасте от 40 до 44 лет она составляет 7,1–11,5 года, а для пациентов от 60 до 64 лет — 2,7–3,9 года. Частота сопутствующих заболеваний у больных с хроническими заболеваниями почек также высока. Их среднее количество у больного, находящегося на заместительной почечной терапии, равно четырем, и основную роль при этом играют заболевания сердечно-сосудистой системы [22].
Пациенты с хроническими заболеваниями почек имеют большую вероятность умереть от осложнений своего заболевания, чем дожить до потребности в диализе. Летальность вследствие заболеваний сердца среди пациентов с терминальной стадией хронической почечной недостаточности в 10 раз выше, чем в общей популяции. Например, по данным американского регистра 2002 года у больных с почечной недостаточностью в 24,8% случаев выявлена ишемическая болезнь сердца, а в 8,7% — инфаркт миокарда [29]. У пожилых пациентов с хронической почечной недостаточностью частота ишемической болезни сердца выше на 22%, латентной ишемии — на 16%, а новых коронарных событий — в 3,4 раза по сравнению с пациентами без нарушения функции почек [6]. По данным исследования HOPE легкая почечная недостаточность (креатинин плазмы 124–200 мкмоль/л), независимо от других факторов риска и лечения, ассоциировалась с увеличением сердечно-сосудистой смертности от инфаркта миокарда и инсульта на 40% [25].
Предметом интереса недавних исследований стал вопрос, в какой мере сопутствующие сердечно-сосудистые заболевания могут быть связаны с нарушениями функции паращитовидных желез, развивающимися параллельно со снижением функции почек. Концепция, в соответствии с которой воздействие на рецепторы, подобные рецепторам паращитовидных желез, обнаруженные во многих органах и тканях, могут играть определенную роль в развитии и прогрессировании сердечно-сосудистых заболеваний у пациентов с хроническими заболеваниями почек, является относительно новой [2].
Вторичный гиперпаратиреоз при хронических заболеваниях почек
У пациентов с хроническими заболеваниями почек нарушенный синтез гормонально-активного витамина D в сочетании с длительной гиперкальциемией и повышенным уровнем фосфатов приводит к вторичному гиперпаратиреозу, одному из наиболее частых и тяжелых осложнений (около 30% пациентов, находящихся на программном гемодиализе) [12]. Это состояние, характеризующееся компенсаторной гиперсекрецией паратиреоидного гормона, приводит как к морфологическим изменениям паращитовидных желез, так и к развитию фиброзного остеита, потере костной массы и к сопутствующим сердечно-сосудистым заболеваниям [20]. Как правило, уровни паратиреоидного гормона в крови начинают повышаться при уменьшении скорости клубочковой фильтрации ниже 60 мл/мин/1,73 м2 [22]. К настоящему времени вопрос о времени появления у пациентов с хроническими заболеваниями почек сопутствующих сердечно-сосудистых заболеваний, их каузальной связи с дисфункцией паращитовидных желез и возможности обратного развития на фоне патогенетического лечения вторичного гиперпаратиреоза до конца не ясен [2, 3].
Давно известно, что паратиреоидный гормон оказывает воздействие на функционирование многих органов и систем [3]. При уремии, выделяясь в супрафизиологических концентрациях, он приобретает черты «универсального уремического токсина», вызывая плейотропную органную дисфункцию. Гиперсекреция паратиреоидного гормона способствует развитию ренальной остеодистрофии, уремической кардиомиопатии, «кальцификации миокарда», клапанов сердца и его проводящей системы, диффузному фиброзу миокарда, внескелетной кальцификации, артериальной гипертензии, ускорению развития атеросклероза, генерализованной васкулопатии, энцефалопатии; влияет практически на все стадии гемопоэза; нарушает секрецию инсулина [3, 15, 17, 20, 25, 31]. Эти события неразрывно связаны (по крайней мере, частично) с избыточной концентрацией паратиреоидного гормона и плохо корригируются заместительной почечной терапией.
Вторичная гиперплазия паращитовидных желез с повышением уровня паратиреоидного гормона в крови развивается практически у всех больных с хроническими заболеваниями почек. Вторичный гиперпаратиреоз у больных с хроническими заболеваниями почек — это компенсаторная гиперфункция паращитовидных желез, исходно направленная на поддержание физиологических параметров минерального и костного обмена, приводящая при прогрессировании почечной недостаточности к необратимым морфологическим изменениям (гипертрофии и гиперплазии главных клеток) паращитовидных желез [3].
Таким образом, своевременная диагностика, профилактика и адекватное лечение вторичного гиперпаратиреоза чрезвычайно важны для повышения качества и продолжительности жизни пациентов с хроническими заболеваниями почек.
Патогенез вторичного гиперпаратиреоза при хронических заболеваниях почек
Патогенез вторичного гиперпаратиреоза при хронических заболеваниях почек до конца не ясен и продолжает уточняться. В развитии вторичного гиперпаратиреоза играют роль разнообразные факторы, что приводит к запуску целого каскада биохимических и патофизиологических изменений, приводящих к необратимым морфологическим изменениям паращитовидных желез [2, 3, 22, 23]: транзиторная и/или персистирующая гиперфосфатемия (ретенция фосфатов); резистентность рецепторов органов-мишеней к паратиреоидному гормону; изменение метаболизма витамина D.
На сегодняшний день в целом остается верной гипотеза Bricker N.?S. (1972), в основу которой были положены представления о том, что при хронической почечной недостаточности главным стимулом к развитию вторичного гиперпаратиреоза является гипокальциемия, которая возникает в ответ на гиперфосфатемию, связанную с ретенцией фосфатов [7, 8]. При хронической почечной недостаточности, особенно в терминальной ее стадии, происходит патологическая фенотипическая модуляция рецепторов (в т. ч. из-за изменения молекулярной структуры и их количества) к ионизированному кальцию на поверхности клеток паращитовидной железы и других органов-мишеней (кость, кишечник, сосуды и прочее), что кардинально изменяет гомеостаз кальция. В результате происходит сдвиг секреторной set-point и клетки паращитовидных желез начинают высвобождать паратиреоидный гормон в ответ не только на низкую, но и на нормальную концентрацию ионизированного кальция в крови больного [5, 9]. Снижение концентрации в крови 1,25-дигидроксихолекальциферола и увеличение концентрации фосфатов также являются прямыми стимуляторами синтеза паратиреоидного гормона [7, 8].
Эти представления легли в основу широкого клинического применения у пациентов, находящихся на заместительной почечной терапии, гипофосфатной диеты, фосфат-связывающих препаратов и кальцитриола. В результате удалось добиться более благоприятного течения ренальных остеодистрофий. Однако это не уменьшило остроту проблемы вторичного гиперпаратиреоза и связанных с ним осложнений со стороны сердечно-сосудистой системы.
Современные стандартные подходы к лечению вторичного гиперпаратиреоза при хронических заболеваниях почек
Современная (стандартная) терапия нарушений минерального обмена и связанных с ним осложнений включает диетические рекомендации по ограничению приема фосфатов, прием аналогов витамина D и фосфат-связывающих препаратов. Это в ряде случаев позволяет контролировать показатели фосфорно-кальциевого обмена и уровень паратиреоидного гормона в пределах целевых значений, установленных K/DOQI [22]. Целью терапии вторичного гиперпаратиреоза является снижение четырех лабораторных показателей: уровня паратиреоидного гормона, кальция и фосфора в сыворотке крови, а также фосфорно-кальциевого произведения (табл. 1).
Cтандартная терапия нарушений минерального и костного обмена по данным литературы более чем в половине случаев не позволяет достичь необходимого клинического эффекта, а в некоторых ситуациях даже противопоказана [20].
Так, лишь 47,5% пациентов, находящихся на программном гемодиализе, соблюдают диету, направленную на ограничение фосфатов, при этом уровень фосфора и кальция сыворотки у этой группы больных не имеет достоверных различий по сравнению с пациентами, не соблюдающими диету. Кроме того, содержание фосфора в различных диетах, назначаемых пациентам, варьирует от 550 до 1000 мг/сутки (18–36 ммоль/сутки), что затрудняет контроль количества поступающих с пищей фосфатов [2].
Адекватный гемодиализ также не всегда позволяет справиться с нарушениями минерального обмена. Известно, что современная гемодиализная терапия позволяет удалять лишь лимитированное количество фосфатов: от 20 до 40 ммоль за сеанс, что за неделю составляет 60–120 ммоль [24]. Более того, риск развития тяжелых форм гиперпаратиреоза (и, как следствие,?— относительный риск смерти) у таких больных прямо пропорционален продолжительности нахождения на гемодиализе (смертность в этой группе больных составляет 44% за 4 года) [1]. Эффективным является увеличение диализного клиренса фосфатов с использованием ежедневного дневного или ночного гемодиализа, гемодиафильтрации [11]. Однако такой подход неприменим в широкой клинической практике.
Эффективность терапии активными формами витамина D, например кальцитриолом, также зачастую не оправдывает ожиданий. Применение этой группы препаратов ограничено, во-первых, из-за исходной или развивающейся на фоне лечения резистентности, что требует назначения их в дозах, превышающих физиологические. Во-вторых, имея относительно узкое «терапевтическое окно» и усиливая всасывание кальция и фосфора в желудочно-кишечном тракте, они приводят к гиперкальциемии, усугубляют гиперфосфатемию и увеличивают фосфорно-кальциевое произведение [28]. Предполагаемые механизмы резистентности к лечению активированными аналогами витамина D при хронической почечной недостаточности включают в себя: опосредованные уремией снижение транспорта кальцитриола в паращитовидные железы; снижение образования комплекса кальцитриол–рецепторы к витамину D; снижение содержания функциональных рецепторов к витамину D в ткани паращитовидных желез [12]. Парикальцитол (Земплар) — синтетический селективный активатор рецепторов витамина D.
Подобные парикальцитолу модифицированные аналоги витамина D имеют меньший кальциемический эффект и, соответственно, более широкое терапевтическое окно [12, 19]. Кроме того, они быстрее, чем кальцитриол, подавляют секрецию паратиреоидного гормона и приводят к менее выраженному увеличению концентрации кальция и фосфора в сыворотке [27]. Парикальцитол сохраняет свою способность снижать паратиреоидный гормон у пациентов с гиперфосфатемией или с устойчивостью к терапии кальцитриолом [18].
Традиционное применение кальциевых фосфат-биндеров позволяет в ряде случаев корригировать гиперфосфатемию и гипокальциемию. Однако эта группа препаратов позволяет абсорбировать не более 50% потребляемого фосфора [16]. Кроме того, как любой другой препарат, фосфат-биндеры не лишены побочных эффектов: гиперкальциемия за счет всасывания кальция; связывание в кишечнике железа наряду с фосфатом; желудочно-кишечные расстройства. Необходимо считаться с тем, что на стандартной диете (1–1,2 г/кг/сутки белка) эффективны только высокие дозы карбоната кальция (9–10 г/сутки). Длительное применение таких доз карбоната кальция в 60% случаев осложняется гиперкальциемией. В настоящее время созданы фосфат-биндеры на полимерной основе, не содержащие ни алюминия, ни кальция и не всасывающиеся в кишечнике: севеламера гидрохлорид (RenaGel), севеламера карбонат (Renvela), Genzyme, Ирландия. Основное различие между ними состоит в том, что последний не вызывает метаболического ацидоза и таким образом не способствует прогрессированию костной болезни. Однако опыта применения этой группы препаратов в России пока нет [2].
В качестве крайней меры пациентам с осложненными формами вторичного гиперпаратиреоза применяется оперативное лечение, которое, к сожалению, подчас также оказывается неэффективным [2].
Указанные трудности в лечении нарушений минерального и костного обмена у больных с хроническими болезнями почек способствовали разработке и внедрению в клиническую практику принципиально новой группы препаратов — кальцимиметиков, изменяющих чувствительность рецепторов паращитовидных желез. Цинакалцет (Код АТХ: Н05ВХ01) производится международной биотехнологической компанией AMGEN (США) и зарегистрирован в Северной Америке под торговым названием Сенсипар, а в Европе — Мимпара.
В России препарат появился относительно недавно, поэтому достаточный опыт его практического применения еще не накоплен. За рубежом цинакалцет активно применяется с 2004 года более чем в 34 странах и хорошо зарекомендовал себя не только с клинической, но и с экономической точки зрения, позволяя заметно снизить затраты на лечение тяжелых осложнений хронических заболеваний почек.
Цинакалцет обладает прямым кальцимиметическим действием, непосредственно снижающим уровень паратиреоидного гормона, повышая чувствительность рецептора к внеклеточному кальцию. Снижение уровня паратиреоидного гормона коррелирует с концентрацией цинакалцета в крови. После перорального приема цинакалцета его максимальная концентрация в плазме крови достигается примерно через 2–6 часов, что сопровождается максимальным снижением уровня паратиреоидного гормона в крови. После этого концентрация цинакалцета начинает снижаться, а уровень паратиреоидного гормона повышается в течение 12 часов после введения дозы, в последующем супрессия паратиреоидного гормона остается примерно на одном и том же уровне до конца суточного интервала при режиме дозирования один раз в день. Примерно 80% вводимой дозы цинакалцета выводится почками, 15% — через желудочно-кишечный тракт. Снижение концентрации цинакалцета происходит в два этапа: первоначальный период полувыведения составляет примерно 6 часов, окончательный — от 30 до 40 часов. Стабильное содержание препарата достигается в течение 7 дней с минимальной кумуляцией. После достижения стабильной фазы концентрация кальция в сыворотке крови остается на постоянном уровне в течение всего интервала между приемами препарата. По данным литературы цинакалцет позволяет существенно снизить уровень паратиреоидного гормона уже к концу второй недели лечения.
В качестве иллюстрации вышесказанному приводится следующий клинический пример:
Больная Х., 64 года, с декабря 2005 года находится на лечении программным гемодиализом (в ГВКГ им. Н.?Н.?Бурденко с апреля 2007 года) по поводу терминальной почечной недостаточности в исходе диабетической нефропатии в сочетании с хроническим пиелонефритом. С 1965 года диагностируется алиментарно-конституциональное ожирение 2–3 степени, с 1996 года — сахарный диабет 2-го типа средней тяжести, а затем — тяжелого течения. С 1998 года — ишемическая болезнь сердца: клиника нагрузочной стенокардии отсутствовала, диагноз верифицирован на основании признаков «безболевой ишемии» миокарда и AV-блокады I степени по данным суточного мониторирования электрокардиограммы. Примерно с того же времени повышение уровня артериального давления (АД) до 220 и 140 мм рт. ст., адаптирована к АД 160/100 мм рт. ст. Постоянная четырехкомпонентная гипотензивная терапия в составе: Альбарел 2 мг/сутки, Амловас 20 мг/сутки, Аккупро 20 мг/сутки, Эгилок 100 мг/сутки — позволяла поддерживать целевой уровень АД (не свыше 140/90 мм рт. ст.) до 2005 года. С целью профилактики атеросклеротических осложнений постоянно принимала статины в суточной дозе 10 мг.
С начала 2005 года присоединяются клинико-лабораторные и инструментальные признаки прогрессирования атеросклероза, «озлокачествления» гипертензивного синдрома: в январе 2005 года появляется микроальбуминурия, которая уже в марте сменяется протеинурией до 1,5 г/сутки; несмотря на регулярный прием рекомендованных гипотензивных препаратов развивается лабильность АД. В связи с этим по рекомендации врачей поликлиники при ситуационном повышении АД свыше 160/100 мм рт. ст. (до двух-трех раз в неделю) принимала дополнительно Кордафлекс 40 мг/сутки. По данным визуализирующих методов исследования (эхокардиографии, рентгенографии органов грудной клетки) определяется достаточно быстрое увеличение массы миокарда (исходно 345 г, в последующем 436 г) с появлением признаков диастолической дисфункции первого типа и клинических симптомов хронической сердечной недостаточности на уровне функциональной классификации (ФК) II, метастатической кальцификации мягких тканей, крупных сосудов и створок аортального клапана (атеросклеротический стеноз устья аорты), что в тот период времени трактовалось как следствие особенно тяжелого течения атеросклероза, и в связи с этим увеличивается суточная доза статинов до 20 мг.
В декабре 2005 года на фоне роста азотемии (креатинин сыворотки крови 780 мкмоль/л) в результате обострения пиелонефрита, присоединения пневмонии у больной диагностируется терминальная стадия хронической почечной недостаточности и начинается лечение программным гемодиализом (3 раза в неделю по 4 часа), проведение которого вначале сопровождалось усугублением тяжести гипертензивного синдрома (АД до 240/140 мм рт. ст.). В марте 2006 и феврале 2007 года на фоне плохо поддающейся коррекции артериальной гипертензии переносит повторные острые нарушения мозгового кровообращения в бассейне левой среднемозговой артерии с исходом в правосторонний гемипарез и сенсорно-моторную афазию. В апреле 2007 года для продолжения лечения переводится в ГВКГ им. Н.?Н.?Бурденко.
В этот период у больной сохраняется выраженная артериальная гипертензия (180–200/80–90 мм рт. ст.), резистентная к стандартной ультрафильтрации и вышеуказанной медикаментозной терапии. Проведение гемодиализа с ультрафильтрацией в ежедневном режиме в течение 6 дней в неделю позволило снизить «сухой вес» на 6 кг, что сопровождалось стабилизацией АД на уровне 160/90 мм рт. ст. Концентрация фосфора в сыворотке крови составляла 2,51 ммоль/л, кальция — 2,62 ммоль/л (фосфорно-кальциевое произведение = 6,58 ммоль2/л2), уровень паратиреоидного гормона — 24,8 пг/мл. Учитывая «высокое» фосфорно-кальциевое произведение и нормальное содержание паратиреоидного гормона, медикаментозная терапия не назначалась, больной рекомендовалась гипофосфатная диета и прием карбоната кальция (до 3 г в сутки), однако соблюдение диетических правил оказалось невозможным из-за двигательных расстройств (правосторонняя гемиплегия) и низкого комплаенса (дисциркуляторная энцефалопатия с выраженными когнитивными расстройствами). Это в течение трех месяцев привело к усугублению гиперфосфатемии и гиперкальциемии (3,0 ммоль/л и 2,7 ммоль/л соответственно).
Несмотря на почти полное обездвиживание больной, предрасполагающее к развитию адинамической болезни кости, появляются лабораторные и клинические признаки гиперпаратиреоза: увеличение уровня паратиреоидного гормона до 488 пг/мл, присоединение нестерпимого кожного зуда. Ультразвуковое исследование паращитовидных желез не выявило аденоматозных изменений. Высокий уровень фосфора сделал невозможным назначение активированных аналогов витамина D. Было принято решение об изменении диализной программы с увеличением времени диализа до 15 часов в неделю и добавлением к стандартному гемодиализу еженедельно проводимой гемодиафильтрации (конвекционный клиренс — 21 литр в неделю), использовались также индивидуальные диализаторы с мембраной повышенной сорбционной активности (полиметилметакрилат) с достижением недельного Kt/V до 3,75. Это позволило приостановить прогрессирование клинических и лабораторных признаков гиперпаратиреоза (уровень паратиреоидного гормона к декабрю 2008 года составлял 504 пг/мл), выраженность кожного зуда уменьшилась, однако уровень фосфора и кальция по-прежнему оставался высоким (фосфорно-кальциевое произведение > 8,2 ммоль2/л2). Когда все методы современной терапии нарушений фосфорно-кальциевого и костного обмена были исчерпаны, нами был назначен цинакалцет (декабрь 2008 года) в стартовой дозе 30 мг/сутки.
В дальнейшем контроль показателей фосфорно-кальциевого обмена и уровня паратиреоидного гормона осуществлялся один раз в месяц. С целью оценки возможного влияния цинакалцета на уровень АД, функцию сердечной мышцы ежемесячно выполнялись трансторакальная эхокардиография, суточное мониторирование АД и ЭКГ. Оценка нарушений диастолической функции левого желудочка сердца выполнялась по общепринятым критериям [10, 13, 14]. Ежедневно контролировались масса тела, уровень АД и частота сердечных сокращений (ЧСС) (утром и вечером).
Динамический контроль за указанными параметрами показал, что через 2 недели лечения у больной Х. стойко снизился уровень как систолического, так и диастолического АД (со 160/90 мм рт. ст. до 140/80 мм рт. ст.), уменьшилась ЧСС (с 90 до 78 ударов в минуту), что подтверждалось данными СМАД и ХМЭКГ в январе 2009 года. Снижение АД и урежение ЧСС позволило откорректировать в сторону уменьшения состав гипотензивной терапии: постепенно были полностью отменены Эгилок и Кордафлекс. Уровни паратиреоидного гормона, кальция и фосфора крови оставались прежними. Поскольку в «Инструкции по применению цинакалцета» заявлено, что транзиторное снижение паратиреоидного гормона начинается через 6 часов после приема первой дозы, а стойкое — через 7 дней лечения, отсутствие эффекта через месяц приема препарата у нашей больной было расценено как следствие недостаточной начальной дозы, в связи с чем она была увеличена до 60 мг/сутки (2 таблетки). Однако появление через два дня стойкой тошноты заставило нас вернуться к исходной дозе цинакалцета 30 мг в сутки. Начальное снижение уровня паратиреоидного гормона до 345 пг/мл отмечено лишь в феврале 2009 года — на третьем месяце лечения цинакалцетом в дозе 30 мг/сутки. Еще через месяц начали снижаться уровни кальция, фосфора в крови и фосфорно-кальциевое произведение. Прием цинакалцета в той же дозе в монотонном режиме в течение четырех месяцев позволил практически нормализовать концентрацию кальция и фосфора сыворотки крови (соответственно 2,06 и 2,24 ммоль/л) к июлю 2009 года, а также снизить активность паратиреоидного гормона до 155 пг/мл.
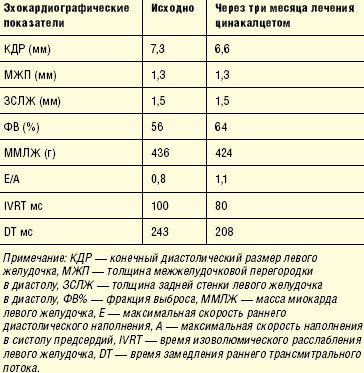
Исходно масса миокарда была повышена до 436 г за счет концентрической гипертрофии и в последующем не изменилась, однако через три месяца лечения цинакалцетом улучшились эхокардиографические показатели функционального состояния сердечной мышцы. Если в начале периода наблюдения имелись все признаки диастолической дисфункции первого типа, характеризующейся нарушением релаксации левого желудочка (аномальная релаксация) и патогенетически связанной с гипертрофией левого желудочка, повышенным уровнем артериального давления и паратиреоидного гормона, то через три месяца лечения цинакалцетом они регрессировали (табл. 2). Незначительно увеличилась фракция изгнания левого желудочка.
Обсуждение
Таким образом, только комплексный подход к лечению нарушений фосфорно-кальциевого обмена и вторичного гиперпаратиреоза с включением в фармакологическую комбинацию кальцимиметиков (цинакалцет) у больной, находящейся на заместительной почечной терапии, позволил поддерживать целевые уровни фосфорно-кальциевого обмена и паратиреоидного гормона, рекомендованные K/DOQI.
В приведенном клиническом случае традиционные подходы к коррекции минерального и костного обмена и связанного с ними вторичного гиперпаратиреоза у больной с терминальной стадией хронической почечной недостаточности, находящейся на гемодиализе, оказались неэффективными, как нам видится, по следующим причинам: невозможность соблюдения гипофосфатемической диеты и приема фосфат-биндеров (карбоната кальция) пациенткой с интеллектуально-мнестическими и двигательными расстройствами; назначение аналогов активированного витамина D (кальцитриол) было ограничено гиперкальциемией.
Дополнение комплексного лечения нарушений минерального обмена цинакалцетом позволило в течение трех месяцев достичь целевых значений минерального обмена и уровня паратиреоидного гормона. Преимуществом цинакалцета в данном случае мы считаем, помимо его очевидной эффективности в отношении гиперфункции паращитовидных желез и минерального обмена, возможность точного дозирования и однократного приема в течение суток.
Более спокойное течение артериальной гипертензии на наш взгляд явилось следствием комплекса причин: сыграли свою роль устранение гипергидратации (исходная масса тела составляла 90 кг, в последующем — 84 кг), успешная коррекции фосфорно-кальциевого обмена и снижение уровня паратиреоидного гормона. Учитывая относительно быстрое достижение нормотензии без увеличения количества и суточной дозировки антигипертензивных препаратов, нельзя исключать непосредственный гипотензивный эффект цинакалцета. Экспериментально были установлены как прямой, так и опосредованный повышенной продукцией NO вазодилятирующий эффект цинакалцета [26], а также его ингибирующее влияние на выработку ренина юкстагломерулярным аппаратом почек [23].
Диспептический синдром в виде тошноты и тяжести в эпигастрии, развившийся на следующий день после увеличения вдвое (до 60 мг) суточной дозы цинакалцета, регрессировал после возвращения к исходной дозе 30 мг так же быстро, как и развился, что не потребовало отмены препарата. Лабораторно-инструментальное обследование (фиброгастродуоденоскопия, ультразвуковое исследование органов брюшной полости, биохимическое тестирование общей и панкератической амилазы в крови и диастазы в моче) не выявило какой-либо патологии со стороны дуоденохоледохопанкреатической зоны, что позволило нам рассматривать развитие данного симптомокомплекса в рамках побочного действия цинакалцета и сделать предварительный вывод о хорошей переносимости препарата. По результатам контролируемых клинических исследований (данные о 656 больных, принимавших цинакалцет, и о 470 больных, принимавших плацебо) наиболее часто встречающимися побочными эффектами были тошнота и рвота, которые отмечались у 31% больных в группе терапии цинакалцетом и у 19% больных в группе плацебо, а также у 27% больных в группе терапии цинакалцетом и у 15% в группе плацебо. Тошнота и рвота были легкой и умеренной степени выраженности и в большинстве случаев носили кратковременный характер. Прекращение терапии в результате развития нежелательных эффектов было вызвано главным образом тошнотой (5%) и рвотой (4%).
Причиной нарушения диастолической функции левого желудочка у больной Х. на наш взгляд являлась концентрическая гипертрофия миокарда, как один из наиболее часто встречающихся вариантов ремоделирования левого желудочка у больных, длительно страдающих артериальной гипертензией и сахарным диабетом. Через три месяца приема цинакалцета стали регрессировать клинические симптомы хронической сердечной недостаточности и эхокардиографические признаки диастолической дисфункции, что более вероятно обусловлено как снижением АД до целевого уровня, так и устранением кардиотоксического действия супрафизиологических коцентраций паратиреоидного гормона. Сыграла свою роль и отмена бета-блокаторов, что стало возможным после назначения цинакалцета, поскольку эта группа препаратов негативно влияет на податливость миокарда. К сожалению, четких рекомендаций и схем терапии больных с диастолической хронической сердечной недостаточностью в настоящее время не существует. Европейское общество кардиологов (ESC) в 1997 г. опубликовало лишь общие направления терапии хронической сердечной недостаточности у больных с диастолической дисфункцией [29]. Поэтому любой положительный опыт лечения нарушений диастолической функции левого желудочка должен тщательно анализироваться.
Кроме того, минимальная эффективная поддерживающая доза цинакалцета 30 мг/сутки, что соответствует 1 упаковке (28 таблеток) на месяц, позволяет говорить о приемлемом фармакоэкономическом профиле препарата.
Таким образом, первый опыт применения цинакалцета при вторичном гиперпаратиреозе у пациентки с терминальной стадией хронической почечной недостаточности, находящейся на программном гемодиализе, оказался более чем положительным. Конечно, для выявления корреляции между снижением уровня паратиреоидного гормона и улучшением течения сердечно-сосудистой патологии необходимо накопить достаточный клинический опыт. Последующие исследования могут подтвердить или опровергнуть данное утверждение.