У лежачего больного плохо отходит мокрота что делать
Санация дыхательных путей: как избавиться от мокроты
Время чтения: 3 мин.
У больных спинальной мышечной атрофией часто возникают сложности с самостоятельным удалением мокроты или слизистого отделяемого из верхних и нижних дыхательных путей. Это связано с нарушением глотания, а также с повышенной секрецией мокроты во время простудных заболеваний, которым пациенты с СМА, к сожалению, часто подвержены.
Справиться с этой проблемой поможет специальный прибор — аспиратор.
Рассказываем, как пользоваться аспиратором, какие катетеры подходят для разных видов санации, а также о способах и правилах санации верхних дыхательных путей и носовой полости. Текст подготовлен совместно с фондом «Семьи СМА» по материалам видео-инструкции «Санация дыхательных путей: как избавиться от мокроты. В помощь родителям».
Когда нужно делать санацию дыхательных путей?
Если мы видим слизистое отделяемое из носа или во рту у ребенка, слышим шумное дыхание или чувствуем клокотание, положив руку на его грудную клетку — значит, ребенку требуется санация.
Что такое аспиратор?
Аспиратор — это прибор, который с помощью вакуума удаляет мокроту и слизь из верхних или нижних дыхательных путей через специальные трубочки. Аспираторы бывают стационарные, работающие от сети, и портативные, с аккумулятором.
Аспираторы / Фонд «Семьи СМА»
Аспиратор работает от напряжения 220 вольт. У него есть кнопка включения и регулятор силы всасывания. Обычно его устанавливают на максимум: иначе мощности домашнего аспиратора не хватит, чтобы эффективно удалить всю мокроту и слизь.
Для санации используются различные виды катетеров. Их делают разноцветными: каждый цвет соответствует определенному диаметру катетера.
Катетеры разной толщины, помеченные разным цветом / Фонд «Семьи СМА»
Чем толще катетер, тем эффективнее он удаляет мокроту и, к сожалению, тем больше неприятных ощущений доставляет ребенку. Более тонкий катетер практически незаметен, им можно заходить через носовую полость. Но он не всегда удаляет все, что нужно, и процедура санации затягивается.
Желательно иметь под рукой сразу несколько катетеров разного диаметра, и в каждой ситуации выбирать оптимальный.
Когда следует использовать аспиратор?
Аспиратор необходим после каждого использования откашливателя, поскольку откашливатель не всегда полностью удаляет мокроту из легких. Часто мокрота скапливается в области горла — ее нужно обязательно удалить. Завершить санацию можно с помощью слюноотсоса. Это поможет убрать мокроту, которая скопилась в дыхательных путях.
Аспиратор можно использовать самостоятельно для санации слюны или слизи, которая скопилась в ротовой полости.
Порядок работы с аспиратором
Прежде чем начать санацию, наденьте перчатки. Если такой возможности нет — хотя бы воспользуйтесь антисептиком для рук.
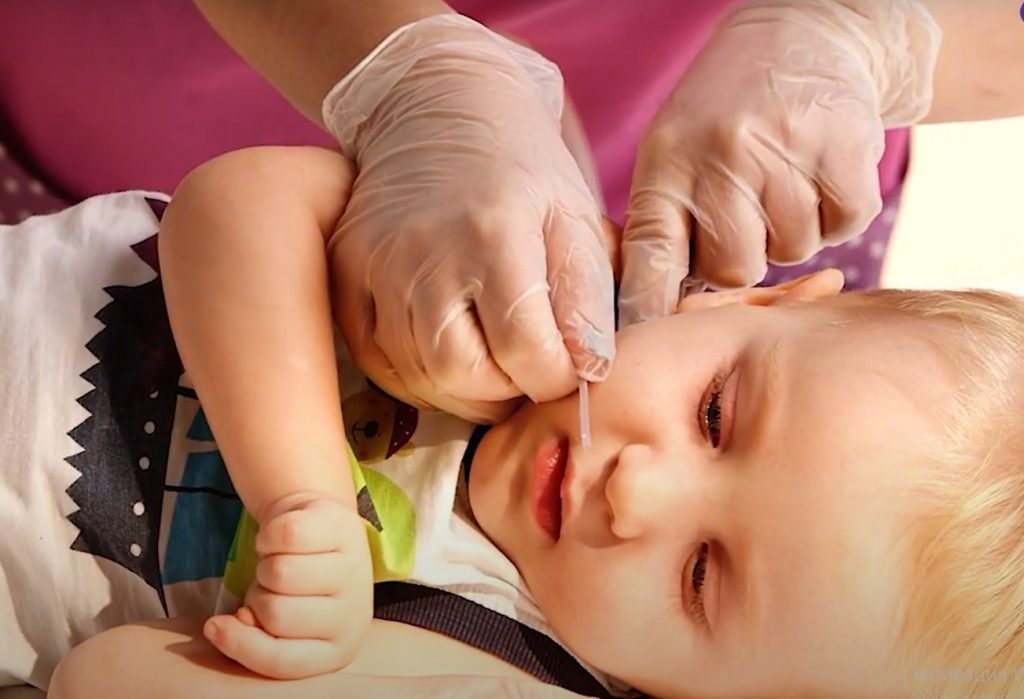
Не заводите катетер слишком глубоко, чтобы не спровоцировать у ребенка позывы к рвоте. Чтобы узнать нужную глубину, измерьте расстояние от верхней челюсти по губе до угла нижней челюсти.
Измеряем расстояние от верхней челюсти по губе до угла нижней челюсти / Фонд «Семьи СМА»
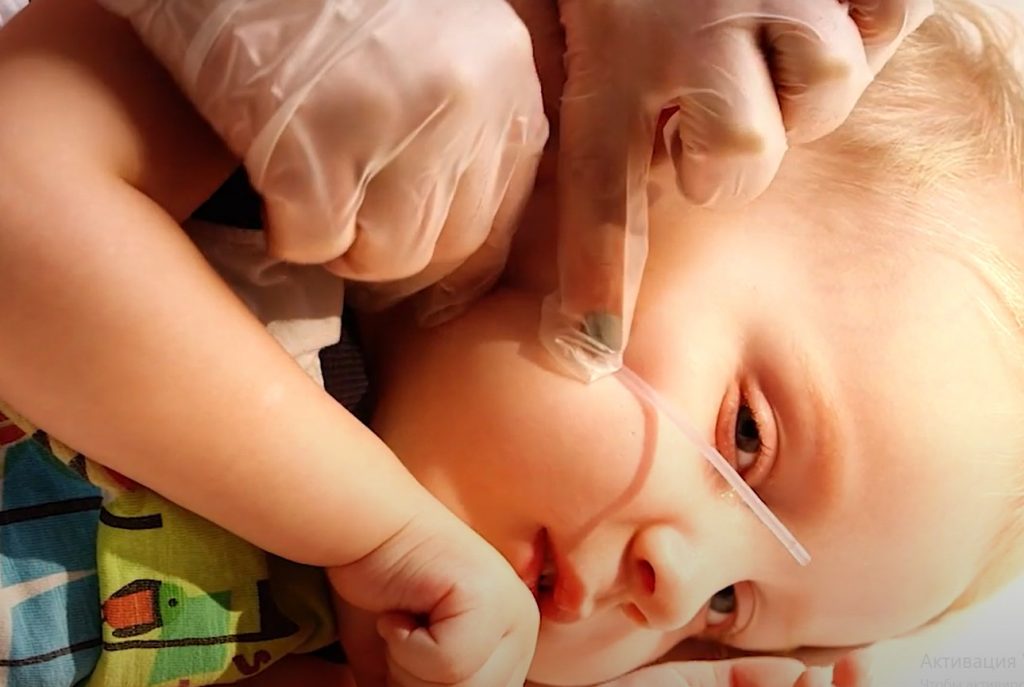
Для санации дыхательных путей через нос:
Отмеряем нужную длину, прикладывая катетер к кончику носа, ушку и углу челюсти / Фонд «Семьи СМА»
Если вводить зажатый катетер, можно травмировать слизистую ребенка.
Уход за аспиратором
Чашку, в которую собирается аспират, нужно мыть ежедневно, по мере заполнения. На чаше указана ее вместимость.
Фильтры следует менять по мере загрязнения, но не реже, чем раз в 6 месяцев.
Каждый электроаспиратор оснащен индикатором, который определяет давление. Давление не должно превышать 80 мм ртутного столба.
После завершения санации аспирационный катетер нужно промыть водным раствором хлоргексидина.
При санации детей с трахеостомой катетер не должен выходить за границы трахеостомической трубки. Если катетер будет слишком длинным, он травмирует слизистую, что может впоследствии привести к трахеомаляции и пролежням. Чтобы этого избежать, можно взять старую трубку, которой ребенок уже не пользуется, ввести в нее катетер и маркером сделать отметку. Этот эталонный катетер держать около кроватки ребенка и первое время с ним сверяться.
Кашель у пожилых людей
Кашель у пожилых людей
Особенности кашля у пожилых людей
Кашель у пожилых людей может быть симптомом серьезных заболеваний, и бороться с ним не так просто, как в молодом возрасте.
В стареющем организме все органы подвержены дегенеративно-дистрофическим изменениям, в том числе и респираторный тракт. Это такие изменения:
* ослабление мышц и подвижности реберных хрящей;
* ослабление иммунитета, атрофические изменения эпителия, сужение бронхов, пневмосклероз;
* уменьшение объема легких, снижение эластичности ткани;
* уменьшение кислорода в крови из-за снижения прохождения газов через альвеолы.
В результате многие органы, в том числе легкие, не выполняют свои функции в полном объеме. Это приводит к тому, что скапливается мокрота, которая хорошо отходит только при нахождении человека в лежачем положении, в других случаях слизь вызывает сильный кашель.
Помимо инфекционных заболеваний дыхательных путей, хронического бронхита, туберкулеза и рака, кашель у пожилых людей могут вызывать другие причины:
* избыточная масса тела – необходимы меры, направленные на снижение веса, в том числе регулярное выполнение посильного комплекса физических упражнений.
* нарушения в работе сердца – здесь требуется наблюдение и лечение у кардиолога.
Сердечный кашель
При сердечной недостаточности происходит застой крови в малом круге кровообращения. Вследствие этого возникает отек легочной ткани и появляется кашель, называемый в медицине сердечным бронхитом.
Начальные симптомы сердечного кашля у пожилых сходны с бронхитом, но он отличается тем, что является сухим, в отличие от простудного. При прогрессировании заболевания могут появиться сгустки крови, пугающие возможностью онкологии.
Сердечный кашель у пожилых может быть вызван следующими причинами:
— артериальная гипертензия, при которой в ночное время происходит скопление мокроты. Приступы надрывного кашля возникают в спокойном положении или при небольшой физической нагрузке и не прекращаются до полного отхождения мокроты;
— сердечная недостаточность (левожелудочковая). Из-за нехватки воздуха наблюдаются длительные, до полутора часов, приступы. Физические нагрузки усиливают кашель и могут вызвать надрывные приступы отхождения мокроты. Ночью кашель болезненный, хотя и не сильный;
— имплантированный кардиостимулятор.
Чтобы отличить кашель при сердечной недостаточности от других заболеваний, необходимо обратить внимание на такие симптомы, как сильное сердцебиение, одышка, возможная потеря сознания.
Человек дышит хрипло и прерывисто, иногда с мучительной одышкой. При прогрессировании болезни симптомы присутствуют даже в состоянии покоя, человек бывает вынужден спать в сидячем положении из-за одышки. Такие больные теряют в весе и чувствуют постоянную усталость.
Сухой кашель у пожилых людей
Люди пожилого и старческого возраста могут иметь несколько заболеваний одновременно, и кашель иногда вызывают несколько причин.
Сухой кашель у пожилых могут вызвать применяемые лекарственные препараты: неселективные бета-блокаторы, порошковый ингалятор и другие.
Как отличить сухой кашель при сердечной недостаточности от простудного или вызванного приемом лекарственных препаратов?
У пожилого человека с сердечной недостаточностью кашель усиливается в положении лежа; мокрота не отхаркивается; могут появляться сгустки крови в запущенных случаях.
Сухой кашель у пожилых людей может появиться при обострении бронхита, а также при пневмонии, коклюше, раке легких. Этот кашель зачастую проявляется в виде мучительных, затяжных приступов, не приносящих облегчения.
Иногда у пожилых людей кашель появляется во время приема пищи. Наиболее частой причиной этого является отсутствие зубов и плохое пережевывание пищи, заглатывание больших кусков еды. Кашель может быть обусловлен заболеваниями желудка: язва, гастроэзофагит. При гастроэзофагите происходит заброс содержимого желудка в пищевод, раздражаются рецепторы, и возникает кашель. Причинами кашля во время еды могут быть астма, обезвоживание организма, ожирение, респираторные заболевания.
Кашель у лежачих пожилых людей (застойная пневмония)
У лежачих пожилых людей происходит скопление легочной жидкости и слизи ввиду мышечной слабости и недостаточности сердечной деятельности. Это приводит к продолжительному надсадному кашлю. При отхождении небольшого количества мокроты человеку становится легче.
Если больной не может откашлять большое количество скопившейся мокроты, она застаивается, в ней развиваются микроорганизмы, и возникает застойная пневмония.
Лечение в этом случае направлено на уничтожение инфекции, восстановление вентиляции легких, снижение отечности легочной ткани.
В лечении используют:
* антибактериальные, отхаркивающие, антиоксидантные препараты;
* метаболики для улучшения работы сердца;
* необходима лечебная гимнастика, ингаляции, кислородная терапия.
Лечебная гимнастика
Для профилактики застойной пневмонии лежачему больному необходим массаж грудной клетки, частая смена положения, регулярное выполнение дыхательной гимнастики для улучшения вентиляции легких.
Особенности лечения у людей преклонного возраста
Для пожилых людей очень важно подобрать лекарственные препараты в зависимости от имеющихся у них заболеваний. Для этого надо обязательно посетить врача. Даже если это симптом банальной простуды, только врач сможет подобрать правильное лечение с учетом общего состояния здоровья пожилого пациента. Старческий кашель должен лечиться препаратами с коррекцией доз в соответствии с возрастом, с учетом изменения фильтрации в почках.
У пожилых людей снижен иммунитет, мокрота отходит плохо, а это очень весомый фактор риска развития пневмонии.
Медикаментозная терапия в гериатрической практике предусматривает назначение муколитиков — препаратов, разжижающих мокроту и способствующих ее выведению (бромгексин, лазолван, АЦЦ и др.).
При приеме этих препаратов нужно строго соблюдать определенные врачом дозировки.
Одновременно с муколитиками нельзя принимать противокашлевые препараты. Мокрота должна отходить свободно. Пожилым людям применение отхаркивающих средств рекомендуют в виде ингаляций. Это позволяет использовать средства с большей эффективностью и снизить воздействие лекарств на почки и печень.
Очень хорошо подходят для этих целей небулайзеры (компрессорные ингаляторы). Расщепленные в них до мельчайшей пыли лекарственные вещества попадают в самые мелкие участки бронхов. Небулайзер можно заправить обычным физраствором (хлоридом натрия) или щелочной минеральной водой и добавить к ним необходимую дозу муколитика. Как правило, мокрота отходит очень хорошо.
Наряду с муколитиками назначают антигистаминные препараты (лоратадин, супрастин, тавегил и др.), чтобы устранить аллергический фактор.
Для ускорения выздоровления пожилым людям назначают также витаминные препараты.
При высокой температуре и тяжелом состоянии врач может назначить антибиотики.
Врач-гериатр УЗ «6-я ЦРКП Ленинского района г. Минска»
Брицко Наталья Афанасьевна
Хронический и острый бронхит: чем опасна болезнь и как её лечить
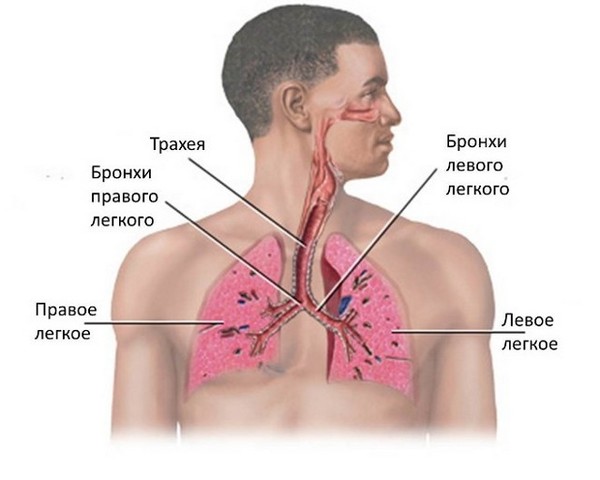
Бронхит – это патологическое состояние, при котором развивается воспаление бронхов. В свою очередь, бронхи – это пути, которые проводят воздух от трахеи к тканям легких, согревают воздушный поток, увлажняют и очищают его. Находятся они в нижней части трахеи и представляют собой две крупных ветви.
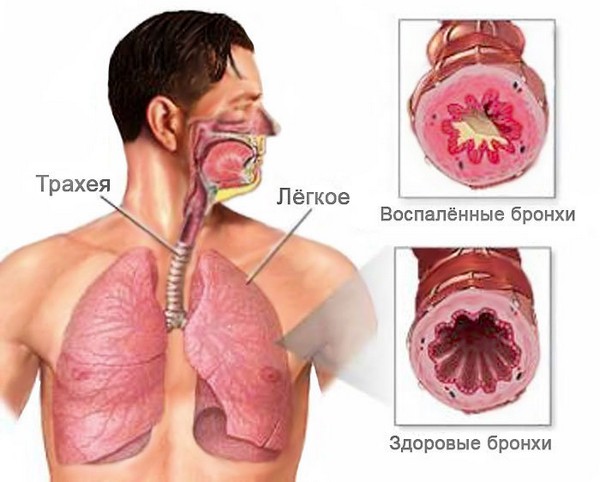
Болезнь вызывает воспаление слизистой оболочки или всей толщи бронхиальных стенок. Начинается чрезмерное выделение слизи, затрудняется дыхание. Организм пытается самостоятельно вывести лишнюю слизь, поэтому появляется сильный мучительный кашель. Патология может переходить из кратковременной острой в продолжительную хроническую форму, поэтому требует комплексного незамедлительного лечения.
Острый бронхит
Развивается в подавляющем большинстве случаев и представляет собой распространенное осложнение острой респираторной инфекции. Зачастую диагностируется у детей, так как они более восприимчивы к подобным инфекциям.
При остром поражении бронхов происходит размножение условно-патогенной микрофлоры. Слизистая меняет свою структуру, развивается поражение верхних слоев и стенок бронхов. Формируется отек слизистой, эпителиальные клетки отторгаются организмом, появляются инфильтраты на подслизистом слое. Процессы сопровождаются тяжелым продолжительным кашлем, который может сохраняться даже после излечения пациента.
Острая форма лечится в течение 3-4 недель. На протяжении этого времени восстанавливается структура и функции бронхов. При правильной и своевременной терапии прогноз благоприятный.
Хронический бронхит
При хроническом бронхите кашель с выделением мокроты наблюдается на протяжении не менее двух лет в течение трех месяцев ежегодно. При этом важно исключить наличие других причин кашля.
Такая форма чаще возникает у взрослых, так как формируется только при длительном раздражении бронхов. Причиной раздражения может быть не только многократно перенесенное острое заболевание, но и сигаретный дым, газы, пыль, химические испарения и прочие отрицательные факторы.
Продолжительное воздействие на слизистую бронхов неблагоприятных факторов вызывает изменения в слизистой, постепенное повышение выделения мокроты. Существенно снижается способность бронхов проводить воздух, а вентиляция легких нарушается.
Формы хронического бронхита
В зависимости от характера воспалительных процессов выделяют:
С учетом наличия нарушения проходимости (обструкции) дыхательных путей бронхит может быть:
По причинам развития болезни выделяют:
Причины заболевания
При острой и хронической формах причины развития патологического состояния бронхов несколько отличаются.
Острый бронхит в 90% случаев формируется в результате попадания в организм вирусной инфекции: гриппа, аденовируса, респираторно-синцитиального, коревого или коклюшного вируса, а также прочих возбудителей. Реже болезнь становится результатом бактериального поражения стафилококком, стрептококком, пневмококком и др.
Среди прочих факторов, которые способствуют развитию острой формы болезни:
При хронической форме основной причиной развития признано курение. У курильщиков болезнь диагностируют в 2-5 раз чаще, чем у некурящих людей. Табачный дым наносит вред как при активном, так и при пассивном курении.
Среди прочих предпосылок развития хронической формы – повторно перенесенные и частые острые бронхиты, ОРВИ, пневмонии, болезни носоглотки. Инфекционная составляющая в таких условиях усугубляет уже имеющееся поражение бронхов.
Симптомы бронхита
Признаки патологии отличаются в зависимости от острой или хронической формы течения болезни:
Осложнения
Острый бронхит может провоцировать осложнение в виде бронхопневмонии – инфекционно-воспалительного процесса, который поражает легкие, вызывает лихорадку, сухой кашель, общую слабость.
Бесконтрольное прогрессирование хронического заболевания приводит к регулярным острым пневмониям и со временем переходит в обструктивную болезнь легких. При этом сужается просвет и отекает слизистая дыхательных путей, частично разрушаются легочные ткани.
Хронический бронхит также может стать причиной развития легочной гипертензии, сердечно-легочной недостаточности, эмфиземы легких, бронхоэктатичской болезни, пневмонии и ряда других опасных заболеваний.
Когда стоит обратиться к врачу
Крайне важно не пускать болезнь на самотек. К врачу нужно обращаться при появлении первых симптомов возможного бронхиального поражения: кашля, повышенной температуры, недомогания. Врач проведет диагностику, укажет, как и чем лечить бронхит и кашель, а дальнейшая терапия пройдет в домашних условиях под контролем доктора. В большинстве случаев патология не требует госпитализации.
Бесконтрольное течение острой болезни в большинстве случаев приводит к усугублению симптоматики, повторному развитию заболевания, переходу в хроническую болезнь и формированию осложнений.
Чтобы определить болезнь и изучить степень поражения бронхов, необходима комплексная диагностика пациента и изучение клинической картины. Этим занимается терапевт или педиатр, который назначает необходимые для диагностики обследования. При необходимости он направляет пациента на консультации к пульмонологу и другим смежным специалистам.
Если по результатам опроса и осмотра у врача появились подозрения на бронхит или другие схожие болезни, назначаются дополнительные обследования:
Среди возможных дополнительных исследований: эхокардиография, электрокардиография, бронхография и др.
Лечение
Терапия бронхита носит комплексный характер, так как преследует цель избавить организм от инфекции, восстановить проходимость бронхов, устранить усугубляющие болезнь факторы.
В первые дни острой фазы необходимо придерживаться постельного режима, много пить, соблюдать молочно-растительную диету. Крайне важно отказаться от курения и поддерживать влажность воздуха в помещении, где находится больной, на уровне 40-60%.
Медикаментозная терапия острой стадии cводится к приему препаратов, которые облегчают симптомы и предотвращают развитие осложнений. Для этого используют:
Важную роль играет физиотерапия. Улучшить состояние пациента помогает лечебная гимнастика, физиотерапия, вибрационный массаж.
Хроническая форма заболевания требует продолжительного лечения как при обострении, так и во время ремиссии. Схема терапии предусматривает прием перечисленных препаратов по назначению врача, а также интенсивную программу легочной реабилитации, которая помогает снизить проявления болезни.
Максимально важно устранить из жизни пациента причину, которая спровоцировала развитие хронического бронхита, вести здоровый образ жизни, укреплять иммунитет и правильно питаться.
Профилактика бронхита
Профилактика легочных заболеваний – это комплексный и систематический процесс, цель которого – укрепить защитные силы организма и минимизировать воздействие факторов риска. Для этого необходимо в первую очередь отказаться от курения, защищать легкие от пыли, вредных химических соединений, слишком горячего или сухого воздуха. В рамках профилактики важно своевременно лечить хронические инфекции, предотвращать аллергические реакции и обязательно обращаться к врачу при первых признаках заболевания, проходить ежегодную вакцинацию от гриппа и пневмонии.
Муколитические средства в терапии хронической обструктивной болезни легких
Хроническая обструктивная болезнь легких (ХОБЛ) вне зависимости от степени тяжести является хроническим воспалительным процессом с поражением преимущественно дистального отдела дыхательных путей. Важная роль в развитии и дальнейшем прогрессировании воспа
Хроническая обструктивная болезнь легких (ХОБЛ) вне зависимости от степени тяжести является хроническим воспалительным процессом с поражением преимущественно дистального отдела дыхательных путей. Важная роль в развитии и дальнейшем прогрессировании воспаления бронхов отводится воздействию табачного дыма, поллютантов окружающей среды, инфекционных агентов [13, 14]. Одним из основных клинических проявлений воспаления слизистой дыхательных путей является кашель с отделением мокроты.
Процесс образования бронхиального секрета и его продвижение в проксимальном направлении является одной из защитных функций дыхания. Слой бронхиальной слизи увлажняет вдыхаемый воздух, нормализует его температуру, осаждает и эвакуирует пыль, фиксирует микробы и их токсины. Бронхиальный секрет не только механически защищает эпителий от микроорганизмов, но и оказывает бактериостатическое действие. Суточный объем бронхиального секрета в норме составляет от 10—15 до 100—150 мл, или в среднем 0,1–0,75 мл на 1 кг массы тела. Здоровый человек обычно не ощущает избытка бронхиального секрета, кроме того, он не вызывает кашлевой рефлекс, поскольку существует физиологический механизм выведения слизи из трахеобронхиального дерева — мукоцилиарный клиренс (транспорт) (МЦК). Он обеспечивается за счет скоординированной деятельности реснитчатых клеток, которые находятся в структуре многорядного призматического мерцательного эпителия. На их свободной поверхности находится около 200 мерцательных ресничек, совершающих 15—16 колебаний в секунду и перемещающих слой слизи со скоростью 4—10 мм в минуту. Контакт слизи с поверхностью клетки не превышает 0,1 с, что ограничивает время контакта бактерий с клетками слизистой бронхов, возможность их адгезии и внутриклеточной инвазии. Посредством МЦК бронхиальный секрет транспортируется в глотку и затем проглатывается. МЦК — важнейший защитный механизм органов дыхания, обеспечивающий очищение легких от различных ингалируемых веществ, продуктов метаболизма и др. [1, 5, 10].
Бронхиальный секрет продуцируется несколькими видами клеток. Бокаловидные клетки — одноклеточные железы мезокринового типа — выделяют слизистый секрет. Максимальное их количество наблюдается в экстраторакальной части трахеи, по мере уменьшения диаметра бронхов их количество прогрессивно сокращается, а в бронхиолах менее 1 мм они отсутствуют вовсе. У здорового человека соотношение реснитчатых и бокаловидных клеток составляет 10:1. Секреторные клетки Клара синтезируют фосфолипиды и бронхиальный сурфактант. Наиболее многочисленны они в мелких бронхах и бронхиолах. Предполагают, что именно они превращаются в бокаловидные клетки при развитии воспаления в трахеобронхиальном дереве. Альвеолярные пневмоциты II типа синтезируют альвеолярный сурфактант, который, кроме поддержания поверхностного натяжения альвеол и улучшения их растяжимости, принимает участие в транспорте инородных частиц из альвеол до воздухоносных путей, где, собственно, и начинается мукоцилиарный транспорт. Подслизистые бронхиальные железы, относящиеся к железам трубчато-ацинозного типа, выделяют слизисто-серозный секрет. Плазматические клетки, располагающиеся по всей поверхности слизистой трахеобронхиального дерева, вырабатывают иммуноглобулины (в проксимальных отделах вырабатываются преимущественно IgA, а в дистальных — IgG). IgA предотвращает фиксацию бактериальных токсинов к слизистой оболочке и проникновение их в более глубокие слои бронхиальной стенки. В то же время бактерии агглютинируются и элиминируются с мокротой [10].
В норме бронхиальная слизь состоит на 89—95% из воды, в которой находятся ионы Na+, Cl-, Ca+ и др. Эта жидкая часть мокроты необходима для нормального мукоцилиарного транспорта. От содержания воды в геле зависит консистенция мокроты. «Плотная» часть бронхиального секрета состоит из нерастворимых макромолекулярных соединений: высоко- и низкомолекулярных гликопротеинов (муцинов) (2—3%), представленных двумя подтипами: нейтральными (фукомицины) и кислыми (сиаломуцины и сульфамуцины), соотношение которых и обусловливает вязкий характер секрета; сложных белков плазмы — альбуминов, глобулинов, плазматических гликопротеинов (молекулы которых связаны между собой дисульфидными и водородными связями); иммуноглобулинов классов А, G, Е (2—3%); антипротеолитических ферментов — (1-антихимотрипсин, (1-антитрипсин (1—2%); липидов — преимущественно фосфолипиды бронхиального и альвеолярного сурфактанта и небольшое количество глицеридов, холестеролов и свободных жирных кислот (0,3—0,5%). Бронхиальный секрет характеризуется определенными физико-химическим свойствами, и в первую очередь такими реологическими характеристиками, как вязкость и эластичность, от которых зависит его способность к текучести [1, 9, 10].
По физико-химической структуре бронхиальный секрет представляет из себя многокомпонентный коллоидный раствор, который состоит из двух фаз: золь и гель. Золь — жидкая, растворимая фаза, представляет собой глубокий слой толщиной 2—4 мкм, который прилежит непосредственно к слизистой оболочке, в нем плавают и сокращаются реснички, энергия которых передается на него без задержки. В состав золя входят электролиты, сывороточные компоненты, местносекретируемые белки, биологически активные вещества, ферменты и их ингибиторы. Золь продуцируется в респираторной зоне (альвеолах и дыхательных бронхиолах), где он участвует в очищении воздуха, так как обладает умеренными адгезивными свойствами. По мере дальнейшего продвижения секрета к нему присоединяется содержимое бокаловидных клеток и серомукоидных желез, формирующих гель. Гель — нерастворимая, вязкоэластичная фаза — представляет собой верхний, наружный слой бронхиального секрета толщиной 2 мкм, расположенного над ресничками. Гель состоит из гликопротеинов, которые формируют фибриллярную структуру, представляющую собой широкую ячеистую сеть, элементы которой содержат водородные связи. Гель способен перемещаться только после повышения минимального напряжения сдвига (предела текучести), то есть тогда, когда разрываются связанные между собой ригидные цепи. Соотношение двух фаз геля и золя определяется активностью серозных и слизистых желез. Преобладающая активность серозных подслизистых желез приводит к образованию большого количества секрета с низким содержанием гликопротеинов – бронхорее. В противоположность этому гиперплазия слизеобразующих клеток с возрастанием их функциональной активности, наблюдаемая при хроническом бронхите, бронхиальной астме и т. д., характеризуется повышением содержания гликопротеинов, фракции геля и, соответственно, увеличением вязкости бронхиального секрета [1, 10].
Определенное значение имеют и адгезивные свойства секрета, обусловленные его связью с плотной поверхностью бронхов. Адгезия отражает способность к отрыву частей бронхиального секрета воздушным потоком во время кашля и зависит от состояния поверхности слизистой бронхов, их способности смачиваться слизью и характеристики самого секрета.
Таким образом, бронхиальный секрет представляет собой сложный комплекс, состоящий из секрета бронхиальных желез и бокаловидных клеток, поверхностного эпителия, продуктов метаболизма подвижных клеток, альвеолярного сурфактанта, тканевого транссудата. В чистом виде бронхиальный секрет может быть получен только при бронхоскопии. В клинической практике чаще пользуются понятием мокроты; последняя состоит из бронхиального секрета и слюны (см. рисунок) [1].
В ответ на воздействие повреждающего инфекционного и неинфекционного агентов первой реакцией слизистой трахеобронхиального дерева является развитие воспалительной реакции с гиперсекрецией слизи и перестройкой слизистой оболочки, особенно эпителия. До определенного момента гиперпродукция слизи носит защитный характер, но в дальнейшем изменяется не только количество, но и качество бронхиального секрета, что нарушает дренажную функцию бронхов и оказывает влияние на бронхиальную проходимость. Секретообразующие элементы воспаленной слизистой начинают продуцировать вязкую слизь, так как ее химический состав изменяется — увеличивается содержание гликопротеинов, происходит сдвиг в сторону преобладания нейтральных муцинов и уменьшения кислых, что приводит к увеличению фракции геля, его преобладанию над золем и, соответственно, к повышению вязкостно-эластических свойств бронхиального секрета. Этому способствует также значительное увеличение количества и площади распространения бокаловидных клеток вплоть до терминальных бронхиол. Существенно увеличивается также адгезивность мокроты, что отражает нарушение целостности слизистой бронхов и физико-химических свойств мокроты. Параллельно с повышением объема и вязкости мокроты наблюдается снижение ее эластичности вследствие повышения активности протеолитических ферментов бактериального происхождения и нейтрофильной эластазы лейкоцитов. Изменение вязкостно-эластических свойств бронхиального секрета сопровождается существенными качественными изменениями его состава: снижением содержания секреторного IgА, интерферона, лактоферрина, лизоцима, являющихся основными компонентами местного иммунитета и обладающих противовирусной и противомикробной активностью [6, 9, 10].
Ухудшение реологических свойств бронхиального секрета приводит также к нарушению подвижности ресничек мерцательного эпителия, что блокирует их очистительную функцию. С повышением вязкости скорость движения мокроты замедляется или вовсе прекращается. Густой и вязкий бронхиальный секрет со сниженными бактерицидными свойствами является хорошей питательной средой для различных микроорганизмов (вирусов, бактерий, грибов). Повышение вязкости, замедление скорости продвижения бронхиального секрета способствует фиксации, колонизации и более глубокому проникновению микроорганизмов в толщу слизистой оболочки бронхов, что приводит к усугублению воспалительного процесса, нарастанию бронхиальной обструкции, формированию оксидативного стресса. Все это способствует развитию центрилобулярной эмфиземы, дыхательной недостаточности и легочного сердца. Формирование эмфиземы приводит к постепенной утрате обратимого компонента бронхиальной обструкции и нарастанию ее необратимого компонента. Именно на ранних стадиях заболевания преобладает обратимая обструкция, которая складывается из трех компонентов: спазма гладкой мускулатуры, воспалительного отека слизистой оболочки бронхов, гиперсекреции и дискринии бронхиального секрета в сочетании с нарушением МКЦ [6, 12].
Таким образом, при лечении больных ХОБЛ необходимо использовать препараты, улучшающие или облегчающие отделение патологически измененного бронхиального секрета, предотвращающие мукостаз и улучшающие МЦК. С облегчением отделения секрета устраняется и один из важных факторов обратимой бронхиальной обструкции, а также уменьшается вероятность микробной колонизации дыхательных путей. Это достигается в значительной степени благодаря применению муколитических (мукорегуляторных) препаратов [10]. Однако следует помнить о том, что по механизму действия муколитики не являются средствами воздействия на основное звено ХОБЛ — воспалительную реакцию. Они используются в ходе симптоматической терапии, так как оказывают влияние на симптомы заболевания [6].
Наиболее распространены три группы муколитических препаратов: амброксол, ацетилцистеин, карбоцистеин и их производные.
Амброксол (лазолван, амбросан, амбробене, амброгексал, мукосольван, халиксол) (см. таблицу) представляет собой активный метаболит бромгексина (N-десметил-метаболит). В широкой терапевтической практике с успехом используются производные амброксола хлорида и гидрохлорида. Амброксол обладает секретолитическим и секретокинетическим действием, восстанавливает МКЦ, увеличивает проникновение антибиотиков в легочную ткань. Он стимулирует образование трахеобронхиального секрета пониженной вязкости. Важна также способность амброксола восстанавливать МКЦ путем стимуляции двигательной активности ресничек мерцательного эпителия. Отличительной особенностью амброксола и его производных является способность увеличивать продукцию сурфактанта за счет повышения его синтеза, секреции и торможения его распада. Являясь одним из компонентов системы местной защиты легких, сурфактант препятствует проникновению в клетки эпителия патогенных микроорганизмов. Сурфактант также усиливает активность ресничек мерцательного эпителия, что в сочетании с улучшением реологических свойств бронхиального секрета приводит к выраженному отхаркивающему эффекту.
В последние годы появились работы, авторы которых указывают на противовоспалительные и антиоксидантные свойства амброксола, которые можно объяснить его влиянием на высвобождение кислородных радикалов и вмешательством в метаболизм арахидоновой кислоты в очаге воспаления [22]. Однако эти данные нуждаются в дальнейшем уточнении [6].
Амброксол не обладает тератогенным действием, поэтому может использоваться у беременных женщин. Суточная доза препарата при приеме внутрь колеблется от 60 до 120 мг. Обычно взрослым и детям старше 12 лет назначают по 30 мг в таблетках или 4 мл раствора 3 раза в день в первые три дня, а затем дважды в сутки. Курс лечения средними терапевтическими дозами обычно составляет 7–10 дней. При тяжелой хронической почечной недостаточности необходимо снизить дозу или увеличить интервалы между приемами. Побочные явления наблюдаются редко и проявляются в виде тошноты, болей в животе, аллергических реакций, сухости во рту и носоглотке. Препарат не применяется совместно с противокашлевыми средствами, так как это способствует скоплению бронхиального секрета в дыхательных путях.
Бромгексин (бизолвон, бронхосан, флегамин, фулпен) является синтетическим производным алкалоида вазицина, который с древних времен применялся на Востоке как отхаркивающее средство. При приеме внутрь бромгексин превращается в активный метаболит — амброксол, и действие его аналогично действию амброксола, хотя и менее выражено. Бромгексин применяется внутрь в суточной дозе 32—48 мг, разделенной на 2—3 приема. В отличие от амброксола, при тяжелой печеночной недостаточности падает клиренс бромгексина, поэтому необходима корректировка дозы и режима дозирования. Препарат при многократном применении может кумулировать. Он не рекомендуется беременным женщинам и кормящим матерям [1].
Ацетилцистеин (мукомист, мукобене, АЦЦ, флуомицил) (см. таблицу) представляет собой N-производное природной аминокислоты L-цистеина. Производные N-ацетилцистеина являются активными муколитическими препаратами. Эти препараты характеризуются прямым действием на молекулярную структуру слизи. В молекуле ацетилцистеина содержатся сульфгидрильные группы, которые разрывают дисульфидные связи кислых мукополисахаридов мокроты, при этом происходит деполимеризация макромолекул и мокрота становится менее вязкой и адгезивной, легче отделяется при кашле. К разжижению мокроты приводит также стимуляция мукозных клеток, секрет которых обладает способностью лизировать фибрин и кровяные сгустки. Препарат эффективен как при гнойной, так и при слизистой мокроте. Данные о влиянии ацетилцистеина на мукоцилиарный транспорт противоречивы [1, 2].
Важным свойством ацетилцистеина является его способность стимулировать синтез глутатиона путем усиления активности глутатион-S-трансферазы, который принимает участие в процессах детоксикации [16]. Cущественным преимуществом ацетицилстеина является его антиоксидантная активность, которая реализуется различными путями. Препарат повышает внутриклеточную концентрацию глутатиона, выполняющего защитную функцию в дыхательной системе, препятствуя действию окислителей. Ацетилцистеин оказывает также прямое антиферментное действие на свободные радикалы. Кроме того, он снижает продукцию свободных радикалов альвеолярными макрофагами и усиливает фагоцитарную активность моноцитов, макрофагов полиморфонуклеаров [15, 17, 20]. Ацетилцистеин обладает определенными защитными свойствами, направленными против реактивных кислородных метаболитов, свободных радикалов, ответственных за развитие воспаления в воздухоносных путях, что особенно важно для заядлых курильщиков и пожилых больных, у которых активируются окислительные процессы и снижается антиоксидантная активность сыворотки крови [2, 6, 10, 18].
Ацетилцистеин назначают внутрь по 200 мг 3 раза в день (максимальная суточная доза 1200 мг) в течение 1—2 недель, возможно увеличение продолжительности его применения до 6 месяцев. Ацетилцистеин может также использоваться в виде внутрибронхиальных инстилляций по 1 мл 10%-ного раствора и промывания бронхов при лечебных бронхоскопиях. Имеются данные о том, что длительное применение ацетилцистеина при ХОБЛ приводит к снижению частоты, тяжести и длительности обострений [19, 21]. Однако высокие дозы и продолжительный прием ацетилцистеина могут уменьшать продукцию IgA и лизоцима, а также подавлять деятельность реснитчатых клеток, что ведет к нарушению МЦК. Нежелательным в ряде случаев, особенно при интратрахеальном введении препарата, является избыточное разжижение мокроты, способное вызвать синдром «затопления» легких и требующее в этом случае применения отсоса [10]. Среди побочных эффектов в отдельных случаях наблюдаются нарушения в деятельности пищеварительного тракта (тошнота, рвота, изжога, понос), изредка встречается гиперчувствительность в виде крапивницы и бронхоспазма.
Среди препаратов ацетилцистеина наибольшая активность наблюдается у флуимуцила. У этого же лекарственного средства наименее выражены побочные эффекты, так как оно почти не раздражает желудочно-кишечный тракт. Важным достоинством флуимуцила является возможность использования его раствора через небулайзер в комплексной терапии больных ХОБЛ, учитывая не только муколитические свойства препарата, но и антиоксидантную активность [6]. Он также предохраняет a1-антитрипсин от инактивирующего действия HOCl — мощного окислителя, вырабатываемого энзимом миелопероксидазы активных фагоцитов, а также снижает адгезию бактерий на эпителиальных клетках слизистой оболочки бронхов.
Карбоцистеин (бронкатор, мукодин, мукопронт, флюдитек, флуифорт) (см. таблицу) обладает одновременно как муколитическим, так и мукорегулирующим эффектом. Как муколитик он уменьшает вязкость и тягучесть бронхиального секрета, обеспечивая его экспекторацию, а как мукорегулятор — увеличивает синтез сиаломуцинов. Механизм действия карбоцистеина связан с активацией сиаловой трансферазы — фермента бокаловидных клеток слизистой оболочки бронхов, формирующих состав бронхиального секрета. Вместе с тем под действием карбоцистеина происходит регенерация слизистой оболочки, восстановление ее структуры, уменьшение (нормализация) количества бокаловидных клеток, особенно в терминальных бронхах, а следовательно, и уменьшение количества вырабатываемой слизи. Помимо этого, восстанавливается секреция иммунологически активного IgА (специфическая защита) и число сульфгидрильных групп (неспецифическая защита), улучшается МЦК, так как потенцируется деятельность реснитчатых клеток. Кроме прямого воздействия на муциногенную клетку, были выявлены и другие эффекты: антихемотаксический, противоокислительный и ионорегуляторный [9]. Действие карбоцистеина распространяется на все вовлеченные в патологический процесс отделы дыхательных путей — верхние и нижние, а также придаточные пазухи носа, среднее и внутреннее ухо.
Препараты карбоцистеина выпускаются только для приема внутрь (в виде капсул, гранул и сиропов). Среднесуточные дозы для взрослых: по одной капсуле или мерной ложке 3 раза в день. Как правило, продолжительность лечения составляет от 8–10 дней до 3 недель. Возможен длительный прием препарата в течение 6 месяцев. При длительном приеме препарат применяется 2 раза в день. В начале лечения через 3—5 дней объем мокроты увеличивается, а позже (к 9-му дню) снижается [10].
В числе побочных эффектов можно выделить тошноту, нарушения стула, боли в животе. При назначении препаратов карбоцистеина следует соблюдать некоторые меры предосторожности: нецелесообразно одновременно применять препараты, подавляющие секреторную функцию бронхов, и средства от кашля. Препараты карбоцистеина не следует назначать больным сахарным диабетом, так как в одной столовой ложке сиропа содержится 6 г сахарозы. Не рекомендуется применять карбоцистеин беременным и кормящим матерям [6].
Флуифорт представляет собой карбоцистеинлизиновую соль. Лизин увеличивает водорастворимость карбоцистеина, обеспечивая быстрое и полное всасывание; нейтрализует кислотность карбоцистеина, сокращая риск побочных эффектов со стороны желудочно-кишечного тракта. Флуифорт продолжает действовать в течение 8 дней после прекращения приема препарата.
Использование протеолитических ферментов в качестве муколитиков в настоящее время не рекомендуется в связи с возможным повреждением легочного матрикса и высоким риском развития серьезных побочных эффектов, таких как кровохарканье, аллергические реакции и спазм бронхов [11].
Возможно использование фитотерапевтических средств [1, 8]. Механизм действия лекарственных трав многогранен, что связано с действием различных алкалоидов и сапонинов, содержащихся в них. Преимуществом растительных препаратов является то, что биологически активные вещества, выделяемые из лекарственных растений, более естественно включаются в обменные процессы организма (чем синтетические). Отмечается их лучшая переносимость, более редкое развитие побочных эффектов и осложнений. Современный уровень развития фармацевтической промышленности дает возможность выпускать комбинированные растительные препараты высокого качества, содержащие оптимально подобранные дозировки действующих веществ, например, сироп от кашля Суприма-бронхо.
В последнее время для лечения бронхолегочных заболеваний, сопровождающихся бронхообструктивным синдромом, начали использовать новый препарат — фенспирид (эреспал). Он не обладает непосредственно муколитическими и отхаркивающими свойствами, но благодаря противовоспалительному действию этого средства его опосредованно можно отнести к мукорегуляторам. Эреспал воздействует на основные звенья воспалительного процесса в дыхательных путях и обладает тропизмом в отношении дыхательной системы. Он уменьшает отек слизистой бронхов и гиперсекрецию, достоверно увеличивает скорость МКЦ и противодействует бронхоконстрикции, что приводит к улучшению отделения мокроты, уменьшению одышки и кашля [3, 7].
В соответствии с Федеральной программой (1999) [11], представляющей рекомендации по лечению ХОБЛ, муколитические средства назначаются в период ремиссии при наличии явлений мукостаза у больных ХОБЛ любой степени тяжести, а также при обострении заболевания.
Обычно назначаются среднетерапевтические дозы препаратов, выпускающихся в виде таблеток, сиропов, капель, «шипучих» таблеток, сроком на 9—14 дней, а в ряде случаев и более длительно. Продолжительность приема муколитических препаратов зависит от достижения клинического эффекта, который оценивается исходя из улучшения самочувствия больного и качества жизни; изменения симптомов (уменьшение или исчезновение одышки, уменьшение и облегчение кашля, изменение характера мокроты); улучшения показателей функции внешнего дыхания. Следует, однако, учитывать, что у ряда больных хроническим бронхитом после первого дня лечения адгезия и вязкость мокроты могут значительно увеличиться в результате отделения мокроты, накопившейся в бронхах и содержащей большое количество клеточного детрита, воспалительных элементов, белков и т. д. В последующие же дни при правильном выборе препарата реологические свойства мокроты улучшаются приблизительно на 4-й день применения отхаркивающих лекарственных средств, достоверно увеличивается ее количество, снижается вязкость и адгезия, а на 6-8-е сутки лечения происходит стабилизация клинического эффекта [10].
При лечении больных ХОБЛ хорошего результата можно добиться, назначая сочетания муколитических препаратов и бронхолитиков. Наличие вязкой мокроты препятствует доступу ингаляционных препаратов к слизистой бронхов. Поэтому обеспечение экспекторации и освобождение слизистой бронхов от слизи способствует усилению эффективности препаратов и уменьшению их дозы. С другой стороны, бронхолитическая терапия потенцирует действие муколитиков и усиливает их активность. Известно, что β2-агонисты (формотерол, сальбутомол, тербуталин) и теофиллин потенцируют мукоцилиарный клиренс; М-холинолитики (ипратропиум бромид) и теофиллин, уменьшая воспаление и отек слизистой, облегчают отхождение мокроты [5, 10].
При тяжелом течении ХОБЛ в стадии ремиссии, при обострении заболевания среднетяжелого и тяжелого течения показано введение лекарственных средств через небулайзер. Для этого используют специальные растворы амброксола (лазолван) и ацетилцистеина (флуимуцил).
Лазолван выпускается в виде раствора для ингаляций по 100 мл во флаконе (1 мл раствора содержит 7,5 мг амброксола гидрохлорида). Назначают 2—3 мл раствора на ингаляцию, 1—2 раза в сутки. Препарат перед применением смешивают с физиологическим раствором в пропорции 1:1. Противопоказан лазолван при повышенной чувствительности в анамнезе к амброксолу.
Флуимуцил (ацетилцистеин) — раствор для ингаляций в ампулах по 3 мл (в 1 мл 100 мг N-ацетилцистеина). Назначают по 6 мл 5%-ного раствора 1 раз в сутки. При необходимости доза препарата может быть увеличена. В качестве растворителя используют физиологический раствор. Возможно деление на 2—3 ингаляционные дозы. Флуимуцил противопоказан при повышенной чувствительности к ацетилцистеину. С осторожностью его назначают больным бронхиальной астмой. В случае возникновения бронхоспазма препарат следует отменить.
Для избежания кашлевого рефлекса, вызванного глубоким вдохом во время ингаляции, больной должен дышать спокойно. Рекомендуется подогревать ингалируемый раствор до температуры тела. Больным бронхиальной астмой рекомендуется делать ингаляции после использования бронхолитиков. Учитывая то, что бронхолитическая терапия при лечении ХОБЛ является базисной, а также тот факт, что она потенцирует действие муколитиков, возможно использование лазолвана вместе с бронхолитиками в одной небулайзерной камере.
При обострении ХОБЛ возрастает значение инфекционных факторов, что требует назначения антибактериальных средств. Однако при проведении антибактериальной терапии заметно повышается вязкость мокроты вследствие высвобождения ДНК из-за лизиса микробных тел и лейкоцитов. Кроме того, густая вязкая мокрота является существенным препятствием для проникновения антибиотиков в слизистую бронхов и бронхиальный секрет. В связи с этим требуется проведение мероприятий, направленных на улучшение реологических свойств мокроты и способствующих ее лучшему отхождению. Одним из таких методов является назначение муколитиков в сочетании с антибиотиками. Их совместное применение вдвое сокращает период непродуктивного изнуряющего больного кашля в два раза [10].
При одновременном назначении муколитиков и антибиотиков следует учитывать сведения об их совместимости. Амброксол, бромгексин и карбоцистеин при сочетанном применении с антибиотиками усиливают проникновение последних в бронхиальный секрет и слизистую оболочку бронхов, повышая их эффективность. Особенно это касается амоксициллина, цефуроксима, эритромицина, доксициклина, рифампицина и сульфаниламидных препаратов. Так, карбоцистеин усиливает на 20% эффект антибиотиков на бронхиальном уровне. При назначении ацетилцистеина перорально антибиотики (пенициллины, цефалоспорины, тетрациклины) следует принимать не ранее чем через 2 часа после его приема. Препараты ацетилцистеина при ингаляциях или инстилляциях не следует смешивать с антибиотиками, так как при этом происходит их взаимная инактивация [10]. Исключение составляет флуимуцил, для которого создана специальная форма: флуимуцил + антибиотик ИТ (тиамфеникол глицинат ацетилцистеинат). Флуимуцил выпускается для ингаляционного, парентерального, эндобронхиального и местного применения. Тиамфеникол глицинат ацетилцистеинат (это комплексное соединение, объединяющее в своем составе антибиотик тиамфеникол и муколитик флуимуцил. Тиамфеникол обладает широким спектром антибактериального действия и является эффективным в отношении бактерий, наиболее часто вызывающих инфекцию дыхательных путей. Флуимуцил эффективно разжижает мокроту и облегчает проникновение тиамфеникола в зону воспаления, угнетает адгезию бактерий на эпителии слизистой оболочки дыхательных путей [6].
Несмотря на положительные эффекты, которые наблюдаются при применении муколитических, мукорегуляторных средств, данные по их использованию у больных ХОБЛ весьма противоречивы. Благодаря муколитическим свойствам этих препаратов, их способности уменьшать адгезию и активировать мукоцилиарный клиренс, они хорошо зарекомендовали себя при лечении больных ХОБЛ с дискринией и гиперсекрецией. Однако мукорегуляторы (муколитики) не находят точки приложения там, где бронхиальная обструкция связана с бронхоспазмом или необратимыми явлениями. Неоднозначные данные исследований по ХОБЛ не позволяют использовать эти препараты в качестве базисных средств при лечении больных с этой патологией [6]. В программе GOLD (2001) [4] отмечается, что, хотя применение муколитиков (мукокинетиков, мукорегуляторов) у некоторых пациентов с вязкой мокротой приводит к улучшению состояния, в целом эффективность этих препаратов невелика. С точки зрения доказательной медицины, актов, свидетельствующих об эффективности применения муколитиков в терапии больных ХОБЛ, явно недостаточно (уровень D). В той же программе указывается на то, что N-ацетилцистеин, как антиоксидант, снижает частоту обострений ХОБЛ, что может иметь значение при лечении пациентов с частыми обострениями заболевания (уровень доказательности B). Тем не менее, прежде чем начать широкое применение этих средств во врачебной практике, необходимо получить и тщательно оценить результаты продолжающихся сегодня исследований [4].
Таким образом, назначение муколитических средств показано при проведении комплексной терапии больных ХОБЛ, у которых преобладают процессы гиперсекреции и дискринии, так как эти препараты изменяют реологические свойства бронхиального секрета, влияют на процесс слизеобразования, оказывают нормализующее действие на биохимический состав слизи, облегчают отделение мокроты, предотвращают мукостаз и улучшают мукоцилиарный клиренс. Однако муколитики не являются средствами базисной терапии ХОБЛ, так как не оказывают непосредственного влияния на воспалительную реакцию ( основное патогенетическое звено заболевания.
По вопросам литературы обращайтесь в редакцию
И. В. Маев, доктор медицинских наук, профессор
Г. А. Бусарова, кандидат медицинских наук