задержка мочи при приеме антидепрессантов что делать
Лечение функциональных нарушений опорожнения мочевого пузыря
Лечение больных с функциональными нарушениями опорожнения мочевого пузыря является насущной проблемой нейроурологии. Это связано с тем, что до настоящего времени не разработано эффективных и этиопатогенетически обоснованных методов лечения таких больных
Лечение больных с функциональными нарушениями опорожнения мочевого пузыря является насущной проблемой нейроурологии. Это связано с тем, что до настоящего времени не разработано эффективных и этиопатогенетически обоснованных методов лечения таких больных.
Выделяют нейрогенные, миогенные (миопатии) и психогенные (неврозы, шизофрения, истерия и др.) факторы, лежащие в основе функциональных нарушений опорожнения мочевого пузыря. Нейрогенные нарушения и повреждения — основная причина таких нарушений. В отсутствие причины функциональных нарушений опорожнения мочевого пузыря следует думать об идиопатических формах заболевания.
Согласно классификации Международного общества по удержанию мочи, функциональные нарушения опорожнения мочевого пузыря — это результат недостаточной функции мочевого пузыря, гиперактивности уретры или следствие комплексного воздействия обоих нарушений [1]. Недостаточная функция мочевого пузыря возникает вследствие снижения или отсутствия сократительной способности детрузора (арефлексия), которые встречаются при локализации повреждения или неврологического поражения в области фронтальных долей и моста головного мозга, сакрального отдела спинного мозга, при повреждении волокон конского хвоста, тазового сплетения и нервов мочевого пузыря, а также при рассеянном склерозе. Гиперактивность уретры — это следствие наружной детрузорно-сфинктерной диссинергии (ДСД) или нерасслабляющегося (спастического) поперечно-полосатого (п/п) сфинктера уретры, также может проявиться как вариант синдрома Фоулера у женщин. При этом наружная ДСД наблюдается при супрасакральном уровне поражения спинного мозга.
В литературе имеются лишь единичные сообщения о распространенности функциональных нарушений опорожнения мочевого пузыря. Так, P. Klarskov и соавт., оценивая обращаемость в лечебные учреждения Копенгагена, выявили, что ненейрогенные формы нарушения опорожнения мочевого пузыря встречаются в среднем у 7 женщин на 100 000 населения [2]. По данным T. Tammela и соавт., после оперативных вмешательств на органах брюшной полости нарушения опорожнения мочевого пузыря встречаются у 2,9 % пациентов, а после проктологических операций — у 25% больных [3]. Многие авторы считают данную проблему особенно значимой у неврологических больных.
Клиническим проявлением снижения сократительной способности детрузора и нерасслабляющегося п/п сфинктера уретры являются симптомы нарушения опорожнения мочевого пузыря, к которым относятся затрудненное мочеиспускание тонкой, вялой струей, прерывистое мочеиспускание, необходимость прилагать усилия и натуживаться, чтобы начать мочеиспускание, ощущение неполного опорожнения мочевого пузыря.
При отсутствии сократительной способности детрузора в сочетании с паралитическим состоянием п/п сфинктера уретры больные опорожняют мочевой пузырь, искусственно увеличивая внутрибрюшное давление, что клинически проявляется мочеиспусканием слабой струей мочи. При отсутствии сократительной способности детрузора в сочетании со спастическим состоянием наружного сфинктера уретры в большинстве случаев самостоятельное мочеиспускание невозможно и отмечается хроническая задержка мочи.
Нерасслабляющийся п/п сфинктер уретры приводит к инфравезикальной обструкции с симптомами нарушения опорожнения мочевого пузыря.
Клинические проявления наружной ДСД (непроизвольное сокращение п/п сфинктера уретры во время мочеиспускания или непроизвольного сокращения детрузора) включают два вида симптомов, а именно: нарушения опорожнения и накопления мочи в мочевом пузыре. Последние включают учащенное и ургентное мочеиспускание нередко в сочетании с ургентным недержанием мочи и никтурией. Для наружной ДСД характерно неполное опорожнение мочевого пузыря и развитие пузырно-мочеточникового рефлюкса.
Таким образом, различные формы нарушения опорожнения мочевого пузыря могут иметь во многом сходную клиническую картину. В связи с этим правильная и своевременная диагностика функциональных нарушений опорожнения мочевого пузыря является залогом успешного лечения.
Диагностика функциональных нарушений опорожнения мочевого пузыря складывается из сбора жалоб и анамнеза, урологического и неврологического обследования, а также дополнительных методов обследования, среди которых основное место занимает уродинамическое исследование. На начальном этапе обследования обязательна оценка симптомов нижних мочевых путей на основании вопросника I-PSS (Internanional Prostate Symptom Score). Вопросник I-PSS был предложен для оценки нарушений акта мочеиспускания вследствие заболеваний предстательной железы, однако в настоящее время он с успехом применяется и в случаях проявления симптомов заболеваний нижних мочевых путей, вызванных различными факторами, в том числе и неврологического характера.
Для уточнения поведения детрузора и его сфинктеров в фазу опорожнения мочевого пузыря наиболее информативным методом исследования больных является комплексное уродинамическое исследование.
Уродинамическими признаками наружной ДСД, характерной для надкрестцовой локализации патологического процесса, особенно в шейном отделе спинного мозга, являются регистрируемые с помощью электромиографии во время мочеиспускания «всплески» сократительной активности п/п сфинктера уретры и мышц тазового дна. Сокращение мышц тазового дна затрудняет или полностью прерывает поток мочи. Для нерасслабляющегося сфинктера уретры характерно отсутствие снижения электромиографической активности п/п сфинктера уретры во время мочеиспускания. Снижение или отсутствие сократительной способности детрузора уродинамически проявляется отсутствием плавного повышения детрузорного давления в ходе цистометрии или отсутствием позыва к акту мочеиспускания.
Следует подчеркнуть, что только уродинамическое обследование дает возможность достоверно установить форму нарушения функции нижних мочевых путей, приводящих к нарушению опорожнения мочевого пузыря, и во многом определить выбор метода лечения.
Ультразвуковое исследование почек и мочевого пузыря, также как и экскреторная урография, позволяет уточнить анатомическое состояние верхних мочевых путей и количество остаточной мочи в мочевом пузыре. По количеству остаточной мочи в мочевом пузыре после акта мочеиспускания (в норме до 50 мл) можно косвенно судить о функциональном состоянии детрузора и наличии инфравезикальной обструкции.
В таблице перечислены методы лечения больных с функциональными нарушениями опорожнения мочевого пузыря, из которых только медикаментозная терапия и дорзальная ризотомия с электростимуляцией передних корешков могут действительно считаться методами лечения, тогда как другие скорее являются способами опорожнения мочевого пузыря. При этом даже медикаментозная терапия во многом является симптоматическим методом лечения. Несмотря на это, назначение лекарственных средств представляет собой первый этап лечения больных с функциональными нарушениями опорожнения мочевого пузыря. Выбор медикаментов зависит от вида нарушения функции нижних мочевых путей. Так, в случае нарушения сократительной способности детрузора применяют антихолинэстеразные средства и М-холиномиметики, а при гиперактивности уретры — центральные миорелаксанты и α-блокаторы.
У 22 больных со сниженной сократительной способностью детрузора использовали дистигмина бромид (убретид) в дозе 5 мг через день за 30 мин до завтрака в течение 2 мес. При этом через каждые 2 нед делали 7-дневный перерыв в приеме препарата. Механизм действия дистигмина бромида заключается в блокировании ацетилхолинэстеразы, что сопровождается увеличением концентрации ацетилхолина в синаптической щели и соответственно приводит к облегчению передачи нервного импульса.
У всех больных терапевтический эффект развивался в первую неделю приема препарата и выражался в снижении среднего балла I-PSS c 15,9 до 11,3, а количества остаточной мочи — с 82,6 до 54,3 мл. Субъективно пациенты отмечали усиление ощущения позыва и облегчение начала акта мочеиспускания.
Следует отметить, что до настоящего времени остается открытым вопрос о продолжительности лечения антихолинэстеразными средствами. По нашим данным, у 82% больных в разные сроки после окончания 2-месячного курса лечения отмечалось возобновление симптомов, потребовавшее повторного назначения препарата.
К сожалению, мы не накопили собственного опыта применения бетанехола у больных со сниженной сократительной способностью детрузора, так как данный препарат не зарегистрирован для клинического применения в нашей стране и соответственно отсутствует в аптечной сети. Механизм действия бетанехола аналогичен действию ацетилхолина на гладкие миоциты. Данные других авторов показывают, что бетанехол может применяться при лечении больных с легкой степенью нарушения сократительной способности детрузора [4, 5].
α1-адреноблокатор доксазозин (кардура) использовали в ходе лечения 30 больных с гиперактивностью уретры, в том числе 14 пациентов с наружной ДСД и 16 с нарушением произвольного расслабления п/п сфинктера уретры. Доксазозин назначали в дозе 2 мг/сут на ночь.
Через 6 мес средний балл по шкале I-PSS у больных с наружной ДСД снизился с 22,6 до 11,4, количество остаточной мочи уменьшилось с 92,6 до 32,4 мл, а максимальная скорость потока мочи увеличилась с 12,4 до 16,0 мл/сек.
Кроме того, через 6 мес у больных с нарушением произвольного расслабления п/п сфинктера уретры средний балл I-PSS снизился с 14,6 до 11,2, количество остаточной мочи — с 73,5 до 46,2 мл, а максимальная скорость потока мочи увеличилась с 15,7 до 18,4 мл/сек.
Баклофен и тизанидин (сирдалуд) являются центральными миорелаксантами. Они снижают возбуждение моторных нейронов и интернейронов и могут ингибировать передачу нервного импульса в спинном мозге, уменьшая спастичность п/п мышц. По нашим данным, после применения баклофена в дозе 20 мг/сут и тизанидина в дозе 4 мг/сут не было выявлено существенной динамики субъективных и объективных симптомов как у больных с наружной ДСД, так и у пациентов с нарушением расслабления п/п сфинктера уретры. Выраженная слабость мускулатуры конечностей на фоне приема этих препаратов не позволяет увеличивать дозу препаратов, что существенно ограничивает их применение в клинической практике.
Следует отметить, что медикаментозная терапия эффективна у больных с начальными и легкими формами нарушения опорожнения мочевого пузыря. Тем не менее ее целесообразно использовать в качестве первого этапа лечения. В случае недостаточной эффективности медикаментозной терапии необходимо искать новые пути решения проблемы адекватного опорожнения мочевого пузыря.
Предложенная Lapides и соавт. в 80-е гг. прошлого столетия интермиттирующая аутокатетеризация мочевого пузыря до настоящего времени остается одним из основных методов опорожнения мочевого пузыря [6]. Однако этот метод имеет ряд осложнений, к которым относятся инфекции нижних мочевых путей, стриктуры уретры и, самое главное, значительное снижение качества жизни. При невозможности выполнения (неврологические больные с тетраплегией, больные с ожирением) или отказе пациента от аутокатетеризации, у лиц с наружной ДСД и нерасслабляющимся сфинктером уретры, а также со сниженной сократительной способностью детрузора для адекватного опорожнения мочевого пузыря применяют в последние годы имплантацию специальных стентов (производства фирм Balton, Mentor, МедCил) и инъекции ботулинического токсина в зону п/п сфинктера уретры.
 |
| Рисунок 1. Временный уретральный стент |
Временные уретральные стенты имеют форму цилиндра, выполненного из проволочной спирали толщиной 1,1 мм, изготовлены они на основе полимолочной и полигликоликовой кислот с различным периодом разрушения (от 3 до 9 мес) посредством гидролиза (рис. 1). Механические свойства и время разрушения временных стентов зависят от степени поляризации, места и формы зоны имплантации.
Мы имеем опыт применения временных уретральных стентов у семи мужчин с наружной ДСД и у четырех пациентов, у которых отсутствовала сократительная способность детрузора. Временный уретральный стент устанавливали при уретроцистоскопии таким образом, чтобы он «шинировал» как простатический, так и мембранозный отделы уретры. Такое положение стента обеспечивает адекватное опорожнение мочевого пузыря.
У всех больных отмечалось восстановление самостоятельного мочеиспускания сразу после имплантации уретрального стента. Пациенты с наружной ДСД осуществляли мочеиспускание по позыву, а больные с отсутствием сократительной способности детрузора с интервалом 4 ч (6 раз в сутки) с использованием приема Креда. По данным ультразвукового сканирования, через 10 нед после установки стента у больных с наружной ДСД не отмечалось остаточной мочи, а у больных с отсутствием сократительной способности детрузора среднее количество остаточной мочи составило 48 мл и зависело от адекватности выполнения приема Креда. Очень важно, что у больных с наружной ДСД было выявлено снижение максимального детрузорного давления во время мочеиспускания в среднем с 72 до 35 см вод. ст. (профилактика развития пузырно-мочеточникового рефлюкса).
Мы считаем, что временные уретральные стенты обеспечивают адекватное опорожнение мочевого пузыря и показаны тем больным с нарушением опорожнения мочевого пузыря, которым не может быть выполнена интермиттирующая катетеризация мочевого пузыря или которые воздерживаются от нее по различным причинам. Временные стенты могут являться методом отбора больных для установки постоянных (металлических) стентов.
В последние годы в литературе появились сообщения об успешном использовании ботулинического токсина у больных с функциональными нарушениями опорожнения мочевого пузыря. В нашей клинике ботулинический токсин применялся у 16 больных с нарушением опорожнения мочевого пузыря, в том числе у девяти с наружной ДСД, у трех с нерасслабляющимся п/п сфинктером уретры и у четырех с нарушением сократительной способности детрузора. Мы использовали ботулинический токсин типа А фармацевтической фирмы Allergan. Коммерческое название препарата — ботокс (Botox), он представляет собой лиофилизированный порошок белого цвета в вакуумных стеклянных флаконах объемом 10 мл, закрытых резиновой пробкой и герметичным алюминиевым затвором. В одном флаконе содержится 100 ЕД ботулинического токсина типа А.
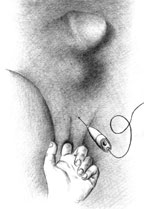 |
| Рисунок 2. Введение ботулинического токсина у мужчин |
Механизм действия ботокса заключается в блокировании выброса ацетилхолина из пресинаптической мембраны в нервно-мышечном синапсе. Фармакологическим эффектом этого процесса является стойкая хемоденервация, а клиническим проявлением — расслабление мышечных структур.
Согласно рекомендациям фирмы-производителя, лиофилизированный порошок разводили 8 мл стерильного 0,9% раствора натрия хлорида без консервантов (1 мл полученного раствора содержит 12,5 ЕД ботокса). Использовали трансперинеальную методику введения препарата. У мужчин под контролем указательного пальца, введенного в прямую кишку, специальную иглу с изоляционным покрытием вводили в точку, находящуюся на 2 см латеральнее и выше анального отверстия (рис. 2). У женщин иглу под контролем указательного пальца, введенного во влагалище, вводили в точку на 1 см латеральнее и выше наружного отверстия уретры на глубину 1,5–2,0 см (рис. 3). Во всех случаях положение иглы контролировали электромиографически по характерному звуку динамика электромиографа. В каждую точку вводили по 50 ЕД ботокса.
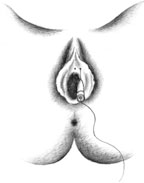 |
| Рисунок 3. Введение ботулинического токсина у женщин |
У всех больных через 10 дней после введения ботулинического токсина исчезла остаточная моча и было отмечено увеличение максимальной скорости потока мочи. Важно, что хемоденервация сфинктера уретры после инъекции ботокса у всех пациентов с нерасслабляющимся п/п сфинктером и наружной ДСД приводила к снижению детрузорного давления, а у больных с нарушением сократительной способности детрузора — к снижению максимального абдоминального давления, вызывающего выделение мочи из наружного отверстия уретры. Это наблюдение представляется крайне важным в отношении профилактики развития пузырно-мочеточникового рефлюкса и сохранения функциональной способности почек. Только у одного больного клинический эффект после инъекции ботокса продолжал сохраняться на протяжении 16 мес, остальным пациентам потребовались повторные инъекции препарата с периодичностью 3–8 мес.
В отдельных случаях, при выраженной инвалидизации больных с нарушением опорожнения мочевого пузыря, используют трансуретральную инцизию или резекцию наружного сфинктера уретры, дренируют мочевой пузырь постоянным уретральным катетером или выполняют цистостомию.
Таким образом, нарушение опорожнения мочевого пузыря может быть следствием различных форм дисфункции нижних мочевых путей. Требуются проведение комплексного уродинамического обследования для уточнения функционального состояния мочевого пузыря и его сфинктеров и выбор адекватного метода опорожнения мочевого пузыря. Отсутствие высокоэффективных и универсальных способов лечения больных с функциональными нарушениями опорожнения мочевого пузыря диктует необходимость поиска новых методов терапии таких больных.
Г. Г. Кривобородов, доктор медицинских наук
М. Е. Школьников, кандидат медицинских наук
РГМУ, Москва
PsyAndNeuro.ru
Побочные эффекты антидепрессантов
С 1990 гг. антидепрессанты группы ТЦА заменяют антидепрессантами группы СИОЗС. При сравнительно одинаковом уровне эффективности СИОЗС безопаснее ТЦА. Однако у СИОЗС есть побочные действия, которые могут влиять на ход лечения.
Переносимость и побочные эффекты – это разные, но весьма тесно связанные понятия. Одной из основных причин прекращения лечения антидепрессантами является сила их побочных действий. 43 % больных депрессией прекращают прием антидепрессантов из-за побочных действий. Пациенты, принимающие ТЦА, чаще обрывают курс лечения и чаще сталкиваются с побочными эффектами, по сравнению с пациентами, принимающими СИОЗС.
Подробнее об основных побочных эффектах:
Кровотечение
– Предполагается, что СИОЗС влияют на гемостаз, воздействуя на захват серотонина тромбоцитами. Чем сильнее антидепрессанты действуют на захват серотонина, тем выше риск кровотечений. Это относится к СИОЗС и венлафаксину, антидепрессанту с самым сильным серотонинэргическим действием из группы СИОЗСиН.
– СИОЗС повышает риск кровотечений в ЖКТ.
– Риск кровотечения повышают СИОЗС, но не ТЦА.
– Риск кровотечения повышает одновременный прием СИОЗС и аспирина, СИОЗС и нестероидных противовоспалительных препаратов.
Побочные действия на сердечно-сосудистую систему
– СИОЗС первоначально вводились в практику как безопасная альтернатива ТЦА. В последнее время появляются свидетельства того, что СИОЗС производят побочные действия на сердечно-сосудистую систему, например удлиняют интервал QT, тем самым повышая риск желудочковой аритмии. Однако ТЦА удлиняют интервал QT значительнее по сравнению с СИОЗС. Среди СИОЗС сильнее других воздействует на интервал QT циталопрам.
– Сердечно-сосудистые побочные реакции ТЦА вызывают чаще, чем СИОЗС; очень низкий риск такого рода побочных эффектов у миртазапина; самый высокий риск повышения давления у СИОЗСиН; среди СИОЗСиН наивысший риск повышения давления у венлафаксина (при дозировке 150 мг/день); повышение давления из-за приема СИОЗС – очень редкое явление.
– Все антидепрессанты, кроме СИОЗС, повышают пульс в покое и снижают вариабельность сердечного ритма; значительнее всего этот эффект проявляется при приеме ТЦА.
Сухость во рту
– Сухость во рту – обычный побочный эффект ТЦА.
– СИОЗС, СИОЗСиН, бупропион – все они могут вызывать сухость во рту; СИОЗСиН повышают риск сухости во рту сильнее, чем СИОЗС; флувоксамин и вортиоксетин не повышают этот риск.
Нарушение работы ЖКТ
– Серотонин играет важную роль в пищеварении, в особенности в том, что касается моторики кишечника.
– Флуоксетин чаще, чем ТЦА вызывает нарушения работы ЖКТ; флуоксетин чаще, чем другие СИОЗС вызывает тошноту, рвоту, диарею, потерю веса, анорексию; ТЦА, по сравнению с флуоксетином, реже вызывают тошноту, анорексию и потерю веса, но чаще вызывают запор и набор веса.
– Венлафаксин чаще, чем СИОЗС вызывает тошноту и рвоту.
Гепатотоксичность
– Слабостью антидепрессантов МАО и ТЦА считалась их гепатотоксичность. Новейшие исследования подтверждают это представление и, кроме того, показывают наличие риска гепатотоксического воздействия у новых антидепрессантов.
– Риск гепатотоксичности относительно выше при приеме нефазадона, бупропиона, дулоксетина, агомелатина; риск относительно ниже при приеме циталопрама, эсциталопрама, пароксетина, флувоксамина.
– В группе ТЦА высокая гепатотоксичность у кломипрамина и амитриптилина.
– Самый высокий риск гепатотоксичности у агомелатина.
– Милнаципран повышает риск гепатотоксичности значительнее, чем дулоксетин.
– СИОЗС, по сравнению с другими антидепрессантами, незначительно повышают риск гепатотоксичности.
Судороги
– Самым рискованным в отношении судорог считается бупропион. Но многое зависит от лекарственной формы. Бупропион IR (немедленное высвобождение) в дозе более 450 мг повышает риск судорог в 10 раз. Бупропион SR (пролонгированное высвобождение) в дозе до 300 мг повышает риск судорог лишь на 0,01-0,03 %. Такое же незначительное повышение наблюдается при приеме СИОЗС.
– У ТЦА эпилептогенный потенциал выше, чем у бупропиона, поэтому антидепрессанты этой группы противопоказаны пациентам с предрасположенностью к судорогам.
– Современные исследования осложняют представление о риске судорог. Новые данные говорят о том, что, похоже, все антидепрессанты способны повышать риск судорог.
– Самые рискованные антидепрессанты: тразодон, лофепрамин, венлафаксин. В группе СИОЗС наибольший риск – при приеме пароксетина и циталопрама, наименьший – при приеме эсциталопрама и сертралина.
– По другим данным, СИОЗС опаснее ТЦА и наиболее высокий риск судорог возникает при приеме сертралина.
– Масштабные исследования, тем не менее, показывают, что большие эпилептические припадки чаще случаются у пациентов, принимающих ТЦА, а не СИОЗС.
Суицид
– FDA в 2004 г. обязало производителей антидепрессантов размещать на упаковке предупреждение о повышении риска самоубийства у детей и подростков. Спорность этого правила в том, что болезнь, которую лечат антидепрессантами, сама повышает риск суицидального поведения. Ограниченность данных о связи приема антидепрессантов с суицидальными попытками по-прежнему не позволяет сделать однозначное заключение.
– Относительное повышение суицидальных рисков наблюдается при приеме венлафаксина, эсциталопрама, имипрамина, дулоксетина, флуоксетина и пароксетина.
Безопасность при передозировке
– Самый высокий индекс опасности (число смертей на тысячу отравлений антидепрессантами) у амоксапина, мапротилина, дезипрамина. У всех СИОЗС и СИОЗСиН индекс опасности ниже чем у ТЦА.
– Доля смертей в общем количестве отравлений у СИОЗС меньше чем у венлафаксина и миртазапина.
Сексуальная дисфункция
– Сексуальную дисфункцию у пациентов с депрессией вызывает болезнь и лекарства, назначаемые для ее лечения. Все антидепрессанты, влияющие на захват серотонина или норадреналина, вызывают сексуальную дисфункцию. Нет доказательств того, что СИОЗС и СИОЗСиН слабее воздействуют на эту сферу по сравнению с ТЦА.
– Чаще всего сексуальную дисфункцию вызывают циталопрам, флуоксетин, пароксетин, сертралин и венлафаксин. Имипрамин – тоже, но слабее чем пять названных антидепрессантов.
– У бупропиона самое слабое побочное действие в сексуальной сфере, по сравнению с другими современными антидепрессантами.
Набор веса
– Ранее считалось, что СИОЗС и СИОЗСиН способствуют набору лишнего веса. Среди СИОЗС самым рискованный в этом отношении – пароксетин, среди ТЦА – амитриптилин. Однако в среднем набор веса при приеме амитриптилина, сертралина и флуоксетина происходит одинаково.
– СИОЗС и СИОЗСиН могут ассоциироваться с потерей веса. После 4 месяцев лечения этот эффект пропадает, а пароксетин начинает способствовать набору лишних килограммов.
– Амитриптилин и миртазапин способствуют набору веса при краткосрочном и долговременном лечении.
– Имипрамин и бупропион способствуют снижению веса или относительно замедляют набор веса при краткосрочном и долговременном лечении.
– В целом новейшие данные говорят о том, что набор веса происходит в той или иной мере при приеме всех антидепрессантов.
Гипонатриемия, нарушения сна, потливость
– Первые сообщения о гипонатриемии из-за приема антидепрессантов касались ТЦА. Но риск гипонатриемии при приеме СИОЗС выше, чем при приеме ТЦА.
– Самый высокий риск в группе СИОЗС у циталопрама и эсциталопрама.
– У венлафаксина риск такой же как у СИОЗС или выше.
– Риск гипонатриемии при приеме антидепрессантов повышается у пожилых пациентов и в случае одновременного приема диуретиков.
– Действие антидепрессантов на сон может сильно различаться. Длительность сна может сокращаться, а может и увеличиваться.
– Венлафаксин уменьшает фазу REM сна, в связи с чем его назначают при лечении нарколепсии.
– У многих ТЦА очень сильный седативный эффект.
– Бупропион может вызывать бессонницу.
– Повышенная потливость встречается при приеме ТЦА, СИОЗС и СИОЗСиН.
– Потливость отмечается у 10 % пациентов, принимающих СИОЗС, венлафаксин, ТЦА.
Смертность
– Антидепрессанты повышают смертность. Есть данные, что антидепрессанты повышают риск смерти от инфаркта и инсульта. С другой стороны, влияние на тромбоциты может положительно сказываться на здоровье сердечно-сосудистой системы.
– Оценить влияние антидепрессантов на риск смерти сложно по нескольким причинам, в том числе и потому, что депрессия, как доказано, при любой степени тяжести уменьшает продолжительность жизни.
Серьезной проблемой при использовании ИМАО был риск гипертонического криза. Чтобы избежать его, пациентам приходилось существенно изменять рацион, исключая продукты, содержащие тирамин.
Внедрение ТЦА ослабило проблему смертельно опасного гипертонического криза, но ТЦА повысили риски кардио- и нейротоксичности.
СИОЗС и СИОЗСиН не угрожают гипертоническим кризом, но при этом они чаще чем ТЦА связаны с кровотечением и состоянием гипонатриемии.
В отношении безопасности передозировки СИОЗС лучше, чем ТЦА. Также ТЦА проигрывает по таким показателям как переносимость и частота преждевременного прекращения лечения.
СИОЗС и СИОЗСиН нельзя считать абсолютно безопасными препаратами для сердечно-сосудистой системы. Преимущество СИОЗС в отношении риска судорог нельзя считать доказанным.
Сексуальная дисфункция возникает при приеме СИОЗС чаще, чем при приеме СИОЗСиН и чаще при приеме СИОЗСиН, чем при приеме ТЦА.
Интересно, что при проведении исследований в контрольных группах, принимавших плацебо, проявляется примечательная закономерность. В исследованиях безопасности СИОЗС в контрольной группе было меньше побочных эффектов. В исследованиях, проверявших безопасность ТЦА, в контрольных группах, где участникам давали плацебо, было больше побочных эффектов. Видимо, это объясняется эффектом Голема – феноменом самосбывающегося пророчества. Там, где ученые были уверены в преимуществах СИОЗС, исследования даже на этапе сбора данных о действии плацебо говорили в пользу СИОЗС.
Данные о побочных действиях антидепрессантов систематизируются и обновляются в базе данных по нейропсихофармакологии, созданной в рамках проекта “Психиатрия и нейронауки”. Перейти к базе: http://psyandneuro.ru/neuropsychopharmacology/
Автор перевода : Филиппов Д.С.
Источник : Wang SM, Han C, Bahk WM, Lee SJ, Patkar AA, Masand PS, Pae CU. Addressing the Side Effects of Contemporary Antidepressant Drugs: A Comprehensive Review. Chonnam Med J. 2018 May;54(2):101-112.