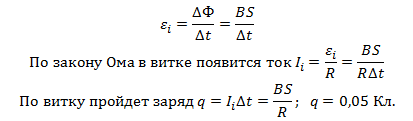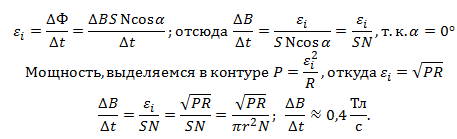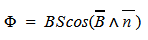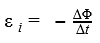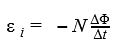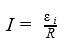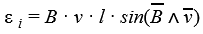закон фарадея в чем измеряется
Законы электролиза Фарадея
Законы электролиза Фарадея представляют собой количественные соотношения, основанные на электрохимических исследованиях Майкла Фарадея, которые он опубликовал в 1836 году.
Данные законы определяют связь между количеством веществ, выделяющихся при электролизе и количеством электричества, которое прошло при этом через электролит. Законов Фарадея два. В научной литературе и в учебниках встречаются различные формулировки данных законов.
Электролиз — выделение из электролита входящих в его состав веществ при прохождении электрического тока. Так, например, при пропускании электрического тока через слегка подкисленную воду вода разлагается на составные части — газы (кислород и водород).
Количество выделившегося из электролита вещества пропорционально количеству протекшего через электролит электричества, т. е. произведению из силы тока на время, в течение которого этот ток протекал. Поэтому явление электролиза может служить для измерения силы тока и определения единицы силы тока.
Электролит — раствор и вообще сложная жидкость, проводящая электрический ток. В аккумуляторах электролитом служит раствор серной кислоты (в свинцовых) или раствор едкого калия, либо едкого натра (в железоникелевых). В гальванических элементах электролитом служат также растворы каких-либо химических соединений (нашатыря, медного купороса и т. п.).
Первый закон электролиза Фарадея
Масса вещества, которое осядет на электроде при электролизе, прямо пропорциональна количеству электричества, переданного к этому электроду (прошедшего через электролит). Под количеством электричества понимается количество электрического заряда, который обычно измеряется в кулонах.
Второй закон электролиза Фарадея
Для определенного количества электричества (электрического заряда) масса химического элемента, который осядет на электроде при электролизе, прямо пропорциональна эквивалентной массе данного элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество.
Одно и то же количество электричества приводит к выделению на электродах при электролизе эквивалентных масс различных веществ. Для выделения одного моля эквивалента любого вещества необходимо затратить одно и то же количество электричества, а именно 96485 Кл. Данная электрохимическая константа называется числом Фарадея.
Законы Фарадея в математической форме
m – масса вещества, осевшего на электроде;
Q – величина полного электрического заряда в кулонах, который прошел при электролизе;
F = 96485,33(83) Кл/моль — число Фарадея;
M- молярная масса элемента в г/моль;
z – валентное число ионов вещества (электронов на ион);
M/z – эквивалентная масса осевшего на электроде вещества.
Применительно к первому закону электролиза Фарадея, M, F и z – константы, поэтому чем больше будет Q, тем больше окажется и m.
Применительно ко второму закону электролиза Фарадея, Q, F и z – константы, поэтому чем больше будет M/z, тем больше окажется m.
Для постоянного тока имеем
n – количество молей (количество вещества), выделенного на электроде: n = m/M.
t – время прохождения постоянного тока через электролит Для переменного тока суммируется полный заряд за время.
t – полное время электролиза.
Лекция 1. Законы Фарадея
Описание
4. Выход вещества по току.
5.Способы определения выхода по току при использовании постоянного и импульсного тока.
6.Второй закон Фарадея.
7.Кажущиеся случаи отклонения от законов Фарадея.
Оглавление
1. Первый закон Фарадея
Первый закон Фарадея устанавливает связь между количеством прошедшего через электрохимическую систему электричества и количеством прореагировавшего вещества.
Математически этот закон выражается уравнением:
2. Электрохимический эквивалент.
Электрохимический эквивалент представляет собой количество вещества, прореагировавшего в результате протекания единицы количества электричества.
Электрохимический эквивалент может быть получен расчетным путем, если известна электрохимическая реакция, т.е. исходные вещества и ее продукты. Уравнение для расчета электрохимического эквивалента выглядит следующим образом:

где М – молярная масса реагента, n – число электронов, участвующих в реакции, F – число или постоянная Фарадея: F = 96486 ≈96500 Кл/моль.
3. Кулонометры. Классификация кулонометров.
В серебряном кулонометре определяется масса серебра, выделяющаяся
В весовых кулонометрах (к ним относятся серебряные и медные) количество прошедшего в них электричества рассчитывается по изменению массы катода или анода. В объемных кулонометрах расчет производится на основании измерения объема получающихся веществ (газа в водородном кулонометре, жидкой ртути в ртутном кулонометре). В титрационныхкулонометрах количествоэлектричества определяется по данным титрования веществ, образующихся в растворе в результате электродной реакции.
Этиловый спирт добавляют в электролит для получения более мелкокристаллических, компактных катодных осадков и с целью предотвращения окисления медных электродов кулонометра.
О количестве прошедшего электричества судят по изменению массы катода, до и после электролиза.
катодом, а анод готовится из чистого серебра.
В качестве электролита в серебряном кулонометре используется нейтральный или слабокислый 30% раствор нитрата серебра.
Газовый водородно-кислородный кулонометр применяется для приближенных измерений малых количеств электричества. В нем измеряют общий объем водорода и кислорода, выделяющихся при электролизе водного раствора H2SO4или NaOH, а из этой величины вычисляют количество прошедшего электричества. Применяют эти кулонометры сравнительно редко, т.к. точность их небольшая, а в работе они менее удобны, чем весовые кулонометры.
Наиболее распространенные из титрационныхкулонометров – йодный
Йодныйкулонометр представляет собой сосуд с разделенными катодным и анодным пространствами платиновоиридиевыми электродами. В анодное отделение вводят концентрированный раствор иодида калия с добавлением соляной кислоты, в катодное отделение – раствор соляной кислоты. При пропускании тока на аноде выделяется йод, который затем титруют тиосульфатом натрия (Na2S2O3). По результатам титрования рассчитывают количество электричества.
4. Выход по току
Часто на электроде протекает не одна электрохимическая реакция, а несколько самостоятельных параллельных реакций. Например, при выделении Zn из кислого раствора ZnSO4наряду с разрядом ионов Zn:
протекает реакция восстановления ионов гидроксония: 2Н3О + +2ē → Н2 + 2H2O.
Если на электроде протекает несколькопараллельных электрохимических реакций, то I закон Фарадея будет справедлив для каждой из них.
Для практических целей, для того, чтобы учесть какая доля тока или количества прошедшего через электрохимическую систему электричества расходуется на каждую конкретную реакцию введено понятие выхода вещества по току.
Таким образом, ВТ позволяет определить часть количества прошедшего через электрохимическую систему электричества, которая приходится на долю данной электрохимической реакции.
Знание ВТ необходимо, как при решении теоретических вопросов: например, при построении парциальных поляризационных кривых и выяснении механизма электрохимической реакции, так и в практике электроосаждения металлов, неметаллов, сплавов, с целью оценки эффективности технологической операции. ВТ на практике чаще всего определяют делением практической массы вещества на теоретическую массу, определенную по закону Фарадея.
5. Способы определения ВТ при использовании импульсного тока
Если же через границу раздела фаз протекает импульсный ток, то при определении ВТ возникают большие трудности. Единой методики или прибора для определения ВТ при импульсномэлектролизе не существует. Сложность определения ВТ в условиях импульсногоэлектролиза обусловлена тем, что проходящий через систему ток расходуется не только на электрохимическую реакцию, но и на заряжение двойного электрического слоя. Электрический ток, проходящий через границу раздела и вызывающий электрохимическое превращение, называется часто фарадеевским током. Ток заряжения расходуется на заряжение двойного электрического слоя, реорганизацию растворителя, самого реагента, т.е. на все на то, что создает условия для протекания электрохимической реакции, поэтому выражение для общего тока, проходящего через электрохимическую систему, будет выглядеть следующим образом:
I = Iз + Iф, где Iз – ток заряжения, Iф – фарадеевский ток.
Если не требуется определения абсолютных значений ВТ, то в качестве критерия оценки эффективности импульсного электролиза можно использовать отношения количества электричества, затраченного на растворение осадка к количеству электричества, затраченного на его формирование.
6. Второй закон Фарадея.
Второй закон Фарадея является непосредственным следствием первого закона. Во втором законе Фарадея отражена связь, существующая между количеством прореагировавшего вещества и его химической природой.
Согласно второму закону Фарадея:
Математически этот закон выражается уравнением:
Второй закон Фарадея является непосредственным следствием первого закона. Во втором законе Фарадея отражена связь, существующая между количеством прореагировавшего вещества и его химической природой.
Согласно второму закону Фарадея:
7. Кажущиеся случаи отклонения от законов Фарадея
Количество образующегося газообразного хлора всегда меньше, чем это следует по закону Фарадея из-за того, что Cl2растворяется в электролите и вступает в реакцию гидролиза:
Если учесть массу хлора, прореагировавшего с водой, получим результат, соответствующий рассчитанному по закону Фарадея.
Часто на электроде протекает не одна электрохимическая реакция, а несколько самостоятельных параллельных реакций. Например, при выделении Zn из кислого раствора ZnSO4наряду с разрядом ионов Zn:
протекает реакция восстановления ионов гидроксония: 2Н3О + +2ē → Н2 + 2H2O.
Если на электроде протекает несколько параллельных электрохимических реакций, то I закон Фарадея будет справедлив для каждой из них.
История открытия закона Фарадея
Майкл Фарадей – английский ученый физик, проводивший опыты с электричеством. До открытия Фарадея считалось, что между магнитным и электрическим полями нет никакой связи. Фарадей обосновал доказательство того, что магнитное поле вызывает электрический ток. Это явление получило название электромагнитной индукции, а закон стал одним из основных в электродинамике.
Фарадей был не единственным ученым, который задумался о связи электрического и магнитного поля. Одновременно с ним над этими явлениями работал Джозеф Генри. Но Фарадей все-таки первым сформулировал и опубликовал результаты своих исследований.
Электромагнитная индукция – появление электрического тока, поля или электрической поляризации в условиях изменения во времени магнитного поля или при движении материальной среды в нем.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
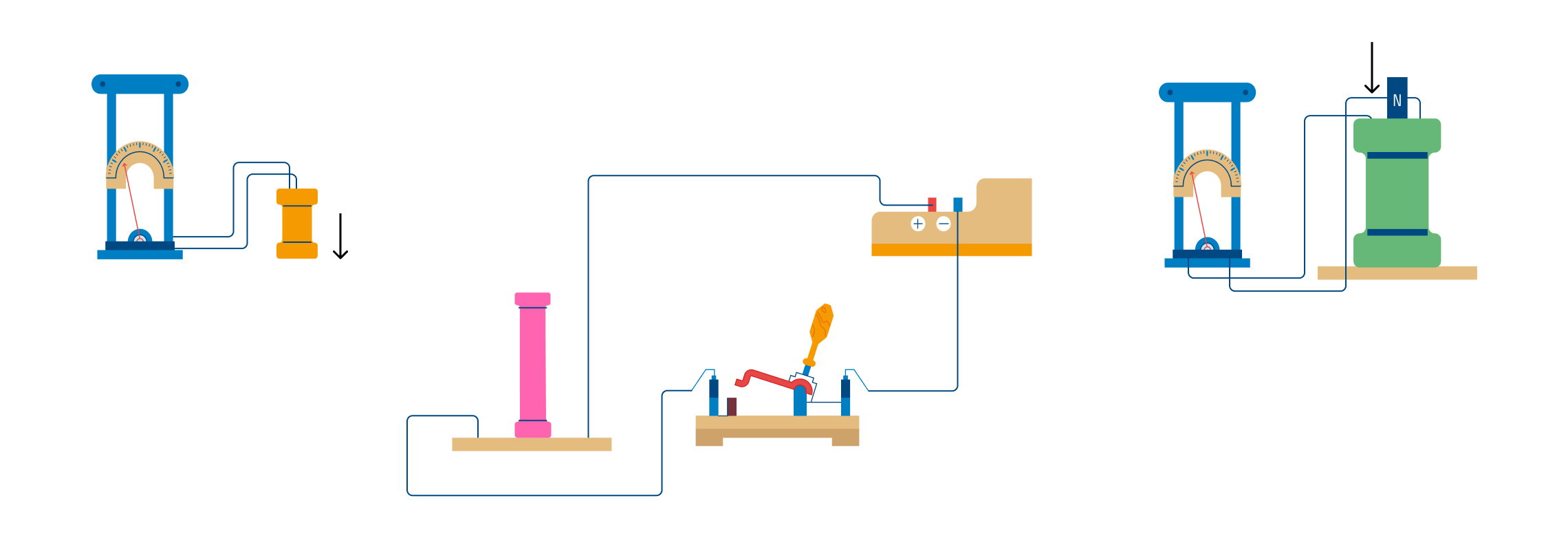
К своему открытию Фарадей шёл порядка десяти лет. В 1831 году ученый провел эксперимент, позволивший ему открыть элеткромагнитную индукцию. Он намотал на один железный сердечник две катушки, автономные друг от друга. Одна катушка была подключена к источнику тока, вторая к гальванометру – прибору, измеряющему силу тока. Когда по первой катушке шел электрический ток, ее магнитное поле возрастало. В это же время гальванометр, подключённый ко второй катушке, фиксировал возникновение в ней тока. Таким образом, Фарадей доказал, что в результате влияния магнитного поля, появляется ток. Такой ток стали называть индукционным. Но появлялся он только в момент подключения или отключения первой катушки от цепи. Если по первой катушке шел постоянный ток, то во второй в это время ничего не регистрировалось.
«Электрический магнетизм» проявлялся и в тот момент, когда Фарадей передвигал вторую катушку относительно первой. Сила индукционного тока увеличивалась, если движение катушки было быстрым, и наоборот.
Затем Фарадей заменил первую катушку на магнит, который вводил во вторую катушку. Явление электромагнитной индукции повторилось в точности как в опыте с двумя катушками.
Фарадей пришел к выводу, что возникновение индукционного тока зависит от количества линий магнитного поля, которые проходят сквозь контур.
Формула закона Фарадея
Проводя опыты с катушками и магнитом, Фарадей обнаружил, что величина электродвижущей силы зависит от скорости перемещения катушек или магнита. Это позволило ему выявить закономерность и сформулировать закон электромагнитной индукции.
Закон электромагнитной индукции: электродвижущая сила пропорциональна скорости изменения магнитного потока, проходящего через контур.
Формулировка закона выглядит следующим образом: Ε=-ΔΦ/Δt
E в этой формуле – электродвижущая сила, ΔΦ – изменение магнитного потока, а Δt – время, за которое изменяется магнитный поток. Единицы измерения ЭДС – вольты, магнитного потока – веберы. Δ – разница между конечным и начальным параметром.
В выражении закона Фарадея стоит минус. Он подразумевает применение к этому закону правила Ленца.
Э. Х. Ленц – российский физик, основоположник электротехники. Сформулировал правило индукционного тока в 1833 году.
Правило Ленца добавляет к закону пояснение, что ток, образовавшийся в результате индукции, всегда имеет противоположное направление образующему его магнитному потоку. Магнитное поле индукционного тока всегда препятствует магнитному потоку из внешнего источника. Суть правила очень близка закону сохранения энергии.
Применение закона Фарадея
Закон Фарадея позволил создать такие устройства и приборы как электродвигатели, трансформаторы, генераторы переменного тока, индукционные печи, дроссели, электросчетчики. Принцип действия всех этих устройств основан на электромагнитной индукции.
Трансформаторы передают энергию переменного электромагнитного поля за счет явления взаимной индукции, таким образом трансформируя величину напряжения на разных клеммах.
Примеры решения задач
1. В однородном магнитном поле, индукция которого 1 Тл, имеется плоский проводящий виток, площадь которого равна 100 см 2. Виток расположен перпендикулярно линиям магнитного потока. Сопротивление витка равно 200 мОм. Какой заряд протечет через поперечное сечение витка, если не станет поля?
При исчезновении магнитного поля изменится магнитный поток через виток:
После изменения магнитного потока в контуре появится ЭДС индукции:
2. Концы катушки из тысячи витков радиусом 5 см замкнуты накоротко. Сопротивление катушки 100 Ом. С какой скоростью должна изменяться индукция магнитного поля, перпендикулярного плоскости катушки, чтобы в ней выделялась тепловая мощность 100 мВт.
По закону электромагнитной индукции
Закон электромагнитной индукции
Магнитный поток
Прежде, чем разобраться с тем, что такое электромагнитная индукция, нужно определить такую сущность, как магнитный поток.
Представьте, что вы взяли обруч в руки и вышли на улицу в ливень. Чем сильнее ливень, тем больше через этот обруч пройдет воды — поток воды больше.
Если обруч расположен горизонтально, то через него пройдет много воды. А если начать его поворачивать — уже меньше, потому что он расположен не под прямым углом к вертикали.
Теперь давайте поставим обруч вертикально — ни одной капли не пройдет сквозь него (если ветер не подует, конечно).
Магнитный поток по сути своей — это тот же самый поток воды через обруч, только считаем мы величину прошедшего через площадь магнитного поля, а не дождя.
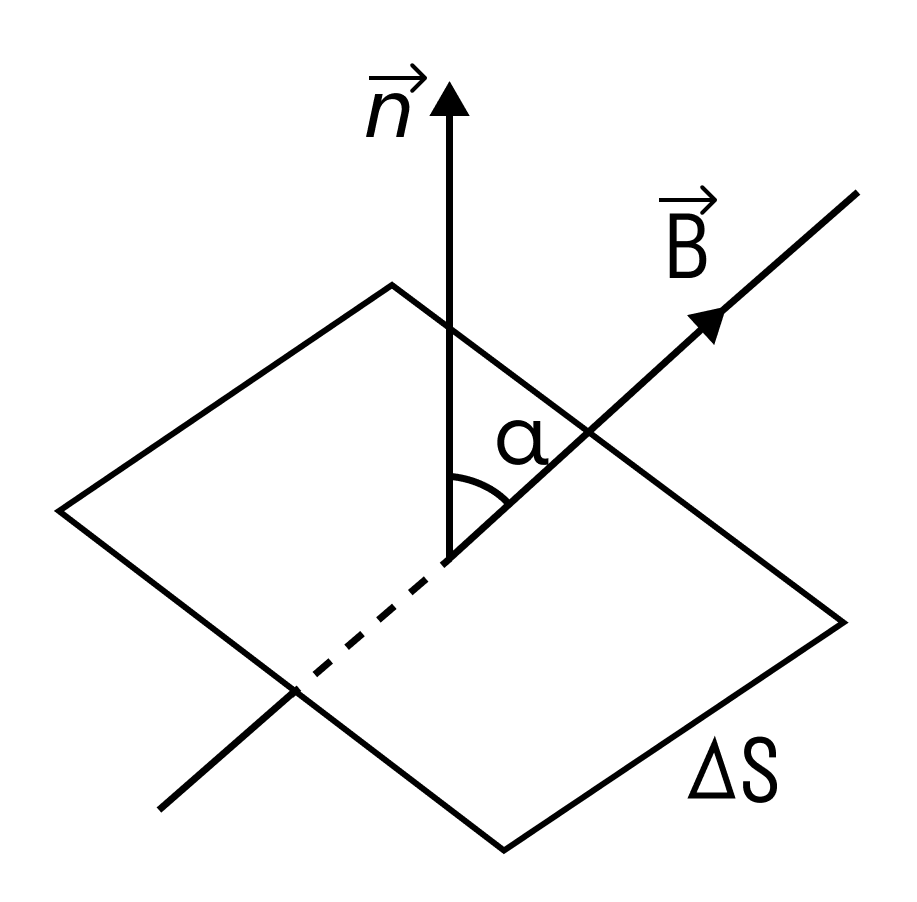
Магнитным потоком через площадь S контура называют скалярную физическую величину, равную произведению модуля вектора магнитной индукции B, площади поверхности S, пронизываемой данным потоком, и косинуса угла α между направлением вектора магнитной индукции и вектора нормали (перпендикуляра к плоскости данной поверхности):