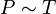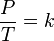закон шарля утверждает что
Закон Шарля. Изохора
В 1787 году Ж. Шарль экспериментально установил, что при постоянном объеме давление данной массы газа прямо пропорционально температуре.
Закон Шарля При неизменном объеме V отношение давления p данной массы газа m к его абсолютной температуре T есть величина постоянная.
Термодинамический процесс, во время которого объем остается неизменным, называется изохорным (от греческих слов isos — равный и chora — занимаемое место), а линия, которая его изображает — изохорой
Математически закон Ж. Шарля можно записать в виде:
\( \dfrac
Закон Шарля может быть записан в виде:
\[ p = \dfrac
Для сравнения того же вещества при двух различных условиях, закон можно записать в виде:
\( \dfrac
Закон Шарля справедлив только для идеального газа. Он применим с определенной степенью точности к реальным газам при низких давлениях и невысоких температурах (например, атмосферный воздух, продукты сгорания в газовых двигателях и пр.)
Согласно закону Шарля изохорные процессы происходят так, что между давлением и температурой идеального газа существует линейная зависимость — при повышении температуры данной массы газа его давление возрастает.
Закон Шарля выводится как частный случай из уравнения Менделеева–Клапейрона:
\( p\cdot V = v\cdot R\cdot T \)
где R – универсальная газовая постоянная ( R = 8,31441 Дж/моль∙К ), ν – число молей вещества, P – давление газа, V – объем газа, T – температура газа.
Он может быть получен как следствие основного уравнения молекулярно-кинетической теории идеального газа:
Изопроцессы в газах. Закон Шарля.
Давление р данной массы газа при постоянном объеме пропорционально температуре.
Закон Шарля был открыт французским физиком Ж. Шарлем в 1787 году.
Процесс изменения состояния термодинамической системы при постоянном объеме называется изохорным (от греч. hora — пространство).
Закон Шарля, как и другие газовые законы, является следствием уравнения состояния идеального газа:

Согласно (р = const Т при V = const), давление газа линейно зависит от температуры при постоянном объеме. Эта зависимость изображается прямой, которая называется изохорой.
С ростом объема газа при постоянной температуре давление его, согласно закону Бойля-Мариотта, падает. Поэтому изохора, соответствующая большему объему, лежит ниже изохоры, соответствующей меньшему объему.
В соответствии с (р = const Т при V = const), все изохоры начинаются в точке Т = 0 (давление идеального газа при абсолютном нуле равно нулю).
Изохорный процесс используется в газовых термометрах постоянного объема.
Закон Шарля
В современном мире электронная техника развивается семимильными шагами. Каждый день появляется что-то новое, и это не только небольшие улучшения уже существующих моделей, но и результаты применения инновационных технологий, позволяющих в разы улучшить характеристики.
Не отстает от электронной техники и приборостроительная отрасль – ведь чтобы разработать и выпустить на рынок новые устройства, их необходимо тщательно протестировать, как на этапе проектирования и разработки, так и на этапе производства. Появляются новая измерительная техника и новые методы измерения, а, следовательно – новые термины и понятия.
Для тех, кто часто сталкивается с непонятными сокращениями, аббревиатурами и терминами и хотел бы глубже понимать их значения, и предназначена эта рубрика.
Зако́н Ша́рля или второй закон Гей-Люссака — один из основных газовых законов, описывающий соотношение давления и температуры для идеального газа. Экспериментальным путем зависимость давления газа от температуры при постоянном объёме установлена в 1787 году Шарлем и уточнена Гей-Люссаком в 1802 году.
Неоднозначность терминологии
В русско- и англоязычной научной литературе существуют некоторые различия в наименовании законов, связанных с именем Гей-Люссака. Эти различия представлены в следующей таблице.
| Русскоязычное название | Англоязычное название | Формула |
|---|---|---|
| Закон Гей-Люссака | Закон Шарля (en:Charles’s law) Закон Гей-Люссака Закон объёмов (Volumes Law) | 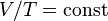 |
| Закон Шарля | Закон Гей-Люссака (en:Gay Lussac’s law) Второй закон Гей-Люссака | 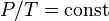 |
| Закон объёмных отношений | Закон Гей-Люссака (en:Gay Lussac’s law) |
Формулировка закона
Формулировка закона Шарля следующая:
Давление газа фиксированной массы и фиксированного объёма прямо пропорционально абсолютной температуре газа.
Проще говоря, если температура газа увеличивается, то и его давление тоже увеличивается, если при этом масса и объём газа остаются неизменными.Закон имеет особенно простой математический вид, если температура измеряется по абсолютной шкале, например, в градусах Кельвина. Математически закон записывают так:
P — давление газа, T — температура газа (в градусах Кельвина), k — константа.
Этот закон справедлив, поскольку температура является мерой средней кинетической энергии вещества. Если кинетическая энергия газа увеличивается, его частицы сталкиваются со стенками сосуда быстрее, тем самым создавая более высокое давление.
Для сравнения того же вещества при двух различных условиях, закон можно записать в виде:
Закон Амонтона о давлении и температуре: закон давления, описанный выше, должен быть на самом деле приписан Гильому Амонтону, который в конце XVII века (точнее между 1700 и 1702 годом) обнаружил, что давление фиксированной массы газа, поддерживаемого при постоянном объёме, пропорционально его температуре. Амонтон обнаружил это при постройке «воздушного термометра». Называть это закон законом Гей-Люссака просто некорректно, поскольку Гей-Люссак исследовал взаимосвязь между объёмом и температурой, а не давлением и температурой.
Закон Шарля был известен как закон Шарля и Гей-Люссака, поскольку Гей-Люссак опубликовал его в 1802 году с использованием по большей части неопубликованных с 1787 года данных Шарля. Закон Гей-Люссака, закон Шарля и закон Бойля — Мариотта все вместе образуют объединённый газовый закон. В сочетании с законом Авогадро эти три газовых закона обобщаются до уравнения состояния идеального газа.
Закон Шарля
Зако́н Ша́рля или второй закон Гей-Люссака — один из основных газовых законов, описывающий соотношение давления и температуры для идеального газа. Экспериментальным путем зависимость давления газа от температуры при постоянном объёме установлена в 1787 году Шарлем и уточнена Гей-Люссаком в 1802 году.
Содержание
Неоднозначность терминологии
В русско- и англоязычной научной литературе существуют некоторые различия в наименовании законов, связанных с именем Гей-Люссака. Эти различия представлены в следующей таблице.
| Русскоязычное название | Англоязычное название | Формула |
|---|---|---|
| Закон Гей-Люссака | Закон Шарля (en:Charles’s law) Закон Гей-Люссака Закон объёмов (Volumes Law) |  |
| Закон Шарля | Закон Гей-Люссака (en:Gay Lussac’s law) Второй закон Гей-Люссака |  |
| Закон объёмных отношений | Закон Гей-Люссака (en:Gay Lussac’s law) |
Формулировка закона
Формулировка закона Шарля следующая:
Давление газа фиксированной массы и фиксированного объёма прямо пропорционально абсолютной температуре газа.
Проще говоря, если температура газа увеличивается, то и его давление тоже увеличивается, если при этом масса и объём газа остаются неизменными.Закон имеет особенно простой математический вид, если температура измеряется по абсолютной шкале, например, в градусах Кельвина. Математически закон записывают так:
Этот закон справедлив, поскольку температура является мерой средней кинетической энергии вещества. Если кинетическая энергия газа увеличивается, его частицы сталкиваются со стенками сосуда быстрее, тем самым создавая более высокое давление.
Для сравнения того же вещества при двух различных условиях, закон можно записать в виде:
Закон Амонтона о давлении и температуре: закон давления, описанный выше, должен быть на самом деле приписан Гильому Амонтону, который в конце XVII века (точнее между 1700 и 1702 годом [1] [2] ) обнаружил, что давление фиксированной массы газа, поддерживаемого при постоянном объёме, пропорционально его температуре. Амонтон обнаружил это при постройке «воздушного термометра». Называть это закон законом Гей-Люссака просто некорректно, поскольку Гей-Люссак исследовал взаимосвязь между объёмом и температурой, а не давлением и температурой.
Закон Шарля был известен как закон Шарля и Гей-Люссака, поскольку Гей-Люссак опубликовал его в 1802 году с использованием по большей части неопубликованных с 1787 года данных Шарля. Закон Гей-Люссака, закон Шарля и закон Бойля — Мариотта все вместе образуют объединённый газовый закон. В сочетании с законом Авогадро эти три газовых закона обобщаются до уравнения состояния идеального газа.
См. также
Примечания
Ссылки
Литература
Полезное
Смотреть что такое «Закон Шарля» в других словарях:
ЗАКОН ШАРЛЯ — ЗАКОН ШАРЛЯ, объем газа при постоянном давлении прямо пропорционален его абсолютной температуре. Эта зависимость была впервые выведена Жаком ШАРЛЕМ в 1787 г. Закон представляет собой частный случай ЗАКОНА ИДЕАЛЬНОГО ГАЗА. Его иногда называют… … Научно-технический энциклопедический словарь
ЗАКОН ШАРЛЯ — один из основных газовых законов, согласно которому давление р данной массы идеального газа при постоянном объёме изменяется пропорционально изменению термодинамической (абсолютной) температуры Т: Реальные газы подчиняются этому закону при… … Большая политехническая энциклопедия
закон Шарля — Šarlio dėsnis statusas T sritis fizika atitikmenys: angl. Charles’ law vok. Charlessches Gesetz, n rus. закон Шарля, m pranc. loi de Charles, f … Fizikos terminų žodynas
Закон Бойля-Мариотта — Закон Бойля Мариотта один из основных газовых законов. Закон назван в честь ирландского физика, химика и философа Роберта Бойля (1627 1691), открывшего его в 1662, а также в честь французского физика Эдма Мариотта (1620 1684), который открыл… … Википедия
Закон Бойля — Мариотта — Воздух (или инертный газ), находящийся в запечатанном пакете с печеньем расширяется, когда продукт поднят на значительную высоту над уровнем моря (ок 2000 м) Закон Бойля Мариотта один из основных газовых з … Википедия
ЗАКОН ИДЕАЛЬНОГО ГАЗА — ЗАКОН ИДЕАЛЬНОГО ГАЗА, закон, определяющий соотношение давления, температуры и объема идеального газа: pV = nRT, где п количество молекул газа, a R универсальная ГАЗОВАЯ ПОСТОЯННАЯ; закон гласит, что при постоянной температуре (Т) произведение… … Научно-технический энциклопедический словарь
Закон Гей-Люссака — Анимация, представляющая зависимость объёма газа от температуры (закон Гей Люссака) Закон … Википедия
Шарля закон — давление pt идеального газа неизменной массы и объёма возрастает при нагревании линейно: рt = р0(1 + αt), где рt и р0 давление газа при температурах t и 0°C, α = 1/273К 1. Открыт в 1787 французским учёным Ж. Шарлем, уточнён Ж. Гей Люссаком… … Энциклопедический словарь
Закон Менделеева-Клапейрона — Уравнение состояния Статья является частью серии «Термодинамика». Уравнение состояния идеального газа Уравнение Ван дер Ваальса Уравнение Дитеричи Разделы термодинамики Начала термодинамики Уравнен … Википедия
Закон Бойля — Воздух (или ин … Википедия
Закон Шарля
Один из пионеров воздухоплавания Жак Александр Сезар Шарль пришел в науку в результате своего увлечения строительством монгольфьеров — больших воздушных шаров, заполненных разогретым воздухом, — которые тогда только-только появились. Я беседовал с современными пилотами воздушных шаров, и они утверждают, что их конструкция с использованием открытой газовой горелки, разработанная Шарлем более двух столетий назад, не претерпела принципиальных изменений и используется до наших дней. Ничего удивительного в том, что научные интересы Шарля лежали в области исследования свойств газов, стало быть, нет. Закон, носящий его имя, Шарль сформулировал в 1787 году после ряда опытов с кислородом, азотом, водородом и углекислым газом.
Чтобы понять смысл закона Шарля, представьте себе газ как скопление быстро движущихся и соударяющихся молекул. Давление газа определяется ударами молекул о стенки сосуда: чем больше ударов, тем выше давление. Например, молекулы воздуха в комнате, где вы находитесь, оказывают на поверхность вашего тела давление 101 325 паскалей (или 1 бар, если речь идет о метеорологии).
Закон Шарля, наряду с другими газовыми законами, лег в основу уравнения состояния идеального газа, описывающего соотношение давления, объема и температуры газа с количеством вещества..
Французский физик, химик, инженер и воздухоплаватель. Родился в Божанси (Beaugency). В молодости служил чиновником в Министерстве финансов в Париже. Заинтересовавшись воздухоплаванием, разработал монгольфьеры современной конструкции, подъемная сила которых обусловлена расширением нагретого горелкой воздуха внутри шара. Он же одним из первых стал наполнять воздушные шары водородом (который во много раз легче воздуха и обеспечивает значительно большую подъемную силу, нежели горячий воздух), установив благодаря этому рекорды высоты подъема (более 3 000 м) и дальности полета (43 км). Именно занятия воздухоплаванием заставили Шарля заинтересоваться исследованиями свойств газов.