запах брома на что похож
Интересные факты о броме
Здравствуйте, наши дорогие читатели. Бром – это химически активный неметалл 17-й группы периодической таблицы химических элементов. Чистый бром существует в виде коричневой жидкости при стандартной комнатной температуре и давлении. Этот активный неметалл используется в химических реакциях для производства антипиренов (компонент, какой добавляют в материалы органического происхождения для обеспечения их огнеустойчивости), пестицидов, лекарств, красок и т.д.
И это далеко не все, что можно рассказать об этом химическом элементе. В статье мы собрали для вас самые интересные факты о броме, какие должны понравиться как детям, так и взрослой аудитории.
Бром является галогеном, как и все элементы, входящие в 17-ю группу периодической таблицы химических элементов. Как нам известно из уроков химии, галогены могут существовать в трех формах: в газообразной, жидкой и твердой. Так как бром располагается в 4-м периоде, в середине группы галогенов, он имеет промежуточные свойства в сравнении с остальными галогенами. Это единственный неметалл в периодической таблице, который является жидким при обычных условиях. Его название произошло от греческого слова «bromos», какое буквально переводится как «зловоние» или «неприятный запах».
Он представляет собой темную красновато-коричневую жидкость при комнатной температуре. Его свойства, в целом, аналогичны другим галогенам, таким как хлор, йод и фтор. Он является очень реактивным окислителем.
Бром – это очень плохой проводник электричества. Вызвано это тем, что он существует как ковалентное соединение двух атомов брома без свободных электронов.
Он очень реактивен. Учитывая его высокую реакционную способность, в чистом виде он очень токсичный и может вызвать химические ожоги кожи. Однако бромид-ион, присутствующий в воде, не токсичен и является микроэлементом, какой ежедневно попадает в наш организм вместе с водой и пищей.
По своей плотности он приблизительно в 3 раза превышает плотность воды. Его плотность приблизительно такая же, как плотность твердого алюминия.
Бром и хлор – это единственные галогены, какие имеют более одного природного изотопа. Два встречающихся в природе изотопа брома существуют примерно в равных пропорциях. На долю Br-79 приходится около 51% всего брома, в то время как на долю Br-81 вся остальная часть – 49%. Именно поэтому его атомная масса находится приблизительно посередине, между 79 и 81. Эти изотопы стабильны. Все остальные изотопы брома, какие производят в лабораториях, являются радиоактивными. Они варьируются от Br-66 до Br-97 с периодом полураспада от наносекунд до нескольких часов.
Учитывая его высокую реакционную способность, практически все элементы периодической таблицы образуют с ним соединения. Есть несколько исключений для элементов, не являющихся реактивными, то есть, инертных (благородные газы). Одним из простейших его соединений является Бромоводород (HBr). Бромоводород существует в виде газа, а при растворении в воде становится сильной кислотой.
Образование связей между бромом и углеродом приводит к образованию широкого семейства соединений, известных как броморганические соединения. Это наиболее распространенные органические соединения, содержащие галогены в природе (например, фторорганические и хлорорганические соединения). К примеру, мировые океаны ежегодно выбрасывают миллион тонн бромоформа (CHBr 3) и 60 тысяч тонн бромметана (CH 3 Br).
Тирский пурпур – это краситель, какой использовали древние цивилизации. Он считался элитным красителем в древние времена. Обычно этот краситель получали из мидий и моллюсков. В 1909 году было обнаружено, что тирский пурпур содержит в себе бром.
Из всех химических элементов на нашей планете, он является 44-м по распространенности. Его меньше чем других галогенов, таких как фтор и хлор. Он существует в виде ионных солей в земной коре в количестве около 2.5 частей на 1 000 000. Так как он существует в виде солей, растворимых в воде, он имеет тенденцию встречаться в высоких концентрациях в соленых озерах и минеральных водах. По этой причине его легче всего извлечь именно из этих источников. Что касается основных производителей этого химического элемента, то ими являются США (1 место), Израиль (2 место) и Китай (3 место).
Как уже было отмечено ранее, соединения брома используются в качестве пестицидов в сельском хозяйстве. Они также используются для придания материалам органического происхождения огнеустойчивых свойств. Ранее соединения брома использовались в огнетушителя. Он также содержится в растворах для проявления фотопленки.
Этот химический элемент был открыт двумя разными химиками независимо друг от друга. Первым был немецкий химик Карл Якоб Левих. Он выделил его из минеральной воды, добываемой в местом источнике. Вторым был французский химик Антуан Жером Балар. Он знал, что в водорослях присутствуют и другие галогены, такие как йод. Зола – это соли, оставшиеся после сжигания органических веществ. Поэтому Балар использовал золу морских водорослей для создания солевого раствора, какой после перегонял, в результате чего получил новый галоген бром.
Раньше этот химический элемент использовался в медицине. Его соединения обладают седативным действием и использовались для лечения эпилепсии. Однако с развитием медицины и изучением влияния брома на организм человека стало понятно, что эти соединения очень токсичны. Поэтому в конечном итоге лекарства с его соединениями были заменены на более безопасные аналоги.
На этом наша статья подошла к концу, уважаемые читатели. Надеемся, что публикация была для вас действительно интересной и полезной.
Бром (Br, Bromum)
История брома
Открытие брома произошло в первой трети XIX столетия, независимо друг от друга немецкий химик Карл Якоб Лёвих в 1825 году, а француз Антуан Жером Балар – в 1826 представили миру новый химический элемент. Интересный факт – изначально Балар назвал свой элемент муридом (от латинского muria – рассол), потому что открытие своё сделал, изучая средиземноморские соляные промыслы.
Общая характеристика Брома
Нахождение брома в природе
Бром – широко распространённый химический элемент, во внешней среде встречается практически везде. Особенно много брома находится в солёной воде – морей и озёр, там он имеется в виде бромида калия, бромида натрия и бромида магния. Наибольшее количество брома образуется при испарении морской воды, есть он и в некоторых горных породах, а также в растениях.
В организме человека находятся до 300 мг брома, в основном в щитовидной железе, так же бром содержит кровь, почки и гипофиз, мышцы и костная ткань.
Физические и химические свойства брома
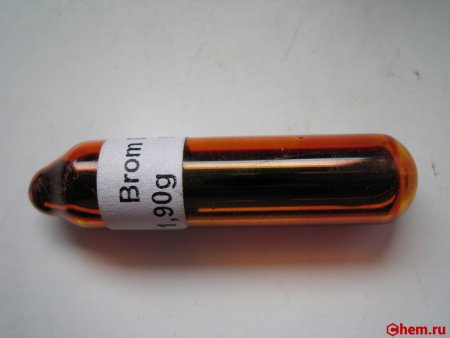
Бром обычно представляет собой едкую тяжёлую жидкость, имеет красно-бурый цвет и резкий, очень неприятный (зловонный) запах. Является единственным из неметаллов, при комнатной температуре находящийся в жидком состоянии.
Бром (а также – пары брома)– токсичное и ядовитое вещество, при работе с ним необходимо применять средства химической защиты, потому что при попадании на кожу и слизистые человека бром образует ожоги.
Состав природного брома – два стабильных изотопа ( 79 Br и 81 Br), молекула брома состоит из двух атомов и имеет химическую формулу Br2.
Суточная потребность организма в броме
Потребность здорового организма в броме – не более 0,8-1 г.
Продукты питания богатые бромом
Наряду с имеющимся в организме, бром человек получает с пищевыми продуктами. Основными поставщиками брома являются орехи (миндаль, фундук, арахис), бобовые (фасоль, горох и чечевица), пшеница и макаронные изделия из твёрдых сортов пшеницы, ячневая крупа, молочные продукты, водоросли и практически все виды морской рыбы.
Опасность и вред брома
Не рекомендуется применять препараты брома людям, в силу специфики работы нуждающимся в стабильной концентрации внимания (водителям, альпинистам, монтажникам-высотникам).
Признаки избытка брома
Переизбыток данного вещества обычно бывает при передозировке препаратов брома, для людей категорически нежелательна, потому что может представлять реальную опасность для здоровья. Основные признаки избытка брома в организме – воспаления и высыпания на коже, сбои в работе пищеварительной системы, общая вялость и подавленность, постоянные бронхиты и риниты, не связанные с простудами и вирусами.
Признаки нехватки брома
Нехватка в организме брома проявляется бессонницей, замедлением роста у детей и подростков, понижением уровня гемоглобина в крови, но, не всегда эти симптому связывают именно с недостаточным количеством брома, поэтому для подтверждения подозрений, нужно посетить доктора и сдать необходимые анализы. Часто из-за нехватки брома повышается риск самопроизвольного прерывания беременности (выкидыш на разных сроках, вплоть до третьего триместра).
Полезные свойства брома и его влияние на организм
Бром (в виде бромидов) применяется при различных заболеваниях, основное его действие – седативное, поэтому препараты брома часто назначаются при нервных расстройствах и нарушениях сна. Соли брома являются эффективным средством для лечения заболеваний, вызывающих судороги (особенно эпилепсии), а также нарушений деятельности сердечно-сосудистой системы и некоторых желудочно-кишечных недугов (язвы желудка и двенадцатиперстной кишки).
Усвояемость брома
Усвояемость брома замедляют хлор, алюминий, йод и фтор, поэтому принимать препараты, содержащие соли брома нужно только после консультации с врачом.
Бром и его влияние на мужскую потенцию
Вопреки ничем не подтверждённым слухам (больше похожим на анекдоты), бром не оказывает угнетающего воздействия на половое влечение и потенцию мужчин. Якобы бром в виде белого порошка добавляют в еду молодым бойцам в армии, а также пациентам мужского пола в псих-диспансерах и заключённым в тюрьмах и колониях. Этому нет ни одного научного подтверждения, а слухи можно объяснить способностью брома (его препаратов) оказывать успокаивающее воздействие.
По некоторым источникам, бром способствует активизации половой функции у мужчин и увеличению как объёма эякулянта, так и количества сперматозоидов, в нём содержащихся.
Применение брома в жизни
Бром применяется не только в медицине (бромид калия и бромид натрия), но и в других областях, например в фотографии, нефтедобыче, в производстве моторного топлива. Бром используется при изготовлении боевых отравляющих веществ, что ещё раз подчёркивает необходимость осторожного обращения с данным элементом.
Бром — ядовитый элемент с интересными свойствами
Бром — простое вещество, галоген, открыт в начале 19-го века. 
Свойства
Тяжелая жидкость темно-красного цвета. Только бром и ртуть из всех простых веществ в нормальных условиях являются жидкостями. Запах неприятный, именно он дал название веществу (от греческого «бромос», означающего дурной запах). В воде растворяется плохо, хотя и лучше, чем остальные галогены. Смешивается с органическими растворителями в любых пропорциях.
Химически активный элемент, сильный окислитель, образует довольно сильную бромоводородную кислоту HBr. Кроме этого, образует ряд кислородосодержащих кислот. Вступает в реакции с галогенами, неметаллами, металлами. Не реагирует с кислородом, азотом, платиной, танталом. Образует бромиды, легко присоединяется к органическим соединениям.
Следует различать бром, как химический элемент и лекарство «бром», который прописывают в поликлинике в качестве успокаивающего. Бром очень ядовит, а в медицинских целях используется калий бромистый или натрий бромистый, усиливающие процессы торможения в ЦНС.
Бром и его пары ядовиты, при попадании на кожу жидкий бром вызывает долго незаживающие химические ожоги. Работать с реактивом допускается только с использованием всех средств защиты, включая специальную одежду, перчатки и противогаз. Особенно опасно вдыхание паров брома для людей с болезнями органов дыхания, так как может развиться отек легких. При отравлении бромом следует обеспечить человеку свежий воздух или ингаляции кислородом и вызвать врача. Помогает теплое молоко, сода, содосодержащая минеральная вода, кофе. Антидотом и нейтрализатором разливов брома служит раствор тиосульфата натрия. Им можно также пропитывать лицевые повязки для защиты от паров. При небольших разливах подойдет обычная сода, но реакция с бромом экзотермическая, вызывает повышение температуры воздуха и усиливает испарения, так что лучше иметь под рукой тиосульфат натрия.
Применение

— Бром востребован для получения резины высокого качества.
— Для аналитических целей используют бром, бромную воду, калий бромистый, натрий бромистый.
— Бромид серебра применяется в качестве светочувствительного материала в фотографии.
— Почти половина производимого брома идет на получение 1,2 дибромэтана, который входит в состав топлива как антидетонационная присадка, применяется для защиты древесины от повреждения насекомыми, в органическом синтезе.
— Бром широко используют для получения антипиренов — специальных добавок и пропиток, придающих краскам, пластмассам, древесине, текстильным материалам противопожарные свойства.
— Бромхлорметан применяется для наполнения огнетушителей.
— Пентафторид брома применяется в ракетном топливе.
— В сельском хозяйстве соединения брома используются для борьбы с вредителями растений.
— Растворы бромидов применяются в нефтедобыче, на горно-обогатительных комбинатах.
— В медицине растворы KBr и NaBr входят в состав успокаивающих средств, например, в состав «корвалола».
— Бром может использоваться в качестве дезинфицирующего агента для замены хлора в бассейнах, на станциях водоподготовки.
Калий бромистый, натрий бромистый, бромистоводородная кислота, стандарт-титр калий бромид продаются в нашем интернет магазине по выгодным ценам.
Запах брома на что похож
Содержание
История
Бром был независимо открыт двумя химиками: Карлом Якобом Лёвихом (нем. Carl Jacob Löwig ) в 1825 году, и Антуаном Жеромом Баларом в 1826 году. Открытие Балара, молодого преподавателя колледжа города Монпелье, сделало его имя известным всему миру. Из одной популярной книги в другую кочует утверждение, что, огорчённый тем, что в открытии брома никому не известный Антуан Балар опередил самого Юстуса фон Либиха, последний воскликнул, что, дескать, не Балар открыл бром, а бром открыл Балара. Однако это утверждение неточно: фраза принадлежала не фон Либиху, а Шарлю Жерару, который очень хотел, чтобы кафедру химии в Парижском университете занял Огюст Лоран, а не избранный на должность профессора А. Балар.
Происхождение названия
Название элемента происходит от др.-греч. βρῶμος — «дурной запах, зловоние».
Нахождение в природе
В качестве исходного сырья для производства брома служат:
Получение
Затем элементный бром выделяют из раствора потоком водяного пара или воздуха и конденсируют.
Физические свойства
Изотопы
Природный бром состоит из двух стабильных изотопов 79 Br (50,56 %) и 81 Br (49,44 %). Искусственно получены многочисленные радиоактивные изотопы брома.
Химические свойства
Бром немного, но лучше других галогенов растворим в воде ( 3,58 г на 100 г воды при 20 °C), раствор называют бромной водой. В бромной воде протекает реакция с образованием бромоводородной и неустойчивой бромноватистой кислот:
С большинством органических растворителей бром смешивается во всех отношениях, при этом часто происходит бромирование молекул органических растворителей.
По химической активности бром занимает промежуточное положение между хлором и йодом. При реакции брома с растворами йодидов выделяется свободный йод:
Напротив, при действии хлора на бромиды, находящиеся в водных растворах, выделяется свободный бром:
При реакции брома с серой образуется S2Br2, при реакции брома с фосфором — PBr3 и PBr5. Бром реагирует также с неметаллами селеном и теллуром.
Реакция брома с водородом протекает при нагревании и приводит к образованию бромоводорода HBr. Раствор HBr в воде — это бромоводородная кислота, по силе близкая к соляной кислоте HCl. Соли бромоводородной кислоты — бромиды (NaBr, MgBr2, AlBr3 и др.). Качественная реакция на присутствие бромид-ионов в растворе — образование с ионами Ag + светло-желтого осадка бромида серебра AgBr, практически нерастворимого в воде.
С кислородом и азотом бром непосредственно не реагирует. Бром образует большое число различных соединений с остальными галогенами. Например, со фтором бром образует неустойчивые BrF3 и BrF5, с йодом — IBr. При взаимодействии со многими металлами бром образует бромиды, например, AlBr3, CuBr2, MgBr2 и др. Устойчивы к действию брома тантал и платина, в меньшей степени — серебро, титан и свинец.
Жидкий бром легко взаимодействует с золотом, образуя трибромид золота AuBr3:
Бром — сильный окислитель, он окисляет сульфит-ион до сульфата, нитрит-ион — до нитрата и т. д.
При взаимодействии с органическими соединениями, содержащими двойную связь, бром присоединяется, давая соответствующие дибромпроизводные:
Присоединяется бром и к органическим молекулам, в составе которых есть тройная связь. Обесцвечивание бромной воды при пропускании через неё газа или добавлении к ней жидкости свидетельствует о том, что в газе или в жидкости присутствует непредельное соединение.
При нагревании в присутствии катализатора бром реагирует с бензолом с образованием бромбензола C6H5Br (реакция замещения).
При взаимодействии брома с растворами щелочей и с растворами карбонатов натрия или калия образуются соответствующие бромиды и броматы, например:
Реагирует с родановодородом:
HSCN + Br2 ⟶ BrCN + HBr + S↓
Бромсодержащие кислоты
Помимо бескислородной бромоводородной кислоты HBr, бром образует ряд кислородных кислот: бромную HBrO4, бромноватую HBrO3, бромистую HBrO2, бромноватистую HBrO.
Применение
В химии
Промышленное применение
Значительная часть элементарного брома до начала 1980-х использовалась для производства 1,2-дибромэтана, входившего в состав этиловой жидкости — антидетонирующей добавки в бензины, содержащей тетраэтилсвинец; дибромэтан в этом случае служил источником брома для образования относительно летучего дибромида свинца для предотвращения осаждения твёрдых оксидов свинца на деталях двигателя. Бром также используется в синтезе антипиренов — добавок, придающих пожароустойчивость пластикам, древесине, текстильным материалам.
В медицине
В производстве оружия
Со времен Первой мировой войны бром используется для производства боевых отравляющих веществ.
Физиологическое действие
Биологическое значение
В 2014 году исследование показало, что бром (в форме бромид-иона) является необходимым кофактором в ходе биосинтеза коллагена IV, делая элемент существенным в архитектуре базальной мембраны и развитии тканей у животных. Тем не менее, не было отмечено никаких чётких симптомов или синдромов дефицита при полном удалении брома из пищи. В других биологических функциях бром может не быть необходимым, но всё же приносить пользу, особенно когда он заменяет хлор. Например, в присутствии перекиси водорода H2O2 синтезируемая эозинофилами с ионами хлорида или бромида эозинофильная пероксидаза обеспечивает мощный механизм, с помощью которого эозинофилы убивают многоклеточных паразитов (таких, как, например, нематодные черви, участвующие в филяриозе) и некоторые бактерии, такие как бактерии туберкулёза). Эозинофильная пероксидаза — это галопероксидаза, которая более эффективно использует бром, а не хлор для этой цели, производя гипобромит (бромводородную кислоту), хотя использование хлорид-иона также возможно. Хотя α-галоэфиры, как правило, считаются высокореактивными и, следовательно, токсичными промежуточными продуктами в биоорганическом синтезе, млекопитающие, включая людей, кошек и крыс, по-видимому, биосинтезируют следы α-бромэфира, 2-октил-4-бром-3-оксобутаноата, которые присутствуют в их спинномозговой жидкости и, вероятно, играют пока неясную роль в возникновении быстрого сна.
Морские организмы являются основным источником броморганических соединений, и именно в этих организмах роль брома могла бы быть намного более высокой. Более 1600 таких броморганических соединений были идентифицированы к 1999 году. Наиболее распространённым является метилбромид (CH3Br), около 56 000 тонн которого синтезируется за год морскими водорослями. Эфирное масло гавайской водоросли Asparagopsis taxiformis состоит из 80 % бромоформа. Большинство таких броморганических соединений в море синтезируется водорослями под действием уникального фермента, ванадийбромпероксидазы.
Особенности работы
При работе с бромом следует пользоваться защитной спецодеждой, противогазом, специальными перчатками. Из-за высокой химической активности и токсичности как паров брома, так и жидкого брома его следует хранить в стеклянной, плотно закупоренной толстостенной посуде. Сосуды с бромом располагают в ёмкостях с песком, который предохраняет сосуды от разрушения при встряхивании. Из-за высокой плотности брома сосуды с ним ни в коем случае нельзя брать только за горло (горло может оторваться, и тогда бром окажется на полу).
Проливы брома целесообразно посыпать карбонатом натрия:
либо влажной пищевой содой:
Мифы, легенды, заблуждения и их опровержения
Существует широко распространённая городская легенда, будто бы в армии, местах лишения свободы и психиатрических больницах добавляют соединения брома в еду для снижения полового влечения. Происхождение этого мифа доподлинно неизвестно.
Препараты брома имеют солёный вкус и оказывают седативный (успокаивающий) и снотворный эффект.
Запах брома на что похож
Происхождение названия
Нахождение в природе
В качестве исходного сырья для производства брома служат:
Получение
Cl2\ <+>\ 2 Br^ <->-> 2 Cl^ <-> <+>Br2
Физические свойства
Br 0 → Br + + Шаблон:Math: 11,81381 эВ [9] ; Br + → Br 2+ + Шаблон:Math: 21,80 эВ; Br 2+ → Br 3+ + Шаблон:Math: 35,90 эВ; Br 3+ → Br 4+ + Шаблон:Math: 47,3 эВ; Br 4+ → Br 5+ + Шаблон:Math: 59,7 эВ; Br 5+ → Br 6+ + Шаблон:Math: 88,6 эВ; Br 6+ → Br 7+ + Шаблон:Math: 109,0 эВ (по другим данным 103,0 эВ [9] ); Br 7+ → Br 8+ + Шаблон:Math: 192,8 эВ.
Изотопы
Шаблон:Main Природный бром состоит из двух стабильных изотопов 79 Br Шаблон:Nobr и 81 Br Шаблон:Nobr Искусственно получены многочисленные радиоактивные изотопы брома.
Химические свойства
Бром немного, но лучше других галогенов растворим в воде (Шаблон:Num на Шаблон:Num воды при 20 °C), раствор называют бромной водой. В бромной воде протекает реакция с образованием бромоводородной и неустойчивой бромноватистой кислот:
Br2 + H2O HBr + HBrO
С большинством органических растворителей бром смешивается во всех отношениях, при этом часто происходит бромирование молекул органических растворителей.
По химической активности бром занимает промежуточное положение между хлором и иодом. При реакции брома с растворами иодидов выделяется свободный иод:
Напротив, при действии хлора на бромиды, находящиеся в водных растворах, выделяется свободный бром. Реакция протекает при кипении:
Cl2 <+>\ 2 KBr\ \xrightarrow
При реакции брома с серой образуется S2Br2, при реакции брома с фосфором — PBr3 и PBr5. Бром реагирует также с неметаллами селеном и теллуром.
Реакция брома с водородом протекает при нагревании и приводит к образованию бромоводорода HBr. Раствор HBr в воде — это бромоводородная кислота, по силе близкая к соляной кислоте HCl. Соли бромоводородной кислоты — бромиды (NaBr, MgBr2, AlBr3 и др.). Качественная реакция на присутствие бромид-ионов в растворе — образование с ионами Ag + светло-желтого осадка бромида серебра AgBr, практически нерастворимого в воде.
С кислородом и азотом бром непосредственно не реагирует. Бром образует большое число различных соединений с остальными галогенами. Например, со фтором бром образует неустойчивые BrF, BrF3 и BrF5, с хлором — BrCl, с иодом — IBr и IBr3, получен также бромид астата AtBr. При взаимодействии со многими металлами бром образует бромиды, например, AlBr3, CuBr2, MgBr2 и др. Устойчивы к действию брома тантал и платина, в меньшей степени — серебро, титан и свинец.
Жидкий бром легко взаимодействует с золотом, образуя трибромид золота AuBr3 [10] :
Характерные степени окисления брома: −1 (бромиды Br − ), +1 (гипобромиты BrOШаблон:Sup), +3 (бромиты BrOШаблон:Subsup), +5 (броматы BrOШаблон:Subsup), +7 (перброматы BrOШаблон:Subsup).
Бром — сильный окислитель, он окисляет сульфит-ион до сульфата, нитрит-ион — до нитрата и т. д.
При взаимодействии с органическими соединениями, содержащими двойную связь, бром присоединяется, давая соответствующие дибромпроизводные:
Присоединяется бром и к органическим молекулам, в составе которых есть тройная связь. Обесцвечивание бромной воды при пропускании через неё газа или добавлении к ней жидкости свидетельствует о том, что в газе или в жидкости присутствует непредельное соединение.
При нагревании в присутствии катализатора бром реагирует с бензолом с образованием бромбензола C6H5Br (реакция замещения).
При взаимодействии брома с растворами щелочей и с растворами карбонатов натрия или калия образуются соответствующие бромиды и броматы, например:
Бромсодержащие кислоты
Помимо бескислородной бромоводородной кислоты HBr, бром образует ряд кислородных кислот: бромную HBrO4, бромноватую HBrO3, бромистую HBrO2, бромноватистую HBrO.
Применение
В химии
Промышленное применение
Значительная часть элементарного брома до начала 1980-х использовалась для производства 1,2-дибромэтана, входившего в состав этиловой жидкости — антидетонирующей добавки в бензины, содержащей тетраэтилсвинец; дибромэтан в этом случае служил источником брома для образования относительно летучего дибромида свинца для предотвращения осаждения твёрдых оксидов свинца на деталях двигателя. Бром также используется в синтезе антипиренов — добавок, придающих пожароустойчивость пластикам, древесине, текстильным материалам.
В медицине
В производстве оружия
Со времен Первой мировой войны бром используется для производства боевых отравляющих веществ.
Физиологическое действие
Биологическое значение
Особенности работы
При работе с бромом следует пользоваться защитной спецодеждой, противогазом, специальными перчатками. Из-за высокой химической активности и токсичности как паров брома, так и жидкого брома его следует хранить в стеклянной, плотно закупоренной толстостенной посуде. Сосуды с бромом располагают в ёмкостях с песком, который предохраняет сосуды от разрушения при встряхивании. Из-за высокой плотности брома сосуды с ним ни в коем случае нельзя брать только за горло (горло может оторваться, и тогда бром окажется на полу).
Проливы брома целесообразно посыпать карбонатом натрия:
Однако реакция элементарного брома с содой носит сильно экзотермический характер, что ведёт к увеличению испарения брома, к тому же выделяющаяся углекислота также способствует испарению, поэтому пользоваться вышеописанными методами Шаблон:Нет АИ 2. Шаблон:Нет АИ 2 для дегазации брома подходит водный раствор тиосульфата натрия Na2S2O3. Для локализации больших проливов брома можно использовать раствор тиосульфата натрия с добавками пенообразующих веществ и аэросила. Этот же раствор (3—5-процентный тиосульфат натрия) используется для смачивания ватно-марлевых повязок, которые помогают защитить органы дыхания от паров брома.
Мифы, легенды, заблуждения и их опровержения
Существует широко распространённая городская легенда, будто бы в армии, местах лишения свободы и психиатрических больницах добавляют соединения брома в еду для снижения полового влечения. Происхождение этого мифа доподлинно неизвестно.