запоры после химиотерапии что делать
Осложнения противоопухолевой терапии на желудочно-кишечный тракт
В данной статье рассматриваются следующие осложнения противоопухолевого лечения со стороны желудочно-кишечного тракта:
Снижение массы тела (недостаточность питания)
Снижение массы тела у онкологического пациента возникает вследствие многих факторов: необходимо учитывать лечение пациента сейчас и в прошлом, состояние больного, объем операционных вмешательств и т.д.
Причины потери массы тела:
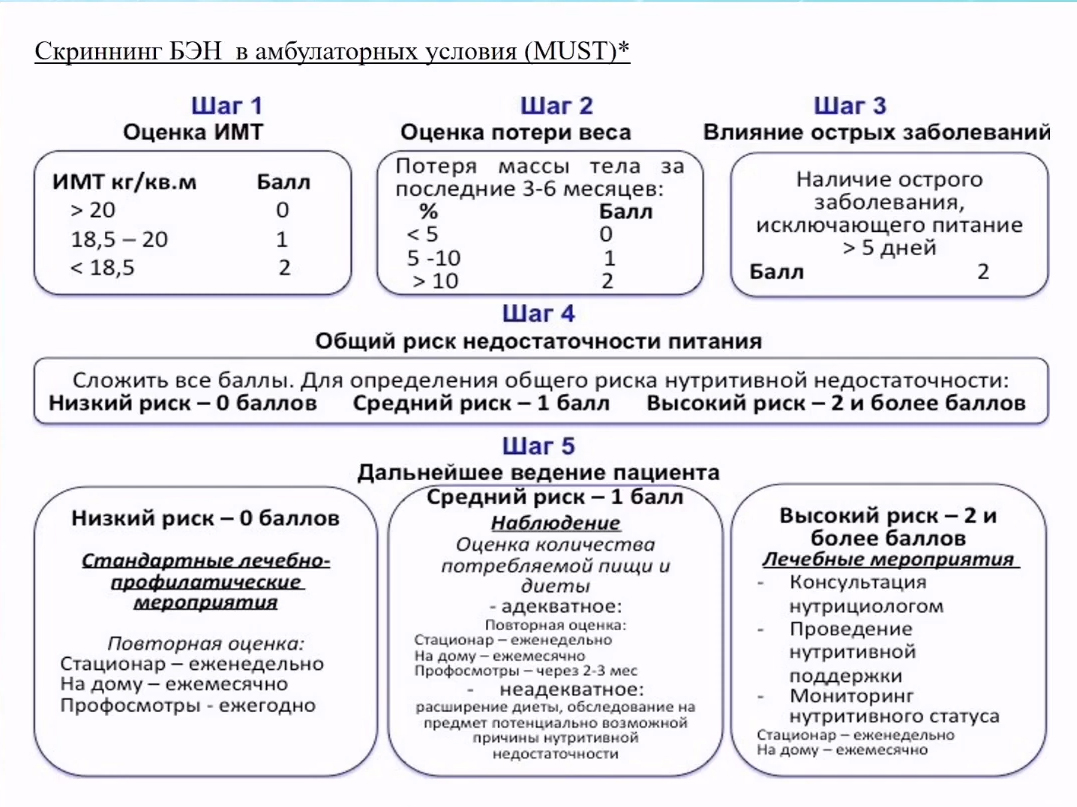
Оценка недостаточности питания
В амбулаторной практике используются различные шкалы для оценки недостаточности питания.
Оценка ситуации должна включать в себя как минимум следующие вопросы:
Алгоритм назначения нутриционной поддержки
Данный алгоритм должен разрабатываться совместно со специалистом, поскольку пациент не может самостоятельно подобрать для себя адекватную терапию, которая поспособствует улучшению самочувствия и облегчению симптоматики.
Для алгоритма назначения нутриционной поддержки необходимо ответить на следующие вопросы:
Для расчета энергетических потребностей пациента необходимо оценить имеющуюся недостаточность питания, риски прогрессирования недостаточности питания.
Осуществляется выбор оптимального пути введения лечебного питания. Возможны следующие варианты: сиппинг (лечебное питание, которое пациент может употреблять самостоятельно), зондовое питание, комбинированная нутриционовая поддержка (совмещение парентерального и энтерального питания). Отдельно стоит рассматривать ситуации, когда у пациента есть стома (гастростома, энтеростома, эзофагостома): в этом случае введение препаратов лечебного питания может осуществляться через нее.
Определяется режим кормления, режим введения препаратов лечебного питания.
Определяются сроки нутриционной поддержки пациента.
Осуществляется выбор препаратов для конкретной ситуации.
Методы оценки эффективности проводимой нутриционной поддержки
Эти методы часто используются в рутинной практике. Они позволяют оценить изменение состава тела на фоне нутриционной поддержки, оценить объем жировой массы, внеклеточной и внутриклеточной жидкости, косвенно оценить количество мышечной массы.
Эти методы редко используются в рутинной практике. Однако их достоинство в доступности – врач может осуществить оценку состояния тела прямо во время приема.
Пострезекционные синдромы
Синдромы оперированного желудка
К ним относятся – депминг-синдром, гипогликемический синдром, анемический синдром, синдром приводящей петли, рефлюкс-эзофагит, недостаточность питания, моторные нарушения культи желудка, анастомоза.
Чаще всего с этими синдромами сталкиваются пациенты, которые перенесли операции на желудке, пищеводе или поджелудочной железе. Данные симптомы могут развиваться, как в раннем, так и в более отсроченном периоде.
Демпинг-синдром. Как правило, проявляется слабостью, потливостью после приема пищи, головокружением, зачастую возникает при приеме углеводистой пищи. Развивается, как в раннем, так и в позднем послеоперационном периоде. Синдром обусловлен быстрой эвакуацией пищи из пищевода в тонкую кишку с последующим развитием гипергликемии, то есть пища быстро попадает из пищевода в тонкую кишку, что вызывает повышение уровня глюкозы (сахара) в крови.
Обычно регулируется подбором режима питания и рациона, а также медикаментозными препаратами.
Пациентам, страдающим демпинг-синдромом, необходимо вести пищевой дневник. Это поможет отследить причины синдрома (определенное время суток, определенная еда и т.д.).
Гипогликемический синдром. Проявляется недостаточным уровнем сахара в крови. Является разновидностью позднего демпинг-синдрома.
Анемия. Обусловлена дефицитом железа и витамина В-12 после удаления желудка. Данное состояние необходимо корректировать и компенсировать препаратами.
Рефлюкс-эзофагит. Это заброс пищи из тонкой кишки в пищевод. Самыми частыми проявлениями рефлюкс-эзофагита является изжога, горечь во рту, тяжесть после приема пищи, ощущение жжения по ходу пищевода. Реже симптом проявляется жжением в области языка, кислым привкусом во рту. Корректируется режимом питания, новыми жизненными привычками и назначением медикаментозной терапии.
Недостаточность питания или потеря массы тела. Данный синдром требует коррекции рациона и режима питания, а также назначения дополнительной нутриционной поддержки.
Важно знать, сколько массы пациент потерял до операции, после операции, во время химио/лучевой терапии. Исходя из этого подбираются препараты лечебного питания.
Нарушение культи желудка, анастомоза (т.е. места соединения органов). Осложнение, которое относится к моторно-эвакуаторным нарушениям. Корректируется медикаментозно.
Болевой синдром. Может быть обусловлен разными факторами. При обращении к врачу важно описать, когда возникают боли, связаны ли они с приемом пищи, через какое время и в каком месте после приема пищи возникают, проходят самостоятельно или требуют применения препаратов, сопровождаются ли тошнотой, рвотой, нарушением стула.
Астения. Состояние общей слабости и утомляемости.
Эти и другие симптомы, которые могут беспокоить пациента в послеоперационном периоде или на фоне проводимого лечения. Любые жалобы требуют обращения к врачу.
Диагностика синдромов оперированного желудка
Обследования позволяют подобрать терапию, дать точные рекомендации по образу жизни.
Как установить причину рефлюкса (заброса пищи обратно в пищевод)?
В сложных случаях для оценки характера рефлюктата и оценки того, что именно забрасывается в пищевод, используется суточная импеданс-pH-метрия. Данное исследование особенно актуально для пациентов, которые перенесли гастрэктомию (удаление желудка), резекцию пищевода.
Обследование выполняется в тех клинических ситуациях, когда пациент получает медикаментозное лечение, но улучшения не наблюдаются. Либо, когда жалобы не соответствуют характеру проведенного оперативного вмешательства.
Консервативная терапия после оперативного вмешательства на желудке
Последствия оперативного вмешательства на поджелудочной железе
Хирургические вмешательства на поджелудочной железе зачастую влекут за собой недостаточность выработки ряда ферментов и гормонов в организме. Нехватка данных веществ может привести к потере массы тела, вторичному диабету, диарее, синдрому избыточного бактериального роста. Вторичной проблемой становится боль в животе.
Чтобы оценить недостаточность ферментов проводится анализ кала на панкреатическую эластазу.
Основное лечение патологии заключается в заместительной ферментативной терапии, подбор питания.
Нарушение стула на фоне лечения (диарея/запор)
Диарея
Основные факторы, которые вызывают диарею (в зависимости от них подбирается терапия):
Любой из вышеперечисленных симптомов требует обращения к врачу для назначения терапии.
Если на фоне диареи, у пациента отмечается подъемы температуры, интоксикация, то необходимо дополнительное обследование на псевдомембранозный колит.
Диарея и недержание кала
После операций на органах, расположенных в малом тазу, у пациента может наблюдаться комбинация сразу двух синдромов – диареи и недержания кала. Чаще всего данное расстройство наблюдается у пациентов гинекологического профиля.
У больного может наблюдаться неоформленный или полуоформленный стул, а также фрагментная дефекация в течение дня, трудности с удержанием кала и газов после возникновения позывов на дефекацию. Иногда бывает ночное недержание кала.
Чтобы оценить состояние анального сфинктера специалисты назначают сфинктерометрию.
При лечении патологии применяется комбинация методов – лекарственная терапия, физиотерапия, физические упражнения.
Запор / задержка стула
Симптом может сопровождаться такими жалобами, как напряжение и/или боли в животе, натуживание, вздутие живота, твердый кал, ощущение неполного опорожнения кишечника, необходимость ручного пособия при опорожнении, отсутствие позывов на дефекацию или ложные позывы на дефекацию без опорожнения кишечника.
Причинами запора/задержки стула могут послужить:
Если пациент наблюдает у себя запор или задержку стула, необходима консультация специалиста.
Методы диагностики, которые помогут установить причину запоров:
Если на фоне лечения задержка стула длится от 4 суток, а также отмечаются повышенное газообразование, тошнота и/или рвота, боли в кишечнике, то необходима срочная консультация специалиста!
Терапия запора/задержки стула
Традиционным методом лечения является медикаментозная терапия. В случае спаечного процесса может потребоваться хирургическое лечение.
Отметим, что противоболевая терапия может усугубить ситуацию.
Лучевые поражения кишечника
Лучевые поражения кишечника проявляются в виде колитов – воспалительного заболевания слизистой оболочки кишечника. Колиты преимущественно развиваются у пациентов, получающих терапию на область малого таза (матка, цервикальный канал, простата, прямая кишка, мочевой пузырь).
Колиты могут возникнуть на любом этапе лечения: во время начала лучевой терапии и в течении 3 месяцев после окончания лечения. Существуют и позднеотстроченные лучевые колиты, которые возникают в течение первого года после проведенной лучевой терапии.
Симптомы
К основным симптомам лучевого поражения кишечника относят: нарушение стула, диарея, ложные позывы к дефекации, боли по ходу кишечника и боли в заднем проходе, в зависимости от зоны, куда пациент получает лучевую терапию. При достаточно выраженном воспалении появляются следующие симптомы — недержание кала и газов, диспепсия, метеоризм, рвота, тошнота, снижение массы тела на фоне диареи.
Если в начале лучевой терапии, во время нее, после нее у пациента отмечается выделение крови с каловыми массами – стоит немедленно обратиться к врачу! Он назначит необходимые обследования и лечение.
Диагностика лучевых поражений кишечника
Исследования, которые позволяют определить степень поражения и назначить терапию:
Терапия
При лучевых поражениях желудочно-кишечного тракта терапия зависит от локализации патологического процесса. В основном используются:
Срок лечения определяется специалистом. Стоит отметить, что лучевой колит невозможно вылечить за 2-3 недели, терапия должна быть длительной и систематической.
Авторская статья:
Захарова П.А.
Гастроэнтеролог, гепатолог НМИЦ онкологии им. Н.Н. Петрова
Особенности питания пациентов с целью профилактики и лечения энтероколита, ассоциированного с противоопухолевой лучевой и химиотерапией
Войцицкий В.Е., д.м.н., профессор, заведующий кафедрой онкологии ФГБОУ ВО НГМУ Минздрава РФ. Лебедева В.А., к.м.н., доцент кафедры онкологии ФГБОУ ВО НГМУ Минздрава РФ
Энтероколит на фоне лечения онкологических заболеваний
Нарушение работы пищеварительной системы является самым частым нежелательным явлением, связанным с лучевой и химиотерапией.
Симптомами поражения кишечника после химиотерапии являются: возникновение болей в животе спазматического характера, появление урчания и вздутия живота, запоров или поносов, а также неустойчивого стула – чередования запоров с диареей. При этом позывы к опорожнению кишечника часто бывают болезненными. Иногда в каловых массах наблюдается слизь или примесь крови. В этом состоянии больной испытывает чувство вялости и слабости, иногда наблюдается повышение общей температуры тела.
Понос после химиотерапии возникает вследствие дисбактериоза в кишечнике, вызванного действием цитостатических препаратов. Также причиной поноса является поражение периферической нервной системы, которое проявляется вегетативной полинейропатией. Диарея нередко является побочным явлением и антиэметогенных препаратов сопроводительной терапии.
Диарея способствует нутритивной недостаточности и ведет к нарушениям трофологического статуса организма. Нутритивная недостаточность рассматривается как фактор повышенного риска синдрома полиорганной недостаточности в период лечения онкологических больных и приводит к росту медикаментозной нагрузки, увеличению длительности пребывания больных в стационаре и, как следствие, прямых и непрямых затрат на лечение. Известно, что коррекция статуса питания способствует улучшению прогноза выживаемости, снижению риска послеоперационных осложнений и токсичности химиотерапии, повышению качества и продолжительности жизни.
Клинические проявления энтероколита вносят свой вклад в формирование хронического болевого синдрома, который существенно снижает качество жизни больных, требует дополнительной фармакотерапии, нередко является причиной нарушения режима химиотерапии.
Изменения кишечной микрофлоры на общем фоне проблем нередко обделено врачебным вниманием. Однако, развивающийся дисбактериоз снижает эффективность пищеварения, создает условия для дополнительной нагрузки на детоксикационные системы печени, способствует развитию вздутия живота и процессов гниения в кишечнике.
Клиническая эффективность некоторых продуктов питания позволяет рассматривать их как средства, корригирующие нежелательные побочные действия фармакотерапии, или средства, повышающие эффективность лечебного воздействия фармпрепаратов. К таким продуктам питания относятся биологически активные добавки, которые сочетают в себе активные формы фармакопейных штаммов бифидобактерий, факторы роста и продукты метаболизма бифидобактерий, имеют небольшую кислотность, соответствующую кисломолочным продуктам.
Выраженные симптомы энтероколита, ректита, ректосигмоидита могут стать причиной прерывания курса химио- или лучевой терапии, что влечет за собой снижение эффективности лечения. При умеренном проявлении симптомы поражения кишечника существенно ухудшают аппетит, снижают физическую толерантность к легким физическим нагрузкам, что ограничивает возможности пациента выполнить такие рекомендации врача, как «для лучшей переносимости лечения хорошо питайтесь и чаще бывайте на свежем воздухе».
В итоге, нарушение работы кишечника может стать причиной низкой эффективности противоопухолевого лечения.
Защитная роль микрофлоры в профилактике развития энтероколита на фоне противоопухолевого лечения
Серьезным недостатком химиотерапевтических средств, применяемых при онкологических заболеваниях, является низкая селективность и связанная с этим высокая общая токсичность. Осложнения, возникающие при химиотерапии, включают как гемо- и иммунодепрессию, так и структурные поражения внутренних органов. Одним из серьезных осложнений является некротическая энтеропатия, связанная с поражением слизистой оболочки кишечника, и гепатобилиарные расстройства. С химиотерапией связано развитие дисбиоза кишечника, а именно избыточный рост и активизация Clostridiumdifficile и реже Klebsiellaoxytoca, что является одной из причин упорного течения диареи на фоне ПХТ и на долгое время после окончания ПХТ.
В здоровом кишечнике основная масса нормальных кишечных бактерий фиксирована к специфическим рецепторам энтероцитов и колоноцитов слизистой оболочки кишечника, образуя микроколонии, которые в виде биопленок покрывают поверхность слизистой оболочки. Лишь небольшая часть нормальной кишечной микрофлоры находится в просвете кишки в свободном состоянии.
Осуществляемые кишечной микробиотой метаболические процессы чрезвычайно важны для нормальной функции всех систем организма человека, и, в первую очередь, для гомеостаза и обеспечения физиологических процессов в кишечнике. Так, кишечная микрофлора поддерживает энергетический гомеостаз слизистой оболочки кишечника, синтезирует витамины, метаболизирует желчные кислоты, деградирует ксенобиотики, обеспечивает энтероциты дополнительным источником энергии за счет образования короткоцепочечных жирных кислот. Короткоцепочечные жирные кислоты обладают также иммуномодулирующим действием, супрессируют продукцию провоспалительных цитокинов, повышают толерантность слизистой оболочки кишечника к антигенной нагрузке.
Энтероциты и колоноциты относятся к клеткам с высокой скоростью обменных процессов. Покровный эпителий слизистой оболочки кишечника отличается высокой митотической активностью росткового слоя. Скорость полного обновления клеток кишечного эпителия в двенадцатиперстной и тощей кишке составляет около трех суток, в подвздошной и в толстой кишке 4-5 суток. Высокий темп пролиферации эпителиальных клеток кишечника и интенсивное обновление клеток сопровождаются процессом быстрого продвижения клеток из крипт, где они образуются, на ворсинки — место интенсивного функционирования и слущивание отработавших клеток в просвет кишки. Кишечные симбионты также являются клетками с высокой митотической активностью, что обеспечивает обновление адгезированных к слизистой оболочке микроколоний, адекватное смене эпителиальных пластов. Таким образом, кишечная микробиота и слизистая оболочка кишечника человека представляют собой взаимовыгодный симбиоз, где микрофлора защищает и питает слизистую оболочку кишечника человека, а кишечник предоставляет анатомический субстрат для фиксации и осуществления жизненных функций бактерий. Разрушение этой связи влечет за собой снижение структурной устойчивости энтероцитов и колоноцитов к воздействию агрессивных факторов, к которым несомненно относится ПХТ.
Предсказать степень сохранности кишечной микробиоты у пациентов невозможно, поскольку она достаточно чувствительна к характеру питания и образу жизни, любой длительной фармакотерапии и воздействию стрессовых факторов. Однако по этим же причинам становится ясно, что у онкологического пациента имеются в большом количестве факторы, неблагоприятно действующие на симбиоз кишечной микробиоты и кишечника человека. Патогенное влияние ПХТ на кишечник проявляется диареей. Клинически степень тяжести существенно отличается: от диареи без энтероколита до геморрагического эрозивного энтероколита. Одной из ведущих причин формирования тяжести морфологических изменений слизистой оболочки кишечника является нарушение естественной микробиоты и избыточный рост Klebsiellaoxytica. Сохраняющийся после ПХТ дисбиоз кишечника лежит в основе длительного рецидивирующего течения диареи.
Повышенное содержание просветной микрофлоры из бифидобактерий обеспечивает создание благоприятной среды для кишечных пристеночных симбионтов за счет увеличения содержания в кишечнике короткоцепочечных жирных кислот, высокого уровня колицинов, подавления роста гнилостной микрофлоры, усиления ферментативной обработки содержимого кишки. В таких условиях агрессивное действие цитостатических и гормональных препаратов на слизистую оболочку кишечника существенно менее травматично как для ворсинок кишечника, так и для микроколоний симбионтов. В свою очередь более сохранная морфологически слизистая оболочка за счет процессов обновления эпителиальных пластов скорее восстанавливает свою функциональную структуру. В конечном итоге, это приводит к отсутствию или меньшей степени тяжести клинических проявлений нарушения работы кишечника.
Пробиотические продукты питания и препараты
Совершенствование схем противоопухолевой химиотерапии путем включения в нее препаратов-корректоров побочных эффектов традиционных цитостатиков, является одной из приоритетных задач современной онкологии. Улучшение качества жизни, повышение переносимости пациентом агрессивной фармакотерапии во многом зависит от нутритивного статуса его организма и продуктов, используемых в качестве лечебного питания. По этой причине питание онкологического пациента должно быть направлено не только на обеспечение энергетических потребностей, но и обладать лечебно-профилактическими свойствами. С целью профилактики развития энтероколита перспективными представляются пробиотик-содержащие продукты питания и биологически активные добавки к пище. Пробиотические продукты питания и биологически активные добавки способствуют улучшению пищеварения и регенерации слизистой оболочки кишечника, создают в кишечнике временный микробиоценоз.
По этой причине наиболее привлекательно выглядят именно пробиотические продукты питания и биологически активные добавки, которые выпускаются в жидкой форме и небольшие по объему. При такой форме выпуска бифидобактерии выступают в роли закваски, наполняя питательную среду своими метаболитами, бактериоцинами и витаминами. В отличие от лекарственных средств в продуктах питания большое значение придается вкусовым качествам продукта. Для людей со сниженным аппетитом или анорексией органолептические свойства продукта могут стать ключевым фактором в принятии решения – пить или не пить полезный продукт. Органолептические свойства жидких лекарственных форм пробиотиков оставляют желать лучшего. По компонентному составу принято выделять: пребиотики, пробиотики, симбиотики.
Пробиотики (определение ВОЗ) – это непатогенные для человека микроорганизмы, которые способны восстанавливать нормальную микрофлору органов, а также губительно воздействовать на патогенные и условно-патогенные бактерии. Иными словами, пробиотиками называют микробы, которые в норме составляют микрофлору различных органов человека. В настоящее время к пробиотикам относятся следующие микроорганизмы: Лактобактерии (L. acidophilus, L. plantarum, L. casei, L. bulgaricus, L. lactis, L. reuteri, L. rhamnosus, L. fermentum, L. jonsonii, L. gassed); Бифидобактерии (B. bifidum, B. infantis, B. longum, B. breve, B. adolescents); Непатогенные разновидности Escherichia Coli; Непатогенные разновидности Bacillus (В. subtilis); Непатогенные разновидности Enterococcus (Enterococci faecium, Е. salivarius); Молочнокислый стрептококк (Str. thermophylus); Дрожжевые грибки Saccharomyces boulardii.
Симбиотики – препараты, содержащие в своем составе пребиотики и пробиотики.
Особенности питания при развитии энтероколита, ассоциированного с противоопухолевой лучевой или химиотерапией
Чтобы облегчить состояние больного при диарее после химиотерапии, нужно придерживаться следующих рекомендаций:
Пищу больной должен принимать в отварном, протёртом или приготовленном на пару виде. Исключаются специи, жир и грубая клетчатка растительного происхождения.
Пища принимается часто и малыми порциями, через каждые три часа. В результате получается в сутки не менее пяти – шести приёмов еды.
В рацион питания вводятся продукты закрепляющего действия – варёный рис; сухари из белого хлеба или чёрствый белый хлеб; бананы; печёные яблоки; супы на некрепком бульоне из мяса, рыбы или овощей с разваренными крупами; нежирные виды мяса и рыбы в виде паровых котлет; варёные яйца и паровые омлеты; каши в протёртом виде, напоминающие «размазню», приготовленные на воде.
Из напитков рекомендуется крепкий чай, минеральная вода, отвары из трав с дубильными веществами, соки и кисели с вяжущими свойствами, несладкие компоты из сухофруктов малой концентрации.
Чтобы возместить потерю жидкости и элеткролитов, рекомендуется принимать регидратирующие растворы Регидрон и Гастролит.
При запорах после химиотерапии рекомендуется придерживаться следующих правил:
Необходимо включить в рацион продукты, богатые клетчаткой. К ним относятся овощи, фрукты, зелень, ягоды, цельнозерновой хлеб, неочищенные крупы, семечки и орехи. Хорошо помогают справиться с запорами абрикосы, сливы, свекла, а также курага и чернослив.
Нужно каждый день пить много жидкости, не менее двух литров. К полезным напиткам относятся чистая вода, свежеприготовленные соки из фруктов и овощей, морсы и компоты, зелёный чай без сахара. Особенно полезными являются компоты из сухофруктов.
Необходимо каждодневное движение, к которому относятся прогулки пешком в течение не менее получаса. Хорошо помогает справиться с запорами езда на велосипеде и утренняя гимнастика.
Клинические исследования
Исследование влияния лечебно-профилактического и лечебного введения продукта кисломолочного обезжиренного «Биовестин-А» на токсические эффекты противоопухолевой химиотерапии (ПХТ) в тканях печени и кишечника у мышей с карциномой легких Льюис
Исполнитель: лаборатория фармацевтических исследований СО РАН ФГБУН Новосибирский институт органической химии им. Н.Н. Ворожцова – заведующая лабораторией д.б.н.. профессор Толстикова Т.Г.
Исследования проведены на 60 самках мышей линии С57Bl/6 (22-25 г, 1,5 мес.), из которых сформированы группы
В работе использовали модель экспериментальной противоопухолевой (ПХТ), имитирующей стандартную схему СНОР. При воспроизведении ПХТ мышам на 10 день после перевивки карциномы легких Льюис вводили парентерально однократно комплекс цитостатиков: доксорубицин в дозе 4 мг/кг внутривенно; циклофосфан, винкристин и преднизолон внутрибрюшинно в дозах 50 мг/кг, 0,4 мг/кг и 5 мг/кг соответственно. Продукт кисломолочный обезжиренный «Биовестин-А» вводили в двух режимах: в лечебно-профилактическом (ежедневно в течение 17-ти дней после перевивки опухоли + в течение ПХТ) и лечебном (только на фоне ПХТ с 11-го по 17-ый день после перевивки опухоли). Перевивочный материал брали из банка опухолей Института цитологии и генетики СО РАН. Данная опухоль является солидной, перевивается внутримышечно, диссеминирует гематогенно в легкие.
На 18 день после перевивки (период роста метастазов) животных выводили из опыта декапитацией. После вскрытия у животных определялась масса печени и селезенки, на гистологическое исследование брали образцы тканей печени и кишечника (тонкого и толстого).
Результаты исследования:
При лечебно-профилактическом введении продукта кисломолочного обезжиренного «Биовестина-А» на фоне опухоли без ПХТ (IV группа) у животных наблюдается уменьшение степени деструктивных процессов, по сравнению с контрольной группой. В гепатоцитах выявляется очаговая мелковезикулярная липидная инфильтрация, и лишь у одного животного наблюдалась гидропическая дистрофия в центролобулярных зонах (рис. 1).
Рис. 1. Печень животного IV группы. (ПХТ после профилактического и лечебного введения продукта кисломолочного обезжиренного Биовестина-А). Мелковезикулярная липидная инфильтрация гепатоцитов. В просвете синусоидов увеличенные купферовские клетки и клетки с липидными включениями. Окраска гематоксилином и эозином. Ув. 400.
Популяция гепатоцитов без явных признаков гетерогенности, отмечалось увеличение двухъядерных гепатоцитов по сравнению с контролем. Некрозы отдельных гепатоцитов локализовались перипортально вокруг метастазов, постнекротические мелкоочаговые гранулемы не выявлялись. В синусоидах наблюдалось большое количество клеток с липидными гранулами в цитоплазме. По сравнению с контролем незначительно увеличилось и количество купферовских клеток. В просветах синусоидов выявлялись отложения фибрина в виде гомогенных эозинофильных масс.
При лечебном введении продукта кисломолочного обезжиренного «Биовестина-А» (V группа) на фоне опухоли и ПХТ в печени существенной положительной динамики по сравнению с группой животных, получавших только ПХТ, не выявлено. У всех животных отмечалось умеренное венозное полнокровие. На фоне очагового метастазирования в гепатоцитах центролобулярных зон наблюдалась преимущественно гидропическая дистрофия. У 2 особей отмечалась дискомплесация печеночных балок и выявлялась тотальная гидропическая дистрофия в сочетании с мелковезикулярной липидной инфильтрацией гепатоцитов. Гепатоциты резко увеличены в размерах, что сопровождалось компрессией перифокально расположенных с ними гепатоцитов, которые находились в состоянии ацидофильной дегенерации. На этом фоне отмечалась и редукция синусоидального русла (рис. 2).

Морфологическое исследование влияния продукта кисломолочного обезжиренного «Биовестин-А» на цитотоксический эффект ПХТ по схеме СНОР в кишечнике мышей с перевиваемой опухолью
У всех контрольных животных (I группа) в тонком и толстом кишечнике отмечалось умеренно выраженное полнокровие подслизистой оболочки с незначительной лимфоцитарной инфильтрацией. Тонкая кишка имеет типичное строение и состоит из слизистой оболочки, подслизистой основы, мышечной и серозной оболочек. Кишечные ворсинки высокие, содержат центральное хилоносное пространство, выстланное эндотелиоцитами. Снаружи ворсины покрыты высоким однослойным призматическим эпителием с незначительным содержанием бокаловидных клеток (рис. 3). Кишечные крипты открываются в межворсинчатое пространство. В них отмечаются клетки с повышенной митотической активностью и единичные клетки Панета с эозинофильными гранулами в цитоплазме. В тонком кишечнике наблюдался незначительный отек ворсин и подслизистой оболочки. Кишечные ворсинки толстого кишечника покрыты однослойным каемчатым эпителием составляющей частью, которого, является наличие многочисленных бокаловидных клеток (рис. 4). Признаков межуточного воспаления и некротических изменений не выявлено.
При введении животным с перевитой опухолью комплекса цитостатиков (II группа) в тонком кишечнике наблюдались выраженный отек и уменьшение высоты кишечных ворсин, диапедез эритроцитов, слущивание поверхностных слоев с мелкоочаговыми некрозами эпителия и резко уменьшенное количество бокаловидных клеток. Энтероциты увеличены в размерах, с конденсацией хроматина по периферии ядер.

Рис. 3. Тонкая кишка контрольного животного. Незначительный отек кишечных ворсин. Окраска гематоксилином и эозином. Ув. 200.
.
Рис. 4. Толстая кишка контрольного животного. Незначительный отек каемчатого эпителия. Окраска гематоксилином и эозином. Ув. 100
В кишечных криптах отмечается увеличение секреторной активности в клетках Панета. Хилоносные пространства большей частью сужены, заполнены гомогенными эозинофильными массами. Также отмечалась инфильтрация подслизистой оболочки полиморфноядерными лейкоцитами (рис. 5).
Рис. 5. Тонкая кишка животного после однократного введения ПХТ. Отек ворсин, некроз и десквамация эпителия. Окраска гематоксилином и эозином. Ув. 400.
Рис. 6. Толстая кишка животного после однократного введения ПХТ. Отек ворсин и десквамация эпителия. Окраска гематоксилином и эозином. Ув. 400.
В толстом кишечнике наблюдались сходные альтеративные изменения (рис. 6). Лимфоидные фолликулы (пейеровские бляшки) в подслизистом слое не выявлялись.
При лечебно-профилактическом введении продукта кисломолочного обезжиренного «Биовестина-А» (III группа) в сочетании с ПХТотмечаются положительные сдвиги альтеративных процессов в кишечнике. У всех животных наблюдается уменьшение отека кишечных ворсин с сохранностью их высоты в тонком и толстом кишечнике (рис. 7).
Рис. 7. Тонкая кишка животного после профилактического введения продукта кисломолочного обезжиренного «Биовестина-А» и ПХТ. Уменьшение отека кишечных ворсин и сохранение их высоты. Окраска гематоксилином и эозином. Ув. 200.
В тонком кишечнике по сравнению с группой животных, получавших только ПХТ, отмечается выраженное уменьшение секреторной активности в клетках Панета с восстановлением популяции бокаловидных клеток. В области кишечных крипт выявляются активно пролиферирующие эпителиоциты. В подслизистом слое тонкого кишечника выявляется отек, незначительная лимфоцитарная инфильтрация и диапедезные кровоизлияния. В толстом кишечнике наблюдаются многочисленные пейеровские бляшки (лимфоидные фолликулы), что является свидетельством сохранения иммунной системы (рис. 8 а, б).
Рис. 8 а. Толстая кишка животного после профилактического введения продукта кисломолочного обезжиренного «Биовестина-А» и ПХТ. Незначительный отек каемчатого эпителия с инфильтрацией подслизистого слоя лимфоцитами. Окраска гематоксилином и эозином. Ув. 200.
Рис. 8 б. Толстая кишка животного после профилактического введения продукта кисломолочного обезжиренного «Биовестина-А» и ПХТ. Лимфоидный фолликул в подслизистом слое. Окраска гематоксилином и эозином. Ув. 200.
При лечебно-профилактическом введении продукта кисломолочного обезжиренного «Биовестина-А» на фоне опухоли без ПХТ (IV группа) в тонком и толстом кишечнике признаков деструктивно-некротических изменений не выявлено. В толстом кишечнике наблюдались многочисленные лимфоидные образования в подслизистом слое (Пейеровы бляшки). В тонком кишечнике отмечалась умеренная лимфоцитарная инфильтрация слизистой оболочки (рис. 9, 10).
Рис. 9. Тонкая кишка животного после профилактического введения продукта кисломолочного обезжиренного Биовестина-А. Незначительная лимфоцитарная инфильтрация кишечных ворсин. Окраска гематоксилином и эозином. Ув. 200.
Рис. 10. Толстая кишка животного после профилактического введения продукта кисломолочного обезжиренного Биовестина-А. Незначительная лимфоцитарная инфильтрация подслизистого слоя. Окраска гематоксилином и эозином. Ув. 200.
Лечебное введение продукта «Биовестин-А» привело к незначительному уменьшению выраженности экссудативно-пролиферативных процессов в тонком и толстом кишечнике (уменьшение отека кишечных ворсин и сохранение их высоты) только у двух животных. У 8 животных сохранялись выраженные признаки токсического поражения в тонком кишечнике в виде уменьшения высоты кишечных ворсин, отека и некрозов каемчатого эпителия, отсутствия бокаловидных клеток. В области кишечных крипт выявлялись активно пролиферирующие эпителиоциты. По сравнению с группой животных, получавших только ПХТ, в толстом кишечнике наблюдался лишь поверхностный отек каемчатого эпителия и выявлялись единичные лимфоидные образования в подслизистом слое.
Заключение:
Внутрижелудочное введение продукта кисломолочного обезжиренного «Биовестин-А» ежедневно профилактически в течение 10 дней до ПХТ и дополнение ПХТ ежедневным внутрижелудочным введением «Биовестин-А» предотвращает развитие энтеропатии, сохраняет лимфоидную ткань тонкого и толстого кишечника.
Влияние биологически активной добавки к пище «Биовестин» на функциональное состояние желудочно-кишечного тракта у пациентов, получающих адьювантную химиотерапию по схемам PF, TPF и FOLFOX
Лебедева В.А., Войцицкий В.Е., Чаукина В.А., Соколов А.В., Понебратец О.Ю.
Цель исследования. Установить влияние на функцию пищеварительного тракта симбиотического продукта «Биовестин» (биологически активная добавка к пище) при включении его в диету пациентов на фоне адьювантной химиотерапии по поводу колоноректального рака.
Материалы и методы.Продукт ввели в рацион 26 больных со злокачественными опухолями головы и шеи, желудка, толстой кишки, принятых на адьювантную химиотерапиюпо схемам PF, TPF и FOLFOX, включающим 2-5 суточную постоянную инфузию фторурацила. Контрольная группа из 26 больных со злокачественными опухолями аналогичной локализации получала адьювантную химиотерапиюпо схемам PF, TPF и FOLFOX без пробиотических продуктов в диете. Средний возраст пациентов группы исследования 57,2±3,41лет; средний возраст пациентов группы контроля 61,1±5,19 лет.
Проведен анализ гастро-интестинальной токсичности первого курса химиотерапии по критериям CTCAE, версия 4.03, 2010год. Шкала отражает 0-4 степени токсичности по следующим параметрам: анорексия, ухудшение аппетита, неопухолевый асцит, диарея, эзофагит, сухость рта, изжога, фистула кишки, ЖКТ-кровотечение, тошнота, рвота, тонкокишечная непроходимость, боль в животе, стоматит, гастрит, проктит, нарушение вкуса.
Показатели оценены ежедневно в первые семь дней каждого курса ПХТ.
В ходе наблюдения были выявлены следующие показатели гастро-интестинальной токсичности: анорексия, ухудшение аппетита, диарея, боль в животе, стоматит. Максимальная степень токсичности и количество случаев выявления каждого состояния представлены в таблице 1.
Таблица 1. Выявленные признаки гастро-интестинальной токсичности во время первого курса химиотерапии