диагностическим критерием гетерозиготной формы семейной гиперхолестеринемии является
Семейная гиперхолестеринемия (СГХС) – наследственная патология, характеризующаяся выраженным повышением количества липопротеинов низкой плотности (ЛПНП) в кровотоке и высоким риском раннего развития ишемической болезни сердца. В большинстве случаев протекает бессимптомно. Иногда отмечается боль в груди, волдыри на руках, коленях и вокруг глаз, сухожильные и подкожные отложения холестерина. Основные методы диагностики – сбор наследственного анамнеза, анализ крови на общий холестерин и ЛПНП. Для лечения используется гиполипидемическая диета, регулярные физические нагрузки, медикаментозная коррекция липидоснижающими препаратами, аферез атерогенных липопротеидов.
МКБ-10
Общие сведения
Синонимы семейной гиперхолестеринемии – первичная, наследственная гиперхолестеринемия. Является не самостоятельным заболеванием, а состоянием предрасположенности к сердечно-сосудистым болезням – атеросклерозу сосудов, ИБС, острому инфаркту миокарда. Данные о распространенности СГХС имеют большой разброс, поскольку во многих случаях патология остается недиагностированной. Частота гетерозиготной формы, при которой у пациента имеется один дефектный ген из пары, составляет 1 случай на 108-300 человек. Гомозиготная форма, характеризующаяся наличием двух мутационных генов в аллели, протекает тяжелее и встречается гораздо реже – у 1 человека из 1 миллиона. Среди всех вариантов гиперхолестеринемии на долю семейной ГХС приходится 10% случаев.
Причины
СГХС является наследственной аутосомно-доминантной патологией, которая вызывается мутацией генов, ответственных за метаболизм ЛПНП и активность их рецепторов. При наличии одного дефектного гена в паре возникает гетерозиготная гиперхолестеринемия – легкое и умеренное нарушение метаболизма липидов. В редких случаях у пациентов присутствует два парных измененных гена (от матери и от отца), развивается гомозиготная гиперхолестеринемия – тяжелое расстройство липидного обмена со злокачественным течением. Причиной семейной гиперхолестеринемии является мутация в одном из следующих генов:
Патогенез
В основе семейной гиперхолестеринемии лежит генетически обусловленное повышение уровня ЛПНП. Чаще всего оно вызывается снижением активности специфического рецептора, ответственного за выведение липопротеинов. ЛПНП – наиболее атерогенные частицы. Атеросклеротические бляшки формируются при их накоплении в субэндотелиальном пространстве. Чем выше уровень липопротеинов с низкой плотностью в крови, тем интенсивнее протекает процесс.
Хуже всего ЛПНП выводятся у людей с гомозиготной первичной гиперхолестеринемией: оба парных гена имеют мутацию, функциональность рецептора снижена на более чем на 50%, концентрация ЛПНП высокая, плохо поддается коррекции при помощи медикаментов и диеты. Атеросклероз и его осложнения развиваются в детском и подростковом возрасте. При гиперхолестеринемии гетерозиготного типа только один ген дефектный, половина или более рецепторов остаются функциональными, количество ЛПНП повышается, но долгое время не проявляется клинически. Зачастую первым признаком СГХС становится атеросклероз, ишемическая болезнь сердца или инфаркт миокарда.
Симптомы
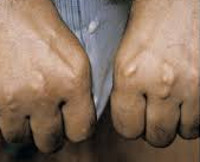
СГСХ развивается с рождения, но часто не имеет выраженных клинических признаков. Диагноз устанавливается с опозданием при манифестации сердечно-сосудистых заболеваний, таких как ИБС, инфаркт сердечной мышцы, атеросклероз. Симптомы гиперхолестеринемии наблюдаются менее чем у половины больных. Примерно у трети пациентов формируются сухожильные ксантомы – уплотнения из жироподобного вещества (холестерина), прощупываемые над сухожилиями. Узелки особенно легко определяются на кистях. Холестерин откладывается под кожей век, возле глаз в виде ксантелазм – желтоватых или не имеющих специфического цвета плоских узелков.
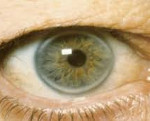
Патогномоничный признак СГСХ – липоидная дуга роговицы. Она представляет собой скопления холестерина по краю роговицы, которые обнаруживаются при офтальмологическом осмотре и выглядят как белый или серо-белый ободок. В отдельных случаях больные отмечают боль и дискомфорт в области груди, водянистые высыпания на коже рук, локтей и коленей. На стадии развития атеросклероза выявляются мозаичные симптомы поражения внутренних органов.
Осложнения
При отсутствии лечения гомозиготная первичная гиперхолестеринемия способствует развитию атеросклероза до 20-летнего возраста, продолжительность жизни больных не превышает 30 лет. Нелеченые пациенты с гетерозиготной формой патологии имеют высокий риск развития ИБС, к 60 годам диагноз подтверждается у 85,5% мужчин и у 53% женщин. Средние показатели продолжительности жизни для мужчин составляют 53 года, для женщин – 62 года. ИБС становится причиной смерти половины мужчин с наследственной гетерозиготной гиперхолестеринемией. Около 20% случаев инфаркта миокарда до 45 лет связаны с наличием СГХС.
Диагностика
Обследованием пациентов занимаются терапевт, кардиолог, врач-генетик. Важным этапом диагностики является сбор личного и семейного анамнеза. Учитывается возраст больного и время начала симптомов, потому что для наследственной патологии характерен ранний дебют. В пользу диагноза семейной гиперхолестеринемии рассматривается наличие двух и более близких родственников (особенно детей) с повышенным холестерином крови, ксантомами и/или липоидными дугами роговиц. Основная задача дифференциальной диагностики – исключение вторичной гиперхолестеринемии. Обследование больных проводится следующими методами:
Лечение семейной гиперхолестеринемии
Терапия включает комплекс мероприятий, нацеленных на снижение количества ЛПНП. Тактика определяется формой гиперхолестеринемии, величиной отклонения показателей липидограммы от нормы, выраженностью симптомов и возрастом пациента. Значительная часть лечебных процедур проводится амбулаторно при регулярном контроле эффективности лечащим врачом. Пациентам назначается:
Прогноз и профилактика
Благоприятное течение семейной гиперхолестеринемии наиболее вероятно при гетерозиготном типе, раннем начале лечения и периодическом контроле уровня холестерина на протяжении всей жизни. Из-за наследственного характера патологии предупредить ее развитие невозможно. Профилактические меры нацелены на раннюю диагностику гиперхолестеринемии, что позволяет сократить вероятность атеросклероза, ИБС, инфаркта мышцы сердца. Для этого проводится каскадный скрининг – исследование уровня липидов крови у всех ближайших родственников пациента.
Диагностическим критерием гетерозиготной формы семейной гиперхолестеринемии является
ПРОБЛЕМА ДИАГНОСТИКИ И ЛЕЧЕНИЯ ГЕТЕРОЗИГОТНОЙ СЕМЕЙНОЙ ГИПЕРХОЛЕСТЕРИНЕМИИ У ЛИЦ С ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА
Цель обзора: оценить известные данные по гетерозиготной семейной гиперхолестеринемии у лиц с ишемической болезнью сердца.
Семейная гиперхолестеринемия (СГХС) – это генетически обусловленное аутосомно-доминантное заболевание, характеризующееся повышением уровня холестерина липопротеинов низкой плотности (ХС-ЛПНП) за счёт дефектного гена, который кодирует образование ЛПНП-рецептора на мембране клетки, и вызывающее преждевременное развитие ишемической болезни сердца (ИБС) [1, 2]. При гетерозиготной форме СГХС (геСГХС) наследование дефектного гена передаётся от одного родителя. Распространенность гетерозиготной формы составляет около 1:500 человек [3]. Манифестирует геСГХС, как правило, с развития субклинического атеросклероза, что в дальнейшем ведёт к быстрому возникновению и прогрессированию ИБС [4–6]. Существует также гомозиготная форма СГХС (гоСГХС), при которой наследование мутантного гена передаётся от обоих родителей, её распространенность значительно меньше по сравнению с гетерозиготной формой (1:300 000 – 1 000 000 человек) и возникает она в детском возрасте [4, 5]. Клинические проявления гоСГХС ярко выражены и, как правило, не вызывают затруднений при постановке диагноза.
Широко известно, что ИБС развивается у лиц с геСГХС в более молодом возрасте (у мужчин 95-го процентиля.
Б) Родственник 1-й степени родства с ксантомами сухожилий и/или липоидной дугой роговицы или дети моложе 18 лет с ХС ЛНП > 95 процентиля
А) У пациента ранняя (мужчины 8
Примечание: диагноз устанавливается на основании суммы баллов, полученных в каждой группе (внутри группы баллы не суммируются), учитывается только один признак, дающий максимальное количество баллов внутри каждой из групп. ЛНП – липопротеины низкой плотности, ХС – холестерин.
Британские диагностические критерии СГХС (Simon Broome Registry) [4]
«Определённый» диагноз ставится, если:
? ОХС > 6,7 ммоль/л или ХС ЛНП > 4,0 ммоль/л у ребенка младше 16 лет,
или ОХС > 7,5 ммоль/л или ХС ЛНП > 4,9 ммоль/л у взрослого
? Плюс одно из нижеперечисленного: наличие сухожильных ксантом у пациента или родственника первой степени родства (родители, дети, братья, сестры), или у родственника 2-й степени родства (дедушки, бабушки, дяди или тети); позитивный тест ДНК-диагностики, подтверждающий мутации гена рецептора-ЛНП, апоВ-100 или PCSK9
«Вероятный» диагноз СГХС ставится, если:
? ОХС > 6,7 ммоль/л или ХС ЛНП > 4,0 ммоль/л у ребенка младше 16 лет, или ОХС > 7,5 ммоль/л или ХС ЛНП > 4,9 ммоль/л у взрослого
? Плюс одно из нижеперечисленного: отягощенный семейный анамнез до 50 лет у родственника 2-й степени родства, до 60 лет у родственника 1-й степени родства; ОХС > 7,5 ммоль/л у взрослого 1-й или 2-й степени родства или повышение ОХС > 6,7 ммоль/л у ребенка или родственника 1-й степени родства в возрасте менее 16 лет
Примечание: ДНК – дезоксирибонуклеиновая кислота, ЛНП – липопротеины низкой плотности, ОХС – общий холестерин.
Ведущую роль в диагностике СГХС занимает генетический анализ. Генетический скрининг проводится в отношении генов LDLR, АРОВ, PCSK9 и LDLRAP1. Однако отрицательный результат генетического скрининга не исключает диагноза гетерозиготной семейной гиперхолестеринемии, так как примерно у 20 % этих больных мутации выявить не удается. В свою очередь, положительный результат генетического исследования, даже при отсутствии фенотипических проявлений и диагностических критериев подтверждает данный диагноз [12].
Каким пациентам следует провести ДНК-анализ? Необходимо использовать DLCN-критерии для определения индексных пациентов (показатель DLCN > 5) или критерии Simon Broom Registry, с помощью которых пациенту установлен вероятный диагноз СГХС [12, 17, 18]. Также ДНК-анализ следует проводить при обнаружении значимого субклинического атеросклероза, который можно определить с помощью дуплексного сканирования крупных артерий. Если толщина комплекса интима-медиа 1,3–1,5 или локальное утолщение на 0,5 (или на 50 % от близлежащих участков), то такие данные следует трактовать как наличие атеросклеротической бляшки [19, 20, 21]. На сегодняшний день полный спектр генетических исследований в России на мутации в генах рецептора ЛПНП (LDLR), аполипопротеина В-100 (АpoB) и пропротеинконвертазы субтилизин/кексин 9-го типа (PCSK9) проводится в Москве. Стоимость исследования панели «Семейная гиперхолестеринемия» составляет около 30 тысяч рублей, что для ряда больных представляется значимой суммой. Таким образом, возникает проблема постановки диагноза геСГХС, при её подозрении. Если пациенту с ИБС не выставляется диагноз геСГХС, при его наличии, то лечение статинами будет основано на оценке риска развития сердечно-сосудистых осложнений по шкале SCORE и по Фрамингемской шкале. Оценка риска сердечно-сосудистых осложнений не может быть оценена у пациентов с гетерозиготной семейной гиперхолестеринемией по шкале SCORE и Фрамингемской шкале, так как лица с диагнозом гетерозиготной семейной гиперхолестеринемии уже относятся к высокому риску сердечно-сосудистых осложнений, даже при отсутствии заболеваний, обусловленных атеросклерозом, а если имеются такие заболевания – к очень высокому риску [15, 22]. В случае невыявления геСГХС риск будет занижен, а соответственно лечение – неполноценным, из-за неверно установленных целевых уровней ЛПНП и нерационально подобранной дозы статинов. Таким образом, пациенты с невыявленной геСГХС не получат адекватной терапии [2, 12].
На сегодняшний день в лечении гетерозиготной семейной гиперхолестеринемии на первом месте стоят препараты группы ингибиторов ГМГ-КоА редуктазы (статины), которые входят в алгоритм лечения у пациентов с ИБС [22]. По этой причине эффект от терапии статинами у лиц с данной патологией и наличием ИБС может наблюдаться, но, как правило, он непродолжителен. Такой эффект объясняется неверно установленным целевым уровнем ХС-ЛПНП, а также особенностями патогенеза геСГХС (генетически запрограммированный, прогрессирующий атеросклеротический процесс). В начале лечения пациентам с гетерозиготной формой СГХС рекомендуется снижение липопротеинов низкой плотности на 50 % от исходных цифр. Затем, при высоком риске сердечно-сосудистых осложнений менее 2,5 ммоль/л, а при очень высоком менее 1,8 ммоль/л [12], назначаются максимально переносимые дозы статинов. При недостаточном эффекте помимо статинов могут потребоваться другие препараты, такие как: эзетемиб и секвестранты желчных кислот [15]. В тяжёлых случаях при неэффективности медикаментозной терапии либо непереносимости лекарственных препаратов может потребоваться аферез липопротеинов (АЛ) [12, 23, 24]. АЛ – это экстракорпоральный метод лечения, с помощью которого проводят преципитацию ЛПНП. Одна процедура АЛ способна снизить уровень ХС-ЛПНП на 50 % от исходной. Рекомендуется его проведение еженедельно или 1 раз в две недели [12, 15, 25].
Препараты, основанные на ингибировании PSCK9, показали возможность их применения для большого числа пациентов с гетерозиготной СГХС, когда не удаётся добиться снижения показателей ХС-ЛПНП на высоких дозах статинов или когда наблюдается их непереносимость [8, 26]. Был проведён ряд исследований (LAPLASE-2, RUTHEFORD-2), которые показали значительное снижение уровня ХС-ЛПНП. LAPLASE-2 показал снижение уровня ХС-ЛПНП у резистентных пациентов к терапии статинами на 62–65 % от исходного уровня [25]. В исследовании RUTHEFORD-2 было 4 группы пациентов. Первая группа получала эволокумаб в дозе 140 мг 1 раз в две недели, вторая – 420 мг 1 раз в месяц, третья – плацебо 1 раз в две недели и четвертая – плацебо 1 раз в месяц. Все пациенты получали максимально переносимую дозу статинов и 62 % пациентов дополнительно получали эзетемиб. В обеих группах пациентов на эволокумабе снизился уровень ЛПНП на 61 и 63 % соответственно в течение 12 недель. В последующем уровень ЛПНП составил менее 1,8 ммоль/л у 67 % пациентов из первой группы и 88 % из второй [17]. В настоящее время нет широкого применения ингибиторов PSCK9 (алирокумаб, эволокумаб), в связи с высокой стоимостью данных препаратов. Так, стоимость курса терапии эволокумабом на 1 месяц составляет около 30–35 тысяч рублей [12, 15]. В нашей стране уже есть пациенты, которые получают данный вид лечения бесплатно, но их крайне мало [12, 15]. Бесплатная терапия ингибиторами PSCK9 проводится в рамках благотворительных акций от липидных центров субъектов Российской Федерации. Так как существует неразрывная связь между геСГХС и ИБС, то лечение геСГХС сводится к сердечно-сосудистой профилактике, и от того, насколько своевременно будет диагностировано данное заболевание, насколько адекватное лечение будет получать пациент, зависит время развития ИБС, её тяжесть и дальнейший прогноз для жизни.
Известно, что профилактике сердечно-сосудистых заболеваний отводится большое значение, так как они стоят на первом месте среди причин смерти. Поэтому для сердечно-сосудистой профилактики в семьях пробанда с геСГХС проводится семейный каскадный скрининг [12, 27, 28]. Каскадный скрининг проводится среди родственников первой и второй линии родства. Он включает в себя те же методы диагностики, что и для пробанда, и те же самые критерии. Однако для семейного каскадного скрининга предпочтительнее ДНК-анализ, так как фенотипические проявления и диагностические критерии могут вовсе отсутствовать. Каскадный скрининг позволяет выявить геСГХС на ранних стадиях, когда ещё не сформировались заболевания сердечно-сосудистой системы.
Заключение
Таким образом, несмотря на достижения современной медицины, помощь пациентам с геСГХС далека от идеальной. Главная проблема заключается как раз в выявлении таких пациентов. Несвоевременность диагностики у лиц со скрытыми формами ведёт к развитию и прогрессированию ишемической болезни сердца. Обращение к врачу, к сожалению, происходит при уже возникших заболеваниях сердечно-сосудистой системы, что является проблемой ранней диагностики геСГХС. Врачи-кардиологи, в свою очередь, должны помнить о данной причине повышения липопротеинов низкой плотности, подозревать геСГХС при гиперхолестеринемии, не поддающейся терапии статинами. Ведь возможно недостижение контрольных цифр обусловлено наличием у пациента такого заболевания, как гетерозиготная семейная гиперхолестеринемия. С помощью простых критериев диагностики геСГХС мы можем отобрать пациентов, у которых предполагаем диагноз геСГХС. Среди этих лиц можем определить тех, кто нуждается в ДНК-анализе для подтверждения диагноза и дальнейшего направления на получение бесплатного лечения таргетными препаратами – ингибиторами PSCK9. В настоящее время смертность от сердечно-сосудистой патологии стоит на первом месте среди всех причин смертности и большое внимание уделяется её профилактике. Выявление геСГХС – это не только стандартная постановка диагноза и назначение лечения, но и профилактика сердечно-сосудистых заболеваний и событий, а это то, к чему стремится современная медицина.
Диагностическим критерием гетерозиготной формы семейной гиперхолестеринемии является
Этиология и встречаемость семейной гиперхолестеринемии. Семейная гиперхолестеринемия (MIM №143890) — аутосомно-доминантное заболевание метаболизма холестерина и липидов, вызываемое мутациями в гене LDLR. Семейная гиперхолестеринемия встречается во всех расах и имеет распространение 1 на 500 в большинстве европеоидных популяций. Это составляет чуть меньше 5% всех пациентов с гиперхолестеринемией.
Патогенез семейной гиперхолестеринемии
Рецептор ЛПНП, трансмембранный гликопротеид, преимущественно экспрессирующийся в печени и коре надпочечников, играет ключевую роль в гомеостазе холестерина. Он связывает аполипопротеин В-100, единственный белок ЛПНП, и АроЕ, белок ЛПОНП, липопротеинов средней плотности, остатков хиломикронов и некоторых ЛПВП. Рецепторы ЛПНП печени захватывают из кровотока приблизительно 50% липопротеинов промежуточной плотности и 66-80% низкой плотности за счет эндоцитоза; остаток захватывается недостаточно изученным путем, не зависящим от рецептора ЛПНП.
Мутации, связываемые с семейной гиперхолестеринемией, наблюдают в гене LDLR; от 2 до 10% таких мутаций — большие инсерции, делеции или перестройки, вызванные рекомбинацией между повторами Alu в пределах гена LDLR. Некоторые мутации — доминантные. Большинство мутаций достаточно редкие, хотя некоторые популяции — например, ливанцы, французские канадцы, южноафриканские индийцы, южноафриканские евреи ашкенази и африканеры (жители ЮАР голландского происхождения) имеют общие мутации и высокое распространение болезни из-за эффекта родоначальника.
Гомозиготные или гетерозиготные мутации в гене LDLR уменьшают эффективность эндоцитоза ЛПНП и липопротеинов средней плотности и вызывают накопление ЛПНП плазмы за счет увеличения их синтеза из липопротеинов средней плотности и уменьшения печеночного захвата. Высокий уровень ЛПНП в плазме вызывает атеросклероз, увеличивая захват ЛПНП через рецептор-независимые пути, например эндоцитоз окисленных ЛПНП макрофагами и гистиоцитами.
Моноциты, проникающие через интиму артерий и захватывающие ЛПНП, образуют пенистые клетки и выбрасывают цитокины, вызывающие пролиферацию гладкомышечных клеток артериальной стенки. Первоначально гладкомышечные клетки производят достаточно коллагена и матричного белка, чтобы сформировать над пенистыми клетками волокнистый колпачок; но, поскольку пенистые клетки продолжают эндоцитоз окисленных ЛПНП, в конечном счете, они прорываются через колпачок в просвет артерии и инициируют образование тромба. Такое образование тромба — основная причина инсультов и инфарктов миокарда.
Окружающая среда, пол и генетический фон модифицируют эффект мутаций рецептора ЛПНП на их уровень в плазме, и тем самым частоту возникновения атеросклероза. Основной средовой модификатор уровня ЛПНП в плазме — диета; в Тунисе большинство гетерозигот по семейной гиперхолестеринемии имеют уровень ЛПНП в диапазоне «нормы» для жителей США и редко страдают сердечно-сосудистыми болезнями и ксантомами.
Аналогично китайские гетерозиготы по семейной гиперхолестеринемии, проживая в Китае, редко имеют ксантомы и сердечно-сосудистую патологию, тогда как китайцы, гетерозиготы по семейной гиперхолестеринемии, проживающие в западных странах, имеют клинические проявления, сходные с гетерозиготами по семейной гиперхолестеринемии европейского происхождения. Пищевой холестерин подавляет синтез рецепторов ЛПНП и тем самым поднимает уровень ЛПНП в плазме; этот эффект усиливается насыщенными жирными кислотами, например пальмитиновой (из молочных продуктов), и ослабляется ненасыщенными жирными кислотой, например олеиновой и линолевой.
Поскольку аналогичная диета неодинаково поднимает уровень ЛПНП среди разных пациентов, на метаболизм ЛПНП также должны влиять и другие средовые и генетические факторы. Некоторые семьи с семейной гиперхолестеринемией передают другой доминантный локус, уменьшающий уровень ЛПНП в плазме, что подтверждает наличие генетического модификатора.
Фенотип и развитие семейной гиперхолестеринемии
Гиперхолестеринемия, самый ранний симптом при семейной гиперхолестеринемии, обычно появляется уже при рождении и остается единственным клиническим симптомом в первом десятилетии жизни у гетерозиготных пациентов; во всех возрастных периодах концентрация холестерина в плазме выше 95-го процентиля у более чем 95% пациентов. «Старческая» дуга роговицы и ксантомы сухожилий начинают появляться к концу второго десятилетия жизни, к моменту смерти уже 80% гетерозигот по семейной гиперхолестеринемии имеют ксантомы. Почти 40% взрослых пациентов имеют рецидивирующие непрогрессирующие полиартриты и тендосиновиты.
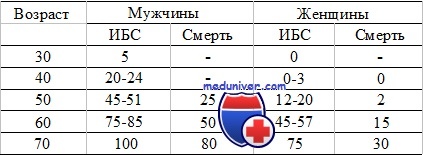
Подсчитано, что развитие ИБС среди гетерозигот по семейной гиперхолестеринемии зависит от возраста и пола. Чаще всего при отсутствии лечения концентрация холестерина превышает 300 мг/дл.
Гомозиготная форма семейной гиперхолестеринемии проявляется ксантомами сухожилий и дугой роговицы уже на первом десятилетии жизни. Без энергичного лечения гомозиготная семейная гиперхолестеринемия обычно летальна к возрасту 30 лет. Концентрация холестерина без лечения колеблется между 600 и 1000 мг/дл.
Особенности проявлений семейной гиперхолестеринемии:
• Возраст начала: для гетерозигот — молодость или средний возраст; для гомозигот — детство
• Гиперхолестеринемия
• Атеросклероз
• Ксантомы
• Старческая дуга
Лечение семейной гиперхолестеринемии
Повышение холестерина ЛПНП плазмы крови и наличие в семейном анамнезе гиперхолестеринемии, ксантом или ранней ИБС заставляет предположить диагноз семейной гиперхолестеринемии. Тем не менее подтвердить диагноз трудно, поскольку для этого нужно определить функции рецептора ЛПНП в фибробластах кожи или мутации в гене LDLR. В большинстве популяций большое количество мутаций в гене LDLR затрудняет прямой анализ ДНК, если не подозревается конкретная мутация.
Тем не менее отсутствие ДНК-подтверждения не создает помех для оказания помощи пациентам с семейной гиперхолестеринемией, поскольку окончательный молекулярный диагноз не дает прогностической или терапевтической информации, в основном зависящей от семейного анамнеза и уровня холестерина в плазме.
Независимо от того, семейная это гиперхолестеринемия или нет, все пациенты с повышенным уровнем холестерина ЛПНП требуют энергичных мер по нормализации концентрации для уменьшения риска ИБС. Тщательная нормализация уровня холестерина может предохранить и обратить развитие атеросклероза. Гетерозиготам по семейной гиперхолестеринемии необходимо строжайшее соблюдение высокоуглеводной диеты с резким уменьшением потребления жиров, обычно приводящей к 10-20% снижению уровня холестерина ЛПНП.
Поскольку такого уменьшения обычно недостаточно, пациентам также назначают лечение одним из трех классов лекAPCтвенных средств (или их комбинацией): секвестрантами желчных кислот, статинами (ингибиторы 3-гидрокси-3-метилглутарил КоА редуктазы) и никотиновой кислотой. Текущие рекомендации — начало лекарственной терапии в 10-летнем возрасте у пациентов с концентрацией холестерина ЛПНП выше 190 мг/дл и отрицательным семейным анамнезом по ранней ИБС, и для пациентов с уровнем холестерина ЛПНП выше 160 мг/ дл с положительным семейным анамнезом.
У гомозигот по семейной гиперхолестеринемии уровень холестерина плазмы можно уменьшить до 70% с помощью плазмафереза. Терапевтическая эффективность плазмафереза повышается, если его проводить на фоне энергичной терапии статинами и никотиновой кислотой. В редких случаях проводят пересадку печени.
Показатели зависимости ИБС и смерти от возраста и пола (в %) у гетерозигот по семейной гиперхолестеринемии
Риски наследования семейной гиперхолестеринемии
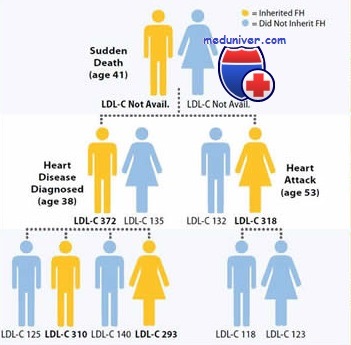
Поскольку семейная гиперхолестеринемия — аутосомно-доминантное заболевание, каждый ребенок больного родителя имеет 50% шанс унаследовать мутантный аллель гена LDLR. Без лечения гетерозиготы по семейной гиперхолестеринемии имеют 100% риск развития ИБС к 70 годам для мужчин и 75% риска для женщин. Постоянное лечение заметно уменьшает этот риск, нормализуя концентрацию холестерина в плазме.
Пример семейной гиперхолестеринемии. У Л.Л., ранее здорового 45-летнего французского канадца, произошел инфаркт миокарда. У него была небольшая ксантома в ахилловом сухожилии справа. У его брата также была ИБС; его мать, бабушка по матери и два дяди по матери умерли от осложнений ИБС. Кроме семейного анамнеза и пола, факторы риска по ИБС и атеросклерозу для Л.Л. включали повышенный уровень ЛПНП, небольшое ожирение, малую физическую активность и курение. На основе семейного анамнеза заподозрена аутосомно-доминантная форма гиперхолестеринемии.
В подтверждение этого подозрения при молекулярном анализе обнаружено, что он гетерозиготен по делеции 5′-конца гена рецептора ЛПНП (LDLR), эту мутацию обнаруживают у 59% французских канадцев с семейной гиперхолестеринемией. Обследование детей Л.Л. показало, что у двоих из трех детей уровень ЛПНП повышен.
Кардиолог сказал Л.Л., что дополнительно к лекарственной терапии эффективное лечение его ИБС требует изменения диеты и образа жизни, т.е. снижения в рационе питания насыщенных жиров и холестерина, повышения физической активности, снижения массы тела и прекращения курения. Больной не последовал этим рекомендациям и умер годом позже от повторного инфаркта.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021