диоксид титана в форме анатаза
Что такое титановые белила и почему эта пищевая добавка больше не считается безопасной
Пищевая добавка E171, представляющая собой порошок диоксида титана, — распространенный компонент многих продуктов питания. Раньше считалось, что благодаря химической инертности она полностью безопасна для человека, но весной 2021 года выяснилось, что это не совсем так. Почему исследователи пришли к такому выводу? Рассказывает химик Илья Чикунов.
Что такое диоксид титана и «с чем его едят»
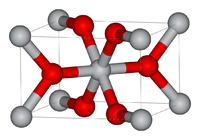
В зависимости от желаемой кристаллической полиморфной модификации диоксид титана производят либо сульфатным, либо хлоридным способом. Анатазная форма диоксида титана может быть получена только в результате сульфатного процесса, а рутиловая — обоими способами. В настоящее время E171 состоит из чистого анатаза и/или рутила. До 2006 года для применения в пищевой промышленности разрешалась только анатазная форма. Рутил допускается для замены анатаза в пищевых продуктах, особенно в пленочных покрытиях для таблеток, пищевых добавок и продуктов питания. В структурах анатаза и рутила основной строительный блок состоит из атома титана, окруженного шестью атомами кислорода. Структуры различаются искажением и сборкой октаэдров — в рутиле они соединены через углы и грани (рис. 1).

Хотя обе формы разрешены к применению в пищевых продуктах, характеристика образцов, полученная в американских и европейских лабораториях, показывает, что преобладает анатаз. Например, пять из шести жевательных резинок содержали TiO2 в виде анатаза и только одна включала смесь анатаза и рутила.
Пищевые продукты, содержащие TiO2
Читайте также
Диоксид титана обнаружен в жевательных резинках, кондитерских изделиях, соусах и заправках, немолочных сливках и в диетических добавках. По сведениям о новых продуктах, представленных на рынке 62 крупнейших экономик мира, использование TiO2 постоянно увеличивалось до 2014 года; Е171 входит в состав более чем 3500 продуктов питания или напитков.
TiO2 присутствует в 51% жевательных резинок, 25% помад, жидкостей и спреев, 21% смешанных продуктов, 10% пастилок, желе и жевательных конфет и 10% леденцов.
Жевательные резинки и кондитерские изделия, включая пастилки, желе и жевательные конфеты, — самые распространенные категории продуктов питания, содержащих TiO2. Торты и пирожные представляют собой вторую по значимости категорию. Количество TiO2 в коммерческих продуктах показывает, что жевательные резинки являются наиболее богатыми диоксидом титана и содержат до 5,4 мг/г. Следующая категория — сладости с содержанием до 2,5 мг/г, затем кондитерские изделия — до 0,5 мг/г продукта, в съедобных украшениях, покрытиях и начинках — до 20 мг/г, в обработанных орехах 3,8 мг/г, в пищевых добавках 2,8 мг/г и в салатах и сэндвич-спредах на основе соленых продуктов 2,5 мг/г продукта.
Сколько TiO2 съедает человек?
Количество TiO2, потребляемого в США ежедневно, оценивалось примерно в 0,2–0,7 мг TiO2 на кг массы тела в день (мг/кг/д), в то время как население Великобритании и Германии потребляет около 1 мг TiO22/кг/д. Независимо от сценария воздействия и методологического выбора наибольшее количество TiO2 употребляют дети (3–9 лет) и подростки (10–17 лет). Вклад жевательных резинок незначителен по сравнению с кондитерскими изделиями, включая выпечку, освежающие дыхание конфеты, соусы, салаты и спреды для сэндвичей, безалкогольные напитки и сыр. В исследовании, основанном на данных Голландского национального исследования потребления продуктов питания, продуктами, вносящими наибольший вклад в потребление TiO2 детьми младшего возраста (2–6 лет), являются кондитерские изделия (сладости, шоколадные изделия и жевательные резинки) и мелкая выпечка (печенье и проч.). Помимо пищевых продуктов таблетированные лекарства и пищевые добавки содержат до 3,6 мг/г TiO2.
Судьба TiO2 в живом организме
После приема внутрь частицы TiO2 проходят через пищеварительный тракт, начиная с ротовой полости, за которой следует желудочно-кишечный тракт (ЖКТ), включающий пищевод, желудок, тонкий и толстый кишечник и прямую кишку. Во время прохождения через пищеварительные жидкости частицы TiO2 в основном агломерируются под воздействием белков и электролитов, но небольшая часть всё еще находится в наноразмерном диапазоне. При диспергировании агломераты способны разрушаться, что приводит к увеличению количества «свободных» наночастиц. На степень агломерации и количество «свободных» наночастиц дополнительно могут влиять условия в пищевых продуктах и в среде ЖКТ. Низкая абсорбция TiO2 и, наоборот, высокий процент диоксида титана, выводимого из организма с фекалиями, ранее считались доказательством отсутствия какого-либо неблагоприятного эффекта. Однако новые данные о кишечном отделе ставят это под сомнение. Частицы TiO2, независимо от их размера и гидрофильности/гидрофобности, способны проникать через слизь в нижележащие ткани.
Когда частицы TiO2 преодолевают защитную триаду слизь — микробиота — эпителий, они в некотором количестве попадают в системную циркуляцию и проникают в печень и почки, а также обнаруживаются в легких, селезенке и мозге с периодом полувыведения 12,7 дня, что показано на грызунах. Группа экспертов сочла, что Е171 имеет низкую пероральную системную доступность, не выше 0,5%, но может проходить через плаценту и передаваться плоду. Исследования на крысах показали длительный, 200–450 дней, период полувыведения частиц с размером 7–90 нм. Следовательно, в организме накопленные частицы TiO2 регулярно пополняются, что предполагает биоаккумуляцию, то есть накопление в организме. В тканях умерших людей частицы TiO2 обнаружены в печени, селезенке, почках и кишечнике.
У мышей, подвергавшихся пероральному воздействию наночастиц 
Переоценка безопасности Е171
Группа экспертов в мае 2021 года поменяла оценку безопасности пищевой добавки TiO2 (Е171) в соответствии с запросом Европейской комиссии от марта 2020-го. В масштабном документе, содержащем ссылки на 323 научные публикации, пересмотрены результаты предыдущей рекомендации EFSA от 2016 года, где подчеркивалась необходимость дополнительного изучения биологических свойств TiO2. Председатель группы экспертов заявил:
«Принимая во внимание все имеющиеся научные данные, группа заключила, что диоксид титана больше не может считаться безопасной пищевой добавкой. Важнейшим элементом для этого вывода является то, что мы не смогли отвергнуть опасения по генотоксичности частиц диоксида титана после его употребления. После приема внутрь всасывание частиц невелико, но они способны накапливаться в организме».
Оценка проводилась в том числе с учетом актуальных сведений о наночастицах, которые появились со времени заключения EFSA от 2016 года. Эксперты впервые применили Руководство научного комитета EFSA по нанотехнологиям (EFSA Scientific Committee Guidance on Nanotechnology) 2018 года к оценке безопасности пищевых добавок. Краситель Е171 содержит до 50% частиц в нанодиапазоне (то есть меньше 100 нанометров), воздействию которых подвергаются потребители.
Эксперты опасаются риска генотоксичности, при этом определить ежедневные безопасные количества добавки Е171 оказалось невозможным. Специалисты по управлению рисками Европейской комиссии были проинформированы о выводах EFSA и будут разрабатывать соответствующие регулирующие меры, чтобы обеспечить безопасность потребителей.
Может быть интересно
Национальное агентство по безопасности пищевых продуктов, окружающей среды и гигиены труда Франции (ANSES), рассмотрев риски, связанные с воздействием пищевой добавки Е171, добилось того, что в 2019 году использование TiO2 в пищевых продуктах было запрещено.
Параллельно Управление по безопасности продуктов питания и потребительских товаров (Нидерланды, NVWA) пришло к заключению о потенциально опасных для здоровья последствиях употребления TiO2; представителями NVWA подчеркивалась важность изучения иммунотоксикологических эффектов в дополнение к потенциальным последствиям репротоксикологического характера.
Что обнаружили эксперты
Заключение экспертов основано на новых научных данных, которые их группа сочла достоверными, включая результаты расширенного исследования репродуктивной токсичности в одном поколении (EOGRT). Основные выводы, которые могут стать поводом для запрета добавки Е171, таковы:
После публикации заключения руководитель Роспотребнадзора РФ А. Попова заявила, что исследовательским подразделениям поручено тщательно изучить действие Е171. Ранее токсико-гигиеническую оценку TiO2 проводили в 2019 году и пришли к выводу, что существуют риски, обусловленные наноразмерным TiO2, при его употреблении внутрь. Отметим, что продукты и изделия, которые не являются пищевыми, опасности не представляют.
Оксид титана(IV)
| Оксид титана(IV) | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Диоксид титана |
| Химическая формула | TiO2 |
| Эмпирическая формула | TiO2 |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдое |
| Молярная масса | 79,866 г/моль |
| Плотность | (Р) 4,235 г/см³ (А) 4,05 г/см³ (Б) 4,1 г/см³ |
| Термические свойства | |
| Температура плавления | 1843 °C |
| Температура кипения | 2972 °C |
| Температура разложения | 2900 °C |
| Классификация | |
| Рег. номер CAS | 13463-67-7 |
| Рег. номер PubChem | 26042 |
| SMILES | O=[Ti]=O |
Оксид титана(IV) (диоксид титана, двуокись титана, титановые белила, пищевой краситель E171) TiO2 — амфотерный оксид четырёхвалентного титана. Является основным продуктом титановой индустрии (на производство чистого титана идёт лишь около 5 % титановой руды). [1]
Содержание
Строение
Оксид титана существует в виде нескольких модификаций. В природе встречаются кристаллы с тетрагональной сингонией (анатаз, рутил) и ромбической сингонией (брукит). Искусственно получены ещё две модификации высокого давления — ромбическая IV и гексагональная V.
| Модификация/Параметр | Рутил | Анатаз | Брукит | Ромбическая IV | Гексагональная V | |
|---|---|---|---|---|---|---|
| Параметры элементарной решётки, нм | a | 0,45929 | 0,3785 | 0,51447 | 0,4531 | 0,922 |
| b | — | — | 0,9184 | 0,5498 | — | |
| c | 0,29591 | 0,9486 | 0,5145 | 0,4900 | 0,5685 | |
| Число формульных единиц в ячейке | 2 | 4 | 8 | |||
| Пространственная группа | P4/mnm | I4/amd | Pbca | Pbcn | ||
Нахождение в природе
В чистом виде в природе встречается в виде минералов рутила, анатаза и брукита (по строению первые два имеют тетрагональную, а последний — ромбическую сингонию), причём основную часть составляет рутил.
Третье в мире по запасам рутила месторождение находится в Рассказовском районе Тамбовской области. Крупные месторождения находятся также в Чили (Cerro Bianco), канадской провинции Квебек, Сьерра-Леоне.
Свойства
Физические, термодинамические свойства
Чистый диоксид титана — бесцветные кристаллы (желтеет при нагревании). Для технических целей применяется в раздробленном состоянии, представляя собой белый порошок. Не растворяется в воде и разбавленных минеральных кислотах (за исключением плавиковой).
Температура плавления, кипения и разложения для других модификаций не указана, так как они переходят в рутильную форму при нагревании (см. выше).
| Модификация | Интервал температуры, K | |||||
|---|---|---|---|---|---|---|
| 298—500 | 298—600 | 298—700 | 298—800 | 298—900 | 298—1000 | |
| рутил | 60,71 | 62,39 | 63,76 | 64,92 | 65,95 | 66,89 |
| анатаз | 63,21 | 65,18 | 66,59 | 67,64 | 68,47 | 69,12 |
| Модификация | ΔH°f, 298, кДж/моль [6] | S°298, Дж/моль/K [7] | ΔG°f, 298, кДж/моль [8] | C°p, 298, Дж/моль/K [9] | ΔHпл., кДж/моль [10] |
|---|---|---|---|---|---|
| рутил | -944,75 (-943,9 [3] ) | 50,33 | -889,49 (-888,6 [3] ) | 55,04 (55,02 [3] ) | 67 |
| анатаз | -933,03 (938,6 [3] ) | 49,92 | -877,65 (-888,3 [3] ) | 55,21 (55,48 [3] ) | 58 |
Вследствие более плотной упаковки ионов в кристалле рутила увеличивается их взаимное притяжение, снижается фотохимическая активность, увеличиваются твёрдость (абразивность), показатель преломления (2,55 — у анатаза и 2,7 — у рутила), диэлектрическая постоянная.
Химические свойства
Диоксид титана амфотерен, то есть проявляет как осно́вные, так и кислотные свойства (хотя реагирует главным образом с концентрированными кислотами).
Медленно растворяется в концентрированной серной кислоте, образуя соответствующие соли четырёхвалентного титана:
В концентрированных растворах щелочей или при сплавлении с ними образуются титанаты — соли титановой кислоты (амфотерного гидроксида титана TiO(OH)2)
То же происходит и в концентрированных растворах карбонатов или гидрокарбонатов:
C перекисью водорода даёт ортотитановую кислоту:
При нагревании с аммиаком даёт нитрид титана:
При сплавлении с оксидами, гидроксидами и карбонатами образуются титанаты и двойные оксиды:
При нагревании восстанавливается углеродом и активными металлами (Mg, Ca, Na) до низших оксидов.
При нагревании с хлором в присутствии восстановителей (углерода) образует тетрахлорид титана.
Нагревание до 2200 °C приводит сначала к отщеплению кислорода с образованием синего Ti3O5 (то есть TiO2·Ti2O3), а затем и тёмно-фиолетового Ti2O3.
Гидратированный диоксид TiO2·nH2O [гидроксид титана(IV), оксо-гидрат титана, оксогидроксид титана] в зависимости от условий получения может содержать переменные количества связанных с Ti групп ОН, структурную воду, кислотные остатки и адсорбированные катионы. Полученный на холоде свежеосажденный TiO2·nH2O хорошо растворяется в разбавленных минеральных и сильных органических кислотах, но почти не растворяется в растворах щелочей. Легко пептизируется с образованием устойчивых коллоидных растворов. При высушивании на воздухе образует объёмистый белый порошок плотностью 2,6 г/см³, приближающийся по составу к формуле TiO2·2H2O (ортотитановая кислота). При нагревании и длительной сушке в вакууме постепенно обезвоживается, приближаясь по составу к формуле TiO2·H2O (метатитановая кислота). Осадки такого состава получаются при осаждении из горячих растворов, при взаимодействии металлического титана с HNO3 и т. п. Их плотность
3,2 г/см³ и выше. Они практически не растворяются в разбавленных кислотах, не способны пептизироваться.
При старении осадки TiO2·nH2O постепенно превращается в безводный диоксид, удерживающий в связанном состоянии адсорбированные катионы и анионы. Старение ускоряется кипячением суспензии с водой. Структура образующегося при старении TiO2 определяется условиями осаждения. При осаждении аммиаком из солянокислых растворов при рН Токсические свойства, физиологическое действие, опасные свойства
TLV(предельная пороговая концентрация, США): как TWA (среднесменная концентрация, США) 10 мг/м³ A4 (ACGIH 2001).
ПДК в воздухе рабочей зоны — 10 мг/м³ (1998)
Добыча и производство
Мировое производство диоксида титана на конец 2004 года достигло приблизительно 5 миллионов тонн. [11]
Основными производители и экспортёры диоксида титана:
В последние годы чрезвычайно быстро растет производство диоксида титана в Китае.
В России пигментный диоксид титана не производят, но производят технические марки, используемые в металлургии. На территории СНГ диоксид титана производится на Украине предприятиями «Сумыхимпром», город Сумы, «Крымский ТИТАН», г. Армянск) и КП «Титано-магниевый комбинат» (г. Запорожье). Сумский государственный институт минеральных удобрений и пигментов (МИНДИП) в своих научно-исследовательских работах особое место уделяет технологиям получения оксида титана (IV) сульфатным способом: исследование, разработка новых марок, модернизация технологии и аппаратурного оформления процесса.
Как указано выше, диоксид титана встречается в виде минералов, однако этого источника недостаточно, поэтому значительная его часть производится. Существуют два основных промышленных метода получения TiO2: из ильменитового (FeTiO3) концентрата и из тетрахлорида титана.
Производство диоксида титана из ильменитового концентрата
Первый завод по производству титановых белил из природного титанового минерала ильменита FeTiO3 был построен в Норвегии в 1918 г., однако первые промышленные партии белил имели жёлтый цвет и плохо подходили для живописи, так что фактически белые титановые белила стали использоваться художниками лишь в 1922—1925 гг. При этом следует указать, что до 1925 г. были доступны лишь композитные титановые пигменты на базе барита или кальцита.
До 1940-х гг. двуокись титана выпускалась в кристаллической модификации — анатаз (β-TiO2) тетрогональной сингонии с показателем преломления
Технология производства состоит из трёх этапов:
Производство диоксида титана из тетрахлорида титана
В 1938—1939 гг. способ производства изменился — появился так называемый хлорный метод производства белил из тетрахлорида титана, благодаря чему титановые белила стали выпускаться в кристаллической модификации рутил (α-TiO2) — также тетрагональной сингонии, но с другими параметрами решётки и несколько б́ольшим по сравнению с анатазом показателем преломления 2,61.
Существуют три основных метода получения диоксида титана из его тетрахлорида:
Применение
Основные применения диоксида титана:
Другие применения — в производстве резиновых изделий, стекольном производстве (термостойкое и оптическое стекло), как огнеупор (обмазка сварочных электродов и покрытий литейных форм), в косметических средствах (мыло и т. д.), в пищевой промышленности (пищевая добавка E171).
Цены и рынок
Нормативы
В настоящее время диоксид титана по ГОСТ 9808-84 не выпускается.
По данным техническим условиям работает ЧАО «Крымский ТИТАН» (Украина, г. Армянск).
По данным техническим условиям работает ОАО «Сумыхимпром» (Украина, г. Сумы).
Диоксид титана: что это, описание, польза и вред, применение
Диоксид титана – это неорганическое соединение, относящееся к группе оксидов. В составе имеет атомы титана и кислорода. Используется во многих сферах благодаря проявлению как основных, так и кислотных свойств. В пищевой промышленности применяется в качестве отбеливающего красителя, имеет код пищевой добавки Е171. Вещество ценится в косметологии, металлургии, фармацевтике. О безопасности дискутируют, постоянно проводятся научные исследования. В России и в большинстве стран диоксид титана считается безвредным.
Что такое диоксид титана, формула
Двуокись титана представляет собой амфотерный оксид, в котором на один атом титана приходится два атома кислорода. Химическая формула TiO2. За счёт сильного металла (титана) проявляются основные свойства, то есть способность взаимодействовать с кислыми солями, кислотами, неметаллами, которая сопровождается лёгкой передачей электрона. Кислород проявляет кислотные свойства, обеспечивает возможность реагировать с металлами, щелочами, основными солями.
Оксид титана (IV) встречается в природе в составе некоторых минералов:
Анатаз – мелкие пластинчатые или призматические кристаллы зеленовато-желтого, черного цвета с примесями олова, ниобия, железа, отличаются ярким блеском и высокой прочностью (5,0-6,0 по шкале Мооса). Встречается относительно редко, распространён в гидротермальных источниках в месторождениях кварца и кальционита, горного хрусталя на территории Урала, Хабаровского края, а также в Норвегии, Франции.
Рутил – красно-бурые столбчатые хрупкие кристаллы, чаще всего непрозрачные, с примесями олова, ванадия, тантала, хрома. Характерен металлический блеск. Является основным компонентом титановых руд. На территории России месторождения на Урале и в Туве, за рубежом – Австралия, Индия, США, Италия. Встречается рядом с кварцем, гранитом, магматическими породами.
Брукит – уплощённые неравномерно окрашенные минералы (от бесцветного до бурого) таблитчатой формы. Богат примесями ниобия, железа, тантала. Находится в месторождениях горного хрусталя, апатита, рутила, кварца. Основные области формирования – Пермская область, Приполярный Урал, Швейцария, Австрия.
При нормальных условиях диоксид титана имеет вид бесцветных кристаллов без вкуса и запаха. При дроблении образуется мелкодисперсный порошок белого цвета низкой гигроскопичности. При нагревании приобретает желтоватый оттенок. Добавка плохо растворяется: не растворяется в воде, в органических растворителях, в том числе в спирте, минеральных кислотах. Высоко устойчив к разному типы воздействия: стабилен при температуре до 2000 °С. Выдерживает изменение pH среды в широком диапазоне. Не разлагается со временем.
Химический состав, характеристики, пищевая ценность
Диоксид титана не имеет пищевой ценности для организма. В связи с нерастворимостью он не всасывается через слизистые оболочки органов желудочно-кишечного тракта, а выводится вместе с каловыми массами в неизменном виде, не оказывая влияния на метаболизм человека. Титановые белила, добавляемые в продукцию, тщательно очищены и не содержат примесей. Характеристики:
| Показатель | Значение |
| Массовая доля чистого диоксида титана | не менее 92% |
| Массовая доля нерастворимых примесей | не более 0,2% |
| Массовая доля летучих веществ | не более 0,5% |
| pH раствора | 6,5 – 8 |
| Белизна (в условных единицах) | Не менее 94 |
История использования
Знакомство с титаном как с химическим элементом началось именно с открытия двуокиси. Английский учёный и минеролог Уильям Грегор изучал железистые пески – дюнные россыпи, богатые магнитным железняком (Fe2TiO4). В ходе экспериментов в 1791 году он выделил новый оксид, который назвал манакеновой землёй. Одновременно в Германии известный немецкий химик Мартин Генрих Клапрот изучал рутил и тоже выделил титановый диоксид, назвав его в честь персонажей древнегреческой мифологии титанов. Звание первооткрывателя досталось Грегору, поскольку он сделал открытие немного раньше, однако осталось название, данное Клапротом. Спустя 10 лет французский химик Луи-Николя Воклен переоткрыл вещество, выделив его из другого минерала – анатаза.
Масштабный синтез титановых белил начался в 1918 году с открытия двух заводов по производству добавки в Норвегии и США. Эти фирмы поставляли соединение в приближенные страны, где его применяли в основном в промышленности, объём продаж был небольшой. Главными потребителями стали художники: живописцы применяли вещество как белило, однако многие партии имели желтоватый оттенок, поэтому не всегда подходили.
В 1923 году открылась компания по выпуску двуокиси титана во Франции. Краситель использовали как эффективный отбеливатель. Через 17 лет производство существенно увеличило темпы из-за открытия более доступного и массового способа получения. Продукт распространился практически по все страны мира.
В 1994 году амфотерный оксид был допущен к использование в пищевой промышленности. При этом его активно применяли в косметологии в фармацевтики для придания светлого оттенка кремам, зубным пастам, таблеткам. В продуктах питания вещество часто встречается в жевательных резинках, кремах для тортов.
К 2004 году производство стало падать. Вероятно, это было связано с конкуренцией на рынке с другими пигментами, в том числе натуральными, а также тенденцией на яркие цвета в пище и косметике. В 2010 году стали появляться данные о токсическом действии двуокиси титана на организм. Не было конкретных доказательств опасности добавки. В 2020 году её запретили во Франции на основании исследований Французской Сельскохозяйственной Академии. В других странах, в том числе в Канаде, России, США Е171 допущена к использованию к предельно допустимых количествах и встречается в продукции повсеместно.
Получение и производство
Промышленное производство оксида происходит на сложно устроенных химических заводах. Впервые синтез проводился из ильменитового концентрата – минерала ильменита (титанового железняка). При этом получалось не чистое вещество, а минеральная модификация – анатаз. Технология существовала до 1940 года и включала несколько этапов:
Данный метод был не очень удобен и эффективен. Получаемые титановые белила имели плохо очищенные примеси железа, производство было трудоёмким, приходилось контактировать с токсичными веществами и использовать массивное оборудование.
В конце 1939 года был предложен новый способ получения двуокиси титана, который вывел производство на качественно новый уровень. Его начали добывать из четырёххлористого титана посредством различных технологий:
Наиболее распространён высокотемпературный парофазный синтез, предложенный в 1948 году. Реакция идёт в безводных условиях, сначала получают хлорид титана (IV) путём воздействия на титановую руду газообразного хлора в присутствии молекулярного углерода (в качестве восстановителя). Затем отделенных от побочных продуктов тетрахлорид окисляется. При этом специалисты полностью владеют ситуацией и могут направлять ход синтеза в нужную сторону, поэтому готовый продукт очень качественный и чистый. Такой способ получения требует высокой квалификации сотрудников, а выпускаемая добавка самая дорогая на рынке.
Воздействие на организм
Оксид титана (IV) в виде пищевой или косметической добавки не наносит вреда здоровью. Это связано с тем, что он плохо проникает через кожу и совсем не всасывается в кишечнике, что исключает его участие в биохимических циклах. Однако наночастицы титановых белил имеют мельчайшие размеры, гораздо более меньшие, чем макромолекулы вещества. Наночастицы при вдыхании могут привести к возникновению злокачественных новообразований.
Вред для организма, противопоказания, побочные эффекты
Негативное влияние титановых белил связано с образованием мелких твёрдых частиц, способных повреждать слизистые оболочки и влиять на ДНК клеток человека, проявляя мутагенные свойства. Внесение мутации в генотип приводит к тому, что клетка становится опухолевой и начинает бесконтрольное деление. В результате возникает онкология. Пищевая добавка Е171 в составе продуктов питания потенциально не может вызвать рост новообразований, поскольку наночастицы наносят урон при вдыхании, а не пероральном употреблении.
Главным противопоказанием к приёму пищи, содержащей двуокись титана, является индивидуальная непереносимость. Она возникает редко, проявляется в тошноте, диспепсии, аллергических реакциях. Людям с заболеваниями печени, почечной недостаточностью, сниженным иммунитетом, а также детям и пожилым следует избегать таких продуктов. С осторожностью их могут принимать беременные и кормящие женщины. Диоксид титана не имеет побочных эффектов.
Полезные свойства
Высокая реакционная способность и уникальные свойства диоксида титана ценятся во многих отраслях деятельности. Для здоровья человека он нейтрален, положительно не влияет. Однако его полезные качества применяются в нанотехнологиях, пищевой промышленности, медицине. В качестве пищевой добавки титановый оксид выгоден, потому что не изменяет вкус и запах продукта, не всасывается и не участвует в пищеварении. При этом краситель даёт яркое и быстрое отбеливание, безопасное для организма.
Научные исследования диоксида титана
Международное агентство по исследованию рака включило оксид в список возможных канцерогенов. В 2010 году были опубликованы данные Национального института сельскохозяйственных исследований Франции о возможной токсичности двуокиси титана. Исследователи проводили испытания на лабораторных грызунах и на небольшой выборке добровольцев.
Опыты на крысах показали существенное снижение иммунитета и повышение риска появления злокачественных новообразований. Однако результаты были не вполне достоверными, т.к. их нельзя перенести на людей. Европейское агентство по безопасности продуктов питания заинтересовалась экспериментами, но после изучения 4 публикаций, сделанных в течение 6 лет, пришло к выводу, что нет оснований запрещать пищевую добавку, т.к. в статьях речь идёт о вдыхании наночастиц. Тем не менее, правительство Франции в 2020 году решило запретить Е171.
Спустя год Европейское управление по безопасности пищевых продуктов вновь вернулось к обсуждению этого вопроса и сделало заявление, что диоксид титана больше не может называться безопасной добавкой и вскоре его необходимо исключить из оборота на всей территории Европейского союза. Несмотря на это, сегодня добавка по-прежнему разрешена, а дискуссия об отмене только ведется.
Потенциальное негативное влияние титановых белил сохраняется в косметической продукции, которая требует распыления (солнцезащитные аэрозоли), а также в кремах. В связи с этим многие государства ужесточили требования и понизили предельно допустимую концентрацию оксида в этих товарах.
Применение диоксида титана
Титановые белила применяются во всех сферах деятельности. С давнего времени их используют в производстве красок, в том числе лаков. Соединение ценится также в пищевой промышленности в качестве нейтрального красителя, не влияющего на структуру и свойства продукта, а также в медицине, косметологии. Часто диоксид титана необходим при производстве бумаги, пластмасс, синтетики и много другого.
Применение диоксида титана в пищевой промышленности
Е171 – это краситель с отбеливающим эффектов. Он придаёт белый цвет самым разным продуктам, а также способствует поддерживанию и сохранению других цветов, защите их от ультрафиолетового излучения. Пищевую добавку можно найти в составе различной пищи:
Титановый диоксид добавляется в большинство продуктов для улучшения товарного вида. Он удобен в использовании, поскольку не изменяет вкуса и запаха, выдерживает высокие температуры, не разлагается и не портит структуру с течением времени. Кроме того, на данный момент он считается безопасным, поэтому добавляется в допустимых количествах. Нормативными актами строго ограничена концентрация Е171 в пище: не более 0,1 мг на 1 кг массы продукта.
Применение диоксида титана в фармацевтике и косметологии
Пигмент используется при различных лекарственных форм для придания им белого цвета. Для этого разрешено добавлять только высокочистый диоксид титана. Окраска проявляется при внесении минимальных количеств красителя. Е171 не только улучшает внешний вид прерпаратов, но и защищает их от разрушительного действия УФ-излучения. Титановые белила можно найти в составе:
Способность двуокиси титана поглощать лучи ультрафиолета нашла применение в косметических товарах. В кремах до и после загара он выполняет защитную функцию, препятствует появлению ожогов, неравномерной пигментации, развитию злокачественных опухолей кожи.
Диоксид титана в зубной пасте, а также мыле и других гигиенических средствах титановый диоксид в основном улучшает внешний вид.
Применение диоксида титана в других сферах
В промышленности оксид титана (IV) – незаменимый реагент во многих производствах. Так, при выпуске синтетических тканей вещество способствует образованию матовой гладкой поверхности, участвует в отбеливании.
Диоксид титана добавляется в большинство лакокрасочных материалов, а также в стройматериалы:
Добавка повышает устойчивость материала к солнечному света и других негативным атмосферным факторам, тем самым продлевает срок службы.
Двуокисью титана отбеливают обои и различные виды бумаги (цветную, картонную, парафиновую). То же характерно и для пластмассы: соединение обеспечивает чистую белизну, усиливает яркость других цветов, укрепляет пластик.
Как катализатор оксид может применяться в неорганическом и органическом синтезе для ускорения протекания химических реакций. Важно, что при этом он остаётся инертным, не даёт ненужных примесей.
Допустимые нормы приема
Не существует установленной дозы приёма диоксида титана. Предел поступления в организм контролируется путём ограничения концентрации Е171 в продуктах. Товары не должны содержать более 1% титанового диоксида. В солнцезащитных средствах не более 2-25%.
Класс опасности, хранение
Диоксид титана относится к 4 классу опасности – малоопасные химические вещества. Способны нанести вред здоровью при несоблюдении мер безопасности. Хранить необходимо в оригинальной упаковке вдали от солнечных лучей, при относительной влажности не более 70%, исключить проветривание. Температурный режим не должен превышать 25 °С. Срок годности 5 лет с момента изготовления.
Где купить и сколько стоит диоксид титана
Двуокись титана продаётся заводами-производителями. Продукция в основном импортируется из-за рубежа: США, Великобритания, Германия. Существуют и отечественные производители. Средняя цена за 25 кг Е171 составляет 1000 рублей за 1 кг. В розницу титановые белила можно купить в интернет-магазинах, 50 грамм красителя стоят 300-500 рублей.
Заключение
Диоксид титана – это неорганическое соединение, амфотерный оксид, который активно используется в промышленности в качестве отбеливающего вещества, а также для повышения устойчивости к негативным факторам окружающей среды. Краситель улучшает товарный вид продуктов питания, косметических средств. В солнцезащитных кремах и аэрозолях защищает кожные покровы от УФ-излучения. На сегодняшний день Е171 считается безопасным, однако вскоре это может измениться.