ген hfe мутация в гетерозиготной форме
Наследственный гемохроматоз, I тип (ген HFE) (Hemochromatosis Type 1 (Gene HFE))
Метод определения MLPA
Выдаётся описание результатов врачом-генетиком!
Данное исследование предназначено для выявления наиболее частых мутаций в гене, ответственном за развитие наследственного гемохроматоза 1 типа. Исследование имеет диагностическое значение, позволяющее определить наследственную природу избыточного накопления железа в организме.
Гемохроматоз представляет собой системное заболевание, характеризующееся прогрессирующим накоплением запасов железа в организме и его отложением в различных органах и тканях. В литературе также можно встретить другие названия заболевания: бронзовый диабет, пигментный цирроз печени, семейный гемохроматоз, гемохроматозный синдром, болезнь перегрузки железом, синдром Труазье-Ано-Шоффара, болезнь фон Реклингхаузен-Аппельбаума.
В свою очередь, гемохроматоз можно подразделить на 2 категории: первичный (наследственный) и вторичный гемохроматоз. Причиной первичного гемохроматоза (НГХ) служат генетические нарушения, в то время как вторичный может быть вызван чрезмерным употреблением пищи богатой железом (красное мясо) или добавок, способствующих его повышенному усвоению (витаминные комплексы, содержащие в своём составе большое количество железа, продукты, богатые аскорбиновой кислотой). Среди причин вторичного гемохроматоза следует назвать также такие патологические состояния, как хронические гемолитические анемии (ß-талассемия) и эритробластопении, разнообразные хронические заболевания печени (вирусные гепатиты В и С, алкогольная болезнь печени и др.), кожная порфирия (porphyria cutanea tarda), увеличивающие содержание железа в организме.
Симптомы и признаки заболевания включают в себя гиперпигментацию кожи, диабет, гепатомегалию (классическая триада), нарушение со стороны деятельности сердца, артропатию и гипогонадизм. Ранние жалобы чаще всего сводятся к слабости, апатии, похуданию, изменению окраски кожи, болям в животе, утрате либидо и явлениям, характерным для начала диабета. Наиболее чёткими объективными признаками полностью развившегося заболевания служат гепатомегалия, гиперпигментация кожи, телеангиэктазии, спленомегалия, артропатия, нарушения сердечного ритма, застойная сердечная недостаточность, выпадение волос на теле, атрофия яичек и желтуха.
Особенность гемохроматоза, затрудняющая своевременную диагностику и лечение, заключается в том, что, как правило, клинические признаки заболевания проявляют себя не сразу, а только лишь, когда количество накопленного железа в организме намного превышает допустимые нормы. Последнее сопровождается грубыми нарушениями со стороны работы внутренних органов и систем.
Для выявления состояния перегрузки организма железом используется целый ряд биохимических маркёров: уровень железа в сыворотке крови, общая железосвязывающая способность сыворотки (ОЖСС), трансферрин, насыщение трансферрина (НТЖ), сывороточный ферритин и др. Наиболее важными показателями обмена железа являются два из них: уровень ферритина и насыщение транферрина. Последний рассчитывается по формуле: НТЖ=(железо сыворотки крови/ОЖСС)х100%. НТЖ точнее отражает запасы железа в организме, так как уровень железа сыворотки и ОЖСС сами по себе обладают большими индивидуальными колебаниями и зависят от множества факторов. Именно повышение уровня ферритина и насыщения трансферрина является первым признаком заболевания.
В настоящее время выделяют 5 типов НГХ: классический (1-й тип), ювенильный (2-й тип), гемохроматоз 3-го, 4-го типов и неонатальный гемохроматоз.
Наследственный гемохроматоз 1-го типа (классический) признан одним из наиболее частых аутосомно-рецессивных заболеваний Европы. Развитие классического гемохроматоза связывают с нарушением работы гена HFE, локализованного на 6-ой хромосоме (6p21.3) и имеющего в своём составе 7 экзонов. На сегодняшний день в результате многочисленных исследований семей больных НГХ уже обнаружено более 25-ти отдельных мутаций в структуре HFE. По данным Fedder и его коллег, более 80% пациентов являются носителями одной из двух самых распространённых мутаций C282Y и H63D этого гена. Частота носительства указанных мутации крайне распространена в ряде северных стран Европы, достигая для C282Y 10-13 % в Британии, Норвегии и Швеции. Ряд отечественных работ показал, что российская частота основных мутаций гена HFE сходна по своим показателям с частотой мутаций в Греции, Италии, Испании и США, где частота аллеля 282Y составляет в среднем 0,02-0,04.
Ген hfe мутация в гетерозиготной форме
Hemochromatosis, iron metabolism.
Полимеразная цепная реакция в режиме реального времени.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Гемохроматоз – наследственное заболевание, передающееся по аутосомно-рецессивному типу, связано с нарушением обмена железа в организме. Гемохроматоз является одним из самых распространенных генетических заболеваний у белого населения. Встречается у мужчин в 24 раза чаще, чем у женщин. От 85 до 90 процентов людей с гомозиготной мутацией C282Y гена HFE имеют фенотипические проявления. Только у 10 процентов людей, гомозиготных по C282Y, есть клинические проявления гемохроматоза с повреждениями органов.
Симптомы наследственного гемохроматоза неспецифичны и обычно отсутствуют на ранних стадиях. Если симптомы есть, то они могут включать в себя общую слабость, летаргию, артралгию и импотенцию. Более поздние проявления включают в себя артралгию, остеопороз, цирроз печени, гепатоцеллюлярный рак, кардиомиопатию, аритмии, сахарный диабет и гипогонадизм.
Диагноз подтверждается повышенным уровнем ферритина в сыворотке крови и повышенным процентным содержанием насыщения трансферрина. Дальнейшая диагностика заключается в генетическом обследовании для выявления подфенотипов. Биопсия печени проводится для определения степени фиброза или для диагностики нетипичного наследственного гемохроматоза с другими генетическими дефектами. Основным лечением наследственного гемохроматоза является флеботомическая терапия (кровопускание). Флеботомия уменьшает запасы железа в организме, стимулирует эритропоэз и мобилизует железо из паренхиматозных клеток и других мест хранения.
Для чего используется исследование?
Когда назначается исследование?
— гиперпигментация (бронзовый цвет кожи, не связанный с загаром);
— гепатомегалия (увеличение печени);
— сахарный диабет неясной этиологии;
— нарушения со стороны деятельности сердца;
Что означают результаты?
По результатам исследования выдается заключение генетика с рекомендациями.
Исследуемые генетические локусы не могут доказывать наличие или отсутствие определенных заболеваний и представляют собой генетические факторы риска. Так как оцениваемые признаки являются многофакторными, для конечных рекомендаций необходимы клинические данные, то есть результат генетического теста требует консультации врача наряду с другими лабораторными исследованиями.
В отчете есть таблица с полиморфизмами генов и их интепретацией.
Если пациент является гомозиготным носителем мутаций C282Y, H63D или сложным гетерозиготным носителем мутаций C282Y/H63D, то диагноз «наследственный гемохроматоз» считается установленным. Для верификации диагноза в этих случаях не требуется проведения биопсии печени.
17 Железосвязывающая способность сыворотки
187 Комплексный анализ на витамины группы B (B1, B2, B3, B5, B6, B9, B12)
19 Клинический анализ крови: общий анализ, лейкоцитарная формула, СОЭ (с микроскопией мазка крови при выявлении патологических изменений)
Кто назначает исследование?
Гематолог, врач общей практики, врач-терапевт.
Ген hfe мутация в гетерозиготной форме
Этиология и встречаемость наследственного гемохроматоза. Наследственный гемохроматоз (MIM №235200) — болезнь накопления железа, встречающаяся у некоторых лиц с гомозиготными или компаундными гетерозиготными мутациями в гене HFE. Большинство пациентов (90-95%) с наследственным гемохроматозом гомозиготны по мутации Cys282Tyr; оставшиеся 5-10% больных — компаундные гетерозиготы по Cys282Tyr и другой мутации, His63Asp. Гомозиготность по мутации His63Asp не ведет к клиническому гемохроматозу, если нет дополнительных причин перегрузки железом.
Частота носительства у белой популяции Северной Америки составляет приблизительно 11% по Cys282Tyr и приблизительно 27% для His63Asp, это означает, что примерно 1 из 330 человек — гомозигота по мутации Cys282Tyr и еще 1 из 135 — ком-паундная гетерозигота по патогенным мутациям в гене HFE. Частота этих мутаций гораздо более низкая среди монголоидов, негроидов и американских индейцев.
Клиническую пенетрантность наследственного гемохроматоза определить трудно; оценки изменяются от 10 до 70%, в зависимости от того, определяется ли наследственный гемохроматоз как органная патология, вызванная накоплением железа, или биохимическим подтверждением повышения насыщения ферритина и уровня трансферрина.
В семейных исследованиях, например, от 75 до 90% гомозиготных родственников больных оказались бессимптомными. Популяционные исследования оценивают пенетрантность наследственного гемохроматоза на основе биохимического подтверждения от 25 до 50%, но пенетрантность может быть более высокой, если выполняется биопсия печени для выявления скрытого цирроза.
Независимо от того, какова пенетрантность, ясно, что мужчины поражаются более часто, чем женщины, и сложные гетерозиготы Cys282Tyr/His63Asp имеют значительно более низкий риск наследственного гемохроматоза, чем гомозиготы Cys282Tyr. Хотя точная величина пенетрантности у гомозигот Cys282Tyr требует окончательного определения, ясно, что пенетрантность неполная.
Патогенез наследственного гемохроматоза
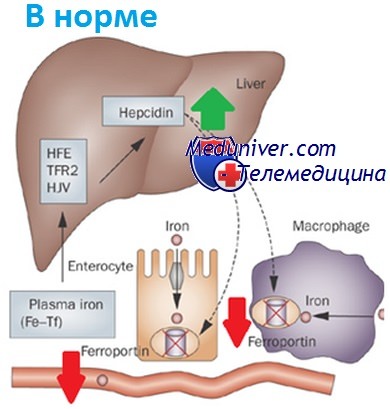
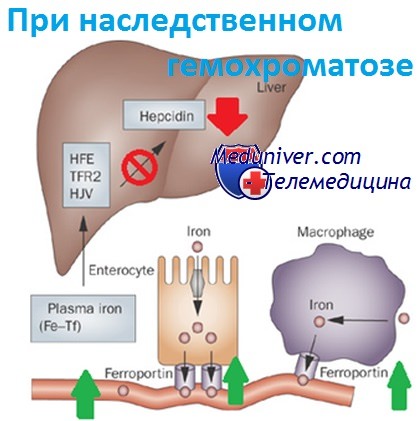
Наследственный гемохроматоз — заболевание, связанное с избытком железа. Запасы железа определяются в основном поглощением его из пищи энтероцитами тонкого кишечника и выходом эндогенного железа из макрофагов, фагоцитирующих эритроциты.
Освобождение железа энтероцитами и макрофагами регулируется циркулирующим гормоном обмена железа, гепсидином, синтезируемым в печени и блокирующим поглощение железа, когда его достаточно. Мутантный белок HFE создает помехи сигналам гепсидина, что приводит к стимуляции энтероцитов и макрофагов к выбросу железа. Таким образом, организм продолжает усваивать железо и использовать его повторно, несмотря на его избыток.
Симптоматика избытка железа развивается лишь у небольшого числа лиц с двумя мутациями в гене HFE. Ранние симптомы включают утомляемость, боли в суставах, снижение либидо и боли в животе. Дополнительные признаки — выявление при обычном обследовании повышенного насыщения трансферрина железом или ферритина. Поздние признаки избытка железа — гепатомегалия, цирроз, печеночно-клеточная карцинома, сахарный диабет, кардиомиопатия, гипогонадизм, артрит и повышенная пигментация кожи. У мужчин симптомы появляются в возрасте 40-60 лет.
Считают, что у женщин симптоматика проявляется вдвое или в десять раз реже, чем у мужчин, симптомы могут не проявиться даже в постменопаузе. Прогноз для пациентов, диагностированных и начавших лечение до развития цирроза печени, отличный. Больные циррозом, получающие эффективное лечение кровопусканиями, все же имеют 10-30% риска развития опухоли печени.
Особенности фенотипических проявлений наследственного гемохроматоза:
• Возраст начала: 40-60 лет у мужчин; в постменопаузе у женщин
• Утомляемость, слабость, гиперпигментация («бронзовая кожа»), сахарный диабет, цирроз, кардиомиопатия
• Высокая насыщенность трансферрина сыворотки железом
• Высокий ферритин сыворотки
Лечение наследственного гемохроматоза
Индивидуумам с генотипом группы риска следует ежегодно контролировать уровень ферритина сыворотки крови. Если содержание ферритина превышает 50 нг/мл, показано кровопускание для удаления некоторого количества крови и поддержания рекомендованной нормальной концентрации ферритина. Кровопускание повторяют до тех пор, пока не будет достигнута нормальная концентрация ферритина. Невозможность достичь нормальной концентрации ферритина в течение 3 мес от начала кровопусканий — плохой прогностический признак.
Как только концентрация ферритина станет ниже 50 нг/ мл, поддерживающие кровопускания проводят каждые 3-4 мес у мужчин и каждые 6-12 мес у женщин. Больным с клиническими проявлениями и начальной концентрацией ферритина более 1000 нг/мл выполняют биопсию печени для уточнения наличия цирроза. Кровопускания пациентам с биохимическими отклонениями необходимо проводить еженедельно, пока гематокрит не составит 75% начального, а концентрация ферритина станет ниже 50 нг/мл.
Риски наследования наследственного гемохроматоза
Наследственный гемохроматоз — аутосомно-рецессивное заболевание с неполной пенетрантностью. Сибсы больного имеют 25% шанс иметь две мутации. Ребенок больного — облигатный носитель с 5% риском иметь две мутации, если оба родителя европеоиды. Из-за очень низкой пенетрантности этой болезни тотальный популяционный скрининг на наличие мутаций гена HFE не считают целесообразным.
Тем не менее из-за распространенности заболевания, неточной определенности пенетрантности и доступности легкого и эффективного лечения, может оказаться оправданным однократное определение насыщения трансферрина сыворотки и концентрации ферритина среди взрослых мужчин северо-европейского происхождения.
Пример наследственного гемохроматоза. С.Ф., 30-летний ранее здоровый мужчина европейского происхождения, направлен на консультацию в клинику генетики, поскольку у его 55-летнего отца только что диагностирован цирроз печени, вызванный наследственным гемохроматозом. Анамнестические сведения и данные медицинского осмотра в норме.
Насыщение трансферрина железом оказалось 48% (в норме 20-50%). Уровень ферритина сыворотки крови также в норме (
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Ген hfe мутация в гетерозиготной форме

Поиск
Гемохроматоз
Е.Ю. ЕРЕМИНА
Мордовский госуниверситет им. Н.П. Огарева, 430005, г. Саранск, ул. Большевистская, д. 68
Еремина Елена Юрьевна — доктор медицинских наук, профессор, заведующая кафедрой пропедевтики внутренних болезней, тел. (834) 247-68-85, e-mail: [email protected]
На клиническом примере продемонстрирована сложность диагностики гемохроматоза, обусловленная генетическим полиморфизмом. В статье приводятся современные данные по этиологии, патогенезу, особенностям клиники, диагностики и лечения больных гемохроматозом. Особое внимание уделено наследственному гемохроматозу и его генетическому многообразию. Представлены сведения о пяти типах первичного гемохроматоза и особенностях их клинической симптоматики. Показано, что наиболее информативными методами диагностики на первом этапе являются исследование содержания железа в сыворотке крови, общей железосвязывающей способности сыворотки крови, процента насыщения трансферрина железом, уровня ферритина в крови. Наиболее чувствительным тестом считается концентрация ферритина в сыворотке крови, которая прямо пропорциональна общему запасу железа в организме. На втором этапе диагностики применяются генетические методы, при необходимости выполняется пункционная биопсия печени.
Ключевые слова: гемохроматоз, генетический полиморфизм, клиника, диагностика.
E.Yu. EREMINA
Mordovia State University named after N.P. Ogarev, 68 Bolshevistskaya St., Saransk, Russian Federation, 430005
Hemochromatosis
Eremina E.Yu. — D. Med. Sc., Professor, Head of the Department of Propaedeutics of Internal Diseases, tel. (834) 247-68-85, e-mail: [email protected]
The clinical example demonstrates the difficulty of a hemochromatosis diagnostics caused by genetic polymorphism. The paper presents the current data on the etiology, pathogenesis, clinical features, diagnosis and treatment of patients with hemochromatosis. Particular attention is given to hereditary hemochromatosis and its genetic diversity. The paper provides information about five types of primary hemochromatosis and their clinical symptoms characteristics. It is shown that the most informative diagnostic methods at the first stage are studying the iron content in the serum, total serum iron binding capacity, transferrin saturation percentage, and ferritin levels in blood. The most sensitive test is the ferritin concentration in the serum, which is directly proportional to the total body iron stores. At the second diagnostics stage genetic methods are used and liver needle biopsy, if necessary.
Key words: hemochromatosis, genetic polymorphism, clinical picture, diagnosis.
Современные диагностические технологии позволяют выявлять многочисленные заболевания печени, прежде считающиеся редкими. Диагностика патологии печени традиционно строится по плану, предусматривающему выявление маркеров вирусной, лекарственной, алкогольной, аутоиммунной и онкологической этиологии заболевания. Однако и при исключении данных причин диагностический поиск не должен прекращаться. Его продолжение ассоциировано с проведением диагностических тестов на наличие более редкой патологии печени, одной из которых является гемохроматоз.
Гемохроматоз представляет собой болезнь «накопления», вызванную перегрузкой организма железом и его отложением в печени, сердце, эндокринных органах, коже и суставах. Различают первичный и вторичный гемохроматоз. Термин первичный гемохроматоз имеет несколько синонимов — наследственный, классический, генетический, бронзовый диабет, пигментный цирроз печени, синдром Труазье — Ано — Шоффара. Своевременная диагностика первичного гемохроматоза имеет особое прогностическое значение, поскольку позволяет на ранних стадиях начать лечение больных и предотвратить развитие тяжелых необратимых состояний, таких как цирроз печени, рефрактерная сердечная недостаточность, сахарный диабет, гипогонадизм, деструктивные артропатии и другие.
Вторичный гемохроматоз наблюдается у пациентов с врожденными и приобретенными гемолитическими и мегалобластными анемиями, находящихся на хроническом гемодиализе, при миелодиспластическом синдроме, многократных гемотрансфузиях, необоснованном лечении препаратами железа. Избыточное отложение железа в печени (гемосидероз) характерно для хронических заболеваний печени различного генеза, сопровождающихся холестазом и алкогольной болезни печени 1.
Первичный гемохроматоз неоднороден, поскольку обусловлен различными генетическими мутациями. На сегодняшний день описаны 5 его типов [4, 5]: связанный с мутацией HFE-гена (1-й тип), ювенильный (2-й тип), не связанный с мутацией HFE-гена (3-й тип), аутосомно-доминантный гемохроматоз (4-й тип) и перегрузка железом у новорожденных (5-й тип). Чаще всего диагностируется 1-й тип гемохроматоза, в основе которого лежит усиление всасывания железа в кишечнике и его накопление в органах-мишенях. Данный тип обусловлен мутациями C282Y (или Cys282Tyr) и H63D (или Нis63Asp) в гене HFE [6]. Мутация C282Y возникает вследствие замены цистеина на тирозин на 282-м шаге, а мутация H63D — гистидина на аспартат на 63-м шаге. Большинство пациентов с 1-м типом гемохроматоза гомозиготны по C282Y [7]. Однако симптомы гемохроматоза присутствуют лишь у половины гомозигот с мутацией C282Y.
Смешанная гетерозиготность C282Y/Н63D, наблюдаемая у 3-5% больных, характеризуется нетяжелым течением без ярко выраженных клинических симптомов заболевания. Подозрение на гемохроматоз возникает при обнаружении высокого уровня сывороточного ферритина и процента насыщения трансферрина [8], однако для подтверждения диагноза обычно требуется проведение биопсии печени.
Еще более редким типом заболевания является ювенильный гемохроматоз (2-й тип), который манифестирует в возрасте 10-30 лет. Он проявляется выраженной перегрузкой железом и быстро прогрессирующей симптоматикой поражения печени и сердца. Мутации при этом типе гемохроматоза расположены в гене HAMP, ответственном за синтез в печени гепсидина. Гепсидин ответственен за уменьшение всасывания железа в кишечнике, ограничение его высвобождения из депо в печени и контроль за поглощением железа ретикулоэндотелиальными клетками [9]. Особенно тяжелое течение гемохроматоза наблюдается у пациентов с комбинированной мутацией гена НАМР с гомозиготностью C282Y HFE-гена. Наоборот, у гетерозигот C282Y/H63D HFE-гена с дополнительными мутациями гена HAMP клиника гемохроматоза обычно менее выражена [5, 6].
Не описано существенных отличий в клинической симптоматике гемохроматоза 2-го и 3-го типов. В основе 3-го типа гемохроматоза лежат мутации гена HJV, ответственного за трансферрин-2, который в свою очередь участвует в регуляции выработки гепсидина при перегрузке организма железом. Клинический дебют 4-го типа гемохроматоза (аутосомно-доминантного) приходится чаще всего на пожилой возраст. Заболевание обусловлено мутацией A77D гена SLC40A1. Этот ген кодирует синтез белка ферропортина, осуществляющего трансмембранный перенос железа в энтероцитах [9]. У больных наблюдается накопление железа в ретикулоэндотелиальной системе, значительно повышается уровень ферритина в сыворотке крови. На поздних стадиях повышается коэффициент насыщения трансферрина железом и появляется органная симптоматика — цирроз печени, сахарный диабет, поражение сердца, суставов и др. Перегрузка железом новорожденных характеризуется задержкой внутриутробного развития и в постнатальном периоде дебютирует быстро прогрессирующими симптомами печеночной недостаточности, приводящими к смертельному исходу вскоре после рождения.
По мере совершенствования молекулярно-генетических методов исследования и их внедрения в клиническую практику перечень генных модификаций, ответственных за развитие гемохроматоза, очевидно, будет расширяться. На сегодняшний день принципиально важным представляется понимание патогенетических механизмов нарушения метаболизма железа в органиме больных и своевременная диагностика гемохроматоза. И здесь следует отметить, что на практике диагностика этого заболевания все еще представляет значительные сложности.
В качестве иллюстрации данного положения приводим описание истории болезни больной У., 1992 г.р. Пациентка заболела остро 20.09.14, без видимой причины, беспокоили тошнота, рвота, тяжесть в правом подреберье, слабость, субфебрильная температура тела. На следующий день потемнела моча, появились ахоличный кал и иктеричность склер. После исключения вирусных гепатитов была госпитализирована в гастроэнтерологическое отделение Мордовской республиканской клинической больницы. Состояние пациентки при поступлении и позднее расценено как удовлетворительное. Из жалоб отмечались лишь небольшая слабость и периодически возникающая после еды тяжесть в правом подреберье. Из ранее перенесенных заболеваний отмечает ОРВИ и краснуху в детстве. Никаких лекарственных, растительных препаратов и БАДов за последние 6 мес. не принимала. Алкоголем не злоупотребляет. Замужем, имеет ребенка трех лет. Беременность и роды протекали без осложнений. Аллергологический, эпидемиологический, профессиональный анамнез без особенностей. Кровезаменители не переливались. Туберкулез, вирусные гепатиты, сахарный диабет у себя и родственников отрицает. У бабушки, матери и самой пациентки — темный оттенок кожи по типу меланодермии, бабушка пациентки умерла от цирроза печени неуточненной этиологии в 65 лет.
Объективно на момент осмотра отмечается выраженная желтушность кожи на фоне меланодермии, иктеричность склер, единичные «сосудистые звездочки» на коже спины. Периферические лимфатические узлы не увеличены. Отеков нет. Живот при пальпации мягкий, чувствительный в правом подреберье. Печень +4 см, умеренной плотности, безболезненная, поверхность гладкая, край ровный, закругленный. Селезенка +2 см, гладкая, мягко-эластичная, безболезненная. Моча темная. Стул оформленный, раз в день, ахоличен, без слизи и крови.
Анализ крови при поступлении: Hb — 132 г/л, эр. — 4,6х10 12 /л, Le — 4,3х10 9 /л (эоз — 8%, сегм — 48%, пал.яд. — 9%, лимф — 24%), тромб. — 195 х10 9 /л, Рет — 25‰, СОЭ — 4 мм/ч. Биохимическое исследование крови при поступлении: билирубин общий — 1177 мкмоль/л, билирубин прямой — 1000 мкмоль/л, АЛТ — 220 Е/л, АСТ — 364 Е/л, ЩФ — 122 Е/л, ГГТП — 112 Е/л, общий белок — 60 г/л, альбумины — 50%, α-1 — 4%, α-2 — 11%, γ — 22%, протромбиновый индекс — 49%, тромбиновое время — 22 сек., АЧТВ — 50 сек, МНО — 1,98, фибриноген — 2,0 г/л, мочевина — 8,6 ммоль/л, креатинин — 106 ммкмоль/л, холестерин — 7,8 ммоль/л, триглицериды — 4,17 ммоль/л, ЛПНП — 1,96 ммоль/л, глюкоза — 4,9 ммоль/л, железо — 23 мкмоль/л, СРБ +, мочевая кислота — 270 мкмоль/л. Гликозилированный гемоглобин от 22.10.14 — 4,0%. Гликемический профиль от 23.10.14: 12.00 — 7,32 ммоль/л, 16.00 — 15,4 ммоль/л, 22.00 — 14,2 ммоль/л, 6.00 — 5,26 ммоль/л. Динамика основных результатов исследования крови представлена на рис. 1. Повторно проведены исследования (ИФА, ПЦР крови) на вирусные гепатиты А, В, С, а также G, Е, TT, цитомегаловирус, вирус Эпштейна — Барр, простого герпеса, описторхоз, лептоспироз, иерсиниоз, токсоплазмоз, паразитарные инвазии, туберкулез (все с отрицательным результатом). Исследованы в динамике сывороточные маркеры аутоиммунных заболеваний печени (AMA M2, ANA, LKM, SMA, SLA/LP — результат отрицательный), маркеры болезни Вильсона — Коновалова, α1-антитрипсин (результат отрицательный).
Рисунок 1. Динамика содержания билирубина общего (мкмоль/л), γ-глютамил-транспептидазы (ГГТП, Ед/л), аланиновой (АЛТ, Ед/л) и аспарагиновой амино-трансфераз (АСТ, Ед/Л) в сыворотке крови больной У.
Сывороточные онкомаркеры от 10.10.14: СА 72-4 — 62,5 Ед/мл, СА 19-9 — 400,0 Е/мл, α-фетопротеин (АФП) — 66,93 МЕ/мл, раковый эмбриональный антиген (РЭА) — 1,3 нг/мл; от 20.10.14: СА 19-9 — 72 Ед/мл, АФП — 230,85 МЕ/мл, от 20.11.14: АФП — 76,6 МЕ/мл.
КТ органов брюшной полости от 14.10.14 с доп. контрастированием печени: КТ-картина гепатоспленомегалии, цирроза печени, портальной гипертензии, асцита, перегиба желчного пузыря, отека поджелудочной железы, лимфоаденопатии (множественные пароаортальные лимфоузлы до 34х16х14 мм.), асцита, правостороннего гидроторакса.
После обнаружения более чем 10-кратного повышения уровня сывороточного ферритина до 1560 нг/мл (в N до 150 нг/мл) при уровне сывороточного железа 30 мкмоль/л возникло подозрение на первичный гемохроматоз, и пациентка была направлена в МКНЦ ДЗ Москвы для проведения генетического исследования и пункционной биопсии печени.
Морфологическое исследование биоптатов печени от 25.11.14: портальные тракты не расширены, умеренно фиброзированы, гиперплазия мелких желчных протоков. В портальных трактах и в синусоидах много макрофагов с крупногранулярной пигментной зернистостью в цитоплазме. Участки перисинусоидального фиброза. Умеренно выраженная гиперплазия клеток ретикулоэндотелиальной системы. При окраске по Перлсу отложения соединений железа выявляются в цитоплазме портальных макрофагов и клеток ретикулоэндотелиальной системы по ходу синусоидов. Заключение: Гемосидероз печени.
Генетическое исследование крови: выявлены мутации Cys282Tyr и His63Asp гена HFE в гетерозиготном состоянии.
Заключительный диагноз основной: Гемохроматоз. Мутации Cys282Tyr и His63Asp в гетерозиготном состоянии. Острый гепатит, вызванный перегрузкой железом, фаза реконвалесценции. Осложнения основного: Портальная гипертензия: спленомегалия, гиперспленизм (тромбоцитопения средней степени тяжести, лейкопения). Сопутствующий: Хронический бескаменный холецистит, ремиссия. За время всего стационарного лечения пациентка получала инфузионную терапию, адеметионин, УДХК 1000 мг/сут, энтросорбенты, преднизолон per os с 30 мг/сут. На фоне лечения зарегистрирована положительная динамика. В настоящее время продолжается прием УДХК 750 мг/сут. Планируется проведение пациентке дополнительных генетических исследований, а также обследование родственников первой линии.
Приведенный случай демонстрирует дебют гемохроматоза у молодой женщины в виде острого гепатита, обусловленного перегрузкой печени железом и, строго говоря, не является классическим. Впрочем, наши знания о данном заболевании и вариантах его течения пока еще довольно скромны. Систематизируя его основные патогенетические звенья, можно с уверенностью утверждать лишь то, что генетические мутации приводят к нарушению контроля за всасыванием железа в кишечнике, увеличению сывороточного ферритина, насыщения трансферрина железом, депонированию железа в виде гемосидерина и ферритина в печени, поджелудочной железе, сердце и других органах. Образующиеся на фоне перегрузки печени железом свободные радикалы запускают реакции перекисного окисления липидов, приводящие к разрушению клеточных мембран, внутриклеточных структур гепатоцитов, нарушению их структуры и функции, а также усиленному синтезу коллагена [6].
Считается, что клинически манифестный гемохроматоз встречается в популяции с частотой 2 случая на 1000 жителей, у мужчин в 5-10 раз чаще и раньше (в возрасте 40-60 лет), чем у женщин (обычно после менопаузы) [4, 8]. Более раннему проявлению клиники заболевания способствуют применение лекарственных средств, витаминов и БАДов, особенно содержащих в своем составе железо и аскорбиновую кислоту, вирусный гепатит С, сопутствующий стеатоз печени и в значительной степени — употребление алкоголя, поскольку алкоголь и перегрузка железом кумулятивно усиливают свободнорадикальное окисление в печени [5, 7, 10, 11].
Клиническая симптоматика гемохроматоза зависит от генетических особенностей пациента, степени перегрузки организма железом, а также от преимущественного поражения тех или иных органов [7]. Вероятность появления гомозиготных больных детей составляет 1:4 в тех случаях, когда оба родителя гетерозиготы по дефектному гену, а гетерозиготных — 1:2 [7]. Гетерозиготное носительство мутации HFE-гена гемохроматоза среди населения составляет 1:10-12 [12].
В стадийном течении гемохроматоза выделяют бессимптомную перегрузку организма железом, синдром перегрузки железом с ранними, неспецифическими проявлениями, и синдром перегрузки железом с клинически выраженным поражением органов-мишеней, сопровождающимся тяжелым нарушением их функции и осложнениями. К начальным признакам заболевания относятся слабость, утомляемость, периодические боли в правом подреберье, артралгии, похудание, сухость и гиперпигментация кожи по типу меланодермии за счет отложения в коже меланина и гемосидерина. Симптомы поражения печени выявляются случайно при проведении обследования и, как правило, ассоциируются с другими заболеваниями. Первичная диагностика гемохроматоза становится возможной либо при развитии острого гепатита на фоне перегрузки железом, подобно тому, как это произошло в описанном случае, либо на поздних стадиях заболевания, когда присутствует характерная для гемохроматотоза триада симптомов: цирроз печени, сахарный диабет и меланодермия. При этом у больных возможна и нетипичная симптоматика, обусловленная доминирующим поражением органа-мишени. Это может быть панкреатогенный сахарный диабет, выраженная внешнесекреторная недостаточность поджелудочной железы, рефрактерная сердечная недостаточность и аритмии, поражения гипофиза, надпочечников, гипогонадизм [13].
Каковы же критерии диагностики гемохроматоза? Прежде всего это клиническая симптоматика в сочетании с наследственной предрасположенностью. Из доступных и информативных диагностических маркеров следует обратить внимание на исследование содержания железа в сыворотке крови (повышено в большинстве случаев, но не всегда), общей железосвязывающей способности сыворотки крови ( 45%), уровня ферритина в крови (у мужчин >300 мкг/л, у женщин >200 мкг/л), а также не объяснимое другими причинами повышение активности сывороточных аминотрансфераз [5, 13]. Наиболее чувствительным тестом считается концентрация ферритина в сыворотке крови, которая прямо пропорциональна общему запасу железа в организме. Повышение уровня ферритина свыше 1000 нг/мл свидетельствует о тяжелой перегрузке железом [5, 13].
При сформировавшемся подозрении на гемохроматоз следут направить пациента на генетическое исследование, прежде всего на наиболее распространенные мутации C282Y, H63D и S65C HFE-гена. Гемохроматоз диагностируется, если пациент — гомозиготный носитель мутации C282Y или же является сложным гетерозиготным носителем 2 мутаций — C282Y и Н63D, как в описанном наблюдении. В этих случаях проведение биопсии печени для верификации диагноза, как правило, не требуется. Изолированные гетерозиготные мутации С282Y и Н63D, сочетающиеся с признаками перегрузки железом, гепатодепрессии, повышения активности сывороточных аминотрансфераз, требуют проведения пункционной биопсии печени с морфологическим исследованием биоптата и окраской реактивом Перлса на содержание железа в гепатоцитах [6]. При морфологическом исследовании биоптата печени обнаруживают признаки портального цирроза, множество макрофагов в соединительной ткани и крупные гранулы гемосидерина в гепатоцитах, а также в эпителии желчных протоков, купферовских клетках и синусоидах.
Ранняя диагностика гемохроматоза является залогом увеличения продолжительности жизни пациентов, что достигается несложной коррекцией питания, образа жизни и адекватным лечением. При гемохроматозе ограничивают продукты, лекарства и БАДы, содержащие железо и витамин С, исключается алкоголь.
Большинству пациентов с гемохроматозом, прежде всего, гомозиготам по мутации HFE-гена, показано проведение флеботомий (кровопусканий). Используются также хелаторы железа, препараты с антиоксидантной и гепатопротекторной активностью, плазмаферез, цитаферез и гемосорбция, применяемые с целью удаления избытка железа из организма. Регулярные, часто пожизненно проводимые флеботомии считаются самым эффективным методом лечения гемохроматоза. Их проводят еженедельно, контролируя уровень гемоглобина, гематокрита и сывороточного ферритина до и после процедуры. Согласно рекомендациям Американской ассоциации заболеваний печени, снижение гематокрита после каждого сеанса флеботомии не должно превышать 20% от исходного. При достижении уровня ферритина 50 мкг/л, частоту флеботомий уменьшают до 4-6 раз в год [13]. Для профилактики симптомов гиповолемии до и после процедуры больные должны употреблять около 2 л жидкости. Применение хелатов (дефероксамин, деферазирокс) показано при невозможности проведения кровопусканий, например, пациентам с анемией, при тяжелом поражении сердца или выраженной гипоальбуминемии [8,13].
К сожалению, первичной профилактики гемохроматоза не существует. Поэтому для предотвращения развития необратимых изменений, таких как цирроз печени, сахарный диабет, сердечная недостаточность, деструктивные артропатии, гипогонадизм, чрезвычайно важна ранняя диагностика заболевания. При появлении в семье больного гемохроматозом необходимо тестирование всех ближайших кровных родственников. Им должно быть предложено скрининговое исследование для выявления гемохроматоза, включающее в себя генетическое тестирование на наличие наиболее распространенных мутаций HFE-гена, определение сывороточного железа, общей железосвязывающей способности сыворотки крови, ферритина и процента насыщаемости трансферрина. Повышение процента насыщения трансферрина и сывороточного ферритина в сочетании с гетерозиготным или гомозиготным носительством мутаций гена HFE свидетельствует в пользу постановки диагноза гемохроматоза. В сомнительных случаях требуется проведение биопсии печени и динамическое наблюдение за пациентом.
1. Cylwik B., Chrostek L., Szmitkowski M. The effect of alcohol on the regulation of iron me-tabolism // Pol. Merkur. Lekarski. — 2008. — Vol. 25(147). — P. 273.
2. Кузнецова А.В., Дуботолкина Е.В., Лойфман Е.А. Показатели обмена железа при хро-ническом гепатите С // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. — 2009. — №19(5). — С. 92.
3. Valenti L., Pulixi E.A., Arosio P. Relative contribution of iron genes, dysmetabolism and hepatitis C virus (HCV) in the pathogenesis of altered iron regulation in HCV chronic hepatitis // Heamatologica. — 2007. — Vol. 92(8). — P. 1037-1042.
4. Adams P.C., Reboussin D.M., Barton J.C. et al. Hemochromatosis and iron-overload screen-ing in a racially diverse population // N. Engl. J. Med. — 2005. — Vol. 352. — P. 1769-1778.
5. Powell L.W., Dixon J.L., Ramm G.A. et al. Screening for hemochromatosis in asymptomatic subjects with or without a family history // Arch Intern. Med. — 2006. — Vol. 166. — P. 294-301.
6. Allen K.J., Gurrin L.C., Costantine C.C. et al. Iron-overload-related disease in HFE heredi-tary hemochromatosis // N. Engl. J. Med. — 2008. — Vol. 358(3). — P. 221-230.
7. Полунина Т.Е., Маев И.В. Синдром перегрузки железом: современное состояние про-блемы // Фарматека. — 2008. — T. 13. — C. 54-61.
8. Powell L.E. New developments in hereditary hemochromatosis // Ces. a Slov. Gastroent. and Hepatology. — 2008. — Vol. 62 (Suppl. 2). — P. 67-70.
9. Knutson M.D., Oukka M., Koss L.M. et al. Iron release from macrophages after erythrophagocytosis is up-regulated by ferroportin I overexpression and down-regulated by hepcidini // Proc. Natl. Acad. Sci. USA. — 2005. — Vol. 102. — P. 1324-1328.
10. Fletcher L.M., Dixon J.L., Purdie D.M. et al. Excess alcohol greatly increase the prevalens of cirrhosis in hereditary hemochromatosis // Gastroenterology. — 2002. — Vol. 122. — P. 298-289.
11. Clouston A.D., Jonsson J.R., Powell E.E. Steatosis as a cofactor in other liver diseases: hep-atitis C virus, alcohol, hemochromatosis and others // Clin. Liver Dis. — 2007. — Vol. 14. — P. 173-189.
12. Арутюнов А.Т., Иваников И.О., Сюткин В.Е. Диагностика и лечение хронических заболеваний печени. — М.: Принт-Ателье, 2005. — 304 с.
13. Tavill A.S. American for the Study of Liver D, American College of G., American Gastro-enterological F. Diagnosis and managment of hemochromatosis // Hepatology. — 2001. — Vol. 33. — P. 1321-1328.
1. Cylwik B., Chrostek L., Szmitkowski M. The effect of alcohol on the regulation of iron metabo-lism. Pol. Merkur. Lekarski, 2008, vol. 25(147), pp. 273.