ифа elisa что это
В связи с развитием клеточных технологий, молекулярной биологии, генетики, физики, химии и ряда других высокотехнологичных дисциплин в повседневную практику внедряются новые высокоточные и высокотехнологичные методы. Данные междисциплинарные тенденции затрагивают и область медицинских знаний, и смежные области биологических, биохимических проблем. За последние десять лет получил широкое распространение и внедрение в массовую практику метод клинической лабораторной диагностики под названием иммуноферментный анализ.
Вообще технологии иммунологических ферментативных и радиологических реакций широко использовались в типировании клеток, культур клеток, различных тканей с начала 80-х годов XX столетия. Однако методы эти были очень трудоемкими, не унифицированными, не стандартизированными, что исключало их использование в лечебно-диагностических целях в массовом порядке. Такими методами пользовались лишь узкие, наукоемкие и высокоспециализированные лаборатории.
Однако с развитием техники, микротехники, производства различных биополимерных материалов стало возможным производить готовые наборы иммуноферментной диагностики, которыми смогут пользоваться лаборатории лечебно-профилактических учреждений широкого профиля. ИФА широко используется для диагностики всевозможных инфекций (хламидиоз, сифилис, цитомегаловирус, токсоплазмоз, герпес и т.д.), как острых, так и хронических, а также скрытых форм, которые протекают без клинических симптомов.Также этот метод применяют для контроля над хроническими заболеваниями. Давайте постараемся разобраться, что это за метод, и какие принципы лежат в его основе?
Компоненты иммуноферментного анализа – иммунная реакция и ферментативная реакция
Иммунная реакция, что это? Что такое антитело, антиген?
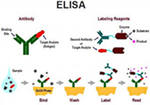
В первую очередь разберем, что такое иммунные реакции. Иммунные реакции – это специфические реакции связывания антигена с антителом с образованием иммунного комплекса. Что это значит? На поверхности каждой клетки любого организма имеются особые структуры, которые называются антигены. Антигены в целом – это молекулы, которые несут информацию о клетке (подобно информации на бейдже у человека, где указываются основные данные этого человека).
Индивидуальные и видовые антигены – что это? Зачем нужны эти антигены?
Имеются антигены индивидуальные, то есть присущие только данному конкретному организму. Эти индивидуальные антигены разные у всех людей, есть похожие друг на друга, но все равно отличающиеся. Двух одинаковых копий индивидуальных антигенов в природе не существует!
Второй основной тип антигенов – это видовые антигены, то есть присущие какому-либо конкретному виду живых существ. Например, у человека присутствует свой видовой антиген, общий для всех людей, у мышей имеется свой мышиный видовой антиген и т.д. На поверхности каждой клетки обязательно присутствуют видовой и индивидуальный антиген.
Как происходит узнавание антигена?
Иммунная клетка связывается с подозрительной клеткой и проводит опознание именно по индивидуальному антигену. В памяти иммунной клетки «записано» как выглядит «свой антиген». Таким образом, если антиген подозрительной клетки совпадает с описанием «свой антиген», значит, эта клетка собственного организма и опасности не представляет. Тогда иммунная клетка «отвязывается» и уходит. А если антиген не совпадает с описанием «свой», тогда иммунная клетка идентифицирует эту клетку как «чужой», а значит потенциально опасный для всего организма. В этом случае иммунная клетка не «отвязывается», а начинает уничтожать опасный объект. Точность такого иммунологического узнавания поражает воображение – 99,97%. Ошибок практически не бывает!
Что такое антитело, иммунный комплекс? 
Антитело – это особая молекула, расположенная на поверхности иммунной клетки. Именно антитело и связывается с антигенами подозрительной клетки. Далее антитело передает информацию внутрь клетки, где происходит опознавание, и получает обратный сигнал двух видов «свой» или «чужой». При сигнале «свой» антитело разрушает связь с антигеном и отпускает клетку.
Что такое иммунный комплекс?
При сигнале «чужой» ситуация разворачивается иначе. Антитело не разрывает связь с антигеном, а наоборот, посылая специфические сигналы, вызывает «подкрепление». Биологически это означает, что другие антитела, находящиеся в другой части клетки, начинают перемещаться к участку, откуда идет сигнал опасности, и также образуют связь между собой и пойманным антигеном. В конце концов, антиген оказывается, окружен со всех сторон и прочно привязан.Такой комплекс антиген + антитело называется иммунный комплекс. С этого момента начинается утилизация антигена. Но сейчас подробности процесса нейтрализации антигена нас не интересуют.
Виды антител (IgA, IgM, IgG, IgD, IgE) 
Существуют 5 типов иммуноглобулинов (Ig), которые связываются с разными видами антигенов в разных местах человеческого организма (например, на коже, на слизистых, в крови и т. д.). То есть антитела имеют разделение труда. Эти иммуноглобулины называются буквами латинского алфавита – A, M, G, D, E и обозначаются следующим образом – IgA, IgM, IgG, IgD, IgE.
В диагностике используют только один вид антител, который наиболее специфичен в отношении определяемого микроба. То есть связывание данного вида антител с определяемым антигеном происходит всегда. Чаще всего применяются IgG и IgM.
Именно этот принцип иммунной реакции (уникальная точность и специфичность узнавания определяемого биологического объекта) лежит в основе иммуноферментного анализа.В силу высокой точности антител в узнавании антигенов, точность всего метода иммуноферментного анализа оказывается также высочайшей.
Ферментативная реакция
Перейдем к рассмотрению ферментативной реакции в работе метода иммуноферментного анализа.
Что такое ферментативная реакция?
Ферментативная реакция – это химическая реакция, при которой одно вещество под действием фермента превращается в другое. Вещество, на которое действует фермент,называется субстратом. А вещество, которое получается в результате воздействия фермента, называется продуктом реакции. Причем особенность ферментативной реакции такова, что определенный фермент действует только на определенный субстрат. Такое свойство фермента узнавать «свой» субстрат называется сродством.
Таким образом, каждый фермент проводит только одну, специфичную для него реакцию. Ферментов в биологическом мире известно великое множество, равно как и ферментативных реакций. В иммуноферментной диагностике используется лишь несколько ферментативных реакций – не более 10.При этом выбирали такие ферментативные реакции, продуктом которых являются окрашенные вещества. Почему же продукты ферментативной реакции должны быть окрашенными? Потому что для вычисления концентрации вещества по окрашенному раствору существует простой химический метод – колориметрия.
Метод колориметрии – суть и принцип

Далее измеряют плотность окраски раствора, концентрацию которого выясняют, и по калибровочному графику находят значение концентрации, соответствующее уровню измеренной плотности окраски раствора.В современных автоматических колориметрах только один раз проводят калибровку, далее аппарат сам строит калибровочную кривую, которая остается в памяти прибора, и измерение происходит автоматически.
В иммуноферментном анализе чаще всего применяются следующие ферменты: пероксидаза, щелочная фосфатаза, авидин.
Как же совмещаются иммунологическая и ферментативная реакция в иммуноферментном анализе? Сейчас мы перейдем к рассмотрению собственно иммуноферментного анализа. Какие этапы он включает и что происходит при протекании этих реакций? Иммуноферментный анализ бывает прямой и непрямой.
Прямой иммуноферментный анализ – этапы проведения
В прямом иммуноферментном анализе используют антитела к выявляемому антигену, соединенные со специфической меткой. Эта специфическая метка и есть субстрат ферментативной реакции.
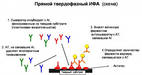
Как проходит прямой иммуноферментный анализ? Берется биологический материал (кровь, соскобы со слизистых, мазки) и помещается в специальные лунки. Биологический материал оставляют в лунках на 15-30 минут, чтобы антигены могли приклеиться к поверхности лунок. Далее в эти лунки добавляют антитела к выявляемому антигену. Это значит, что выявляя антигены, например, сифилиса, добавляются антитела против антигенов сифилиса. Эти антитела получают промышленным способом, а лаборатории покупают уже готовые наборы.Данную смесь исследуемого материала и антител оставляют на некоторое время (от 30 минут до 4-5 часов), чтобы антитела смогли найти и связаться со «своим» антигеном.Чем больше в биологической пробе антигенов, тем больше антител свяжется с ними.
Удаление «лишних» антител
Как было указано, антитела к тому же связаны со специфической меткой.Поскольку антитела добавляются в избытке, то не все они свяжутся с антигенами, а если антигена вообще нет в пробе, то, соответственно, ни одно антитело не свяжется с искомым антигеном. Для того чтобы убрать «лишние» антитела, содержимое из лунок просто выливают. В результате этого все «лишние» антитела убираются, а остаются те, которые связались с антигенами, поскольку антигены «приклеены» к поверхности лунок. Лунки несколько раз ополаскивают специальным раствором, который позволяет вымыть все «лишние» антитела.
Ферментативная реакция – образование окрашенного соединения

Именно так проходит прямой иммуноферментный анализ. Однако сегодня чаще используют непрямой иммуноферментный анализ, поскольку чувствительность и точность непрямого выше, чем прямого. Итак, перейдем к непрямому иммуноферментному анализу.
Непрямой иммуноферментный анализ – этапы проведения
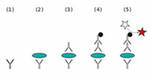
Фиксация антигенов на поверхности лунки и связывание антигена с немеченым антителом
Так же как и для прямого иммуноферментного анализа производится забор биологического материала – кровь, соскобы, мазки. Исследуемый биологический материал вносят в лунки и оставляют на 15-30 минут для приклеивания антигенов к поверхности лунок. Затем в лунки вносят немеченые антитела к антигенам и оставляют на промежуток времени (1-5 часов), чтобы антитела связались со «своими» антигенами и образовали иммунный комплекс (первый этап). После чего удаляют «лишние», не связавшиеся антитела, путем выливания содержимого лунок. Производят промывку специальным раствором для полного удаления всех не связавшихся антител.
Связывание меченого антитела с комплексом антиген + немеченое антитело 
Ферментативная реакция – образование окрашенного соединения
После чего вносят фермент, осуществляющий реакцию превращения «метки» в окрашенное вещество. Окраска развивается в течение 5-30 минут. Затем проводят колориметрию и вычисляют концентрацию окрашенного вещества. Поскольку концентрация окрашенного вещества равна концентрации меченых антител, а концентрация меченых равна концентрации немеченых антител, которая, в свою очередь равна концентрации антигена. Таким образом, получаем концентрацию выявляемого антигена.
Такой двойной контроль в виде использования двух видов антител позволил повысить чувствительность и специфичность метода иммуноферментного анализа. Несмотря на удлинение времени проведения анализа и включение дополнительных этапов, эти потери компенсируются точностью результата. Именно поэтому в настоящее время подавляющее большинство методик иммуноферментного анализа – это непрямой иммуноферментный анализ.
Какие заболевания выявляют методом иммуноферментной диагностики?
Перейдем к рассмотрению того, какие заболевания и какие биологически активные вещества выявляются методом иммуноферментного анализа. Вещества, выявляемые методом иммуноферментного анализа, представлены в таблице.
| Гормоны и маркеры заболеваний щитовидной железы | Тиреопероксидаза (ТПО) |
| Тиреоглобулин (ТГ) | |
| Тиреотропный гормон (ТТГ) | |
| Тироксин (Т4) | |
| Трийодтиронин (Т3) | |
| Свободный тироксин (Т4) | |
| Свободный трийодтиронин (Т3) | |
| Диагностика репродуктивной функции | Лютеинизирующий гормон (ЛГ) |
| Фолликулостимулирующий гормон (ФСГ) | |
| Хорионический гонадотропин (ХГ) | |
| Пролактин | |
| Прогестерон | |
| Эстрадиол | |
| Тестостерон | |
| Кортизол | |
| Стероид связывающий глобулин (ССГ) | |
| Альфафетопротеин (АФП) | |
| Онкомаркеры | Хорионический гонадотропин (ХГ) |
| Простатспецифический антиген (ПСА) | |
| СА – 125 | |
| СА – 19.9 | |
| CYFRA – 21-1 | |
| М – 12 (СА – 15.3) | |
| MUC – 1 (M – 22) | |
| MUC1 (M – 20) | |
| Альвеомуцин | |
| К – цепь | |
| L – цепь | |
| Фактор некроза опухолей (ФНОα) | |
| γ – интерферон | |
| Раково-эмбриональный антиген (РЭА) | |
| Диагностика инфекционных заболеваний | Токсоплазма (IgG, IgM) |
| Краснуха (IgG, IgM) | |
| Цитомегаловирус (IgG, IgM) | |
| Герпес (IgG, IgM) | |
| Туберкулез (IgG, IgM) | |
| Корь (IgG, IgM) | |
| Гепатит Д, Е, А (ВГД, ВГЕ, ВГА) | |
| Гепатит С (ат ВГС, ВГСсore) | |
| Гепатит В (НВs, НВе НВсore) | |
| Уреаплазма (IgG, IgM) | |
| Микоплазма (IgG, IgM) | |
| Хламидия (IgG, IgM) | |
| Микоплазма (IgG) | |
| Сифилис (IgG) | |
| Аспергиллёз (IgG) | |
| Лямблии (IgG) | |
| Helicobacter Pylori (IgG) | |
| Псевдотуберкулез (IgG, IgM) | |
| Кандида (IgG) | |
| Герпес (IgG, IgM) | |
| Эпштейн-Барр (IgG, IgM) | |
| Цитомегаловирус (IgG, IgM) | |
| Диагностика аутоиммунных заболеваний и определение иммунного статуса | IgE – общий |
| С-реактивный белок (СРБ) | |
| Глиадин (IgG, IgA) | |
| IgG4 | |
| Общий IgG | |
| IgG2 | |
| Общий IgA | |
| Секреторный IgA | |
| Общий IgD | |
| Общий IgМ | |
| Циркулирующие иммунные комплексы (ЦИК) | |
| Маркеры заболеваний сердца | Тропонин I |
В таблице приведен далеко не полный перечень анализов (только наиболее распространенные), выполняемых с помощью иммуноферментного анализа. Привести же весь список не представляется возможным, поскольку он будет очень большим и постоянно пополняющимся. Помимо лабораторной диагностики метод иммуноферментного анализа широко используется в научных исследованиях.
Диагностика гельминтоза (глистов) у детей: иммуноферментный анализ
Научная электронная библиотека
Морозова В. С., Габрильянц О. А., Мягкова М. А.,
3.2.3. Иммуноферментный метод (ИФА)
Иммуноферментный анализ (сокращённо ИФА, англ. enzyme-linked immunosorbent assay, ELISA) – лабораторный иммунологический метод качественного или количественного определения различных соединений, макромолекул, вирусов и пр., в основе которого лежит специфическая реакция антиген-антитело. Выявление образовавшегося комплекса проводят с использованием фермента в качестве метки для регистрации сигнала.
Твердофазный ИФА был предложен в 1971 году. Основные принципы твердофазного ИФА, независимо от модификации, заключаются в следующем:
1. На 1 этапе реакции адсорбируют антигены или антитела на твердой фазе. При этом не связавшиеся с твердой фазой реагенты легко удаляются отмыванием.
2. В сенсибилизированных лунках инкубируют исследуемый образец. В лунках с положительным контролем – стандартные реагенты. При этом на поверхности твердой фазы формируются иммунные комплексы. Несвязавшиеся компоненты удаляют отмыванием.
3. При добавлении конъюгата антитело-фермент или антиген-фермент и связывании его с иммобилизованным иммунным комплексом активный центр фермента остается доступным для последующего взаимодействия с субстратом. Инкубация субстрата в лунках с иммобилизованным конъюгатом приводит к развитию цветной реакции. Эту реакцию можно остановить на нужной стадии, выраженность окрашивания можно оценить визуально или по оптической плотности.
Из-за разнообразия объектов исследования – от низкомолекулярных соединений до вирусов и бактерий, и многообразия условий проведения ИФА существует большое количество вариантов этого метода.
Одним из принципов классификации методов ИФА является их разделение по типу проводимых на каждой из иммунохимических стадий реакций. В соответствии с эти все методы можно разделить на две группы –
гомогенные и гетерогенные. Если в ходе выполнения анализа все реакции, включая ферментативную стадию, протекают в растворе, то метод является гомогенным. Гетерогенный ИФА объединяет методы, в которых анализ проводится в двухфазной системе, при этом разделение на фазы может происходить на любой стадии определения [16].
В настоящее время EMIT (гомогенный ИФА) широко распространен во всем мире наряду с твердофазным ИФА (тИФА). EMIT по сравнению с тИФА является более экспрессным (до 2-х минут) и менее трудоемким, хотя менее чувствительный, и поэтому используется только в качественном анализе.
Возможна также классификация по типу иммунохимического взаимодействия на первой стадии анализа (в которой происходит связывание определяемого вещества). Если в системе присутствуют только анализируемое соединение и соответствующие ему центры связывания (антиген и специфические антитела), то метод является неконкурентным. Если же на первой стадии в системе одновременно присутствует анализируемое соединение и его аналог (меченное ферментом анализируемое соединение или анализируемое соединение, иммобилизованное на твердой фазе), конкурирующие за ограниченное количество центров специфического связывания, то метод является конкурентным.
Рис. 10. Конкурентный (а) и неконкурентный (б) ИФА
Примером неконкурентного формата ИФА является «сэндвич»-метод. К носителю с иммобилизованными антителами добавляют раствор, содержащий анализируемый антиген. В процессе инкубации на первой стадии на твердой фазе образуется комплекс антиген-антитело. Затем носитель отмывают от несвязавшихся компонентов и добавляют меченные ферментом специфические антитела. После вторичной инкубации и удаления избытка конъюгата антител с ферментом определяют ферментативную активность носителя, которая пропорциональна начальной концентрации исследуемого антигена. На стадии выявления специфического иммунокомплекса антиген оказывается как бы зажатым между молекулами иммобилизованных и меченных антител, что послужило поводом для широкого распространения названия «сэндвич»-метод.
Ферментативная реакция (цветная реакция) проходит в присутствии перекиси водорода и субстрата, представленного неокрашенным соединением, которое в процессе пероксидазной реакции окисляется до окрашенного продукта реакции на заключительном этапе проведения исследования. Интенсивность окрашивания зависит от количества выявленных специфических антител. Результат оценивается спектрофотометрически или визуально.
«Сэндвич»-метод может быть использован для анализа только тех антигенов, на поверхности которых существуют, по крайней мере, две антигенные детерминанты. На этом формате основано большое количество тест-систем для иммуноферментной диагностики различных инфекций: ВИЧ-инфекция, вирусные гепатиты, цитомегаловирусная, герпесная, токсоплазменная и другие инфекции.
Другим типом классификации схем ИФА является разделение по типу определения концентрации анализуемого вещества:
1) прямое определение образовавшихся иммунокомплексов (аналитический сигнал прямо пропорционален концентрации определяемого вещества) – прямой ИФА;
2) определение концентрации оставшихся свободными, т.е. не вступившими в реакцию компексообразования антител – непрямой ИФА.
Так, среди конкурентных схем твердофазного ИФА существует два основных формата:
Прямой конкурентный формат ИФА использует в качестве меченного ферментом реагента одного из участников иммунохимической реакции (рис. 3) – определяемое соединение или специфический к нему диагностический реагент (антитела). В результате схема ИФА состоит из 3-х стадий:
– сорбции (иммобилизации) специфических антител, либо конъюгата антигена,
– аналитической стадии: конкурентной реакция Аг-Ат с участием меченого ферментом реагента (антигена или антител),
– фермент-субстратной реакции, в результате которой образуется окрашенный (или люминисцентный) продукт.
Например, на полистирольный планшет иммобилизуют специфические антитела (рис. 11 в) иммобилизованые на твердой фазе специфические антитела. На второй стадии к иммобилизованным антителам добавляют раствор, содержащий определяемое вещество и фиксированную концентрацию меченого антигена, инкубируют и после отмывки носителя от несвязавшихся компонентов регистрируют ферментативную активность образовавшихся на твердой фазе специфических иммунных комплексов. В этой схеме меченый ферментом и немеченый антиген конкурируют за связывание с иммобилизованными специфическими антителами.
Рис. 11. Виды конкурентного ИФА:
а – непрямой конкурентный ИФА с иммобилизацией конъюгата антигена с высокомолекулярным веществом и использованием меченых антивидовых антител; б – непрямой конкурентный ИФА с иммобилизацией конъюгата антигена с высокомолекулярным веществом и использованием меченых специфических антител; в – прямой конкурентный ИФА с иммобилизацией специфических антител и использованием меченого антигена (аналита)
Преимуществом прямой схемы является небольшое число стадий, что позволяет легко автоматизировать анализ. К недостаткам схемы относятся сложность методов синтеза ферментных конъюгатов, а также возможное влияние компонентов образца на активность фермента.
В непрямом конкурентном формате ИФА используются меченные ферментом антитела (специфические или вторичные) и иммобилизованный на твердой фазе конъюгат антиген-белок-носитель
(рис. 11 а, б). Непрямая схема с использованием меченых антивидовых антител является одной из наиболее распространенных схем ИФА (рис. 11 а). На поверхности носителя иммобилизуют конъюгат антиген-белок, к которому добавляют раствор, содержащий определяемый антиген и фиксированную концентрацию немеченых специфических антител, инкубируют и после удаления несвязавшихся компонентов добавляют фиксированную концентрацию меченых антивидовых антител. После инкубации и отмывки носителя детектируют ферментативную активность образовавшихся на твердой фазе специфических иммунных комплексов. Величина аналитического сигнала в этом случае находится в обратно-пропорциональной зависимости от концентрации определяемого антигена.
Применение универсального реагента – меченых антивидовых антител – даёт возможность выявлять антитела к разным антигенам. Кроме того, анализируемый образец и меченый реагент вводятся в систему на разных стадиях, что устраняет влияние различных эффекторов, содержащихся в образце, на каталитические свойства ферментной метки. Однако такая схема анализа усложняет его проведение из-за введения дополнительных стадий.
ИФА наркотических веществ и их метаболитов в биологических жидкостях и тканях широко используется в ХТЛ, бюро судмедэкспертизы, клинико-диагностических лабораториях, медицинских центрах. Чаще всего применяется полуколичественный вариант методики, т.к. в большинстве случаев необходимо дать заключение о том, превышает ли уровень метаболитов ПАВ в образце определенную пороговую концентрацию. Однако метод ИФА может использоваться (и используется в некоторых случаях) для количественного определения метаболитов ПАВ с высокой чувствительностью – до 10–9 г/л.
Отдельно следует выделить иммунохимический метод выявления фактов употребления наркотиков в отдаленные промежутки времени (до 4 месяцев после последнего употребления ПАВ), основанный на определении антител к наркотическим веществам в крови человека [4, 5]. Данный метод использует прямую неконкурентную схему ИФА.
Компоненты, используемые в ИФА
Ферментные метки обладают чрезвычайно мощным каталитическим действием, одна молекула фермента может реагировать с большим количеством молекул субстрата. Таким образом, фермент, присутствующий в ничтожных количествах, можно выявить и количественно определить по образованию продуктов катализируемой им реакции. Другое преимущество применения ферментов в качестве меток обусловлено наличием в молекуле многочисленных функциональных групп (сульфгидрильных, карбоксильных, остатков тирозина и др.), через которые можно ковалентно присоединить молекулы лиганда.
В ИФА может использоваться не менее 15 различных ферментов. Наибольшее применение, в соответствии с вышеназванными требованиями, нашли пероксидаза хрена (ПХ), щелочная фосфотаза (ЩФ) и β-D-галактозидаза. Все три стабильны и катализируют высокочувствительные реакции. Кроме того, продукты, получаемые в результате реакций, катализируемых этими ферментами, в зависимости от используемого субстрата, могут выявляться не только колориметрическими методами, но также флуоресцентными методами. Другие ферменты используются значительно реже. Это объясняется их более низкой в сравнении с ПХ и ЩФ удельной активностью.
Выбор субстрата в первую очередь определяется используемым в качестве метки ферментом, так как реакция фермент-субстрат высоко специфична.
Чаще используют хромогенные субстраты, которые, разрушаясь, образуют окрашенное вещество. Перспективным является использование высокоэнергетических субстратов – флуоресцентных, хемилюминесцентных.
3. Антигены и антитела.
Аг и Aт, используемые в ИФА, должны быть высокоочищенными и высокоактивными. Кроме того, Аг должны обладать высокой антигенностью, оптимальной плотностью расположения и количеством антигенных детерминант и гомогенностью. Многие синтетические и рекомбинантные Аг вирусов и бактерий хорошо себя зарекомендовали при использовании в ИФА. Это существенно повысило специфичность и воспроизводимость метода за счет сведения к минимуму перекрестных реакций.
Одним из наиболее важных реагентов в ИФА являются антитела. Чувствительность ИФА зависит от концентрации, активности и специфичности используемых антител. Используемые антитела могут быть поли- или моноклинальными, различного класса (IgG или IgM) и подкласса (IgGl, IgG2), антиаллотипическими или антиидиотипическими. При низкой аффинности Ат распад комплекса Аг-Ат приводит к удалению связанного Аг из системы. Чувствительность и специфичность метода повышается при использовании моноклональных антител. В этом случае появляется возможность обнаруживать низкие концентрации Аг (Aт) в испытуемых образцах.
4. Получение конъюгата.
Конъюгат – это антиген или антитело, «сшитые» с ферментной меткой или белком-носителем. Получение коньюгата – один из важных этапов разработки ИФА.
При синтезе конъюгата с ферментом подбирают такой оптимальный метод введения ферментной метки, чтобы оба компонента конъюгата сохраняли свою биологическую активность: фермент – способность взаимодействовать с субстратом, а антиген или антитело – антигенность и антигенсвязывающую активность, соответственно. Наличие меченого, высокоочищенного антигена позволяет использовать конкурентные методы ИФА. Однако антигены разнообразны по своим физико-химическим свойствам и строению, а значит невозможно разработать универсальные методики для получения конъюгата с антигеном. В этом случае получение конъюгата антигена с ферментом представляет собой отдельную сложную задачу. Приготовление меченых антител для ИФА методически более доступно.
Конъюгирование фермента с иммунохимически активными белками производится различными методами: химическая сшивка, ковалентное связывание молекулы фермента с Аг или Aт и образование соединений через нековалентные связи, например, когда связь между ферментом и Аг или Aт осуществляется иммунологически, через взаимодействие антиген-антитело.
В качестве твердой фазы для проведения ИФА можно применять различные материалы: полистирол, поливинилхлорид, полипропилен и другие вещества. Твердой фазой могут служить стенки пробирки, 96-луночные и др. планшеты, шарики, бусины, а также нитроцеллюлозные и другие мембраны, активно сорбирующие белки.
Иммобилизация антигена или антител на твердой фазе возможна тремя путями:
– пассивная адсорбция, основанная на сильных гидрофобных взаимодействиях между белками и синтетической поверхностью;
– ковалентное прикрепление к твердой фазе;
– иммунохимическое и др. (нековалентное и неадсорбционное присоединение).
Пассивная адсорбция белков широко используется при проведении ИФА на платах для титрования, на нитроцеллюлозных мембранах. Пассивная адсорбция идет по принципу насыщения и коррелирует с молекулярной массой адсорбируемого вещества. В стандартных наборах ИФА используются 96-тилуночные прозрачные полистирольные планшеты.
Рис. 12. Набор для ИФА-определения наркотических еществ в биологических жидкостях: – планшет с нанесенным антигеном; 2 – положительный и отрицательный контрольный образец; 3 – реагент для выявления образовавшихся иммунных комплексов; 4 – растворы буфера для приготовления анализируемых образцов; 5 – раствор буфера для проведения фермент-субстратного окрашивания; – раствор для остановки реакции окрашивания субстрата; – инструкция по применению
Свободные сайты на поверхности твердой фазы, не связавшиеся с сорбируемым агентом, могут фиксировать в ходе теста другие молекулы, в том числе и конъюгаты, что приводит к повышению фонового сигнала. Для предотвращения неспецифического связывания после иммобилизации на твердую фазу основного материала проводят обработку нейтральными для теста веществами. Наиболее популярные блокирующие агенты – бычий сывороточный альбумин (БСА), казеин и др. Выбор блокирующего агента и условия проведения этого этапа зависят от типа твердой фазы, чувствительности системы.
Готовый набор для ИФА-определения наркотических веществ в биологических жидкостях выглядит следующим образом (рис. 12).



