иммуногенность опухоли что это
Иммуногенность опухоли что это
Почечно-клеточный рак (ПКР) наравне с меланомой традиционно считается моделью для изучения новых подходов иммунотерапии. Еще в 2000-х годах предполагалось, что комбинация двух иммунных препаратов – в то время цитокинов – позволит увеличить общую эффективность лечения [1]. В исследованиях предпринимались неоднократные попытки сочетать интерферон и интерлейкин-2 в различных режимах, однако результаты зачастую оказывались настолько противоречивыми, что монотерапия цитокинами так и осталась стандартом того времени [2]. Вторым направлением было изучение комбинаций цитокинов, колониестимулирующих факторов с вакцинами, что тоже не привело к значимому результату.
Спустя десятилетие иммунотерапия сделала новый виток: появились ингибиторы контрольных точек, блокирующие рецепторы-супрессоры или их лиганды на лимфоцитах и опухолевых клетках. Вместе с тем, появились надежды на комбинации нескольких ингибиторов контрольных точек.
Рак почки стимулирует и подавляет иммунную систему
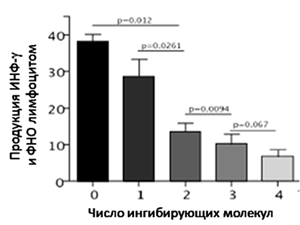
Известно, что ПКР является иммуногенной опухолью. С одной стороны, опухолеассоциированные антигены, находящиеся на клетках рака почки, активируют специфический иммунитет [3]. С другой стороны, система регуляторных механизмов приводит к иммуносупрессии и дезактивации развивающегося противоопухолевого ответа [4]. Ранее было показано, что присутствие иммунных контрольных точек обуславливает агрессивный фенотип ПКР. В частности, экспрессия рецепторов PD-1 и CTLA-4 на клетках, как первичной опухоли почки, так и метастазов, приводит к худшим показателям общей выживаемости больных метастатическим ПКР 6. Также были описаны два агрессивных фенотипа, связанных с лимфоцитами: CD8+PD-1+Tim-3+Lag-3+ и CD25+CD127-Foxp3+/Helios+GITR+ [8]. Примечательно, что чем больше контрольных точек задействовано, тем агрессивнее течение болезни. Еще в 2009 году Blackburn с соавторами показали, что в отсутствие иммуносупрессорных молекул лимфоцит продуцирует большие количества интерферона-гамма и фактора некроза опухоли, являющиеся показателями активности иммунной клетки [9]. При включении двух контрольных точек активность лимфоцита снижается в 2 раза по сравнению с одной и в 3 раза по сравнению с лимфоцитом без инициированных контрольных точек (рисунок 1). Различия в продукции интерферона лимфоцитом между двумя и тремя активными контрольными точками уже достоверно не определяются. Следовательно, можно предположить, что блокада двух контрольных точек является принципиально значимой для активации иммунной системы.
Рисунок 1. Снижение активности лимфоцита при активации ингибирующих молекул (количество от 0 до 4).
Blackburn et al. Nature Immunology 2009 (адаптировано).
Успех иммунотерапии был предопределен в 2015 году
Пять лет назад были опубликованы первые результаты рандомизированного исследования 3 фазы CheckMate 025, в котором изучался ниволумаб [10]. Ниволумаб является моноклональным антителом, действующим на рецептор PD-1. Связывая этот рецептор, ниволумаб приводит к активации лимфоцитов, которые находят опухолевые клетки и поражают их.
В исследовании CheckMate 025 принял участие 821 пациент с метастатическим ПКР и прогрессированием заболевания на первой или второй линии терапии антиангиогенными препаратами. Пациенты были рандомизированы в 2 группы, одна из которых получала ниволумаб (3 мг/кг, внутривенно, каждые 2 недели), а вторая – эверолимус (10 мг внутрь ежедневно).
Основным критерием эффективности была общая выживаемость. Помимо этого проводили оценку объективного ответа, выживаемости без прогрессирования и безопасности применения препарата.
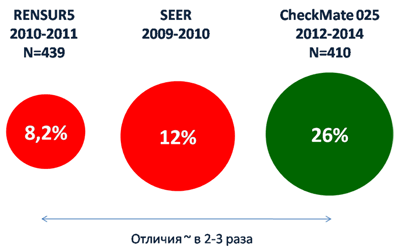
На GU ASCO в 2020 году авторы продемонстрировали окончательные результаты исследования CheckMate 025. Впервые у пациентов с метастатическим ПКР, получавших ингибитор контрольных точек, была проанализирована долгожданная 5-летняя общая выживаемость, которая составила 26%, а ее медиана – 25,8 месяца [11]. Такие показатели, в 2-3 раза превышающие как российские, так и американские результаты, несомненно, впечатляют. Так, в российском исследовании RENSUR5 5-летняя общая выживаемость составила 8,2% (медиана 11 месяцев) [12], а в американской базе SEER – 12% (рисунок 2) [13]. Следует отметить, как в RENSUR5, так и в SEER анализировались пациенты с впервые выявленным распространенным ПКР, в то время как в CheckMate 025 включались пациенты с прогрессированием болезни на стандартной терапии, и даже в этой ситуации результат был лучше.
Рисунок 2. Непрямое сравнение показателей 5-летней выживаемости в российском исследовании RENSUR5,
американской базе данных SEER и исследовании CheckMate 025 (указаны годы включения пациентов).
Частота объективных ответов также была удовлетворительной – 23%. В случае развития ответа на лечение медиана продолжительности ответа составила 18,2 месяца. Медиана выживаемости без прогрессирования была 4,2 месяца.
Нежелательные явления 3-4 степени были зарегистрированы у 19% больных, получавших ниволумаб [10]. За 5 лет частота этих нежелательных явлений увеличилась лишь до 21%, что теоретически свидетельствует об отсутствии долгосрочной токсичности. Из всех нежелательных явлений 3-4 степени у больных из группы ниволумаба чаще всего была усталость (2%). Среди других нежелательных явлений у больных, получавших ниволумаб, были отмечены кашель, тошнота, сыпь, одышка, диарея, запор, снижение аппетита, боли в спине и суставах. С течением времени кардинальных изменений различных видов токсичности также не наблюдалось.
Следовательно, ниволумаб в монотерапии оказался в 5 раз более эффективной терапевтической опцией при токсичности меньшей, чем у таргетных препаратов. Первые результаты этого исследования послужили основанием для разработки комбинации для использования в первой линии терапии.
Настоящее. Двойная иммунотерапия в первой линии
Логичным было после успеха иммунотерапии у пациентов с прогрессированием болезни на традиционных таргетных препаратах изучить эффективность нового метода в первой линии терапии. Более того, целесообразным представлялось использование комбинации ингибиторов, блокирующих две контрольные точки – PD-1 и CTLA-4. Поскольку первая линия терапии вносит максимальный вклад в общую выживаемость пациентов с метастатическим ПКР, и зная, что есть достоверное влияние на продолжительность жизни во второй линии, можно было предположить, что ниволумаб в комбинации с ипилимумабом существенно улучшат общий результат лечения впервые выявленного метастатического рака почки. Наконец, предположим, что если у пациента появились метастазы, то опухолевые клетки ускользнули от иммунного надзора и, следовательно, нужно оказать незамедлительное воздействие на иммунную систему в первой же линии терапии.
В регистрационном рандомизированном исследовании 3 фазы CheckMate 214 [14] не получавшие ранее терапию по поводу светлоклеточного метастатического ПКР пациенты были рандомизированы в группу ниволумаба в комбинации с ипилимумабом (N=550) или в группу сунитиниба, выбранного в качестве препарата сравнения (N=546). Исследование было спланировано так, чтобы оценить эффективность терапии в группе промежуточного и плохого прогноза согласно критериям IMDC. Ниволумаб использовался в дозе 3 мг/кг в комбинации с ипилимумабом в дозе 1 мг/кг каждые 3 недели в количестве 4 доз, далее продолжалась терапия ниволумабом в дозе 3 мг/кг каждые 2 недели. Сунитиниб пациенты получали в стандартном режиме 4/2 в дозе 50 мг. Первичными конечными точками в исследовании были общая выживаемость, выживаемость без прогрессирования и частота объективных ответов в группе пациентов с промежуточным и плохим прогнозом.
Статья предоставлена компанией BMS. Публикуется в редакции авторов.
In nivo veritas: ниволумаб – шаг вперед в прецизионной медицине. XXII Российский онкологический конгресс. Сателлитный симпозиум компании Bristol-Myers Squibb
Покоряя Олимп: путь иммуноонкологии – от PD-L1 к Tumor mutation burden
Руководитель Специализированного центра онкологии, главный онколог клинической больницы № 122, д.м.н., профессор кафедры онкологии Санкт-Петербургского государственного университета, руководитель отделения химиотерапии Санкт-Петербургского клинического онкологического диспансера Рашида Вахидовна ОРЛОВА в начале выступления отметила, что за последнее десятилетие роль прецизионной медицины в онкологии существенно изменилась. Целью современной терапии пациентов со злокачественными новообразованиями является воздействие на внутриклеточные мишени, внутриклеточные сигнальные пути. Человек появляется на свет с врожденным иммунитетом, но раковые клетки подавляют активность иммунной системы в микроокружении опухоли, что обеспечивает выживание и активный рост опухоли. Наиболее изучены два сигнальных пути, позволяющие опухолевым клеткам уклоняться от иммунного ответа, – цитотоксический Т-лимфоцит-ассоциированный антиген 4 (CTLA-4) и рецептор программированной клеточной смерти 1 (PD-1).
Сегодня в иммуноонкологии применяют препараты, направленные на блокаду иммунных контрольных точек CTLA-4 и PD-1/PD-L1 (лиганд рецептора PD-1 на поверхности Т-лимфоцитов). В клинической практике из ингибиторов иммунных контрольных точек, воздействующих на CTLA-4, широкое распространение получил ипилимумаб. Это первый препарат, продемонстрировавший увеличение общей выживаемости при метастатической меланоме. Прогресс в иммунотерапии рака связан также с человеческими моноклональными антителами, селективно блокирующими взаимодействие между PD-1 и его лигандами PD-L1 и PD-L2, пембролизумабом, ниволумабом, атезолизумабом и др. 1
Таким образом, PD-L1-диагностика важна, поскольку влияет на частоту объективного ответа, выживаемость без прогрессирования (ВБП) и общую выживаемость и определяет прогностический потенциал иммунотерапии, что коррелирует с данными клинических исследований и метаанализов. В условиях ограниченных ресурсов определение экспрессии может помочь выбрать кандидатов на проведение иммунотерапии.
В России первым одобренным препаратом для лечения метастатического колоректального рака с высоким уровнем MSI-H/dMMR является ниволумаб.
Таким образом, изучение опухолей и иммунных биомаркеров для выявления потенциальных предикторов опухолевого ответа на иммунотерапию продолжается. Комбинация биомаркеров может иметь значение при выборе иммунотерапии, а их комплексная оценка обеспечивает персонализированный подход к лечению.
Союз титанов: ниволумаб – основа комбинированной иммунотерапии рака легкого
В заключение В.В. Бредер отметил необходимость персонализации подходов к терапии больных раком легкого. Если несколько десятилетий назад рак легкого, в том числе НМРЛ, рассматривался как одно заболевание, то с развитием науки и появлением новых лекарственных препаратов постепенно стали приобретать значимость различия отдельных гистологических типов, с появлением таргетных препаратов – различия генотипов и молекулярных подтипов. Последние два года уже ни у кого не вызывает сомнения, что уровень экспрессии PD-L1 влияет на эффективность иммунотерапии. Все эти маркеры, характеризующие подтипы НМРЛ, имеют важное клиническое значение уже с момента первичной диагностики и планирования терапии. Новый биомаркер – мутационная нагрузка опухоли может стать еще одним маркером, не зависящим от экспрессии PD-L1 и влияющим на выбор терапии пациентов.
Новый подвиг Геракла: ниволумаб в лечении колоректального рака
Главный научный сотрудник отделения клинической фармакологии и химиотерапии НМИЦ онкологии им. Н.Н. Блохина, д.м.н. Алексей Александрович ТРЯКИН подробно рассмотрел применение ниволумаба у пациентов с колоректальным раком (КРР).
Различают два варианта КРР – хромосомно-нестабильный и микросателлитно-нестабильный. Хромосомно-нестабильный вариант характеризуется потерей гетерозиготности, наличием анеуплоидии или полиплоидии, чаще левосторонней локализацией, развитием высокодифференцированной аденокарциномы, слабо выраженной лимфоидной инфильтрацией. Муцинозные опухоли встречаются редко. При микросателлитно-нестабильном КРР имеют место высокий уровень MSI, диплоидия, выраженная лимфоидная инфильтрация, низкодифференцированная аденокарцинома, муцинозные опухоли. Прогноз при микросателлитно-нестабильном КРР более благоприятный, чем при хромосомно-нестабильном. В 5% случаев микросателлитно-нестабильный КРР представлен наследственным неполипозным раком (синдром Линча). Поэтому при выявлении высокого уровня MSI пациента направляют на генетическое обследование. Синдром Линча и мутация BRAF являются взаимоисключающими. Кроме того, в 10% случаев микросателлитно-нестабильный КРР представлен спорадическим раком (метилирование промотера MLH1). В 30–50% случаев спорадический рак сочетается с мутацией BRAF.
Анализ результатов исследования продемонстрировал, что при назначении ниволумаба во второй линии терапии КРР медиана ВБП составила 6,6 месяца, частота ВБП спустя 12 месяцев – 44%. Частота общей выживаемости через 12 месяцев достигла 72%, через 18 месяцев – 67%. Кроме того, преимущество иммунотерапии заключалось в длительности терапевтического эффекта. У пациентов, достигших полного или частичного ответа, прогрессирования заболевания не отмечалось. Объективный ответ на лечение получен у 31% пациентов.
Эффективность ниволумаба не зависела от экспресии PD-L1, мутации BRAF и синдрома Линча.
Профиль безопасности ниволумаба при КРР не отличался от такового при других нозологиях. У 12% пациентов были зарегистрированы серьезные нежелательные явления, связанные с применением препарата. Нежелательные явления, потребовавшие прекращения лечения, наблюдались у 7% больных. В течение последующего 21 месяца наблюдения новых сигналов в отношении безопасности препарата не зафиксировано.
Таким образом, терапия ниволумабом отличается достаточно низкой токсичностью, а также улучшает качество жизни. Клинически значимое улучшение состояния пациентов, получавших терапию ниволумабом, отмечалось в отношении общего соматического статуса, физического функционирования и уменьшения симптомов болезни.
На фоне комбинированной терапии частота объективного ответа составила 55%. При добавлении ипилимумаба к ниволумабу наблюдалась тенденция к увеличению выживаемости больных. Показатели одногодичной ВБП и общей выживаемости составили 71 и 83% соответственно. Но при этом повышалась и токсичность терапии. На фоне терапии двумя препаратами возрастало количество нежелательных явлений 3–4-й степени – с 20 до 32%.
В данном исследовании в другой когорте изучали также эффективность комбинации ниволумаба и ипилимумаба в первой линии терапии мКРР. Ипилимумаб в более низкой дозе 1 мг/кг назначали каждые шесть недель до прогрессирования заболевания, то есть интервалы между введениями были увеличены почти в два раза. При использовании комбинации ниволумаба и ипилимумаба в первой линии терапии частота объективного ответа составила 60%. Соответственно увеличились показатели выживаемости: ВБП – 79%, общая выживаемость – 85%.
Важно отметить, что уменьшение дозы ипилимумаба ведет к значимому снижению токсичности и улучшению переносимости комбинированной терапии. При этом эффективность терапии не снижается.
Согласно последним рекомендациям NCCN по лечению мКРР, в первой линии терапии применяется ниволумаб, пембролизумаб или комбинация ниволумаба и ипилимумаба для ослабленных больных, которые не могут получать активную терапию. Во второй линии иммунотерапия рекомендуется всем пациентам с MSI-H.
Резюмируя сказанное, А.А. Трякин подчеркнул, что определение статуса MSI должно стать стандартом для всех пациентов с КРР. Кроме того, определение уровня MSI является скрининговым тестом для диагностики синдрома Линча.
Дальнейшие исследования позволят расширить базу данных об эффективности и безопасности комбинации ниволумаба и ипилимумаба у пациентов, ранее не получавших лечения, а также у пациентов без микросателлитной нестабильности.
Победа Тесея: ниволумаб в терапии метастатического КРР – первые впечатляющие результаты
Докладчик поделился собственным опытом применения ниволумаба у пациентов с КРР. В течение года было пролечено шесть пациентов с метастатическим КРР. Иммунотерапия ниволумабом продемонстрировала эффективность у четырех пациентов из шести. В настоящий момент они продолжают лечение. У одного пациента во время контрольного обследования отмечалось прогрессирование заболевания, один пациент умер вследствие прогрессирования заболевания.
Пациентка, 40 лет. В августе 2017 г. была госпитализирована со стенозирующей опухолью прямой и сигмовидной кишки с экзофитной формой роста, просвет сужен до 0,6 см. Поводом для обращения за медицинской помощью послужили снижение веса в течение шести месяцев и умеренная общая слабость. При гистологическом исследовании выявлена аденокарцинома G2, при молекулярно-генетическом исследовании – mut KRAS G12D, NRAS, BRAF wild type, MSI-H. Наследственный анамнез: у матери рак толстой кишки. Сопутствующей патологии нет.
Онкомаркеры: раково-эмбриональный антиген (РЭА) – 187 нг/мл, СА 19-9 – 830 Ед/л. По данным магнитно-резонансной томографии (МРТ) – гигантская поперечная опухоль верхнеампулярного отдела прямой кишки, поражение всех слоев стенки кишки и окружающей клетчатки. Увеличение параректальных лимфоузлов до 10 мм. Канцероматоз брюшины с множественными узлами до 23 мм, не исключена инфильтрация наружного слоя передней стенки мочевого пузыря. В правом яичнике солидное образование 41 × 42 × 30 мм. Множественные поражения печени: узловые образования S8/4 – 68 × 59 × 68 мм, S7 – 47 мм (с распадом), S5 – 8,5 мм, S1 – три образования до 25 мм. Диагноз: аденокарцинома прямой кишки с поражением брюшины и печени (cT4N1M1b).
С сентября по ноябрь 2017 г. пациентке проведено четыре курса химиотерапии по схеме FOLFOXIRI. На фоне лечения отмечались прогрессирование заболевания, рост очагов в печени, брюшине. По данным МРТ брюшной полости, малого таза (ноябрь 2017 г.), в печени увеличение очагов S8/4/7 – 97 × 88 × 75 мм, в брюшине – до 32 × 20 мм. Онкомаркеры: РЭА – 217 нг/мл, СА 19-9 – 2300 Ед/л.
С учетом высокого уровня MSI и исчерпанных возможностей химиотерапии больной назначили ниволумаб. С декабря 2017 г. по май 2018 г. выполнено восемь введений препарата в дозе 3 мг/кг каждые две недели. На фоне проводимой терапии был получен частичный регресс опухоли: в печени уменьшение очагов S8/7 – 72 × 63 × 71 мм, в яичнике – уменьшение образования до 15 мм, брюшине – до 23 × 14 мм, прямой кишке – уменьшение протяженности опухоли до 3 см.
В июне 2018 г. пациентке была выполнена центральная резекция печени с сегментэктомией пятого, седьмого и восьмого сегментов и одной из долей первого сегмента. При гистологическом исследовании выявлены обширные поля слизистой с хронической воспалительной инфильтрацией по периферии. В слизи – очаги некроза, гигантские многоядерные клетки инородных тел. Элементов злокачественной опухоли не обнаружено. Сделан вывод о полном лечебном патоморфозе метастаза аденокарциномы в печени (четвертая степень по Лавниковой).
Спустя восемь дней проведен второй этап хирургического лечения: передняя резекция прямой кишки, надвлагалищная ампутация матки с придатками и резекция большого сальника. Данные гистологического исследования: правый яичник и уплотнения в большом сальнике представлены склерозом с кальцификатами, очаговыми некрозами и озерами слизи. Вывод: полный лечебный патоморфоз очагов в большом сальнике и правом яичнике (четвертая степень по Лавниковой). Исследования микропрепаратов: в стенке толстой кишки и десяти исследованных лимфатических узлах скопления ксантомных клеток, лимфогистиоцитарная инфильтрация, очаговые опухолевые некрозы с клетками-тенями, озерами слизи. В области стеноза фокусы аденокарциномы в поверхностных отделах кишки без инвазии жировой клетчатки. Края резекции без опухолевых клеток. Аденокарцинома прямой кишки с выраженным лечебным патоморфозом (третья степень по Лавниковой).
С 27 июня 2018 г. по настоящий момент терапия ниволумабом продолжается (3 мг/кг каждые две недели). Жалоб и осложнений нет. МРТ брюшной полости и малого таза – без признаков прогрессирования. Онкомаркеры: РЭА – 4,5 нг/мл, СА 19-9 – 3 Ед/л.
Таким образом, у пациентки с неблагоприятным прогнозом в результате применения иммунотерапии ниволумабом наблюдался практически полный регресс гигантского опухолевого процесса.
Пациент, 63 года. В ноябре 2017 г. диагностирована аденокарцинома прямой кишки с синхронным большим поражением печени и брюшины (pT3N1M1b). Молекулярно-генетическое исследование: mut KRAS, NRAS, BRAF wild type, MSI-H. В ноябре 2017 г. – январе 2018 г. больному провели четыре курса химиотерапии по схеме FOLFOX с бевацизумабом. При первом контрольном обследовании в январе 2018 г. зафиксировано прогрессирование заболевания со снижением функционального статуса по шкале ECOG до 4 баллов.
С февраля 2018 г. пациенту назначена терапия ниволумабом (3 мг/кг каждые две недели). К сожалению, в данном случае иммунотерапия была назначена слишком поздно, пациент умер.
Важно подчеркнуть, что своевременность назначения иммунотерапевтического лечения играет ключевую роль в его последующей эффективности.
Иммунотерапия является новой высокоэффективной опцией у пациентов с мКРР с высоким уровнем микросателлитной нестабильности (MSI-H). Рассмотренные клинические примеры, а также накопленные данные свидетельствуют о необходимости изменения существующих схем терапии больных мКРР и применения иммунотерапии на более ранних этапах.
Новым стандартом второй линии терапии пациентов с опухолями различной локализации являются ингибиторы PD-1/PD-L1.
Препарат ниволумаб (Опдиво, Bristol-Myers Squibb, США) представляет собой моноклональное антитело к PD-1. Механизм действия ниволумаба основан на блокировании основных точек иммунного ответа. Действие препарата направлено на активацию иммунной системы для борьбы против опухолевых клеток.
Результаты исследований, полученные в реальной клинической практике, подтверждают данные клинических исследований: на фоне применения ниволумаба достигается высокая частота объективного ответа, улучшается качество жизни, увеличивается общая выживаемость пациентов с тяжелыми формами рака, происходит регресс опухоли даже при массивном опухолевом процессе.
Ниволумаб зарегистрирован в России для терапии метастатической меланомы, немелкоклеточного рака легкого, почечно-клеточного рака, уротелиального рака, плоскоклеточного рака головы и шеи, гепатоцеллюлярного рака, колоректального рака с MSI-H, класической лимфомы Ходжкина.
Иммуногистохимическое определение дифференцировки и гистогенеза опухоли
Описание
Иммуногистохимическое определение дифференцировки и гистогенеза опухоли — исследование биоптата ткани, меченого антителами, под микроскопом. Анализ выполняется для определения тканевого происхождения опухоли и степени дифференцировки. Чем выше степень дифференцировки, тем ниже уровень злокачественности.
ИГХ-исследования проводят после выполнения гистологического исследования.
Иммуногистохимическое исследование
Вид морфологического исследования тканей, полученных в ходе биопсии, и меченых специфическими антителами. В основе метода лежит принцип взаимодействия «антиген-антитело». Ткань, в которой происходит патологический процесс, экспрессирует антигены. При нанесении на образец ткани антител, образуется комплекс «антиген-антитело». Благодаря меткам, он становится доступным для визуализации. Врач-патоморфолог изучает количество клеток, окрашенных маркёром. Он определяет в исследуемой ткани локализацию клеток, гормонов и их рецепторов, ферментов, иммуноглобулинов, компонентов клеток и отдельных генов.
Гистогенез опухоли
Гистогенез опухоли — это тканевое происхождение опухоли. Выявление гистогенеза позволяет определить морфологию опухоли и подобрать лечение. Ведь от происхождения опухоли зависит её чувствительность к процедурам химической или лучевой терапии.
Гистогенез опухоли устанавливается посредством изучения морфологии клеток и их сравнения с различными этапами онтогенетического развития клеток органа и ткани, в которых развилась данная опухоль.
Степень дифференцировки
Степень дифференцировки показывает насколько опухолевая клетка отличается от нормальной по строению и функциям.
Дифференцированные новообразования, как правило, относят к доброкачественным.
В рамках исследования используется панель из 5 антител. При необходимости подбираются дополнительные антитела.
При проведении гистологического исследования в сторонней лаборатории необходимо обязательно предоставить протокол гистологического исследования.
Интерпретация результатов
Ответ выдается в виде описания микропрепарата, применяемых красителей и заключения. Заключение может интерпретировать только врач, направивший на проведение исследования.
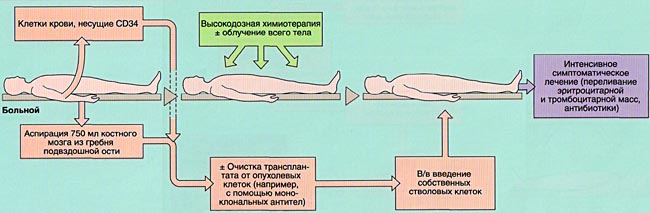
Трансплантация костного мозга и стволовых клеток
Общие принципы
ОБЩАЯ ИНФОРМАЦИЯ О СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТКАХ
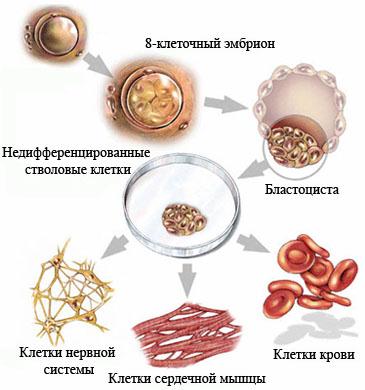
Недифференцированная стволовая клетка, происходящая из бластоцисты, является родоначальницей всех клеток организма, в том числе и стволовой кроветворной клетки (СКК).
Основными свойствами стволовой кроветворной клетки являются возможность дифференцироваться в направлении любого из ростков кроветворения и способность к самоподдержанию.
 Колонии стволовых кроветворных клеток (электронная микроскопия) | 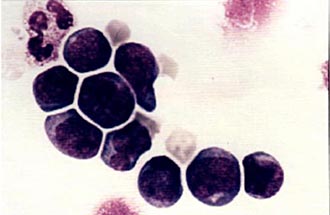 Мононуклеарная фракция, обогащенная клетками CD34, окрашена по Маю-Грюнвальду с докраской по Гимзе. Стволовые клетки, несущие маркер CD34, внешне напоминают малые и средние лимфоциты. |
ИСТОРИЧЕСКАЯ СПРАВКА
Первые работы, посвященные терапевтическому использованию костного мозга, были выполнены в последней декаде XIX века, независимо друг от друга Brown-Sequard, d»Arsonval, Fraser, Billings и Hamilton, которые применяли экстракт костного мозга животных для лечения больных различными видами анемий. Несмотря на положительный эффект, отмеченный всеми авторами, в течение последующих пятидесяти лет использование данной методики носило спорадический характер и не выходило за рамки клинического эксперимента до 1937 года когда Schretzenmayr впервые произвел парентеральное (внутримышечное) введение костного мозга, а в 1939 году Osgood выполнил первое внутривенное введение костного мозга.
Результаты экспериментальных исследований привели клиницистов к идее использования ТКМ при заболеваниях, связанных с поражением костного мозга (лейкозы, апластическая анемия), а также при радиационных воздействиях и проведении химиотерапии, однако основные теоретические и практические проблемы проведения ТКМ удалось преодолеть в 60-е годы. С этого времени ТКМ является одним из методов лечения различных заболеваний крови и иммунной системы.
ВИДЫ ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
Разновидностью АллоТКМ является сингенная ТКМ (трансплантация от однояйцевого близнеца).
ПОКАЗАНИЯ К ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
С развитием появлением колониестимулирующих факторов и развитием технологий клеточной сепарации с 70-х годов для получения гемопоэтических клеток крови вмести костного мозга стали использовать стволовые клетки периферической крови.
Применение клеточных сепараторов значительно упростило проведение процедуры получения стволовых клеток крови, уменьшило число осложнений связанных с дачей наркоза и травматическим повреждения костной ткани.
Еще одним потенциальным источником СКК является пуповинная кровь, основным преимуществом которой является меньшая иммуногенность, однако малое количество стволовых клеток в материале ограничивает ее применение и используется преимущественно в педиатрии или у пациентов с массой тела до 50 кг.
Методика проведения миелотрансплантации различается в зависимости от ее вида (аллогенная или аутологичная), нозологической формы заболевания и ряда других факторов.
ПРАКТИЧЕСКИЕ АСПЕКТЫ МИЕЛОТРАНСПЛАНТАЦИИ
ОПРЕДЕЛЕНИЕ ПОКАЗАНИЙ И ПРОТИВОПОКАЗАНИЙ
Наиболее частыми показаниями к ТКМ/ТСКК являются онкогематологические и гематологические заболевания (лейкозы, злокачественные лимфомы, апластическая анемия, врожденные иммунодефициты и нарушения метаболизма).
Чаше всего ТКМ или ТСКК проводится во время полной ремиссии (ПР), частичной ремиссии (ЧР) или при рецидиве опухоли, чувствительном к химиотерапии. При первичной резистентности к цитостатической терапии результаты ТКМ резко ухудшаются, поэтому в этих случаях операция выполняется относительно редко.
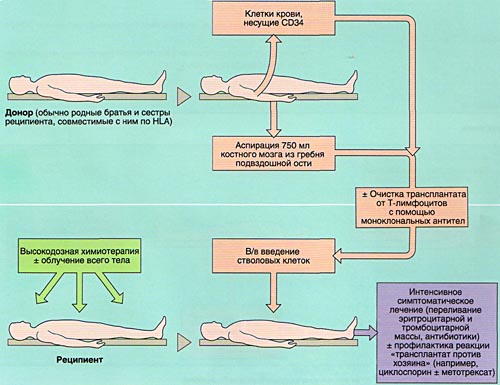
ВЫБОР ДОНОРА
Совместимость костного мозга определяет результаты АллоТКМ. Родственными донорами считаются совместимые по системе HLA братья или сестры реципиента (сибсы). Родители и дети гаплоидентичны (имеют одну общую хромосому из каждой пары, т. е. совпадают между собой на 50%) и не могут быть донорами аллогенного костного мозга. Совместимые сибсы имеются лишь у 20-25% больных, в связи с чем в последние 10 лет активно внедряется АллоТКМ от неродственных HLA-идентичных доноров или частично совместимых родственных доноров.
МОБИЛИЗАЦИЯ, ОБРАБОТКА И ИНФУЗИЯ СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТОК
 А) |  Б) |
А) специальный сосуд (дюар) с жидким азотом для транспортировки контейнеров с костным мозгом
Б) извлеченный из сосуда контейнер с костным мозгом
Инфузия аллогенного, размороженного аутологичного костного мозга или СКК периферической крови проводится внутривенно, капельно после предварительного введения антигистаминных препаратов для предотвращения аллергических реакций.
ИММУНОСУПРЕССИВНАЯ ТЕРАПИЯ (КОНДИЦИОНИРОВАНИЕ)
ПРОФИЛАКТИКА И ЛЕЧЕНИЕ ОСЛОЖНЕНИЙ ПЕРИОДА ЦИТОПЕНИИ
Вскоре после окончания кондиционирования и введения СКК у больного развивается аплазия костного мозга (период отсутствия костного мозгового кроветворения), которая проявляется практически полным отсутствием клеток крови (панцитопенией) и продолжается в среднем 4 недели. Этот период опасен развитием тяжелых осложнений (инфекции, кровоточивость и т.д.).
Основную опасность в периоде цитопении представляют инфекционные осложнения, поэтому их профилактика, своевременное и адекватное лечение являются необходимым условием успешной ТКМ.
Также по показаниям проводится переливание компонентов крови (эритроцитарная масса, тромбомасса, плазма).