иммуногенность вакцины что это
Что означает иммуногенность применительно к вакцинам от COVID-19?
Для борьбы с пандемией COVID-19 ученые во всем мире неустанно работают над созданием вакцин против вируса SARS-CoV-2. Одним из этапов процесса разработки вакцины, предшествующим оценке и получению одобрения со стороны регулирующих органов, является проведение клинических исследований. Клинические исследования призваны подтвердить, что препарат безопасен, а также сделать вывод о его эффективности и иммуногенности1.
Эффективность демонстрирует, насколько хорошо работает вакцина. Она измеряется через способность вакцины предотвратить развитие заболевания1. Для COVID-19, который нередко приводит к серьезным осложнениям, показатели эффективности включают количество случаев бессимптомного протекания болезни у заразившихся, наличие симптомов и их характер, количество госпитализаций и смертей. Для каждого из этих показателей эффективность определяется путем сравнения данных в группе участников исследования, получивших вакцину, с данными в группе, получавшей плацебо. Если в ходе исследования количество заражений, госпитализаций или смертей в группе плацебо достоверно выше, чем в группе, получившей вакцину против COVID-19, можно сделать вывод о том, что вакцина эффективна2.
Более сложным инструментом для оценки того, насколько хорошо работает вакцина, является иммуногенность. Она показывает, какой иммунный ответ вызывает вакцина и как он меняется со временем2.
Принцип работы вакцин состоит в том, что они учат организм распознавать чужеродные элементы (патогены или микроорганизмы – возбудители различных заболеваний) и активировать иммунную систему через введение в организм либо части возбудителя заболевания, либо его инактивированной формы. При этом организм реагирует на инфекцию, не подвергаясь заражению. Благодаря этому в случае естественного столкновения с возбудителем заболевания иммунная система быстрее и эффективнее среагирует на него, чем в случае, если бы она не была активирована3. При измерении иммуногенности оценивается, какие типы иммунных ответов активируются, а также как меняется сила иммунного ответа с течением времени. Этот анализ не только дает информацию о том, насколько хорошо работает вакцина, но и может помочь при расчете дозировки препарата и определении оптимального графика вакцинации1.
При этом оценка иммуногенности – комплексный процесс, сопряженный для ученых с рядом сложностей. В случае вируса SARS-CoV-2, который пока недостаточно изучен, их становится еще больше. Главная сложность состоит в том, чтобы определить, какой именно иммунный ответ, вызванный вакциной, следует считать достаточным.
Чтобы определить способность вакцины вызывать сильный и устойчивый иммунный ответ его сравнивают с реакцией людей, у которых уже есть иммунитет к заболеванию. Если реакция, вызываемая вакциной, сопоставима или сильней, чем реакция, вызываемая естественным иммунитетом, то такая вакцина обещает быть эффективной1. Однако в отношении COVID-19 ученые до конца не выяснили, что именно представляет собой эффективный естественный иммунный ответ. Без этого трудно однозначно оценить иммунный ответ, вызванный вакциной. Ориентиром в данном случае могут быть результаты первых исследований, а также знания о других коронавирусах, таких как SARS. В частности, в ходе доклинических исследований было выяснено, что антитела, особенно те, которые способны связаться с шиповидным белком вируса SARS-CoV-2 и не допустить проникновение вируса в клетки, известные как нейтрализующие антитела, являются частью механизма защиты от инфекции. Вместе с тем на данный момент неизвестно, какой уровень (титр) антител необходим для эффективной защиты. Недавние исследования также показали, что количество нейтрализующих антител, образующихся при естественном иммунитете, может уменьшаться в течение нескольких месяцев. Несмотря на то, что данный вывод не стал неожиданностью, пока неизвестно, какое влияние это окажет на продолжительность иммунного ответа.
Также было выяснено, что в формировании иммунитета к вирусу SARS-CoV-2 участвуют Т-клетки, которые активируют другие защитные реакции иммунной системы или непосредственно нейтрализуют патогены, что подтверждается фактом наличия специфических Т-клеток как у тех, у кого инфекция протекала бессимптомно, так и у тех, кто выздоровел. При этом конкретный тип и количество Т-клеток, необходимых для защиты, все еще неизвестны4.
При измерении иммуногенности ученые рассматривают два ключевых аспекта иммунного ответа:
Антитела способны связываться с поверхностью патогена. За счет этого иммунным клеткам подается сигнал, что патоген необходимо нейтрализовать, и стимулируется выработка белков комплемента, что дополнительно способствует разрушению возбудителя. Кроме того, антитела подавляют инфицирующую способность вируса, связываясь с патогеном и блокируя молекулы, необходимые для его проникновения в клетки, тем самым нейтрализуя его5. Это второй тип антител — нейтрализующие антитела, — которые рассматриваются как потенциальные факторы защиты от инфекции. В то же время при естественном заражении вирусом SARS-Cov-2 появляются и другие виды антител6. Люди, которые никогда не контактировали с возбудителем, будут иметь чрезвычайно низкий фоновый уровень антител, способных связываться с вирусом, и таких людей называют серонегативными. Люди, которые ранее подвергались воздействию возбудителя естественным путем или путем вакцинации, могут иметь высокий уровень антител, способных связывать его, и считаются серо-положительными. Общий уровень продуцируемых человеком антител можно измерить с помощью таких методов, как иммуноферментный анализ, а специфические нейтрализующие антитела можно проверить с помощью методов нейтрализации вируса.
Т-клетки выполняют множество функций при активации иммунного ответа: они участвуют в активации других иммунных клеток, выработке цитокинов — секретируемых факторов, которые могут активировать или ингибировать различные процессы иммунного ответа. Помимо этого, Т-клетки могут непосредственно уничтожать инфицированные или аномальные клетки5. Измерить уровень Т-клеток сложней, чем измерить уровень антител, однако с помощью иммуноферментного спот-анализа можно определить, какие типы Т-клеток присутствуют в организме и на каком уровне.
Вторая серьезная проблема, с которой сталкиваются ученые при оценке иммуногенности вакцин, – это отсутствие глобальных стандартов такой оценки. Из-за той поспешности, с которой ученые всего мира приступили к работе над вакцинами, было невозможно заранее согласовать точные методики используемых тестов. Существует несколько типов иммуноанализа, которые можно использовать для измерения того или иного аспекта иммунного ответа, например, количества нейтрализующих антител, и для каждого варианта могут использоваться разные наборы реагентов и разные процессы скрининга. Из-за разнообразия методик тестирования, используемых в лабораториях по всему миру, в настоящее время не установлены четкие показатели, которые бы указывали на наличие защитного иммунного ответа. Разница в методиках и показателях, в свою очередь, означает, что в настоящее время ученые и регуляторные органы фактически не могут сравнивать вакцины на основе соответствующих данных об иммуногенности, поскольку для каждой вакцины данные получают на основании разных методик тестирования, в разных лабораториях и без использования единых стандартов для сравнения2.
Со временем методики будут стандартизированы, что позволит научному сообществу лучше понять иммунный ответ на вирус SARS-CoV-2 и продолжить разработку вакцин и терапевтических средств от COVID-192. Компания «АстраЗенека» намерена продолжить сотрудничество с учеными, правительствами и многосторонними организациями по всему миру, чтобы обеспечить соблюдение надежных научных стандартов и расширить научные знания о вирусе SARS-CoV-2.
Пресс-релиз подготовлен на основании материала, предоставленного организацией. Информационное агентство AK&M не несет ответственности за содержание пресс-релиза, правовые и иные последствия его опубликования.
Иммуногенность вакцины что это
Экспериментальные исследования в эпидемиологии, основанные на иммунологических тестах, также исходят из сравнительного изучения уровня иммунитета в опытных и контрольных группах лиц. Способность того или иного препарата вызывать выработку иммунитета у привитых называют его профилактической активностью. В тех случаях, когда имеется полная корреляция между уровнем гуморальных антител и их защитной способностью (как, например, при анатоксинах), определение коэффициента эффективности не составляет особого труда.
Для этого в тех или иных реакциях иммунитета определяют число лиц, которые в результате иммунизации приобрели антитела в защитных титрах. При необходимости сравнительной оценки двух или более препаратов процентное соотношение таких лиц к числу привитых каждым из препаратов и будет являться количественным выражением профилактической активности препарата, т. е. коэффициентом его эффективности. При этом следует быть уверенным, что определенный уровень иммунитета является свидетельством защищенности человека от данного заболевания и, конечно, в том, что выбранная методика определения антител является вполне надежной.
Приведенные примеры свидетельствуют о том, что при оценке ряда профилактических препаратов мы можем избежать необходимости постановки дорогостоящих и сложных эпидемиологических опытов. Кроме того, следует учитывать и то, что с каждым годом уровень заболеваемости основными нозологическими формами становится все ниже, а потому и проведение эпидемиологических наблюдений все труднее. Нельзя не согласиться с И.И.Шатровым (1965), который указывал, что значение иммунологических исследований в современных условиях для изучения эффективности все увеличивающегося количества профилактических препаратов все возрастает.
Однако когда речь идет о новом препарате, впервые предлагаемом для борьбы с той или другой инфекцией, оценка его эффективности должна проводиться в условиях контролируемого эпидемиологического опыта. Организация такого опыта должна способствовать получению достоверных ответов на вопросы о защитной способности данного препарата непосредственно для человека, степени его иммуногенности, а также, что очень важно, есть ли корреляция между показателями иммунитета и эпидемиологической эффективности. Если такая корреляция есть, то последующее изучение может быть ограничено рамками иммунологического изучения.
Для правильной постановки любого иммунологического опыта необходимо соблюдение условий, обязательных для контролируемых опытов, что обеспечит достоверность получаемых результатов.
Сыворотки следует хранить в замороженном состоянии, причем замораживанию должны быть подвергнуты все образцы как ранее собранных сывороток, так и свежих. В этом случае если и наблюдается уменьшение активности сывороток, то оно имеет равное значение для сывороток, полученных в разные сроки.
Первые сыворотки должны собираться непосредственно перед вакцинацией. Сроки забора вторых сывороток определяются исходя из иммунологической характеристики инфекции, против которой направлен препарат. Обычно второе взятие сыворотки крови производится не ранее чем через 30 дней после вакцинации.
Иммуногенность новой гриппозной вакцины
Грипп и гриппоподобные заболевания занимают первое место по частоте и количеству случаев в мире. Эпидемия гриппа ежегодно приходит с наступлением осенне-зимнего сезона, и каждый раз иммунная система не готова к встрече с
Грипп и гриппоподобные заболевания занимают первое место по частоте и количеству случаев в мире. Эпидемия гриппа ежегодно приходит с наступлением осенне-зимнего сезона, и каждый раз иммунная система не готова к встрече с ним. Почему? Грипп является чемпионом среди вирусов по способности к генетической изменчивости, которая позволяет ему уходить от иммунного надзора. Вирус с изменившимися поверхностными белками уже не распознается специфическими противогриппозными антителами к штаммам-предшественникам.
Наиболее эффективным, безопасным и экономически оправданным средством профилактики гриппа является вакцинация. Чтобы вакцина защищала от гриппа, должно быть четкое соответствие вакцинных штаммов эпидемическим. В отличие от большинства других вакцинных препаратов, существует необходимость ежегодного обновления штаммового состава противогриппозных вакцин и, следовательно, необходимость ежегодной иммунизации. Проблема гриппа давно вышла за пределы одной страны. Центрами по гриппу ВОЗ, организованными по всему миру, проводится регулярный мониторинг и сбор информации по сезонным циркулирующим штаммам вируса гриппа и вспышкам заболеваемости. На основании анализа присланного материала эксперты делают прогнозы относительно разновидностей гриппа, которые будут циркулировать в следующем эпидсезоне, а также предлагают вирусы-кандидаты в вакцинные штаммы для производителей.
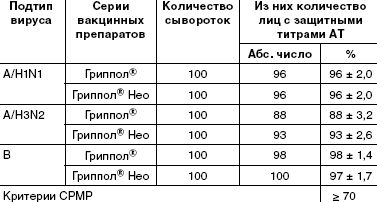
С учетом того, что дифференциальная диагностика гриппа от других ОРВИ затруднена, показатели иммуногенности вакцин принято оценивать по уровню специфических антител к гемагглютинину (ГА). Защитный эффект ГА-специфических антител неоднократно был продемонстрирован как у животных, так и у людей. Антитела нейтрализуют вирус гриппа, предотвращая его связывание с рецепторами, при этом уровень антител к гемагглютинину напрямую коррелирует с уровнем защищенности. При оценке потенциальной эффективности вакцины титр антител не менее чем 1:40 считают защитным. Антитела к другому изменчивому поверхностному белку вируса гриппа — нейраминидазе — не могут предотвратить инфекцию, однако играют важную роль в защите от тяжелых форм гриппа, препятствуя выходу вирусных частиц из инфицированных клеток и дальнейшему распространению вируса в организме. Гемагглютинин и нейраминидаза названы протективными белками, а вакцины, содержащие только эти очищенные белки, — субъединичными.
Современные достижения вирусологии, развитие технологий фармацевтической индустрии, интеграция исследователей разных стран в сфере контроля и борьбы с гриппом позволили вывести на новый уровень разработку и производство гриппозных вакцин. Вакцина Гриппол® Нео — результат международного сотрудничества двух компаний («Солвей Биолоджикалз Б. В.» и ФК «ПЕТРОВАКС»). Эта субъединичная вакцина содержит иммуноадъювант Полиоксидоний® и антигены (гемагглютинин и нейраминидазу) европейского качества, полученные из вируса, выращенного на культуре клеток. Рост вируса для вакцины осуществляется по современной технологии с использованием клеточной линии MDCK (Madine-Darbin Canine Kidney) в бессывороточной среде и является стандартизированным закрытым процессом, исключающим возможность контаминации любыми, в том числе неизвестными агентами. Применение культур клеток для наработки вирусного материала стало уже традиционным для целого ряда вакцинных препаратов. Но только благодаря разработкам специалистов компании «Солвей Биолоджикалз» технология стала доступной и для гриппозных вакцин. В 2001 году была зарегистрирована вакцина Инфлювак ТС (Нидерланды), в 2009 году в России — Гриппол ® Нео.
Снижение антигенной нагрузки в вакцинирующей дозе обеспечивает максимальный профиль безопасности препарата. Антигены с адъювантом образуют комплекс, который стимулирует гуморальное и клеточное звенья иммунитета. Это приводит к образованию специфических к протективным белкам антител, отвечающих за защиту от гриппа, и повышает общую резистентность организма к инфекции.
Клинические исследования безопасности и иммуногенности Гриппол ® Нео проводились с участием добровольцев в высокоспециализированных исследовательских центрах по изучению вакцинных препаратов и поствакцинальных реакций.
Материалы и методы
Вакцины
В клиническом испытании были использованы три инактивированные субъединичные вакцины, содержащие иммуноадъювант Полиоксидоний® и антигены (гемагглютинин и нейраминидазу) актуальных для эпидемического сезона 2008/2009 штаммов вируса гриппа: H1N1 A/Brisbane/59/2007; H3 N2 A/Uruguay/716/2007; B/Florida/4/2006. Два тестируемых препарата представляли собой две серии вакцины Гриппол® Нео производства ООО «ФК «ПЕТРОВАКС», содержащие по 5 либо по 10 мкг гемагглютинина каждого из трех штаммов и 500 мкг Полиоксидония®. В качестве препарата сравнения использовали коммерческую вакцину Гриппол® производства ФГУП «НПО «Микроген», содержащую по 5 мкг ГА штаммов вирусов гриппа типа А (H1N1 и H3N2), 11 мкг гемагглютинина вируса гриппа типа В, 500 мкг Полиоксидония®. Препараты, используемые в исследовании, были контролированы в ГИСК им. Л. А. Тарасевича на соответствие нормативной документации; испытуемые серии Гриппол® Нео и препарат сравнения зашифрованы специалистами ГИСКа, не принимающими участия в данном исследовании. Дешифровка была проведена после завершения клинического исследования и представления всех результатов в ГИСК.
Дизайн исследования
Исследования проведены в соответствии с утвержденными протоколами и согласно разрешению МЗ РФ на клинических базах ФГУ НИИ ДИ Росздрава и ГОУ ВПО СПбГМУ им. ак. И. П. Павлова в соответствии с требованиями Надлежащей клинической практики (GCP).
Дизайн исследования: рандомизированное, двойное слепое, контролируемое сравнительное в параллельных группах. Вакцинация добровольцев проведена после подписания информированного согласия.
Участники были отобраны в соответствии с критериями включения/исключения, определенными протоколом клинического испытания. Всего было вакцинировано 300 здоровых добровольцев в возрасте 18–55 лет (средний возраст — 24,5 ± 0,5 года). Перед прививкой все добровольцы были осмотрены врачом, было проведено измерение температуры тела, артериального давления, женщинам — тест на беременность.
Методом случайного выборочного распределения было сформировано три группы по 100 человек. Вакцинацию проводили однократно в дельтовидную мышцу в объеме 0,5 мл.
Постановка реакции и учет результатов
Парные сыворотки добровольцев, взятые до и через 21 день после вакцинации, исследовали с помощью стандартной методики в реакции торможения гемагглютинации (РТГА), как описано в МУ 3.3.2 1758–03. Постановка РТГА включала следующие этапы: подготовка сывороток, определение гемагглютинирующего титра в РГА и рабочей дозы вируса, постановка самой реакции. Для удаления неспецифических ингибиторов сыворотку обрабатывали RDE по методу, описанному в инструкции к препарату. В качестве рабочей дозы антигена использовалась доза 4АЕ, приготовленная из диагностикумов «Диагностикумы гриппозные для реакции торможения гемагглютинации сухие» (ФСП 42–0321–4042–03) трех штаммов, соответствующих вакцинным. Сыворотки титровали начиная с разведения 1:10. При учете результатов титр 1:1280 — равным 1:1280.
Иммуногенность оценивали в соответствии с требованиями Европейского комитета к противогриппозным вакцинам (СPMP/BWP/214/96), согласно которым должен выполняться по крайней мере один из трех критериев:
Статистика
Результаты исследований статистически обработаны с использованием t-критерия Стьюдента. Вариационный анализ полученных результатов проводили с применением пакета прикладных программ Statistica 6.0.
Результаты и обсуждение
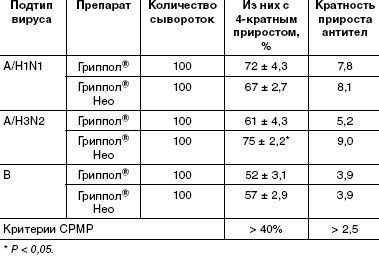
Серологическое обследование с целью оценки иммунологической эффективности вакцинации проводили, сравнивая уровень антител в парных сыворотках, взятых до прививки и на 21-й день после вакцинации. Во всех экспериментальных группах в сыворотках привитых регистрировали статистически достоверное нарастание титров антител. По всем анализируемым критериям не наблюдалось статистически достоверной разницы в иммунном ответе на серии вакцины Гриппол® Нео с различными дозировками антигенов. В таблицах приведены данные, относящиеся к серии, содержащей по 5 мкг гемагглютинина каждого штамма.
Подсчеты числа лиц с серопротекциями (защитными титрами антител (≥ 1:40)) показали, что в каждой группе уровень этих антител соответствует критерию CPMP (табл. 1).
Известно, что человеческая популяция неоднородна по наличию антител к различным штаммам и подтипам вируса гриппа вследствие гриппозных эпидемий и предыдущих вакцинаций. Среди вакцинированных добровольцев выявлены как серонегативные, так и серопозитивные участники (исходно имевшие защитный титр). Представлялось интересным оценить эффективность иммунизации в общей популяции людей (табл. 3).
Выводы и заключение
В настоящее время вакцина Гриппол ® Нео зарегистрирована (РУ № ЛСР-006029/09 от 23.07.2009 г.). Таким образом, семейство вакцин Гриппол ® пополнилось новым полноправным членом, а профилактическая медицина обрела новый инструмент для контроля такого заболевания, как грипп. Гриппол ® Нео стал первой в мире субъединичной адъювантной вакциной с клеточной технологией получения антигенов. При этом впервые вакцинация против гриппа разрешена людям с аллергией на белок куриного яйца. Исследования по расширению показаний к применению вакцины продолжаются.
Е. М. Войцеховская *
В. С. Вакин *, кандидат медицинских наук
А. А. Васильева *
Е. В. Кузнецова *, кандидат биологических наук
Н. И. Лонская **, кандидат медицинских наук
Г. А. Ельшина **, кандидат медицинских наук
М. А. Горбунов **, доктор медицинских наук
А. А. Соминина *, доктор медицинских наук
Ю. А. Зайцева ***
* ГУ НИИ гриппа РАМН, Санкт-Петербург
** ФГУН ГИСК им. Л. А. Тарасевича Роспотребнадзора, Москва
*** ООО ФК «ПЕТРОВАКС», Москва
Ключевые слова: вакцина, грипп, Гриппол ® Нео, клеточная культура
Иммуногенность вакцины что это
«ЭпиВакКорона» – вакцина на основе пептидных иммуногенов против коронавирусной инфекции COVID-19. В этой работе мы продемонстрировали, что иммуногенность вакцины «ЭпиВакКорона» составляет порядка 70%. Также мы показали, что иммунизация этой вакциной не приводит к формированию нейтрализующих антител у здоровых добровольцев. Кроме того, с помощью компьютерного моделирования нами было установлено, что один пептид вакцины, соответствующий участку в рецептор-связывающем домене S-белка вируса SARS-CoV-2, имеет в растворе конформацию, значительно отличающуюся от конформации соответствующего участка в полноразмерном белке. Наконец, с помощью алгоритмов предсказания Т-клеточных эпитопов мы показали, что эпитопы вакцинного белка-носителя и линкерного участка в этом белке обладают наибольшей иммуногенностью среди всех компонентов вакцины.
Криницкий А. А. 2021. Исследование иммуногенности и потенциальной протективности вакцины «ЭпиВакКорона». COVID19-PREPRINTS.MICROBE.RU. https://doi.org/10.21055/preprints-3111948
1. Alexander J. et al. Development of experimental carbohydrate-conjugate vaccines composed of Streptococcus pneumoniae capsular polysaccharides and the universal helper T-lymphocyte epitope (PADRE®) //Vaccine. – 2004. – Т. 22. – №. 19. – С. 2362-2367.
2. Bao Y. et al. Dynamic anti-spike protein antibody profiles in COVID-19 patients //International Journal of Infectious Diseases. – 2021. – Т. 103. – С. 540-548.
3. Bittle J. L. et al. Protection against foot-and-mouth disease by immunization with a chemically synthesized peptide predicted from the viral nucleotide sequence //Nature. – 1982. – Т. 298. – №. 5869. – С. 30-33.
4. Bloomfield G., Kay R. R. Uses and abuses of macropinocytosis //Journal of cell science. – 2016. – Т. 129. – №. 14. – С. 2697-2705.
5. Calis J. J. A. et al. Properties of MHC class I presented peptides that enhance immunogenicity //PLoS Comput Biol. – 2013. – Т. 9. – №. 10. – С. e1003266.
6. Chepurnov A. A. et al. Antigenic properties of SARS-CoV-2/human/RUs/nsk-FRCFtM-1/2020 coronavirus isolate from a patient in Novosibirsk //Jurnal Infektologii. – 2020. – Т. 12. – №. 3.
7. DeLano W. L. et al. Pymol: An open-source molecular graphics tool //CCP4 Newsletter on protein crystallography. – 2002. – Т. 40. – №. 1. – С. 82-92.
8. DiMarchi R. et al. Protection of cattle against foot-and-mouth disease by a synthetic peptide //Science. – 1986. – Т. 232. – №. 4750. – С. 639-641.
9. Farrera-Soler L. et al. Identification of immunodominant linear epitopes from SARS-CoV-2 patient plasma //PloS one. – 2020. – Т. 15. – №. 9. – С. e0238089.
10. Francis J. N. et al. A novel peptide-based pan-influenza A vaccine: a double blind, randomised clinical trial of immunogenicity and safety //Vaccine. – 2015. – Т. 33. – №. 2. – С. 396-402.
11. Goding J. W. Monoclonal antibodies: principles and practice. – Elsevier, 1996.
12. Gonzalez-Galarza F. F. et al. Allele frequency net database (AFND) 2020 update: gold-standard data classification, open access genotype data and new query tools //Nucleic acids research. – 2020. – Т. 48. – №. D1. – С. D783-D788.
13. Ichihashi T. et al. Cross-protective peptide vaccine against influenza A viruses developed in HLA-A* 2402 human immunity model //PloS one. – 2011. – Т. 6. – №. 9. – С. e24626.
14. Jensen K. K. et al. Improved methods for predicting peptide binding affinity to MHC class II molecules //Immunology. – 2018. – Т. 154. – №. 3. – С. 394-406.
15. Kerr M. C., Teasdale R. D. Defining macropinocytosis //Traffic. – 2009. – Т. 10. – №. 4. – С. 364-371.
16. Lamiable A. et al. PEP-FOLD3: faster de novo structure prediction for linear peptides in solution and in complex //Nucleic acids research. – 2016. – Т. 44. – №. W1. – С. W449-W454.
17. Li Y. et al. Linear epitopes of SARS-CoV-2 spike protein elicit neutralizing antibodies in COVID-19 patients //Cellular & molecular immunology. – 2020. – Т. 17. – №. 10. – С. 1095-1097.
18. Maksyutov R. A. et al. (November 18, 2020 – September, 2021) Study of the Tolerability, Safety, Immunogenicity and Preventive Efficacy of the EpiVacCorona Vaccine for the Prevention of COVID-19 // https://clinicaltrials.gov/ct2/show/NCT04780035 – Identifier: NCT04780035. – 2020.
19. Murphy K., Weaver C. Janeway’s immunobiology. – Garland science, 2016.
20. Ni L. et al. Detection of SARS-CoV-2-specific humoral and cellular immunity in COVID-19 convalescent individuals //Immunity. – 2020. – Т. 52. – №. 6. – С. 971-977. e3.
21. Norbury C. C. et al. Class I MHC presentation of exogenous soluble antigen via macropinocytosis in bone marrow macrophages //Immunity. – 1995. – Т. 3. – №. 6. – С. 783-791.
22. Pleguezuelos O. et al. Synthetic Influenza vaccine (FLU-v) stimulates cell mediated immunity in a double-blind, randomised, placebo-controlled Phase I trial //Vaccine. – 2012. – Т. 30. – №. 31. – С. 4655-4660.
23. Poh C. M. et al. Two linear epitopes on the SARS-CoV-2 spike protein that elicit neutralising antibodies in COVID-19 patients //Nature communications. – 2020. – Т. 11. – №. 1. – С. 1-7.
24. Reynisson B. et al. NetMHCpan-4.1 and NetMHCIIpan-4.0: improved predictions of MHC antigen presentation by concurrent motif deconvolution and integration of MS MHC eluted ligand data //Nucleic acids research. – 2020. – Т. 48. – №. W1. – С. W449-W454.
25. Ryzhikov A. B. et al. A single blind, placebo-controlled randomized study of the safety, reactogenicity and immunogenicity of the “EpiVacCorona” Vaccine for the prevention of COVID-19, in volunteers aged 18–60 years (phase I–II) //Russian Journal of Infection and Immunity. – 2021. – Т. 11. – №. 2. – С. 283-296.
26. Ryzhikov A. B. et al. Immunogenicity and protectivity of the peptide vaccine against SARS-CoV-2 //Annals of the Russian academy of medical sciences. – 2021. – Т. 76. – №. 1. – С. 5-19.
27. Skwarczynski M., Toth I. Peptide-based synthetic vaccines //Chemical science. – 2016. – Т. 7. – №. 2. – С. 842-854.
28. Soema P. C. et al. Development of cross-protective influenza A vaccines based on cellular responses //Frontiers in immunology. – 2015. – Т. 6. – С. 237.
29. Soema P. C. et al. Influenza T-cell epitope-loaded virosomes adjuvanted with CpG as a potential influenza vaccine //Pharmaceutical research. – 2015. – Т. 32. – №. 4. – С. 1505-1515.
30. Taboga O. et al. A large-scale evaluation of peptide vaccines against foot-and-mouth disease: lack of solid protection in cattle and isolation of escape mutants //Journal of virology. – 1997. – Т. 71. – №. 4. – С. 2606.
31. Walls A. C. et al. Structure, function, and antigenicity of the SARS-CoV-2 spike glycoprotein //Cell. – 2020. – Т. 181. – №. 2. – С. 281-292. e6.
32. Wang C. Y. et al. Effective synthetic peptide vaccine for foot-and-mouth disease in swine //Vaccine. – 2002. – Т. 20. – №. 19-20. – С. 2603-2610.
33. Yewdell J. W., Reits E., Neefjes J. Making sense of mass destruction: quantitating MHC class I antigen presentation //Nature Reviews Immunology. – 2003. – Т. 3. – №. 12. – С. 952-961.
34. Yi Z. et al. Functional mapping of B-cell linear epitopes of SARS-CoV-2 in COVID-19 convalescent population //Emerging microbes & infections. – 2020. – Т. 9. – №. 1. – С. 1988-1996.
35. Zeng W. et al. Characterization of SARS-CoV-2-specific antibodies in COVID-19 patients reveals highly potent neutralizing IgA //Signal transduction and targeted therapy. – 2021. – Т. 6. – №. 1. – С. 1-3.
36. Zheng Z. et al. Monoclonal antibodies for the S2 subunit of spike of SARS-CoV-1 cross-react with the newly-emerged SARS-CoV-2 //Eurosurveillance. – 2020. – Т. 25. – №. 28. – С. 2000291.
37. Zhou D. et al. Structural basis for the neutralization of SARS-CoV-2 by an antibody from a convalescent patient //Nature structural & molecular biology. – 2020. – Т. 27. – №. 10. – С. 950-958.
38. Лагуткин Д. А., Криницкий А. А. «ЭпиВакКорона» глазами участников испытаний и ученых-биологов / Троицкий Вариант – Наука. – 2021. – №6(325). – С. 10-11, 13.
39. Плоскирева А. А. и др. Первый опыт вакцинопрофилактики коронавирусной инфекции COVID-19 пептидной вакциной «ЭпиВакКорона» //COVID19-PREPRINTS.MICROBE.RU. https://doi.org/10.21055/preprints-3111945. – 2021.
40. Протокол встречи сотрудников Роспотребнадзора, ГНЦ «Вектор» и группы добровольцев / https://epivakorona.com/protokol.vstrechi02022021.htm // epivakorona.com. 2 февраля 2021 года.
41. Роспотребнадзор и ГНЦ «Вектор» ТОП-20 вопросов о вакцине ФБУН ГНЦ ВБ «Вектор» / http://rospotrebnadzor.ru/about/info/news/news_details.php?ELEMENT_ID=15649 // Роспотребнадзор. 27 января 2021 года.
42. Рыжиков А. Б. и др. Вакцинная композиция против коронавирусной инфекции COVID-19 // Патент России №2743595. – 2021. – Бюл. №5
43. Стопкоронавирус.рф – Официальный интернет-ресурс для информирования населения по вопросам коронавируса. – 2021.