иммунология elisa что это
Иммуноферментный анализ
Иммуноферментный анализ (ИФА) — один из видов иммунохимического анализа. Он основан на высокоспецифической иммунологической реакции антигена (АГ) с соответствующим антителом (АТ) с образованием иммунного комплекса. При этом один из компонентов конъюгирован с ферментом. В результате реакции фермента с хромогенным субстратом образуется окрашенный продукт, количество которого можно определить спектрофотометрически.
Любой вариант ИФА содержит 3 обязательные стадии:
В реакции участвуют:
Твердая фаза
В качестве твердой фазы для проведения ИФА можно применять различные материалы: полистирол, поливинилхлорид, полипропилен и другие. Твердой фазой могут служить стенки пробирки, 96-луночные и др. планшеты, шарики, бусины, а также нитроцеллюлозные и другие мембраны, активно сорбирующие белки.
Антигены и антитела
АГ и AT, используемые в ИФА, должны быть высокоочищенными и высокоактивными. АГ должны обладать высокой антигенностью, оптимальной плотностью расположения и количеством антигенных детерминант.
Чувствительность ИФА зависит от концентрации, активности и специфичности используемых антител. Используемые АТ могут быть поли- или моноклональными, различного класса (IgG или IgM) и подкласса (IgG1, IgG2).
Чувствительность и специфичность метода повышается при использовании моноклональных антител. В этом случае появляется возможность обнаруживать низкие концентрации АГ (AT) в образцах.
Ферментные маркеры: наибольшее применение нашли пероксидаза хрена (ПХ), щелочная фосфатаза (ЩФ) и β-D-галактозидаза.
Субстраты
Выбор субстрата, в первую очередь, определяется используемым в качестве метки ферментом, так как реакция «фермент-субстрат» высокоспецифична.
Классификация ИФА
В основу классификации методов ИФА положено несколько подходов:
1 — по типу реагентов, присутствующих на первой стадии ИФА:
2 — по принципу определения исследуемого вещества:
3 — по типу результатов:
Конкурентный ИФА
Конкурентный ИФА для определения антител: искомые антитела и меченые ферментом антитела конкурируют друг с другом за антигены, сорбированные на твердой фазе.
Неконкурентный «сэндвич» – вариант ИФА
Основным достоинством метода является высокая чувствительность, превосходящая возможности других схем ИФА.
Качественный анализ часто используют при скрининговых исследованиях и диагностике инфекционных заболеваний. Результат исследования определяется при сравнении его оптической плотности с расчетной величиной критической оптической плотности (ОПкрит., «Cut-off»).
Формулу для расчета «Cut-off» указывают в инструкции к тест-системе. В расчете «Cut-off» могут участвовать как усредненные значения оптических плотностей положительных и отрицательных контролей, так и оптическая плотность специального контрольного образца — контроля уровня среза.
Если оптическая плотность образца выше, чем Cut-off, образец считается положительным на специфические антитела.
Для полуколичественного варианта проведения методики рассчитывают отношение между средней оптической плотностью образца и оптической плотностью Cut-off.
Образцы рассматриваются как:
Сомнительные результаты анализа нельзя однозначно интерпретировать и для уточнения результата необходимо повторить обследование через 1–2 недели.
Методом ИФА определяют:
Научная электронная библиотека
Морозова В. С., Габрильянц О. А., Мягкова М. А.,
3.2.3. Иммуноферментный метод (ИФА)
Иммуноферментный анализ (сокращённо ИФА, англ. enzyme-linked immunosorbent assay, ELISA) – лабораторный иммунологический метод качественного или количественного определения различных соединений, макромолекул, вирусов и пр., в основе которого лежит специфическая реакция антиген-антитело. Выявление образовавшегося комплекса проводят с использованием фермента в качестве метки для регистрации сигнала.
Твердофазный ИФА был предложен в 1971 году. Основные принципы твердофазного ИФА, независимо от модификации, заключаются в следующем:
1. На 1 этапе реакции адсорбируют антигены или антитела на твердой фазе. При этом не связавшиеся с твердой фазой реагенты легко удаляются отмыванием.
2. В сенсибилизированных лунках инкубируют исследуемый образец. В лунках с положительным контролем – стандартные реагенты. При этом на поверхности твердой фазы формируются иммунные комплексы. Несвязавшиеся компоненты удаляют отмыванием.
3. При добавлении конъюгата антитело-фермент или антиген-фермент и связывании его с иммобилизованным иммунным комплексом активный центр фермента остается доступным для последующего взаимодействия с субстратом. Инкубация субстрата в лунках с иммобилизованным конъюгатом приводит к развитию цветной реакции. Эту реакцию можно остановить на нужной стадии, выраженность окрашивания можно оценить визуально или по оптической плотности.
Из-за разнообразия объектов исследования – от низкомолекулярных соединений до вирусов и бактерий, и многообразия условий проведения ИФА существует большое количество вариантов этого метода.
Одним из принципов классификации методов ИФА является их разделение по типу проводимых на каждой из иммунохимических стадий реакций. В соответствии с эти все методы можно разделить на две группы –
гомогенные и гетерогенные. Если в ходе выполнения анализа все реакции, включая ферментативную стадию, протекают в растворе, то метод является гомогенным. Гетерогенный ИФА объединяет методы, в которых анализ проводится в двухфазной системе, при этом разделение на фазы может происходить на любой стадии определения [16].
В настоящее время EMIT (гомогенный ИФА) широко распространен во всем мире наряду с твердофазным ИФА (тИФА). EMIT по сравнению с тИФА является более экспрессным (до 2-х минут) и менее трудоемким, хотя менее чувствительный, и поэтому используется только в качественном анализе.
Возможна также классификация по типу иммунохимического взаимодействия на первой стадии анализа (в которой происходит связывание определяемого вещества). Если в системе присутствуют только анализируемое соединение и соответствующие ему центры связывания (антиген и специфические антитела), то метод является неконкурентным. Если же на первой стадии в системе одновременно присутствует анализируемое соединение и его аналог (меченное ферментом анализируемое соединение или анализируемое соединение, иммобилизованное на твердой фазе), конкурирующие за ограниченное количество центров специфического связывания, то метод является конкурентным.
Рис. 10. Конкурентный (а) и неконкурентный (б) ИФА
Примером неконкурентного формата ИФА является «сэндвич»-метод. К носителю с иммобилизованными антителами добавляют раствор, содержащий анализируемый антиген. В процессе инкубации на первой стадии на твердой фазе образуется комплекс антиген-антитело. Затем носитель отмывают от несвязавшихся компонентов и добавляют меченные ферментом специфические антитела. После вторичной инкубации и удаления избытка конъюгата антител с ферментом определяют ферментативную активность носителя, которая пропорциональна начальной концентрации исследуемого антигена. На стадии выявления специфического иммунокомплекса антиген оказывается как бы зажатым между молекулами иммобилизованных и меченных антител, что послужило поводом для широкого распространения названия «сэндвич»-метод.
Ферментативная реакция (цветная реакция) проходит в присутствии перекиси водорода и субстрата, представленного неокрашенным соединением, которое в процессе пероксидазной реакции окисляется до окрашенного продукта реакции на заключительном этапе проведения исследования. Интенсивность окрашивания зависит от количества выявленных специфических антител. Результат оценивается спектрофотометрически или визуально.
«Сэндвич»-метод может быть использован для анализа только тех антигенов, на поверхности которых существуют, по крайней мере, две антигенные детерминанты. На этом формате основано большое количество тест-систем для иммуноферментной диагностики различных инфекций: ВИЧ-инфекция, вирусные гепатиты, цитомегаловирусная, герпесная, токсоплазменная и другие инфекции.
Другим типом классификации схем ИФА является разделение по типу определения концентрации анализуемого вещества:
1) прямое определение образовавшихся иммунокомплексов (аналитический сигнал прямо пропорционален концентрации определяемого вещества) – прямой ИФА;
2) определение концентрации оставшихся свободными, т.е. не вступившими в реакцию компексообразования антител – непрямой ИФА.
Так, среди конкурентных схем твердофазного ИФА существует два основных формата:
Прямой конкурентный формат ИФА использует в качестве меченного ферментом реагента одного из участников иммунохимической реакции (рис. 3) – определяемое соединение или специфический к нему диагностический реагент (антитела). В результате схема ИФА состоит из 3-х стадий:
– сорбции (иммобилизации) специфических антител, либо конъюгата антигена,
– аналитической стадии: конкурентной реакция Аг-Ат с участием меченого ферментом реагента (антигена или антител),
– фермент-субстратной реакции, в результате которой образуется окрашенный (или люминисцентный) продукт.
Например, на полистирольный планшет иммобилизуют специфические антитела (рис. 11 в) иммобилизованые на твердой фазе специфические антитела. На второй стадии к иммобилизованным антителам добавляют раствор, содержащий определяемое вещество и фиксированную концентрацию меченого антигена, инкубируют и после отмывки носителя от несвязавшихся компонентов регистрируют ферментативную активность образовавшихся на твердой фазе специфических иммунных комплексов. В этой схеме меченый ферментом и немеченый антиген конкурируют за связывание с иммобилизованными специфическими антителами.
Рис. 11. Виды конкурентного ИФА:
а – непрямой конкурентный ИФА с иммобилизацией конъюгата антигена с высокомолекулярным веществом и использованием меченых антивидовых антител; б – непрямой конкурентный ИФА с иммобилизацией конъюгата антигена с высокомолекулярным веществом и использованием меченых специфических антител; в – прямой конкурентный ИФА с иммобилизацией специфических антител и использованием меченого антигена (аналита)
Преимуществом прямой схемы является небольшое число стадий, что позволяет легко автоматизировать анализ. К недостаткам схемы относятся сложность методов синтеза ферментных конъюгатов, а также возможное влияние компонентов образца на активность фермента.
В непрямом конкурентном формате ИФА используются меченные ферментом антитела (специфические или вторичные) и иммобилизованный на твердой фазе конъюгат антиген-белок-носитель
(рис. 11 а, б). Непрямая схема с использованием меченых антивидовых антител является одной из наиболее распространенных схем ИФА (рис. 11 а). На поверхности носителя иммобилизуют конъюгат антиген-белок, к которому добавляют раствор, содержащий определяемый антиген и фиксированную концентрацию немеченых специфических антител, инкубируют и после удаления несвязавшихся компонентов добавляют фиксированную концентрацию меченых антивидовых антител. После инкубации и отмывки носителя детектируют ферментативную активность образовавшихся на твердой фазе специфических иммунных комплексов. Величина аналитического сигнала в этом случае находится в обратно-пропорциональной зависимости от концентрации определяемого антигена.
Применение универсального реагента – меченых антивидовых антител – даёт возможность выявлять антитела к разным антигенам. Кроме того, анализируемый образец и меченый реагент вводятся в систему на разных стадиях, что устраняет влияние различных эффекторов, содержащихся в образце, на каталитические свойства ферментной метки. Однако такая схема анализа усложняет его проведение из-за введения дополнительных стадий.
ИФА наркотических веществ и их метаболитов в биологических жидкостях и тканях широко используется в ХТЛ, бюро судмедэкспертизы, клинико-диагностических лабораториях, медицинских центрах. Чаще всего применяется полуколичественный вариант методики, т.к. в большинстве случаев необходимо дать заключение о том, превышает ли уровень метаболитов ПАВ в образце определенную пороговую концентрацию. Однако метод ИФА может использоваться (и используется в некоторых случаях) для количественного определения метаболитов ПАВ с высокой чувствительностью – до 10–9 г/л.
Отдельно следует выделить иммунохимический метод выявления фактов употребления наркотиков в отдаленные промежутки времени (до 4 месяцев после последнего употребления ПАВ), основанный на определении антител к наркотическим веществам в крови человека [4, 5]. Данный метод использует прямую неконкурентную схему ИФА.
Компоненты, используемые в ИФА
Ферментные метки обладают чрезвычайно мощным каталитическим действием, одна молекула фермента может реагировать с большим количеством молекул субстрата. Таким образом, фермент, присутствующий в ничтожных количествах, можно выявить и количественно определить по образованию продуктов катализируемой им реакции. Другое преимущество применения ферментов в качестве меток обусловлено наличием в молекуле многочисленных функциональных групп (сульфгидрильных, карбоксильных, остатков тирозина и др.), через которые можно ковалентно присоединить молекулы лиганда.
В ИФА может использоваться не менее 15 различных ферментов. Наибольшее применение, в соответствии с вышеназванными требованиями, нашли пероксидаза хрена (ПХ), щелочная фосфотаза (ЩФ) и β-D-галактозидаза. Все три стабильны и катализируют высокочувствительные реакции. Кроме того, продукты, получаемые в результате реакций, катализируемых этими ферментами, в зависимости от используемого субстрата, могут выявляться не только колориметрическими методами, но также флуоресцентными методами. Другие ферменты используются значительно реже. Это объясняется их более низкой в сравнении с ПХ и ЩФ удельной активностью.
Выбор субстрата в первую очередь определяется используемым в качестве метки ферментом, так как реакция фермент-субстрат высоко специфична.
Чаще используют хромогенные субстраты, которые, разрушаясь, образуют окрашенное вещество. Перспективным является использование высокоэнергетических субстратов – флуоресцентных, хемилюминесцентных.
3. Антигены и антитела.
Аг и Aт, используемые в ИФА, должны быть высокоочищенными и высокоактивными. Кроме того, Аг должны обладать высокой антигенностью, оптимальной плотностью расположения и количеством антигенных детерминант и гомогенностью. Многие синтетические и рекомбинантные Аг вирусов и бактерий хорошо себя зарекомендовали при использовании в ИФА. Это существенно повысило специфичность и воспроизводимость метода за счет сведения к минимуму перекрестных реакций.
Одним из наиболее важных реагентов в ИФА являются антитела. Чувствительность ИФА зависит от концентрации, активности и специфичности используемых антител. Используемые антитела могут быть поли- или моноклинальными, различного класса (IgG или IgM) и подкласса (IgGl, IgG2), антиаллотипическими или антиидиотипическими. При низкой аффинности Ат распад комплекса Аг-Ат приводит к удалению связанного Аг из системы. Чувствительность и специфичность метода повышается при использовании моноклональных антител. В этом случае появляется возможность обнаруживать низкие концентрации Аг (Aт) в испытуемых образцах.
4. Получение конъюгата.
Конъюгат – это антиген или антитело, «сшитые» с ферментной меткой или белком-носителем. Получение коньюгата – один из важных этапов разработки ИФА.
При синтезе конъюгата с ферментом подбирают такой оптимальный метод введения ферментной метки, чтобы оба компонента конъюгата сохраняли свою биологическую активность: фермент – способность взаимодействовать с субстратом, а антиген или антитело – антигенность и антигенсвязывающую активность, соответственно. Наличие меченого, высокоочищенного антигена позволяет использовать конкурентные методы ИФА. Однако антигены разнообразны по своим физико-химическим свойствам и строению, а значит невозможно разработать универсальные методики для получения конъюгата с антигеном. В этом случае получение конъюгата антигена с ферментом представляет собой отдельную сложную задачу. Приготовление меченых антител для ИФА методически более доступно.
Конъюгирование фермента с иммунохимически активными белками производится различными методами: химическая сшивка, ковалентное связывание молекулы фермента с Аг или Aт и образование соединений через нековалентные связи, например, когда связь между ферментом и Аг или Aт осуществляется иммунологически, через взаимодействие антиген-антитело.
В качестве твердой фазы для проведения ИФА можно применять различные материалы: полистирол, поливинилхлорид, полипропилен и другие вещества. Твердой фазой могут служить стенки пробирки, 96-луночные и др. планшеты, шарики, бусины, а также нитроцеллюлозные и другие мембраны, активно сорбирующие белки.
Иммобилизация антигена или антител на твердой фазе возможна тремя путями:
– пассивная адсорбция, основанная на сильных гидрофобных взаимодействиях между белками и синтетической поверхностью;
– ковалентное прикрепление к твердой фазе;
– иммунохимическое и др. (нековалентное и неадсорбционное присоединение).
Пассивная адсорбция белков широко используется при проведении ИФА на платах для титрования, на нитроцеллюлозных мембранах. Пассивная адсорбция идет по принципу насыщения и коррелирует с молекулярной массой адсорбируемого вещества. В стандартных наборах ИФА используются 96-тилуночные прозрачные полистирольные планшеты.
Рис. 12. Набор для ИФА-определения наркотических еществ в биологических жидкостях: – планшет с нанесенным антигеном; 2 – положительный и отрицательный контрольный образец; 3 – реагент для выявления образовавшихся иммунных комплексов; 4 – растворы буфера для приготовления анализируемых образцов; 5 – раствор буфера для проведения фермент-субстратного окрашивания; – раствор для остановки реакции окрашивания субстрата; – инструкция по применению
Свободные сайты на поверхности твердой фазы, не связавшиеся с сорбируемым агентом, могут фиксировать в ходе теста другие молекулы, в том числе и конъюгаты, что приводит к повышению фонового сигнала. Для предотвращения неспецифического связывания после иммобилизации на твердую фазу основного материала проводят обработку нейтральными для теста веществами. Наиболее популярные блокирующие агенты – бычий сывороточный альбумин (БСА), казеин и др. Выбор блокирующего агента и условия проведения этого этапа зависят от типа твердой фазы, чувствительности системы.
Готовый набор для ИФА-определения наркотических веществ в биологических жидкостях выглядит следующим образом (рис. 12).
Тест Elisa / CLIA для обнаружения антител COVID-19
ELISA / CLIA TEST – это серологический тест образца крови, который выявляет антитела к вирусу SARS-CoV-2 количественным образом. Он предоставляет достоверную информацию о двух значениях: антитела типа IgG (перенесенная инфекция) и антитела типа IgM (инфекция в острой фазе).
На сегодняшний день это один из самых надежных тестов, позволяющий узнать, были ли выработаны антитела против COVID-19 или нет. Если результаты показывают наличие антител IgG, это означает, что у пациента была перенесенная инфекция; т. Е. Пациент уже не болен.
Означает ли антитела наличие
иммунитета?
Согласно многочисленным исследованиям и научным данным, наличие антител представляет собой довольно надежный показатель иммунитета. Но на сегодняшний день наличие антител против COVID-19 не гарантирует полного иммунитета против заражения и передачи. Более того, продолжительность действия этих антител индивидуально, поскольку иммунитет работает по-разному у каждого человека.
В настоящее время ведутся исследовния реинфекций и стойкости иммунитета после вакцинации и болезни, но окончательных выводов пока нет. С другой стороны, еще один аспект, который сильно сбивает с толку население, заключается в том, можно ли дифференцировать образование антител путем вакцинации против COVID от образования анти- тел в результате перенесенной болезни. Чтобы раз- решить это сомнение, уже существуют тесты Elisa / CLIA, позволяющие дифференцировать антитела. В настоящее время одобренные вакцины генерируют антитела против белка S1, а естественная инфекция генерирует антитела против спикул (S) и против нуклеокапсида (N).
И еще один большой вопрос от пациентов: если я пройду тест на обнаружение COVID-19 после вак- цинации, будет ли он положительным? Ответ специалистов – НЕТ.
Таким образом, при помощи серологического теста или тест на антитела, которые выработались, можно определить их природу, будь то болезнь или вакцина. Это отличает данный тест от ПЦР и тестом на антигены, которые являются лучшими тестами для выявления заболевания в его острой фазе и с самой высокой вероятностью заражения. Эти тесты обнаруживают генетический материал вируса и его белков соответственно и исключают обнаружение созданных антител.
Таким образом, пациент (вакцинированный или нет) с ПОЛОЖИТЕЛЬНЫМ результатом диагностического теста ПЦР или теста на антигены должен считаться ПОЛОЖИТЕЛЬНЫМ на COVID и должен получить соответствующую медицинскую помощь (изоляция, контроль контактов, лечение). Вероятность ложноположительного результата после вакцинации такая же, как вероятность ложноположительного результата у населения в целом.
В заключение можно сказать, что тест Elisa / CLIA в настоящее время является лучшим тестом для определения наличия антител. А тест ПЦР на сегодняшний день остается наиболее надежным для выявления заболевания как у пациентов с симптомами, так и у бессимптомных пациентов; а тест на антигены остается для подтверждения заражения в случае появления соответствующих симптомов в первые дни заболевания. Что касается иммунитета, то на данный момент не существует теста, который мог бы гарантировать длительный иммунитет, поскольку он продолжает оставаться предметом изучения.
Научное расследование. Что показывает ИФА на специфические IgG к пищевым антигенам?
Используемая терминология.
Антиген (англ. antigen от antibody-generator — «производитель антител») — любое вещество, которое организм рассматривает как чужеродное или потенциально опасное и против которого организм обычно начинает вырабатывать собственные антитела (иммунный ответ). Антитела (иммуноглобулины, ИГ, Ig) — белковые соединения плазмы крови, образующиеся в ответ на введение в организм человека бактерий, вирусов, белковых токсинов и других антигенов. Связываясь с активными участками (центрами) бактерий, грибов или вирусов, антитела нейтрализуют выделяемые ими токсические вещества, препятствуют размножению, обеспечивают их разрушение в реакциях фагоцитоза. Гиперчувствительность (hypersensitivity) – повышенная чувствительность организма к определенным веществам — антигенам. Опосредуется специфическими рецепторами или антителами, находящимися в свободном состоянии или связанными с мембранами клеток, участвующих в иммунной защите или иммунном ответе. Может определенное время иметь латентное присутствие и не проявляться клиническими реакциями. Гиперчувствительность связана с количественными характеристиками антигенов, такими как доза (дозозависимость). Чаще гиперчувствительность является основой развития патологических (аномальных) реакций иммунной системы (ИС) на различные антигены. В таком случае гиперчувствительность – это состояние организма, при котором защитные механизмы иммунной системы, направленные на охрану постоянства внутренней среды организма, не справляются с выводом продуктов метаболитов патологических иммунных реакций из организма в условиях включения всех выделительных систем ( почки, легкие, ЖКТ, слюнные железы, кожа).
Гиперчувствительность Тип I — анафилактический тип или немедленный. В иммунном ответе на антиген синтезируются иммуноглобулины класса Е(IgE), они циркулируют в свободном состоянии и далее фиксируются на Fc-рецепторах, расположенных на базофилах, эозинофилах, тучных клетках. Повторные попадания антигена, вызывает его связывание с фиксированными антителами IgE и ответную дегрануляцию клеток с выбросом медиаторов воспаления, прежде всего гистамина.
Пищевая аллергия (food allergy) – проявляется в виде воспалительных реакций по механизмам «гиперчувствительности I типа» иммунной системы на белки или компоненты пищи, опосредованные иммуноглобулинами класса Е (IgE). Гиперчувствительность тип III – иммунокомплексный тип воспалительных реакций. Характеризуется образованием комплексов в составе антиген + специфическое антитело + компонент комплемента в состоянии циркуляции. Антителами выступают специфические иммуноглобулины классов G (IgG), М (IgM), A(IgA). Образующиеся циркулирующие иммунные комплексы должны быть элиминированы из организма с главной целью — выведение антигена. При хронической нагрузке антигенами и при активном их образовании, циркулирующие иммунные комплексы способны фиксироваться на рецепторах эндотелия мелких сосудов и клетках систем элиминации выделительных систем и вызывать воспалительные реакции к разрушенным аутоантигенам (собственным белкам) и структурам организма. Пищевая непереносимость (food intolerance): 1). Патологические реакции, возникающие на пищу или ее ингредиенты в результате генетических факторов и/или нарушения физиологических этапов пищеварения, которые запускают вторичные воспалительные реакции с участием иммунной системы. Вторичные воспалительные реакции (ВВР) развиваются по причинам контроля иммунной системой всех уровней пищеварения с целью обеспечения толерантности к пищевым антигенам. Процессы изменения антигенных характеристик пищевых продуктов нарушают их распознавание ИС на уровне иммунокомпетентных клеток. ВВР сопровождаются изменением соотношения про- и противовоспалительных цитокинов, перестройками регуляторных механизмов, направленных на обеспечение защитных реакций выведения причинных антигенов и восстановление гомеостаза организма. 2). Коммерческий термин, обозначающий суммарный комплекс патологических реакций на пищу, не принимающий во внимание закономерности системного иммунного воспаления. В связи с этим были введены и широко используются различные «тесты на пищевую непереносимость», характерные для определенной фазы взаимодействия пАГ с ИС. Иммуноферментный анализ (ИФА): (англ. Enzyme-Linked Immunosorbent Assay — ELISA) — лабораторный иммунологический метод, в основе которого лежит специфическая реакция «антиген-антитело», а определение образующегося комплекса производится благодаря ферментативной реакции окисления красителя. Чувствительность медицинского теста S1- отражает долю положительных результатов, которые правильно идентифицированы как таковые (иными словами чувствительность диагностического теста показывает вероятность того, что больной субъект будет классифицирован именно как больной), S1 = число больных, классифицируемые как больные/ общее число тестируемых больных.
Специфичность медицинского теста S2 — отражает долю отрицательных результатов, которые правильно идентифицированы как таковые (т.е. вероятность того, что не больные субъекты будут классифицированы именно как не больные), S2 = число здоровых, классифицируемые как здоровые/ общее число здоровых.
Чувствительность метода измерения — характеристика метода в виде наименьшего значения изменения физической величины, начиная с которого может осуществляться её измерение данным средством. Под чувствительностью ИФА понимается та минимальная концентрация определяемого реагента, при которой заметно различие в величине сигнала этой концентрации и образца, заведомо не содержащего определяемого реагента (отрицательный контроль). Эта разница в величине сигналов должна составлять 2 — 3 величины стандартного отклонения (СО) для отрицательного контроля.
Специфичность метода измерения подразумевает безошибочность диагностики именно требуемой физической величины или параметра: если результат ИФА положительный, значит, найдены именно те антитела или антигены, которые предполагались, а не какие-то другие.
Иммунодиетология™ — 1) термин, введенный авторами для обозначения нового направления иммунологии, изучающего различные этапы взаимодействия пищевых антигенов с иммунной системой; 2) зарегистрированный товарный знак (ТМ) компании ООО «Иммунохелс Рус».
Введение.
В конце 20-го века была выдвинута гипотеза, согласно которой при попадании пищи в желудочно-кишечный тракт, пищевые антигены (пАГ) проникают через кишечные стенки (интестинальный барьер) в кровеносную систему и, в ряде случаев, вызывают патологические реакции иммунной системы, которые в свою очередь, могут приводить к состоянию, известному в иммунологии, как состояние «гиперчувствительности» определенного типа. А состояние «гиперчувствительности», когда иммунная система не справляется с выведением из организма продуктов иммунных реакций, с большой вероятностью приводит к хроническим неинфекционным заболеваниям, часто именуемым «болезнями цивилизации». Основополагающая статья на эту тему появилась в России в 2000 г. (Розенталь В.М., Воейков В.Л., Волков А.В., Кондаков С.Э., Новиков К.Н. «Роль подбора индивидуального питания в экологической реабилитации человека». Материалы III-й международной конференции. Москва, МГУ, 24-25 ноября 2000. М.: Изд-во РАМН, 2000. с.243-247).
На протяжении последующих 20 лет учеными разных стран были разработаны тесты, позволяющие в лабораторных условиях «in vitro» регистрировать эффекты взаимодействия пАГ с иммунной системой человека, используя различные маркеры (измеряемые физические параметры) характерные для определенной фазы или типа взаимодействия пАГ с иммунной системой. Наиболее известные в США и Европе: York, ALCAT, NuTron, Cito, Prime, MRT, в России: Гемокод, РОЭ. Сравнительный анализ тестов приведен в работе (Розенштейн М.Ю., Розенштейн А.З., Кондаков С.Э., Черевко Н.А. «Современные лабораторные методы диагностики пищевой непереносимости». Бюллетень сибирской медицины, 2016, том 15, № 16, с. 69–78.).
Наиболее распространенным в клинической практике является York тест, разработанный York Nutrition Laboratories (UK) в 90-х годах прошлого века, или ИФА на специфические иммуноглобулины класса G (IgG) — в английской транскрипции ELISA IgG. Маркером в данном тесте является концентрация сывороточных специфических IgG к конкретному пАГ, измеряемая методом иммуноферментного анализа (ИФА). Впоследствии, многие известные лаборатории мира, вывели на рынок аналогичный тест, но уже под своим именем: Biomerica, Us Biotek, Genova Diagnostic, Meta Metrics, White Plane, Everly Well, Pinner test (США), ImmuPro, Dr. Fooke, R-Biopharm (Германия); Инвитро, Иммунохелс, Вектор Бест, Иммунотек, G-тест, Иммуновет (РФ). Что именно предлагается на рынках можно представить по характеру рекламы: IgG Food Intolerance Test (IgG тест на пищевую непереносимость), IgG Food Allergy Test (IgG тест на пищевую аллергию), IgG Food Sensitivity Test (IgG тест на чувствительность к пище). Заметим, что речь идет об одном и том же тесте ИФА на IgG к пищевым антигенам. При одинаковом маркере, различие только в наборе пАГ на тест- системе и методе обработки данных.
2. Существует ли критерий для корректного построения элиминационных диет на основе данных теста ИФА на IgG к пАГ и чем отличается используемая нами «методика Immunohealth™» от всех остальных тестов?
Задача данного научного расследования — дать врачам и всем заинтересованным читателям физически корректный и грамотный ответ.
Физическая модель ИФА на специфические IgG к пАГ.
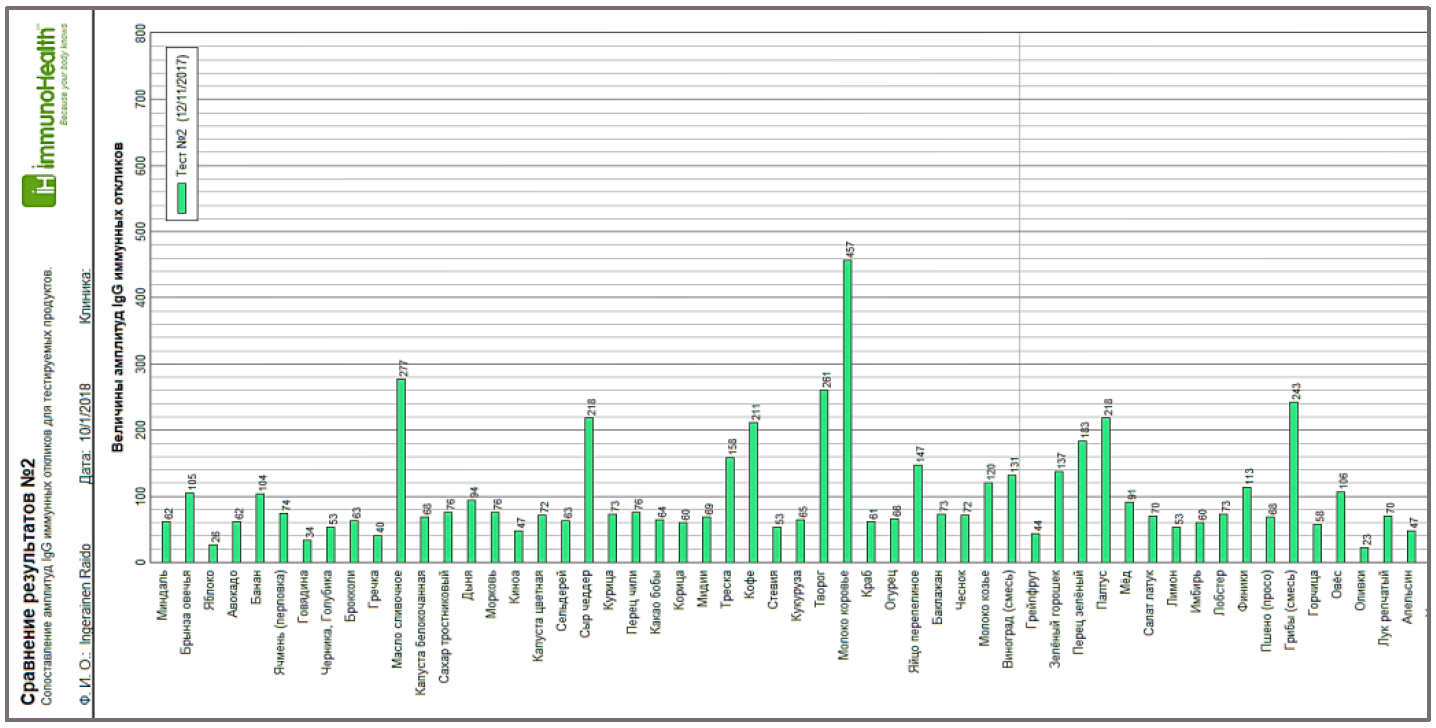
В тесте ИФА на IgG к антигенам из пищевых продуктов последние наносятся на лунки иммунологических плашек ячейки тест- системы для ИФА. В каждую ячейку добавляют равное количество сыворотки крови пациента. В результате взаимодействия специфических сывороточных антител иммунной системы (ИС) с каждым пАГ в образцах сыворотки крови получают порядка 100 иммунных откликов или 100 (для нашего случая) различных величин концентрации Сn(sIgG) специфических IgG. Таким образом, для решения задачи адаптации конкретного индивидуума к пищевой среде проводится эксперимент с его иммунной системой путем смешивания сыворотки крови со статистически представительной выборкой пАГ. Результат подобного тестирования представляет собой 100 значений величин концентраций Сn(sIgG), 1 ≤ n ≤ N, где N=100 — общее число тестируемых пАГ. Как правило, результат тестирования представляется графически в координатах «продукт — амплитуда маркера», Рис 1. Более того, в данной постановке эксперимента совершенно безразлично диагностируем ли мы здорового человека или больного аллергией или иным заболеванием. В том или другом случае, результаты теста ИФА на IgG к пАГ показывают как иммунная система каждого человека взаимодействует с тестируемым набором пищевых антигенов. Т.е. амплитуду IgG иммунных реакций ИС на каждый антиген, что и представлено на Рис 1. На этом лабораторный эксперимент по исследованию взаимодействия пАГ с ИС закончен.
Совершенно очевидно, что ИФА на IgG — диагностический тест, в ходе которого диагностируются процессы взаимодействия специфических иммуноглобулинов (sIgG) c представительной выборкой пАГ. Для описываемого метода ИФА на IgG к пАГ, как метода диагностики иммунных реакций «антиген-антитело» (пАГ-sIgG), характерны следующие оценки: — чувствительность 10−9 – 10−12 моль (вплоть до 10−21 моль в образце); — специфичность – порядка 100% (IgG); — относительная погрешность измерения единичного значения величины концентрации Сn(sIgG) мкг/мл — порядка 3.0-5.0%. Отметим, что медицинские определения «чувствительности S1» и «специфичности-S2», к тесту ИФА на IgG к пАГ, как методу диагностики иммунных реакций «антиген-антитело» (пАГ-sIgG), абсолютно неприменимы. Вывод: никакого отношения эксперимент ИФА на IgG к пАГ к диагностике «пищевой аллергии» не имеет и в этом отношении авторы солидарны с многочисленными критиками. Представьте себе мысленно физический эксперимент из школьного курса физики, аналогичный тому, что мы видим в случае ИФА на IgG к пАГ. Организм – «черный ящик» и мы по косвенным данным (однотипным откликам) должны что-то сказать о состоянии данного «ящика». Предположим, у Вас есть 100 одинаковых по размеру, но из различного материала шаров и Вы решили на расстоянии протестировать этими шарами стену дома, материал и форма которой Вам неизвестны (Рис 2).
Рис 2. Эксперимент по отражению шаров от объекта (стенки).
Вы бросаете перпендикулярно к стенке в локальную область один за другим все шары, они отскакивают от стены под разными углами и на разные расстояния, и на этом эксперимент по взаимодействию шаров со стенкой завершен. Дальнейшие ваши действия уже определяются задачей, поставленной вами перед началом эксперимента. Вас могут интересовать углы отскока, или распределение количества шаров по углам отражения, или длина отскока от стенки в зависимости от материала шаров и т.д. Эти задачи решаются методами, не имеющими отношения к самому эксперименту, только к набору данных по результатам эксперимента.
Вывод: Определение пищевой аллергии методом ИФА на IgG к пАГ является некорректно поставленной задачей тестирования.
Цель теста ИФА на IgG к пАГ.
C точки зрения прикладных задач диетологии, конечным результатом теста ИФА на IgG к пАГ, является не весь набор из 100 значений величин концентраций Сn (sIgG), найденных экспериментально (Рис 1), а только некоторая его часть, которая образована пАГ-антагонистами (пАГ–А), вызывающими патологические реакции ИС, потенциально приводящие к ситуации «гиперчувствительности Тип III» организма индивидуума. Таким образом: основной задачей и конечной целью тестирования реакций «пАГ- sIgG» на основе теста ИФА на IgG к пАГ является исключительно идентификация персонифицированных патологических иммунокомплексных реакций и соответствующих пАГ-А, инициирующих данные реакции. Именно на исключении из рациона пациента пАГ-А, найденных по результатам теста и основывается персонифицированная элиминационная диета: (Розенштейн М.Ю., Розенштейн А.З., Кондаков С.Э., Черевко Н.А. Новый методологический подход к созданию персонифицированной элиминационной диеты при пищевой непереносимости, обусловленной иммунопатологическими реакциями III типа. Бюллетень сибирской медицины, 2015, том 14, № 4, с. 60–67). Встает закономерный вопрос: а как идентифицировать именно патологические реакции по результатам многокомпонентного теста ИФА на IgG к пАГ? (многокомпонентность вызывается тем фактором, что мы проводим единичный ИФА на IgG в каждой n-й ячейке (1 ≤ n≤ N, где N — количество тестируемых пАГ) иммунологической панели. В дальнейшем мы будем использовать более краткую запись многокомпонентного теста ИФА на IgG к пАГ в виде (ELISA IgG)n.
В аллергологии вопрос идентификации патологических иммунных реакций, опосредованных иммуноглобулинами класса Е (IgE), приводящих к «гиперчувствительности Тип I» (аллергические реакции), решается путем экспериментального определения «референтных интервалов» и соответствующих критериев «норма — патология» (“cut-off” criterion), статистически достоверно связанных с наблюдаемой клинической картиной. При этом, основой идентификации реакций «гиперчувствительности Тип I» и инициирующих АГ по результатам теста ИФА на IgE (ELISA IgЕ)n, является только величина титра, или величина концентрации специфических иммуноглобулинов класса Е (IgE) к определенному аллергену (в том числе пАГ).
В отличие от аллергических реакций, опосредованных иммуноглобулинами класса Е (IgE), для иммунокомплексных реакций «пАГ-sIgG», корректное введение «референтных интервалов» и критериев «норма-патология» (в «аллергологическом смысле») принципиально невозможно, поскольку не известны значения концентраций специфических антител класса G к пАГ, при превышении которых наступает клиническая (патологическая) реакция на данный пАГ. Известны только «референтные интервалы» для концентраций общего IgG в крови (стандарт ВОЗ — WHO 67/69).
Несмотря на принципиальные отличия в биохимических свойствах иммуноглобулинов класса E и G, для идентификации патологических иммунокомплексных реакций «пАГ-sIgG», каждая лаборатория, по образу и подобию с анализом на иммуноглобулины класса Е, вводит свои собственные искусственные референтные интервалы, исходя из принятых значений калибраторов, определяющих диапазон величин титров IgG. Критерий «норма-патология», как правило, фиксируется на уровне половины диапазона измерений и является фиксированной величиной для всех тестов. Таким образом, протокол обработки данных теста ИФА на IgG к пАГ формально приводится в соответствие с протоколом, принятым в аллергологии для обработки результатов теста ИФА на IgЕ к пАГ. Именно этот подход использует большинство ведущих лабораторий мира: York-Nutrition, ImmuPro, Dr. Fooke, Biomerica, US Biotek, Genova Diagnostic, Meta Merix, Pinner и др. Аналогичный подход используется и в тестах ALCAT, NuTron, Сito.
С нашей точки зрения, подобный искусственный “аллергологический” подход является физически некорректным и приводит к существенным ошибкам в идентификации патологических иммунокомплексных реакций.
В разработанном нами подходе (методика Immunohealth™), идентификация патологических иммунокомплексных реакций «пАГ-sIgG» по результатам теста (ELISA IgG)n к пАГ, проводится на основе информации о структуре функции плотности распределения вероятности — ФПРВ (Probability Density Function), регистрируемых в эксперименте титров Сn(sIgG), в диапазоне шкалы измерений (Рис 3).
Рис 3. Вид ФРПВ для i-го теста (ELISA IgG)ni. Ti- критерий «норма-аномалия». Tf- условный критерий «норма-патология», принятый в лабораторной практике. Na- количество аномальных реакций, регистрируемых согласно критерию «норма-аномалия», Naf- количество аномальных реакций, регистрируемых согласно условному критерию «норма-патология».
В «методике Immunohealth™» величина персонифицированного критерия «норма — аномалия», c заданной точностью определяется программным путем на основе статистического анализа экспериментальных данных многокомпонентного теста (ELISA IgG)n к пАГ по разработанным алгоритмам программой Immunohealth™ IT. Базовым требованием нахождения корректного значения величины критерия «норма-аномалия», является наличие статистически представительного набора значений титров Сn(sIgG), т.е. необходимо и достаточно, чтобы величина объема выборки N тестируемых пАГ, приближенно удовлетворяла соотношению N ≥ 80.
Погрешность теста (ELISA IgG)n, как правило определяют величиной погрешности измерения амплитуды одного иммунного отклика (Рис 1), т.е. единичного значения концентрации специфических иммуноглобулинов — Сn(sIgG). В реальности, величина погрешности теста определяется не только и не столько погрешностью измерения одного иммунного отклика, а в основном, погрешностью определения числа идентифицируемых патологических иммунокомплексных реакций и соответствующих пАГ. А погрешность в определении числа пАГ-А всецело определяется значением величины титра, корректно разделяющего структуры А и В в ФРПВ (Рис 3). При фиксированном значении титра Tf, принятом в большинстве лабораторий мира на уровне половины значений шкалы измерения (Рис. 3), относительная погрешность в определении числа пАГ-А находится в пределах от 60% до 100%. Использование же персонифицированного критерия «норма — аномалия», определяемого по «методике Immunohealth™», гарантирует минимальную погрешность в определении количества пАГ-А и приводит к идентификации «кластеров» интолерантности ИС к пАГ, объединенных определенным антигенным «сродством». Таким образом, «методика Immunohealth™» позволяет не только диагностировать иммунокомплексные реакции у здоровых и больных людей, но и находить с минимальной погрешностью число пАГ-А, инициирующих патологические иммунокомплексные реакции.
Предлагаемый подход был проверен в течение более чем 15 лет на выборке более 30000 пациентов из разных популяций (США, ЕС, РФ) и на тест- системах для теста (ELISA IgG)n различных производителей. Врачи, использующие «методику Immunohealth™,» в своей практике, отмечают устойчивый положительный клинический эффект с контролем показателей системного воспаления (СОЭ, СРБ, ИЛ6, ИЛ1, ТНФ альфа и т.д.). Патогенетически этот эффект выражается в снижении нагрузки на эффекторные иммунные реакции, направленные на элиминацию причинных пищевых АГ, что достигается соблюдением персонифицированной элиминационной диеты, построенный с использованием предложенного критерия “норма – аномалия”.
Предложенная методика дает специалистам разных профилей инструмент, позволяющий использовать персонифицированную идентификацию и элиминацию причинных пАГ для лечения и профилактики неинфекционных хронических заболеваний. Это особо важно для пациентов с признаками системного воспаления, патогенеза многих неинфекционных заболеваний, таких как метаболический синдром, профилактика ожирения, современные интестинально–энтеропатические расстройства и аутовоспалительные синдромы. Одновременно методика позволяет определять статус ИС и степень пищевой адаптации по отношении к пищевым антигенам окружающей пищевой среды у здоровых людей.
Выводы научного исследования:
1. Корректно выполненный многокомпонентный иммуноферментный анализ (ELISA IgG)n, на специфические к пищевым антигенам иммуноглобулины класса G (IgG), предельно точно показывает концентрацию специфических антител, которая является отражением картины взаимодействия иммунной системы человека (здорового или больного) для каждого n –го пищевого антигена из представительной выборки из N тестируемых антигенов.
2. В «методике Immunohealth™» многокомпонентный иммуноферментный анализ (ELISA IgG)n на специфические к пищевым антигенам IgG, используется для создания индивидуальной адаптационной диеты на основе математически обоснованного критерия «норма – аномалия». Это область диетологии, а более конкретно — иммунодиетологии. Следовательно тест (ELISA IgG)n и «методика Immunohealth™» не имеют никакого отношения к диагностике «пищевой аллергии».
3. Результаты проведенных исследований позволяют сделать вывод о том, что новое направление ИММУНОДИЕТОЛОГИЯ™, базирующееся на корректно используемом многокомпонентном тесте (ELISA IgG)n к пАГ является перспективным направлением современной диетологии, в котором физически корректно учитываются индивидуальные реакции иммунной системы организма на представительную выборку пАГ.