ингибирование реакции что это
Отряд самоубийц в медицине
Отряд самоубийц в медицине
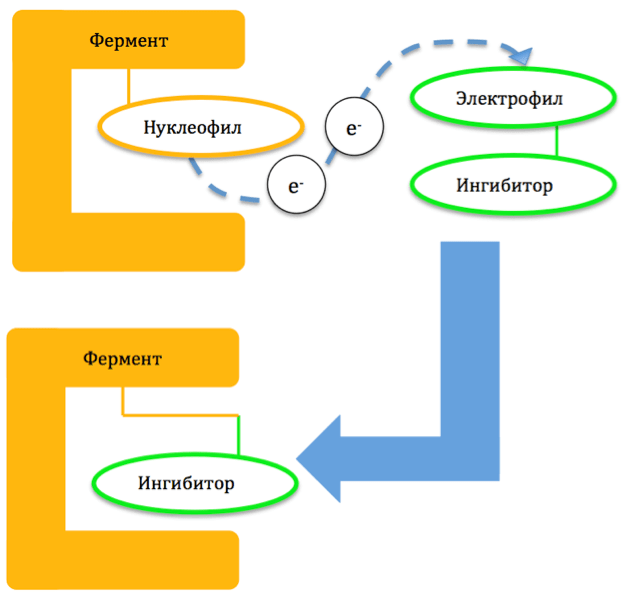
Необратимый ингибитор (оранжевый), подобно диверсанту, подрывает работу фермента (синий). Это потенциальное лекарство против трипаносомы крузи — главной причины болезни сердца в Латинской Америке.
Авторы
Редакторы
Статья на конкурс «био/мол/текст»: Многие лекарства конкурируют с природными молекулами за связывание со своей мишенью. Большинство таких препаратов связывается с белками за счет слабых взаимодействий, но некоторые способны образовывать прочные связи, «выключая» свою мишень до конца ее «жизни», пусть и ценой собственной. Такие лекарства относятся к классу необратимых ковалентных ингибиторов, получивших образное название суицидных ингибиторов (англ. suicide inhibitors). О них и пойдет речь в нашей статье. Как работают и насколько опасны одни из самых эффективных лекарств? Чья болезнь помогла открыть аспирин? Что общего между никотином и грейпфрутовым соком? Ответы на эти и многие другие вопросы вы найдете далее.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2017.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».
Из чего же, из чего же сделаны эти лекарства?
Сегодня сложно представить себе человека, который ни разу в жизни не принял ни одной таблетки. Каждый год прилавки аптек пополняются все новыми и новыми лекарствами. Независимо от цвета упаковки препарата и его лекарственной формы (будь то таблетка, мазь, капсула, раствор для инъекций и т.д.) внутри всегда содержится главный компонент лекарства — действующее вещество. Именно оно и обеспечивает терапевтический эффект.
Большинство действующих веществ является ингибиторами, то есть они блокируют функцию того или иного белка (чаще фермента, но иногда и рецептора) в нашем или чужеродном организме. Многие из них связываются со своей мишенью обратимо, то есть после встраивания в мишень молекула может выйти обратно, так что их возможности сильно ограничены. Но необратимые ковалентные ингибиторы «намертво» связываются со своей мишенью. В результате фермент больше не способен функционировать до тех пор, пока клетка не синтезирует его новые копии.
Низкомолекулярные «взломщики»
«В чем же секрет столь сильного связывания этих ваших необратимых ингибиторов?» — спросите вы. В ковалентной связи. Существует несколько механизмов связывания лекарств с их молекулярными мишенями. Обычно связывание происходит при помощи слабых взаимодействий [4]. Ковалентная же связь является сильнейшим из возможных взаимодействий и превосходит любые другие в десятки, а то и сотни раз (табл.1) [5]!
| Тип связи | Энергия, ккал/моль |
|---|---|
| Ковалентная | 50–150 |
| Электростатическая | 5–10 |
| Водородная | 2–5 |
| Гидрофобная | 0,5–1 |
Механизм образования ковалентной связи строится на том, что пара электронов одного из атомов молекулярной мишени (нуклеофила) распределяется между ним и одним из атомов ингибитора (электрофилом) (рис. 1). Из-за высокой прочности связи ингибитор оказывается необратимо присоединен к ферменту и приводит к разрушению последнего. Восстановление функции фермента наступает только после синтеза его новых копий [5].
Рисунок 1. Общий механизм действия необратимых ингибиторов.
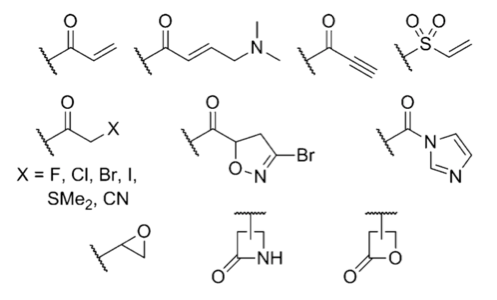
Как же выглядят эти электрофильные группы, которые используются для создания ковалентных необратимых ингибиторов? Найти ответ вы сможете, посмотрев на рисунок 2. Наличие одного из этих фрагментов в структуре лекарства может говорить о том, что оно действует по уже известному вам механизму [6].
Рисунок 2. Примеры электрофильных групп, встречающихся в необратимых ингибиторах.
Несмотря на то, что связывание необратимых ингибиторов приводит к гибели фермента, не следует думать, что одна доза такого лекарства может полностью уничтожить фермент в организме. Наличие и работа генов позволит создать его новые копии, пусть на это и понадобится от нескольких часов до пары дней [2].
Как и все в мире, ковалентные необратимые ингибиторы имеют свои преимущества и недостатки, которые мы представили в формате таблицы 2 [6].
| Преимущества | Недостатки |
|---|---|
| Высокие эффективность и избирательность позволяют использовать меньшие дозы и уменьшить риск побочных эффектов | Высокая активность некоторых представителей может приводить к некрозу печени, мутациям и даже раку! |
| Связывание с важными остатками фермента предотвращает развитие устойчивости микробов, что важно при лечении инфекций | Потенциальная иммуногенность, так как полученный продукт реакции может вызывать аллергический ответ |
| Длительное действие, так как активность фермента вновь появляется только при синтезе его новых копий |
Тернистые пути разработки эффективных лекарств
Если вы думаете, что разработка необратимых ковалентных ингибиторов — легкое дело, то вы глубоко заблуждаетесь. Даже если закрыть глаза на то, что разработка любого лекарства является крайне трудоемким и времязатратным процессом [7], задача не сильно упростится — ведь необратимые ингибиторы требуют особого подхода к своей персоне. Сегодня не так много одобренных препаратов действуют именно таким образом. А механизм действия многих из них открыли только спустя годы после разработки! Ученые на этом пути сталкиваются с большим количеством порой неразрешимых проблем.
Одна из них — участие одного фермента сразу в нескольких метаболических каскадах. Обсуждаемые лекарства необратимо связываются с ферментом-мишенью, уничтожая его на то время, которое требуется на синтез новых копий фермента. Этот процесс может занимать до нескольких суток! В том случае, если фермент-мишень выполнял несколько функций, это чревато серьезными побочными эффектами. Чтобы обойти проблему, необратимо связывающиеся ингибиторы чаще всего применяют для блокирования одного из ферментов потенциально опасных для человека вирусов, бактерий и т. д. [3].
Вторая проблема заключается в том, что при низкой избирательности необратимые ингибиторы могут связываться с нежелательными мишенями, похожими на выбранную нами для ингибирования. Это тоже может приводить к серьезным побочным эффектам. Поэтому важная задача при оптимизации структуры ингибиторов — повышение избирательности к своей мишени [3].
Опасения в отношении побочных эффектов необратимых ингибиторов не лишены оснований. Бум гонений на эту группу препаратов вызвали исследования 1970-х годов. Тогда выяснили, что два из наиболее широко известных представителей этой группы — парацетамол и фуросемид — обладают высокой токсичностью в связи с тем, что, метаболизируясь в печени, они образовывают активные производные, формирующие ковалентные связи с ее белками [2], [8]. Как выяснилось позже, эти единичные случаи не имеют отношения ко многим препаратам из группы необратимых ингибиторов, а парацетамол и фуросемид до сих пор активно используются в клинической практике.
Другим распространенным примером нежелательного необратимого ингибирования является цитохром P450. Цитохромы — группа ферментов в нашем организме, главной задачей которых является обезвреживание потенциально опасных веществ. Первыми необратимыми ингибиторами цитохрома стали алкены и алкины. В результате ингибирования этого фермента процессы детоксикации становятся невозможными. Неполный список препаратов, способных вступать в подобную реакцию, включает 17α-алкенил-стероиды, левомицетин, циклофосфамид, спиронолактон, фурокумарины, никотин, изониазид и барбитураты. Звучит опасно, не правда ли? Не многим опаснее, чем пить грейпфрутовый сок! Его компоненты способны необратимо связываться с цитохромом кишечника и лишать этот фермент активности на 24 часа! К чему это может привести? К тому, что принимаемые в это время лекарства будут более эффективно поступать в наш организм, а рост их концентрации повышает риск развития нежелательных эффектов [5]. Именно поэтому врачи рекомендуют запивать таблетки только водой.
Но всегда ли можно считать необратимые ингибиторы безопасными лекарствами? Конечно же, нет. Поиск необратимых ингибиторов, и правда, не всегда оборачивается успехом для исследователей. В частности, полным провалом завершились исследования мышьяк-содержащих органических соединений для лечения трипаносомоза [9]. Эти соединения необратимо ингибировали жизненно необходимые ферменты трипаносомы за счет образования связей между атомом мышьяка в составе исследуемых веществ и серосодержащими остатками фермента. Но они оказались токсичными не только для трипаносомы, но и для организма человека [5].
К счастью, несмотря на все перипетии судьбы, ученые вновь сфокусировали свои пристальные взгляды на необратимых ковалентных ингибиторах. Лучшее понимание реально существующих рисков и знание механизма химических преобразований открыли множество возможностей для разработки более эффективных лекарств и привели к резкому росту встречаемости необратимых ингибиторов в различных исследованиях [10].
«Ветераны» борьбы за здоровье человечества
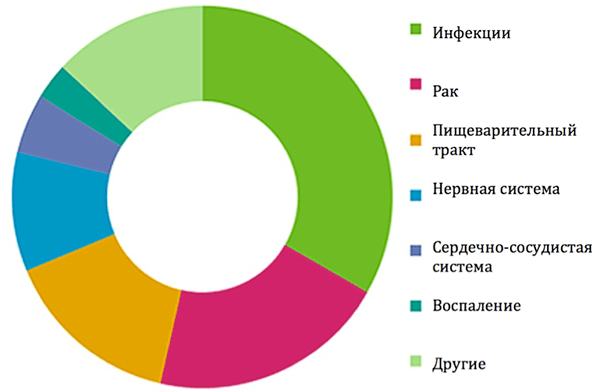
Многие из широко применяемых успешных препаратов — необратимые ковалентные ингибиторы [6]. Например, в 2009 году три необратимо связывающихся ингибитора попали в топ-10 наиболее продаваемых лекарств [2]. В 2011 году из 39 ковалентных лекарств, одобренных в США, 33% являлись противоинфекционными, 20% нашли применение в лечении рака, 15% применялись при болезнях пищеварительного тракта, 10% — при нарушении работы центральной нервной системы, 5% использовались при лечении сердечно-сосудистых заболеваний и один препарат обладал противовоспалительными свойствами (рис. 3) [6], [11].
Рисунок 3. Области применения одобренных в США необратимо связывающихся ингибиторов (данные за 2011 год).
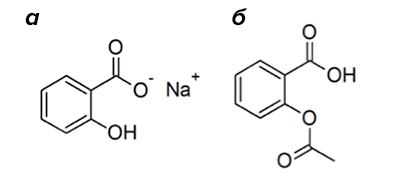
Рисунок 4. Структура салицилата натрия (а) и аспирина (б).
Давайте же поговорим о нескольких наиболее успешных примерах необратимых ковалентных ингибиторов.
Натрия салицилат впервые применили в качестве противовоспалительного лекарства в 1875 году (рис. 4а). Препарат обладал ужасным вкусом и вызывал язвы ротовой полости и желудка. В конце XIX века отец одного из химиков компании Bayer Company, страдающий от тяжелого ревматоидного артрита, упросил своего сына, Феликса Хоффмана, заняться поиском менее опасного аналога салицилата натрия. Феликс синтезировал различные производные и обнаружил, что ацетилсалициловая кислота обладает лучшими свойствами. Так был обнаружен аспирин (рис. 4б). В 1899 году Bayer выпустила аспирин как противовоспалительное, обезболивающее и жаропонижающее средство [2]. Как и в случае многих других препаратов, механизм его действия открыли только спустя 70 лет после коммерциализации препарата [6], за что в 1982 году была вручена Нобелевская премия [2], [12]. Аспирин оказался необратимым ингибитором ферментов, участвующих в реакции воспаления — циклооксигеназ [6].
Рисунок 5. Структура пенициллина.
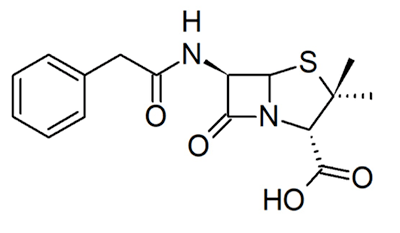
Другие примеры необратимых ковалентных ингибиторов — пенициллины [6]. Их родоначальника, пенициллин (рис. 5), открыл в 1928 году Александр Флеминг [13]. Ученым понадобилось еще 15 лет, чтобы достаточно изучить и начать использовать этот препарат в качестве антибактериального лекарственного средства, что спасло миллионы жизней во время Второй мировой войны [12]. Пенициллин нарушает синтез клеточной стенки бактерий. Он связывается с транспептидазой — ферментом, обеспечивающим первый этап сшивки пептидогликана, который является основным компонентом бактериальной клеточной стенки. Когда пенициллин связывается с транспептидазой, синтез бактериальной клеточной стенки блокируется, и многие бактерии погибают от разрыва клеточной мембраны под воздействием осмотического давления [1].
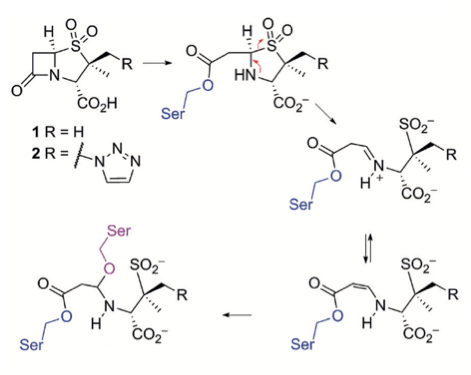
Однако все оказалось не так радужно — у бактерий обнаружились механизмы устойчивости [14]. В частности, резистентность к пенициллинам обеспечивается за счет наличия β-лактамаз — ферментов, расщепляющих пенициллины. Ученые не остановились на достигнутом и разработали ингибиторы этого фермента — сульбактам, тазобактам и клавулановую кислоту. Подобно пенициллинам, в результате нуклеофильной атаки эти соединения претерпевают открытие β-лактамного кольца. Отличие в том, что ингибиторы β-лактамаз подвергаются раскрытию и второго цикла, содержащегося в их структуре. При этом появляется возможность образования дополнительных связей, в том числе и ковалентных (рис. 6) [6], [15].
Рисунок 6. Механизм действия ингибиторов β-лактамаз
Рисунок 7. Структура ацикловира.
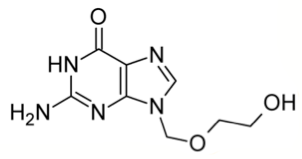
Ацикловир — один из самых эффективных препаратов с противовирусной активностью (рис. 7). Он был открыт в 1974 году крупной ныне фармацевтической компанией — GlaxoSmithKline (тогда она называлась Burroughs Wellcome) — в ходе широкомасштабного поиска противовирусного средства, начавшегося еще в 1960-е годы. А в 1988 году за изучение механизмов действия ацикловира и других препаратов вручили Нобелевскую премию [16].
В клинической практике ацикловир применяют для лечения вируса герпеса. Важно, что здоровые клетки человека не подвергаются действию препарата. Ведь ацикловир попадает в клетку благодаря одному из ферментов вируса — тимидинкиназе! Способность ацикловира связываться с этим ферментом в 200 раз выше, чем с любым ферментом нашего организма. Оказавшись в зараженных клетках, ацикловир преобразуется в ацикловир трифосфат, который связывается с вирусной ДНК и в таком виде необратимо ингибирует вирусные ДНК-полимеразы, необходимые для размножения вируса [17].
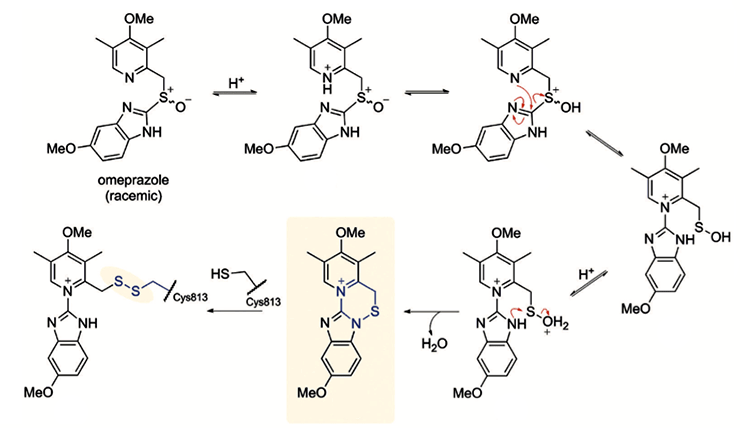
Другим широко известным примером необратимых ингибиторов является омепразол, одобренный к применению в 1980-х. Его применяют при заболеваниях пищеварительной системы, сопровождающихся усиленным выделением желудочной кислоты, таких как изжога или язва желудка. В нейтральной среде омепразол не оказывает действия на наш организм, но при ее закислении желудочным соком необратимо связывается с протонной помпой, ответственной за образование кислоты в желудке. Это происходит потому, что благодаря кислой среде омепразол претерпевает ряд внутримолекулярных перестроек и становится способным принять на себя нуклеофильную атаку каталитического цистеина протонной помпы, тем самым образуя прочную ковалентную связь и выключая этот белок (рис. 8) [6], [18], [19].
Рисунок 8. Механизм действия омепразола.
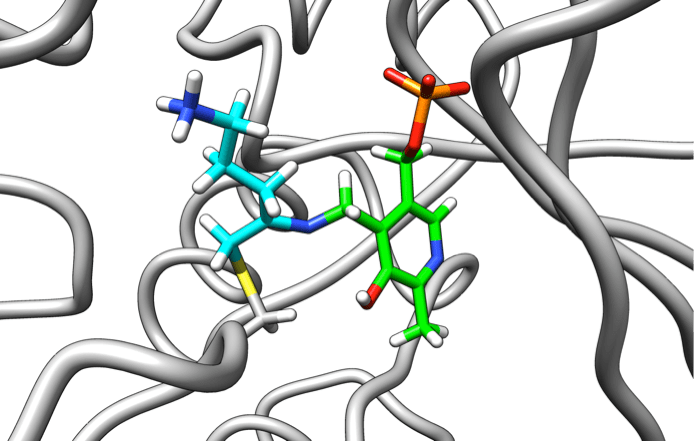
Африканская сонная болезнь, или африканский трипаносомоз, вызывается простейшими рода трипаносома. До конца XX века эта болезнь была практически неизлечима. Вакцины оказались неэффективны против трипаносом из-за того, что последние имеют механизмы обхода иммунной системы человека. Поэтому, основываясь на знаниях о жизненно необходимых ферментах этих простейших, ученые прибегли к разработке механизм-опосредованно связывающихся ингибиторов. Ахиллесовой пятой в метаболизме трипаносом оказался путь биосинтеза полиаминов, вовлеченных в процессы упаковки ДНК и в больших количествах необходимых при делении клеток. Первый этап их синтеза обеспечивает фермент орнитиндекарбоксилаза при участии вспомогательной молекулы — витамина В6. В клетках млекопитающих фермент синтезируется быстро, а у трипаносом этот процесс занимает гораздо больше времени. Именно поэтому необратимые ингибиторы орнитиндекарбоксилазы мало влияют на человеческие клетки, но крайне губительно действуют на паразита [1]. На базе этого механизма был разработан дифторметилорнитин (ДФМО). ДФМО достаточно инертен в растворе, но в результате реакции с витамином В6 приобретает способность связываться с орнитиндекарбоксилазой, которая быстро инактивируется (рис. 9). Эта реакция необратима. Таким образом ДФМО использует собственные реакции фермента для его уничтожения. Препарат показал высокую эффективность против африканской сонной болезни в клинических исследованиях и используется в настоящее время для ее лечения [1].
Рисунок 9. Комплекс производного ДФМО (голубой) с витамином В6 (зеленый) и ферментом орнитиндекарбоксилазой (серый).
А недавно ученые обнаружили, что ДФМО также может использоваться в качестве препарата против рака! Механизм действия ДФМО по отношению к раковым клеткам хорошо изучен. Так же, как и в случае лечения трипаносомоза, этот агент ингибирует действие орнитиндекарбоксилазы. Ведь, что интересно, в опухолевых клетках количество этого белка значительно выше, так как они интенсивно делятся! При инактивации орнитиндекарбоксилазы в раковых клетках падает уровень полиаминов, что нарушает правильную упаковку ДНК, в результате чего клетки перестают делиться. Этот эффект препарата называется цитостатическим. Однако если препарат применять долго, то происходит не замедление деления, а гибель раковых клеток! ДФМО сам по себе не обеспечивает достаточный противораковый эффект, но в комбинации с другими химиотерапевтическими препаратами этот компонент показал увеличение выживаемости пациентов и ускорение темпов выздоровления. Поэтому ДФМО имеет потенциал применения в качестве лекарства, предотвращающего возникновение онкологии, либо снижающего вероятность рецидива рака после удаления опухолевых клеток [20].
Есть ли будущее у необратимых ковалентных ингибиторов?
Долгие годы необратимые ингибиторы были окружены аурой скептицизма, возникшей из-за токсичности некоторых представителей этой группы, обнаруженной в 1970-е годы. Но эффективность и избирательность многих препаратов этой серии доказали, что страхи в их отношении не были оправданными. Конечно, они обладают потенциальной опасностью из-за возможности неспецифических взаимодействий и аллергических реакций, но клиническая практика показывает их незаменимость в лечении целого ряда заболеваний. Сейчас число препаратов этой группы неуклонно растет [6].
Сложность в том, что исследователь должен преследовать сразу несколько целей: повысить избирательность лекарства к ферменту-мишени и тщательно продумать механизм его действия. Но такие свойства необратимых ковалентных ингибиторов, как высокие избирательность и эффективность, высокая продолжительность действия, сниженный риск развития устойчивости к препарату, делают эту группу лекарств незаменимым инструментом в арсенале врачей и разработчиков лекарств [6].
Воздействие на клеточные мишени как средство борьбы с гриппозной инфекцией
1 ФГБУ НИИ гриппа МЗ РФ, Санкт-Петербург, Россия
2 ЗАО МБНПК«Цитомед», Санкт-Петербург, Россия
Скачать PDF
Резюме. Грипп представляет собой высоко контагиозное заболевание человека. На фоне использования противовирусных препаратов формируются лекарственно-устойчивые штаммы вируса, следствием чего является снижение эффективности этиотропной химиотерапии. В обзоре рассмотрены способы снижения уровня репликации вируса и тяжести патологического процесса, основанные на использовании альтернативных мишеней не вирусного, а клеточного происхождения. Описаны препараты, снижающие продукцию провоспалительных цитокинов (эриторан), ограничивающие дегрануляцию тучных клеток (кетотифен), ингибиторы циклооксигеназ (целекоксиб, месалазин, SC-560), ингибиторы сфингозин-1-фосфатного пути (AAL-R), а также повышающие стабильность сосудов путем упрочения контактов между эндотелиальными клетками (белок Slit). Особое внимание уделено ингибиторам клеточных путей, используемых вирусом для повышения репродукции, таких как NF-kB, Raf/MEK/ERK, PI3K/AKT/mTOR. Описана противогриппозная активность ингибиторов киназ и процесса аутофагии, а также препаратов смешанного механизма действия — глицирри- зиновой кислоты и дипептида а-глутамилтриптофана. Дальнейшие исследования в области поиска и оптимизации ингибиторов клеточных компонентов как средств против гриппозной инфекции могут привести к разработке новых противовирусных препаратов высокой эффективности, широкого спектра действия и низкой вероятности развития резистентности.
Грипп представляет собой высококонтагиозное заболевание человека. Ежегодно гриппом на планете переболевает 500 млн человек, умирает около 2 млн [23]. Вирус гриппа вызывает ежегодные эпидемии, а при появлении нового антигенного варианта вируса — пандемии, охватывающие все регионы земного шара и характеризующиеся высокой заболеваемостью, числом пациентов, нуждающихся в госпитализации и смертностью среди всех возрастных групп населения. Пандемия гриппа А(H1N1)pdm09 характеризовалась широким охватом населения многих стран мира, в том числе Российской Федерации, тяжелым клиническим течением и высокой летальностью [5, 16]. Неблагоприятные исходы чаще всего наблюдались не только у лиц с сопутствующими хроническими заболеваниями [16], но и у молодых людей без существенной предшествующей патологии, в том числе у беременных женщин [3, 4]. В последние годы отмечены также случаи инфицирования человека вирусами гриппа птичьего происхождения подтипов H5N1, H7N7 и H7N9 [39].
Вирионы гриппа представляют собой сферические или нитевидные частицы диаметром 80—100 нм, покрытые липидной оболочкой с интегрированными поверхностными гликопротеидами трех типов — гемагглютинином (HA) и нейраминидазой (NA) и вирусным ионным каналом М2. Оболочка вириона происходит от плазматической мембраны клетки-хозяина и содержит липидные «плотики» — участки липидного бислоя, обогащенные холестерином и имеющие высокую плотность и меньшую текучесть, отделенные друг от друга текучими участками мембраны малой плотности. Под липидной оболочкой расположен слой матриксного белка M1, контактирующего с одной стороны с цитоплазматическими доменами HA и NA, а с другой — с сердцевиной вириона. Сердцевинный рибонуклеопротеин (РНП) представлен восемью сегментами генома — одноцепочечной РНК негативной полярности — в комплексе с белком нуклеопротеина и тремя субъединицами полимеразного комплекса.
В настоящее время для профилактики и терапии гриппозной инфекции доступны препараты, обладающие различным механизмом активности. Следуя последовательности событий при развитии гриппозной инфекции, к ним необходимо отнести, во-первых, препараты ин- терферонов и их индукторов, стимулирующие врожденный иммунитет и ограничивающие инфекцию на ранних стадиях [55], и во-вторых, этиотропные препараты, воздействующие на специфические вирусные мишени. Международно признанными противогриппозными препаратами являются химические соединения двух групп — производные адамантана (амантадин и его аналог в России — ремантадин) [49] и ингибиторы вирусной нейрамини- дазы — осельтамивир (Тамифлю®) и занамивир (Реленца®) [8]. В США получено разрешение FDA на использование еще двух ингибиторов нейраминидазы — перамивира (Рапиакта®) внутривенно [50], и ланинамивира (Инавир®) ингаляционно [58]. В России ни перамивир, ни ланинамивир не сертифицированы. Смотрите также публикацию: о роли иммуномодуляторов в лечении и профилактике ГРИППА и ОРВИ.
Недостатком препаратов как первой, так и второй группы является снижение их эффективности при позднем начале лечения [29]. Препараты интерферонов и их индукторов проявляют максимальный уровень защиты при использовании в качестве средств экстренной профилактики, проводимой сразу после инфицирования, еще до появления клинических симптомов. Этиотропные средства эффективны в первые 48 ч после появления клинических симптомов болезни [29]. Кроме того, к этиотропным препаратам вирус, как уже упоминалось, способен быстро вырабатывать устойчивость. С середины 90-х гг., например, отмечен рост доли ремантадин-устойчивых вирусов, и на сегодняшний день практически все изоляты вируса гриппа устойчивы к препаратам адамантаново- го ряда — амантадину и ремантадину [19]. То же было отмечено в пределах подтипа сезонного гриппа A(H1N1), когда за полтора года (с ноября 2007 по март 2009 г.) уровень устойчивости к осельтамивиру вырос с 0 до 100% во всех регионах земного шара [9]. Осельтамивир-устойчивые штаммы отмечены также среди изолятов высокопатогенных вирусов гриппа птиц H5N1 [19] и H7N9 [22], а кроме того, описаны случаи формирования лекарственно-устойчивых вариантов вируса непосредственно в процессе терапии пациентов [22].
Когда речь идет о случаях тяжелого, затяжного, осложненного гриппа, включающих последствия цитокинового шторма [56], или поздних стадий болезни, для уменьшения тяжести заболевания применяют препараты третьей группы, снижающие остроту реактивных процессов. Такие процессы индуцируются вирусом, но реализуются механизмами хозяина. К ним следует отнести такие явления, как отек легких, токсический синдром, гиперпродукцию провоспалительных цитокинов, клеточную воспалительную инфильтрацию ткани легких, геморрагический синдром и т.п. Препараты этой группы не влияют на вирусную репродукцию, а представляют собой средства, влияющие на другие факторы патогенеза гриппозной инфекции, то есть средства патогенетической терапии.
Эти соединения являются важной составляющей терапии не только гриппа, но и других заболеваний со сходным патогенезом. Так, например, в качестве средства борьбы с экспрессией провоспалительных цитокинов при сепсисе был разработан антагонист TLR4 эриторан [42]. Помимо сепсиса, однако, он оказался эффективным средством защиты и от летальной гриппозной инфекции [52]. При дозе вируса, вызывающей гибель 90% животных в контроле, в группе, получавшей эриторан со 2 суток после инфицирования, гибель составила лишь 10—20%, что обеспечивало индекс защшы 78—89%, сопоставимый с показателями препарата сравнения — этиотропного средства осельтамивира. Более того, эриторан проявлял протективную активность и на поздних стадиях инфекции, вплоть до 6-х суток после заражения, когда активность осельтамивира уже не отмечалась [52]. Использование эриторана приводило также к значительной нормализации морфологической картины легких, снижая степень отека и воспалительной инфильтрации легочной ткани. При этом инфекционная активность вируса не менялась под воздействием препарата за исключением поздних стадий развития инфекции, когда размножение вируса в ткани уже не играет ведущей патогенетической роли.
Тяжесть гриппа, как уже упоминалось, во многом обусловлена дисрегуляцией воспалительного ответа на заражение вирусом. Такая инфекция характеризуется избыточной степенью воспалительных процессов и гиперпродукцией провоспалительных цитокинов, известной как «цито- киновый шторм» [56]. Одним из ведущих путей развития воспаления является каскад реакций, запускаемый ферментами циклооксигеназами COX-1 и COX-2, катализирующими превращение арахидоновой кислоты в простагландины. Ингибиторы циклооксигеназ широко используются в медицине как анальгетики и противовоспалительные средства. Классические нестероидные противовоспалительные препараты блокируют как COX-1, так и COX-2, предпочтительнее все же COX-1. В эксперименте синтетические ингибиторы COX-2 (целекоксиб) и COX-1 (SC-560) оказались способны в значительной мере снизить продукцию провоспалительных цитокинов TNFa и G-CSF в бронхолегочных смывах мышей при гриппозной инфекции [6], однако сколько- нибудь существенного влияния на смертность животных, а тем более на продукцию вируса в легких обнаружено не было. Больше того, избирательное угнетение COX-1 приводило даже к повышению смертности, потере веса животными и более выраженной гипотермии, возможно играющей в данном случае ключевую роль.
В другом исследовании [62] была показана дополнительная протективная активность комбинации двух ингибиторов оксигеназ — целе- коксиба и месалазина — с противогриппозным препаратом прямого действия занамивиром. Целекоксиб, как уже указывалось, ингибирует фермент COX-2, месалазин способен угнетать как циклооксигеназный, так и липоксигеназ- ный воспалительные пути, приводя к снижению продукции провоспалительных цитокинов и эйкозаноидов, и, как следствие, к деактивации воспалительных клеток, таких как макрофаги и нейтрофилы. Кроме того, месалазин ингибирует активацию фактора NF-kB и стимулирует синтез фосфатидной кислоты, угнетая тем самым стимуляцию апоптоза церамидами [62]. При начале лечения через 48 часов после инфицирования, что моделирует реальную ситуацию в клинической практике, смертность в группе животных, получавших комбинированное лечение, была ниже, чем в группе, получавшей за- намивир в виде монопрепарата. Снижение титра вируса в легких при этом сопровождалось нормализацией структуры легочной ткани и снижением степени ее воспалительной инфильтрации, в отличие от группы занамивира, где на фоне снижения инфекционной активности вируса не отмечалось разницы в смертности животных и воспалительной реакции в легких.
Другой противовоспалительный препарат — кетотифен — ингибирует процессы дегрануляции тучных клеток [26]. Этим достигается ограничение продукции в очаге воспаления провоспалительных медиаторов, включая гистамин, IFNy и фермент триптазу. Эти свойства кетоти- фена обуславливают его высокую протективную активность на модели летальной гриппозной инфекции, вызванной высокопатогенным вирусом гриппа подтипа H5N1 [24]. Не влияя собственно на репродукцию вируса в легких, кетотифен, тем не менее, нормализовал показатели веса животных, снижал степень отека и воспалительной инфильтрации легочной ткани, уровень апопто- тических процессов в легких и специфическую смертность животных. При этом активность кетотифена, как и в случае эриторана, превышала активность вирусспецифического препарата осельтамивира [24].
Таким образом, приведенные данные свидетельствуют, что необходимы дополнительные экспериментальные и/или клинические исследования, чтобы достоверно обосновать и стандартизировать применение ингибиторов циклооксигеназ в терапии тяжелого гриппа [25].
Важную роль в развитии воспаления в организме играет система реакций сфингозин- 1-фосфатного пути (S1P). Компоненты этого каскада играют важную роль в самых разных аспектах клеточного сигналинга и метаболизма. О важности этого пути свидетельствует, например, тот факт, что стимуляция синтеза S1P приводит к активации факторов транскрипции NF-kB и STAT3 с последующим формированием сигнальной петли, ведущей к злокачестве- ному перерождению клетки. Ингибирование этого процесса фармакологическими препаратами замедляет рост и прогрессирование опухоли и уровень воспалительных медиаторов. На 2013 г. описано свыше 25 препаратов, влияющих на компоненты S1 P-сигнального пути, из них 11 находятся на завершающих стадиях клинических испытаний или разрешены к применению как средства терапии опухолей, ревматоидного артрита, язвенного колита, рассеянного склероза, псориаза, то есть патологий, так или иначе основанных на избыточном или неадекватном воспалении [31]. Рецепторы S1P (S1PR1—S1PR5) участвуют в развитии сепсиса, изменении проницаемости сосудов и развитии отека легких. При этом именно последнее касается темы настоящего обзора и обосновывает правомочность регуляции этих компонентов при тяжелом гриппе, признаком которого является как раз отек легких.
Действительно, применение агониста S1P AAL-R (рис. 1), направленного против раннего иммунного ответа, приводило к существенному снижению смертности животных в эксперименте [59], причем степень защиты (82%) превосходила соответствующий показатель для препарата сравнения — осельтамивира (50%).
Рисунок 1. Структура агониста сфингозин-1- фосфатного пути AAL-R
Подобно кетотифену, AAL-R не влиял на репродукцию вируса в легких животных, однако в значительной степени снижал количество клеток, составляющих воспалительный экссудат. Способность к продукции противовирусных антител при этом сохранялась. Оптимальные защитные показатели были достигнуты при совместном применении осельтамивира и AAL-R. Важно также, что использование этого сфин- гозинового аналога оказалось эффективным даже спустя 4 суток после начала инфекции, что свидетельствует о высоком терапевтическом потенциале такого подхода при терапии поздних и осложненных форм гриппа [36].
Отдельного внимания заслуживает еще один подход к терапии тяжелого гриппа — повышение способности организма к преодолению патологического процесса путем минимизации вредного действия воспалительных медиаторов на сосуды. Известно, что характерным свойством гриппа является резкое повышение проницаемости гистогематического барьера, что ведет к развитию множественных геморрагий и обусловливает полиорганную недостаточность при тяжелом гриппе [28]. Для компенсации этой повышенной проницаемости сосудов в организме существуют сигнальные пути противоположной направленности, стабилизирующие состояние эндотелия и базальных мембран. Так, например, последовательность реакций, запускаемая белком Slit и опосредуемая эндотелиальным рецептором Robo4, была идентифицирована как путь, модулирующий стабильность сосудов путем упрочения контактов между эндотелиальными клетками. Активация такого пути оказалась эффективной для снижения проницаемости капилляров, мультиорганного отека и смертности при многих формах экспериментальных инфекций, включая высокопатогенный грипп H5N1 [32]. При этом сам белок Slit не влиял на продукцию вируса. Более того, что особенно важно, он не оказывал воздействия даже на уровень провоспалительных цитокинов в легких, что свидетельствует о том, что самого по себе ограничения реакции сосудов на гиперцитокинемию достаточно для снижения тяжести заболевания и уровня смертности. В описанных опытах, например, было достигнуто снижение смертности на 40—50%.
В целом, перечисленные препараты применяются как патогенетические средства для терапии тяжелого гриппа. Отличительная их особенность — высокий терапевтический эффект на поздних сроках заболевания и в случаях тяжелого и осложненного гриппа — основана на конкретных мишенях их действия и особенностях патогенеза таких форм инфекции. Известно, что с точки зрения патогенеза любой инфекционный процесс является суммой действия собственно патогена и ответной реакции организма. Как уже упоминалось, препараты прямого противовирусного действия активны лишь в первые дни заболевания, когда в организме протекают интенсивные процессы вирусной репродукции. Однако при уже запущенных реактивных процессах — цитокиновом шторме и массовой деструкции клеток, сформированном отеке легких и нарушениях микроциркуляции органов — основной вклад в патогенез гриппа вносит уже не вирусный, а именно реактивный компонент. Поэтому естественно, что препараты, направленные против этих факторов патогенеза имеют терапевтическую активность.
Выделяется, однако, еще одна, четвертая группа химических препаратов, которая заслуживает отдельного упоминания. Так же, как и препараты предыдущей группы, эти соединения воздействуют не на вирусные, а на клеточные мишени. Особенность этих мишеней состоит в том, что выполняя функции, важные для клетки, они являются необходимыми для жизненного цикла самого вируса. Емкость вирусного генома очень ограничена, и в ходе репродукции он вынужден использовать многие клеточные компоненты, в том числе метаболические и сигнальные механизмы клетки-хозяина. Естественно, что их ингибирование снижает инфекционную активность вируса и уровень его репликации.
Чтобы пояснить зависимость вирусной репродукции от клеточных метаболических путей, приведем наиболее очевидный пример — трансляция вирусных мРНК, полностью обеспечиваемая клеточной системой белкового синтеза. Угнетение этого процесса закономерно приводит к резкому снижению вирусной репродукции. Этот путь используется клеткой, например, в ходе развития антивирусного статуса при воздействии на клетки интерферона [46]. Однако селективность такого воздействия невелика, и действие интерферонов затрагивает как вирусные, так и клеточные процессы. В клетке, находящейся в антивирусном статусе, в равной степени разрушены и вирусные, и клеточные мРНК, благодаря чему подавлен синтез как вирусных, так и клеточных белков.
C развитием методических подходов к изучению внутри- и межклеточных механизмов передачи сигнала было выяснено, что многие вирусы способны использовать для собственной репликации и другие метаболические и сигнальные клеточные сети [47]. В результате многочисленных исследований были разработаны специфические ингибиторы каждого из них, а за последние несколько лет была обнаружена и охарактеризована их противогриппозная активность. Приведем наиболее изученные в этом отношении примеры.
При инфицировании клетки вирусом гриппа активируется центральный и наиболее изученный путь регуляции врожденного противовирусного иммунитета — сигнальный путь NF-kB. В клетках он контролирует экспрессию генов, регулирующих острый воспалительный ответ, адгезию и дифференцировку клеток, апоптоз и ответ на вирусную инфекцию. На ранних стадиях инфекция приводит к активации комплекса PI3K/Akt и последующей активации экспрессии NF-kB. Он, в свою очередь, регулирует экспрессию многих генов, включая, в том числе, проапоптотические факторы TRAIL, Fas и FasL. Два последних активируют эффекторные белки апоптоза — каспазы, ферменты, осуществляющие специфическую деградацию комплекса ядерных пор в инфицированной клетке [12, 13, 51, 63]. Такая деградация является одним из первых этапов многоступенчатого процесса программируемой клеточной гибели. При помощи этого механизма ценой гибели инфицированной клетки достигается ограничение размножения вируса во всем организме.
Однако следует учитывать, что в ядре зараженной клетки происходят процессы транскрипции и репликации вирусного генома, и присутствуют многочисленные фрагменты вирусных РНП, которым предстоит выйти через ядерные поры в цитоплазму для участия в сборке вирио- нов потомства. На последней стадии описанного каскада реакций — деградации ядерных пор благодаря активности каспаз — диффузия вирусных РНП через разрушенные поры существенно облегчается по сравнению с порами интактными. Таким образом, являясь исходно противовирусным сигнальным путем, призванным ограничивать вирусную репродукцию, NF-kB в определенный момент, напротив, способствует более активной реализации жизненного цикла вируса [38]. Угнетение этого сигнального пути мешает реализации вирусной программы репликации и снижает эффективность продукции вирионов потомства.
Препараты-ингибиторы этого пути принадлежат к различным химическим группам и воздействуют на различные компоненты каскада [18]. Одни из них (SC75741) нарушают связывание NF-kB с ДНК, препятствуя тем самым индукции факторов апоптоза и активации кас- паз, другие (PS-341 (бортезомиб), MG132, VL-01 и др.) являются ингибиторами протеосом, препятствуя убиквитин-зависимой деградации IkB или ингибируют NF-KB-активирующую киназу IKK (ацетилсалициловая кислота, LASAG), что в дальнейшем приводит к угнетению процесса фосфорилирования и деградации IkB. В целом, независимо от конкретной точки приложения, ингибирование тех или иных компонентов пути NF-kB приводит к снижению вирусной продукции в клетке [17].
Другим примером использования клеточных путей вирусом гриппа является сигнальный путь Raf/MEK/ERK [33]. Как известно, трансляция вирусных белков происходит в цитоплазме инфицированной клетки. Синтезированные поверхностные белки вириона — мембранный белок M1, гемагглютинин (HA) и нейраминида- за (NA) — транспортируются к плазматической мембране, встраиваются в нее и формируют кластеры. РНП потомства транспортируются к сайтам скоплений поверхностных белков, взаимодействуют с белком М1 и цитоплазматическими доменами HA и NA, что приводит к искривлению мембраны и дальнейшему почкованию ви- рионов потомства [48].
Одним из первых этапов пути Raf/MEK/ ERK, является активация белка Raf при помощи ГТФ-связанной формы белка Ras. Поскольку примерно половина новообразований человека содержит в клетках мутации в генах raf или ras, разработка ингибиторов этих генов велась исключительно в аспекте онкологических проблем. Так, шесть препаратов, доведенных до II фазы клинических исследований в области противораковой химиотерапии, оказались эффективными ингибиторами гриппозной инфекции. Это соединения, близкие между собой по химической структуре — U0126, препараты CI-1040 и PD-0325901, AZD-6244 и AZD-8330, а также препарат RDEA-119 (рис. 2). Их 50% ингибирующие концентрации в отношении вируса гриппа лежат в пределах от 1200 до 4 нМ, что свидетельствует об их высокой противовирусной активности [11, 20].
Рисунок 2. Ингибиторы сигнального пути Raf/MEK/ERK, доведенные до стадии клинических исследований
Еще один сигнальный путь — PI3K/AKT/ mTOR — также используется вирусом гриппа для обеспечения собственной репликации [12]. В клетке этот путь регулирует дифференци- ровку, метаболизм и инициацию трансляции, а также во многом пересекается с другими сигнальными путями, такими как Raf/MEK/ERK и NF-kB. В ходе вирусной репродукции этот путь используется на ранних этапах вирусной инфекции — для регуляции проникновения вируса в клетку, а также на поздних стадиях — для правильной локализации вирусных РНП и предотвращения преждевременного апоптоза инфицированных клеток. Бактериальный метаболит вортманнин и морфолиновое производное кверцетина LY294002, хотя и не были доведены до стадии клинических исследований из-за низкой биодоступности, явились, тем не менее, важным инструментом для фундаментальных исследований, связанных с передачей сигнала посредством PDK-пути, а также основой для разработки оптимизированных производных [34]. Одно из них, NVP-BEZ235 (рис. 3), проходит II фазу клинических исследований в качестве противоракового препарата [47].
Рисунок 3. Структура NVP-BEZ235 — ингибитора PI3K/AKT/mTOR [47]
Описан еще один сигнальный путь, связанный с гриппозной инфекцией. Инфицирование вирусом гриппа активирует сигнальный белок C-Jun терминальную киназу (JNK). Она, в свою очередь, активирует фактор транскрипции AP-1, который стимулирует экспрессию интерферона-в, играющего важную роль в противовирусном ответе клетки. Ингибирование JNK, следовательно, должно приводить к повышению вирусной продукции. Тем не менее, синтетические ингибиторы SP600125 и AS601245 (рис. 4), напротив, снижали уровень репродукции вирусов гриппа независимо от их подтипа. Противовирусная активность этих препаратов была обусловлена их способностью ингибировать синтез вирусных РНК при помощи не выясненного пока механизма [43]. Известно также, что SP600125 не влияет напрямую на активность вирусной РНК-полимеразы, а подавляет активность вирусного белка NS1, что, по-видимому, приводит к большей эффективности системы противовирусного врожденного иммунитета. Эти результаты были подтверждены в опытах на животных, где SP600125 снижал вирусную нагрузку в легких мышей по сравнению с контрольной группой.
Рисунок 4. Структуры SP600125 (а) и AS601245 (б) [43]
Говоря о роли клеточных киназ в цикле репликации вируса гриппа, следует также упомянуть об исследовании Konig et al. [27], в котором при помощи полногеномного скрининга были идентифицированы 295 клеточных факторов, необходимых для репликации вируса. Большая часть этих белков является киназами, то есть ферментами, регулирующими большинство клеточных сигнальных путей. В дальнейшем путем анализа стандартной библиотеки из 300 киназ [37] были изучены ингибиторы киназ широкого спектра, в результате чего идентифицировано вещество ON108110, эффективно ингибирующее 25 из 300 проанализированных киназ. При этом 8 из них оказались ранее охарактеризованы как необходимые для репликации вируса.
Одной их форм реакции клеток на стрессор- ные воздействия является аутофагия — высококонсервативный для всех эукариотических клеток процесс. Исходно аутофагия была идентифицирована как процесс, индуцированный голоданием клетки. Однако к настоящему времени известно, что он играет важную роль в физиологии и патофизиологии и является клеточным ответом на самые разные стимулы, в том числе на вирусную инфекцию. Он также может играть роль в поддержании репродукции вируса гриппа в клетках. В условиях угнетения аутофагических процессов фармакологическими препаратами или при помощи РНК-интерференции выход вирусного потомства и синтез вирусных белков значительно снижаются. Аутофагия, таким образом, является одним из ключевых процессов, обеспечивающих репликацию вируса гриппа.
Zhou et al. [64] было показано, что гриппозная инфекция запускает в зараженных клетках образование аутофагосом и стимулирует синтез белка LC3-II — специфического маркера этих орга- нелл. Обработка таких клеток 3-метиладенином или вортманнином — ингибиторами аутофа- гии — снижала выход вирусных частиц в 2—5 раз, а инфекционность вирусного потомства — приблизительно на порядок. Сходные результаты были получены при инактивации гена LC3 при помощи специфических siRNA. Механизмы подобных взаимоотношений вируса и клетки остаются до конца не выясненными.
Группой исследователей [7] была даже сконструирована система скрининга противогриппозных препаратов на основе анализа взаимодействия между компонентами аутофагического пути. Способность химических соединений угнетать взаимодействие белков Atg5, Atg12 и Atg16 была трактована как потенциальная противогриппозная активность. На панели из 83 растительных препаратов традиционной китайской медицины было идентифицировано соединение эводиамин (рис. 6) — алкалоид, содержащийся в экстракте эводии (Evodia rutecarpa Benth.) способное ингибировать образование аутофагосом, индуцированное гриппозной инфекцией, а также обладающее противовирусной активностью в отношении широкой панели вирусов гриппа разных подтипов. При этом токсичность эводиамина составила 100 мкг/мл, а показатель 50% эффективной дозы — 1,6 мкг/мл, что дает индекс селективности около 60 и свидетельствует о высоком противовирусном потенциале этого соединения и возможности дальнейшей оптимизации его структуры для повышения активности.

Рисунок 5. Структура киназного ингибитора ON108110 [37]
Рисунок 6. Структура эводиамина — ингибитора аутофагии, обладающего противогриппозной активностью [7]
Таким образом, как видно из приведенных примеров, помимо воздействия непосредственно на вирусные мишени, размножение вируса гриппа может быть подавлено при помощи модуляции клеточных сигнальных путей. Следует отметить, что несмотря ни на доказанный противовирусный потенциал, ни на разрешенное клиническое применение, большинство из перечисленных соединений не используется в качестве средства для терапии гриппа. В первую очередь, это связано с высокой комплексностью сигнальных путей-мишеней. Подавляющее большинство этих препаратов разработаны для использования в области онкологии, то есть способны вмешиваться в работу важных для клетки и организма сигнальных систем, регулирующих такие принципиальные процессы, как апоптоз, деление и дифференцировка, ангиогенез и т.д. Воздействие на них, помимо ограничения продукции вируса, приводит ко многим побочным эффектам, которые могут существенно сдвигать соотношение «выгода/риск» в сторону риска для здоровья. Кроме того, особенности фармакологического рынка диктуют необходимость разделения препаратов для лечения опухолей и респираторных вирусных инфекций. Иными словами, в практике фармакологии стремятся избегать одним и тем же действующим веществом лечить и онкологические заболевания, и грипп. Эти аспекты в некоторой степени ограничивают разработку эффективных противогриппозных препаратов, направленных на клеточные мишени.
Некоторые соединения, как было уже упомянуто, сочетают в себе несколько типов активности, каждая из которых приводит к снижению вирусной нагрузки, уменьшению интенсивности воспалительных процессов, нормализации структуры ткани при тяжелой гриппозной инфекции, и т.п. Так, например, глицирризи- новая кислота (ГК) является эффективным и малотоксичным индуктором IFNy В работе Utsunomiya et al. [57] было показано, что благодаря этой способности глицирризиновая кислота на 100% предотвращает смертность мышей от гриппозной инфекции при заражении дозой вируса A(H2N2) 10 LD50. Параллельная обработка животных антителами к IFNy полностью снимала протективный эффект ГК, что доказывает механизм ее защитного действия. С другой стороны [40], показано, что ГК является мощным имуномодулятором. В терапевтических дозах на модели гриппозной инфекции макрофагов человека, вызванной высокопатогенным вирусом гриппа H5N1, ГК снижала продукцию провоспалительных цитокинов CXCL10, IL-6 и CCL-5, а также ингибировала вирусиндуци- рованный апоптоз. При этом не было отмечено никакого влияния этого соединения на продукцию вируса в клетках.
Кроме того показано [41], что в клетках A549, являющихся аналогом альвеолоцитов человека, ГК ингибировала репликацию высокопатогенного вируса гриппа H5N1, снижала степень вирусиндуцированного апоптоза клеток и экспрессию провоспалительных цитокинов. Неясно, является ли такая активность следствием или независима от собственно ее противовирусной активности. Известно, что оболочечные вирусы в процессе слияния вирусной и клеточной мембран нуждаются в определенной текучести липидного бислоя и следовательно, зависят от реологических свойств клеточной мембраны. Так, снижение текучести мембраны на 5% ингибировало размножение ВИЧ-1 на 56%, а 5%-ное повышение текучести напротив, повышало инфекционность вируса в 2,4 раза [21]. Показано также, что те же закономерности применимы и в случае гриппозной инфекции [61]. В высоких концентрациях ГК препятствует интернализации вирионов гриппа, взаимодействуя с мембранами и снижая их текучесть. Эти свойства объясняют также активность ГК in vitro в отношении других вирусов — SARS-ассоциированного коронавируса, ВИЧ-1, респираторно-синцитиального вируса, вируса гепатита В, арбовирусов, вируса осповакцины, вирусов группы герпеса (вирус варицелла- зостер, вирус простого герпеса 1 типа, вирус Эпштейна—Барр, цитомегаловирус, вирус саркомы Капоши) и вируса везикулярного стоматита [15]. В дополнение к уже описанным механизмам подавления вирусной репродукции, известно, что ГК снижает мембранный транспорт и сиалирование поверхностного антигена вируса гепатита В, а также ингибирует ферменты фосфорилирования при инфекции, вызванной вирусом везикулярного стоматита [15].
Таким образом, несмотря на противоречивые сведения о наличии у ГК прямой противовирусной активности в отношении вируса гриппа, можно говорить, что она является, тем не менее, потенциально важным компонентом комплексной противогриппозной терапии благодаря наличию других типов биологической активности, важных при лечении тяжелой и осложненной инфекции. В наших собственных исследованиях [1, 2] продемонстрирована протективная активность ГК против вирусов гриппа A(H1N1) pdm09 и A(H3N2). Снижение титра вируса в ткани легких при этом составило приблизительно 1 порядок. При этом достоверного противовирусного действия в культуре клеток MDCK отмечено не было. Добавление к ГК иммуномодулирующего дипептида а-глутамилтриптофана повышало противовирусную активность комбинации, снижая вирусный титр на 5—6 порядков по сравнению с контролем и гибель животных — на 77%. Таким образом, комбинация двух препаратов, неактивных in vitro, имела выраженный эффект in vivo, и механизмы этой активности следует расшифровывать в дальнейших исследованиях.
Преимущества описанного подхода к терапии гриппа очевидны. В отличие от этиотропных соединений, против которых вирус способен вырабатывать устойчивость, препараты против клеточных мишеней лишены этого недостатка. По сравнению с вирусом гриппа, клетка — гораздо более сложная система, обладающая многими уровнями контроля за возникновением мутаций и их коррекции, вплоть до гибели клетки, несущей эти изменения. Во-вторых, в дополнение к антивирусной активности, многие препараты этой группы обладают другими видами биологической активности — противовоспалительной, цитопротекторной и др. Такая активность не столь важна в случаях заболеваний средней тяжести, однако становится жизненно важной, когда речь идет о случаях позднего, тяжелого и осложненного гриппа, где ведущую роль в патогенезе играют не вирусные, а реактивные процессы. Список препаратов — потенциальных кандидатов для комплексной терапии гриппа, разумеется, не исчерпывается соединениями, перечисленными в настоящем обзоре. С развитием представлений о патогенезе гриппозной инфекции как о сложном процессе, включающем связанные и взаимозависимые каскады реакций, появляются основания включать все больше число ингибиторов каждого из них в число лекарств, способных нормализовать течение гриппа. Сюда относятся статины, ингибиторы ангиотензин-конвертирующего фермента и блокаторы ангиотензинового рецептора, агонисты рецепторов, активируемых перокси- сомными пролифераторами и агонисты АМФ- активируемых протеинкиназ, и др. [14].
В настоящем обзоре мы ограничились терапией одной только гриппозной инфекции. Описанные соединения, однако, воздействуют на процессы, общие для тяжелых воспалительных заболеваний, независимо от конкретной этиологии — продукцию провоспалительных цитокинов, миграцию клеток в очаг воспаления, и т.п. Поэтому следует ожидать, что соединения, активные при гриппе, окажутся также эффективными и при других вирусных заболеваниях сходного патогенеза, как это имеет место в случае ГК. Следовательно, дальнейшие исследования в области поиска и оптимизации ингибиторов клеточных компонентов как средств против гриппозной инфекции могут привести к разработке новых противовирусных препаратов высокой эффективности, широкого спектра действия и низкой вероятности развития резистентности.
Таким образом, препараты для терапии гриппозной инфекции следует разделять как по механизмам действия, так и по срокам применения. Во-первых, это препараты, наиболее эффективные для профилактики и экстренной профилактики (интерфероны и их индукторы). Во-вторых, это препараты этиотропного механизма, использование которых необходимо на всех сроках гриппа после постановки диагноза, но эффективно лишь на ранних стадиях заболевания. Наконец, в-третьих, на дальних стадиях и в случаях тяжелой и осложненной инфекции необходимо использование соединений патогенетического механизма действия, которые могут снижать или не снижать собственно вирусную репродукцию. При этом применение препаратов, действующих на систему врожденного иммунитета, является абсолютно целесообразным как в раннем периоде терапии, так и в более поздние сроки, при этом сочетанное применение специфических и неспецифических препаратов представляет собой оптимальный путь повышения эффективности терапии гриппа.
Дополнительная информация о МБНПК Цитомед: клинические исследования препаратов.