интервенционная радиология что это
Радиология интервенционная
Полезное
Смотреть что такое «Радиология интервенционная» в других словарях:
Радиология — Радиология раздел медицины, изучающий применение ионизирующих излучений для диагностики (радиодиагностика) и лечения (радиотерапия) различных заболеваний, а также заболевания и патологические состояния, возникающие при воздействии… … Википедия
Рентгенология — I Рентгенология медицинская область клинической медицины, изучающая применение рентгеновского излучения для исследования строения и функций органов и систем, а также для диагностики болезней человека. Возникла в конце 19 в. после открытия в 1895… … Медицинская энциклопедия
Я́звенная боле́знь — хроническое рецидивирующее заболевание, основным признаком которого является образование дефекта (язвы) в стенке желудка или двенадцатиперстной кишки. В зарубежной литературе для обозначения этого заболевания обычно используют термины «язва… … Медицинская энциклопедия
Рентгенодиагностика — I Рентгенодиагностика распознавание повреждений и заболеваний различных органов и систем человека с помощью рентгенологического исследования. На начальном этапе развития рентгенологическая область Р. ограничивалась исследованиями органов дыхания… … Медицинская энциклопедия
Рентгеноконтра́стные сре́дства — препараты, заметно отличающиеся по способности поглощать рентгеновское излучение от биологических тканей, в связи с чем их используют для визуализации структур органов и систем, не выявляемых или плохо выявляемых при обычной рентгенографии,… … Медицинская энциклопедия
Ультразвукова́я диагно́стика — распознавание патологических изменений органов и тканей организма с помощью ультразвука. Основана на принципе эхолокации приеме сигналов посланных, а затем отраженных от поверхностей раздела тканевых сред, обладающих различными акустическими… … Медицинская энциклопедия
Список научных журналов ВАК Минобрнауки России c 2011 года — Это служебный список статей, созданный для координации работ по развитию темы. Данное предупреждение не ус … Википедия
Эмболизация — Эта статья посвящена методу лечения. О патологическом состоянии см. Эмболия. Микрофотография эмболизационного материала в артерии почки, удалённой в связи с онкоз … Википедия
Эндоваскулярная хирургия — (рентгенохирургия, интервенционная кардиология и интервенционная радиология) хирургические вмешательства, проводимые на кровеносных сосудах чрезкожным доступом под контролем методов лучевой визуализации с использованием специальных… … Википедия
Радиотерапия — Радиотерапия, лучевая терапия лечение ионизирующей радиацией (рентгеновским, гамма излучением, бета излучением, нейтронным излучением, пучками элементарных частиц из медицинского ускорителя). Применяется в основном для лечения… … Википедия
Портал:Медицина — Начинающим · Сообщество · Порталы · Награды · Проекты · Запросы · Оценивание География · История · Общество · Персоналии · Религия · Спорт · Техника · Наука · Искусство · Философия … Википедия
Интервенционная радиология
Интервенционная радиология – это медицинское направление, которое подразумевает совокупность методично выполняемых исследовательских и лечебных манипуляций, осуществляемых под контролем УЗИ, рентгенографии, компьютерной и магнитно-резонансной томографий (КТ и МРТ).
Метод появился недавно, но уже стремительно развивается и применяется в современных медицинских учреждениях по всем миру. Он удачно сочетает в себе одновременную диагностику и лечение без применения скальпеля.
Основой выполнения рентгенохирургических (интервенционных) операций являются кабинеты ангиографии, которые оборудованы цифровой системой редактирования изображений последнего поколения. Благодаря изобретению неионных котрастосодержащих медпрепаратов с низкой токсичностью, а также гибких зондов с гидрофильным покрытием существует возможность не только подробно обследовать патологическую область, но и прицельно на нее воздействовать. Это помогает бороться со сложными формами заболеваний по разным направлениям медицины.
Основные виды патологий, при которых применяется данная методика:
Отделение интервенционной радиологии
В современных клиниках данный метод широко используется при:
Интервенционная радиология применяется в различных областях медицины: урологии, гинекологии, кардиохирургии, гематологии, ортопедии, онкологии, эндокринологии, гематологии, сосудистой хирургии, неврологии, нейрохирургии и др.
Интервенционная радиология
Когда речь заходит об интервенционной радиологии, пациенты зачастую понимают ее как «хирургию с рентгеном». Однако рентгенассистированная хирургия – лишь малая часть большой современной и быстроразвивающейся области радиологической медицины.
Интервенционная радиология находится на стыке лучевой диагностики и хирургии. Она включает в себя комплекс лечебных и диагностических манипуляций и оперативных вмешательств, осуществляемых под контролем лучевых методов: ультразвука, компьютерной томографии, магнитно-резонансной томографии и рентгена.
Малая инвазивность интервенционной радиологической диагностики и лечения позволяет применять их в нейрохирургии, сосудистой хирургии, кардиохирургии, онкологии, ортопедии и травматологии, эндокринологии, гепатологии и других областях медицины для взрослых и детей.
Использование лучевых методов диагностики в нейрохирургии, кардиохирургии, сосудистой хирургии в разы повышает шансы пациентов не только на выживание, но и на полное восстановление.
Интервенционная радиологическая поддержка хирургических операций позволяет врачу получать «картинку» в реальном времени, что повышает точность и быстроту манипуляций. Это важно, когда счет идет на минуты и нужна филигранная точность.
Применение интервенционной радиологии позволяет:
Интервенционная радиология как метод поддержки диагностических и хирургических манипуляций может использоваться по показаниям в любой области хирургии, в комплексе мер лечения любого заболевания.
В клинике К+31 широко применяются все возможности интервенционной радиологии.
Некоторые виды патологий, в лечении которых применяется интервенционная радиология:
Эндоваскулярная/сосудистая хирургия: облитерирующий атеросклероз артерий нижних конечностей; аневризмы сосудистой системы; синдром Лериша – поражение атеросклеротическими бляшками магистральных подвздошных артерий, являющихся главными магистралями нижних конечностей, что ведет к ишемии конечностей; тромбоэмболия легочной или периферических артерий, вазоренальная гипертензия; облитерирующий эндартериит (прогрессирующее сужение просвета артерий); тромбоз глубоких вен. Артериовенозные мальформации – аномалии развития сосудов, характеризующиеся скоплением (клубом), ведущие к нарушению кровотока, как следствие – к повышению внутрисосудистого давления, увеличению диаметра вен, разрастанию клубков, возрастанию нагрузки на сердце, нарушению питания мозга.
Экстренная эндоваскулярная хирургия: устранение обширных кровотечений, повреждений магистральных сосудов.
Кардиология: ишемическая болезнь сердца; острый инфаркт миокарда; стенозы клапанов сердца и сосудов; постинфарктный кардиосклероз; сердечные пороки и недостаточность; постинфарктные аневризмы, стенокардия.
Диагностика наличия доброкачественных и злокачественных опухолей; их лечение.
Нейрохирургия: инсульты – геморрагические и ишемические.
Виды лучевой диагностики заболеваний и как проводится
Лучевая диагностика массово применяется как при соматических заболеваниях, так и в стоматологии. В РФ ежегодно выполняется более 115 миллионов рентгенологических исследований, более 70 миллионов ультразвуковых и более 3-х миллионов радионуклидных исследований.
Что это такое?
Технология лучевой диагностики является практической дисциплиной, изучающей воздействия разных типов излучения на человеческий организм. Ее цель – выявлять скрытые заболевания, путем исследования морфологии и функций здоровых органов, а также имеющих патологии, включая все системы жизнедеятельности человека.
Недостаток: угроза нежелательного радиационного облучения пациента и медицинского персонала.
Методы и методики
Рентгенологическое исследование, в основе которого лежит метод создания рентгеновского снимка внутренних органов человека подразделяется на:
В данном исследовании важно провести качественную оценку рентгенограммы больного и правильно рассчитать дозовую нагрузку излучения на пациента.
Ультразвуковое исследование, в ходе которого формируется ультразвуковое изображение, включает анализ морфологии и систем жизнедеятельности человека. Помогает выявить воспаления, патологии и другие отклонения в организме исследуемого.
Исследование на основе компьютерной томографии, в ходе которого с помощью сканера формируется КТ-изображение, включает такие принципы сканирования:
Магнитно-резонансное исследование (МРТ) включает следующие методики:
Радионуклидное исследование предполагает применение радиоактивных изотопов, радионуклидов и подразделяется на:
Фотогалерея
Рентгенодиагностика
Рентгенодиагностика распознает заболевания и повреждения в органах и системах жизнедеятельности человека опираясь на изучение рентгеновских снимков. Метод позволяет обнаружить развитие заболеваний, определяя степени поражения органов. Предоставляет информацию об общем состоянии пациентов.
В медицине рентгеноскопию используют для исследования состояния органов, процессы работы. Дает информацию о расположении внутренних органов и помогает выявить патологические процессы происходящие в них.
Также следует отметить следующие методы лучевой диагностики:
Радионуклидная диагностика
Радионуклидная диагностика предполагает регистрацию излучений искусственно введенного в организм радиоактивного вещества (радиофармпрепараты). Способствует изучению человеческого организма в целом, а также его клеточного метаболизма. Является важным этапом выявления онкологических заболеваний. Определяет активность клеток пораженных раком, процессы болезни, помогая оценивать методы лечения рака, предотвращая рецидивы заболевания.
Методика позволяет вовремя обнаруживать формирование злокачественных новообразований на ранних стадиях. Способствует уменьшению процента смертности от рака, сокращая число случаев рецидива у больных онкологией.
Ультразвуковая диагностика
Ультразвуковой диагностикой (УЗИ) называют процесс основанный на малоинвазивном методе исследований человеческого организма. Его суть состоит в особенностях звуковой волны, ее способности отражаться от поверхностей внутренних органов. Относится к современным и наиболее продвинутым методам исследования.
Особенности ультразвукового исследования:
Магнитно-резонансная томография
Метод основывается на свойствах атомного ядра. Оказываясь внутри магнитного поля атомы излучают энергию имеющую определенную частоту. В медицинском исследовании зачастую применяют резонанс излучения ядра атома водорода. Степень интенсивности сигнала напрямую связано с процентным соотношением воды в тканях исследуемого органа. Компьютер трансформирует резонансное излучение в высококонтрастный томографический снимок.
МРТ выделяется на фоне других методик, способностью предоставлять информацию не только структурных изменений, но и локального химического состояния организма. Этот тип исследования не инвазивен и несвязан с применением ионизирующего облучения.
Термография
Метод включает регистрацию видимых изображений теплового поля в человеческом теле, излучающего инфракрасный импульс, который может быть считан непосредственно. Или показан на экране компьютера в виде теплового образа. Полученную таким путем картинку называют термограммой.
Термографию отличает высокая точность измерений. Она дает возможность определять разность температур в организме человека до 0,09%. Эта разность возникает в результате перемен в кровообращении внутри тканей тела. При низкой температуре можно говорить о нарушении кровотока. Высокая температура – симптом воспалительного процесса в организме.
СВЧ-термометрия
Радиотермометрией (СВЧ-термометрией) называется процесс измерения температур в тканях и внутри органов тела на основе их собственного излучения. Врачи производят измерения температуры внутри тканевого столба, на определенной глубине при помощи микроволновых радиометров. Когда установлена температура кожи в конкретном отделе, далее вычисляется температура глубины столба. То же самое происходит при регистрации температуры волн разной длины.
Эффективность метода заключается в том, что температура глубинной ткани в основном стабильна, однако быстро изменяется при воздействии медикаментозными средствами. Допустим если применять сосудорасширяющие препараты. На основе полученных данных можно проводить фундаментальные исследования заболеваний сосудов и тканей. И добиться снижения уровня заболеваний.
Магнитно-резонансная спектрометрия
Магнитно-резонансной спектроскопией (МР-спектрометрией) называется не инвазивный метод исследования метаболизма головного мозга. В основе протонной спектрометрии лежит изменение частот резонанса протонных связей, что находятся в составе разных хим. соединений.
МР-спектроскопия используется в процессе исследования онкологий. На основе полученных данных можно прослеживать рост новообразований, с дальнейшим поиском решений по их устранению.
Клиническая практика использует МР-спектрометрию:
Для сложных случаев спектрометрия является дополнительной опцией при дифференциальных диагностиках вместе с получением перфузийно-взвешеного изображения.
Еще один нюанс при использовании МР-спектрометрии состоит в разграничении выявленного первичного и вторичного поражения тканей. Дифференциация последних с процессами инфекционного воздействия. Особенно важна диагностика абсцессивов в головном мозге на основании диффузионно-взвешенного анализа.
Интервенционная радиология
Лечение при помощи интервенционной радиологии основано на применении катетера и прочего малотравматичного инструментария вместе с использованием локальной анестезии.
По методам воздействия на черезкожные доступы интервенционная радиология разделяется на:
ИН-радиология выявляет степень заболевания, проводит пункционные биопсии, опираясь на гистологические исследования. Непосредственно связана с черезкожными безоперационными методами лечения.
Для лечения онкологий с применением интервенционной радиологии используют локальную анестезию. Далее происходит инъекционное проникновение в паховую область через артерии. Затем в новообразование вводят лекарство или изолирующие частицы.
Устранение закупоренности сосудов, всех кроме сердечных проводится при помощи балионной ангеопластики. То же касается лечения аневризм, посредством освобождения вен, осуществляя ввод лекарства через пораженную область. Что в дальнейшем ведет к исчезновению варикозных уплотнений и других новообразований.
Это видео расскажет подробнее о средостении в рентгеновском изображении. Видео снято каналом: Секреты КТ и МРТ.
Виды и применение рентгеноконтрастных препаратов в лучевой диагностике
В ряде случаев необходимо визуализировать анатомические структуры и органы, неразличимые на обзорных рентгенограммах. Для исследования в такой ситуации применяют метод создания искусственного контраста. Для этого, в область, которую необходимо исследовать, вводят специальное вещество, увеличивающее контрастность области на снимке. Подобного рода вещества имеют способность усиленно поглощать или наоборот уменьшать поглощение рентгеновского излучения.
Контрастные вещества разделяют на препараты:
Жирорастворимые рентген контрастные препараты создаются на базе растительных масел и используются в диагностике структуры полых органов:
Спирторастворимые вещества применяют для исследования:
Нерастворимые препараты создаются на основе бария. Их используют для перорального введения. Обычно с помощью таких препаратов исследуют составляющие пищеварительной системы. Сульфат бария принимают в виде порошка, водянистой суспензии или пасты.
К веществам с малым атомным весом относят уменьшающие поглощение рентгеновских лучей газообразные препараты. Обычно газы вводят для конкурирования рентгеновских лучей в полости тела или полые органы.
Вещества с большим атомным весом поглощают рентгеновское излучение и делятся на:
Водорастворимые вещества вводят внутривенно для лучевых исследований:
В каких случаях показана лучевая диагностика?
Ионизирующее излучение ежедневно используется в больницах и клиниках для проведения диагностических процедур визуализации. Обычно лучевая диагностика используется для назначения точного диагноза, выявления заболевания или травмы.
Назначить исследование вправе только квалифицированный врач. Однако существуют не только диагностические, но и профилактические рекомендации исследования. К примеру, женщинам старше сорока лет рекомендуется проходить профилактическую маммографию не реже, чем раз в два года. В учебных заведениях зачастую требуют ежегодно проходить флюорографию.
Противопоказания
Лучевая диагностика практически не имеет абсолютных противопоказаний. Полный запрет на диагностику возможен в отдельных случаях, если в теле пациента присутствуют металлические предметы (такие как имплантат, клипсы и т. п.). Вторым фактором, при котором процедура недопустима, является наличие кардиостимуляторов.
Относительные запреты на лучевую диагностику включают:
Где применяется лучевая диагностика
Лучевую диагностику широко используют для выявления заболеваний в следующих отраслях медицины:
Также лучевую диагностику проводят при:
В педиатрии
Существенным фактором, который может повлиять на результаты медицинского обследования является внедрение своевременной диагностики детских заболеваний.
Из важных факторов, ограничивающих рентгенографические исследования в педиатрии можно выделить:
Если говорить о важных методиках лучевых исследований, применение которых очень сильно повышает информативность процедуры, стоит выделить компьютерную томографию. Лучше всего в педиатрии использовать ультразвуковое исследование, а также магнитно-резонансную томографию, так как они полностью исключают опасность ионизирующего излучения.
Безопасный метод исследования детей это МРТ, в связи с хорошей возможностью применения тканевого контраста, а также многоплоскостных исследований.
Лучевое исследование детям может назначать только опытный педиатр.
В стоматологии
Нередко в стоматологии используют лучевую диагностику для обследования различных отклонений, к примеру:
Чаще всего в челюстно-лицевой диагностике применяют:
В кардиологии и неврологии
МСКТ или мультиспиральная компьютерная томография позволяет обследовать не только непосредственно сердце, но и коронарные сосуды.
Данное обследование является наиболее полным и позволяет выявить и своевременно диагностировать широкий спектр заболеваний, например:
Лучевая диагностика ссс (сердечно-сосудистой системы) позволяет оценить область закрытия просвета сосудов, выявить бляшки.
В неврологии также нашли применение лучевой диагностике. Пациенты с заболеваниями межпозвонковых дисков (грыжи и протрузии) получают более точные диагнозы, благодаря лучевой диагностике.
В травматологии и ортопедии
Наиболее распространённым методом лучевого исследования в травматологии и ортопедии является рентген.
Обследование позволяет выявить:
Наиболее действенные методы лучевой диагностики в травматологии и ортопедии:
Заболеваний органов дыхания
Наиболее применяемым методами обследования органов дыхания являются:
Реже применяют рентгеноскопию и линейную томографию.
На сегодняшний день допустима замена флюорографии на низкодозную КТ органов грудной клетки.
Рентгеноскопия при диагностике органов дыхания существенно ограничивается серьёзной лучевой нагрузкой на пациента, меньшей разрешающей способностью. Её проводят исключительно соответственно строгим показаниям, после проведения флюорографии и рентгенографии. Линейную томографию назначают только в случае невозможности провести КТ.
Обследование позволяет исключить или подтвердить такие заболевания, как:
В гастроэнтерологии
Лучевая диагностика желудочно-кишечного тракта (ЖКТ) проводится, как правило, с использованием рентгеноконтрастных препаратов.
Таким образом могут:
Иногда специалисты с помощью лучевой диагностики отслеживают и снимают на видео процесс глотания жидкой и твёрдой пищи, чтобы проанализировать и выявить патологии.
В урологии и неврологии
Сонография и УЗИ являются одними из самых распространённых методов обследования мочевыделительной системы. Обычно такие исследования позволяют исключить или диагностировать рак или кисту. Лучевая диагностика помогает визуализировать исследование, даёт больше информации, чем просто общение с больным и пальпация. Процедура занимает немного времени и безболезненна для пациента, при этом позволяет повысить точность диагноза.
При неотложных состояниях
Способом лучевого исследования можно выявить:
Лучевая диагностика при неотложных состояниях позволяет правильно оценить состояние больного и своевременно провести ревматологические процедуры.
При беременности
С помощью различных процедур возможна диагностика уже у плода.
Благодаря УЗИ и ЦДК есть возможность:
На данный момент лишь УЗИ из всех методов лучевой диагностики считается полностью безопасной процедурой при обследовании женщин в период беременности. Чтобы проводить любые другие диагностические исследования беременных, им обязательно иметь соответствующие медицинские показания. И в этом случае – самого факта беременности недостаточно. Если рентген или МРТ на сто процентов не подтверждены медицинскими показаниями, врач вынужден будет искать возможность перенести обследование на период после родов.
Мнение специалистов на этот счет сводится к тому, чтобы исследования КТ, МРТ или рентгеном не проводились в первый триместр беременности. Потому что в это время происходит процесс формирования плода и воздействия любых методов лучевой диагностики на состояние эмбриона до конца неизвестно.
Интервенционная радиология что это
Российский онкологический научный центр им. Н.Н. Блохина РАМН, Москва
Резюме. История развития интервенционной радиологии, системы наведения и контроля, основные интервенционные радиологические процедуры в онкологии.
Ключевые слова: онкология, интервенционная радиология.
История развития интервенционной радиологии
Стремление рентгенологов расширить свои чисто диагностические возможности до лечебных, с одной стороны, и желание хирургов достичь операционных результатов быстрее, менее травматично и не прибегая к общему наркозу — с другой, привели к рождению специальности «интервенционная радиология».
Впервые термин «интервенционная радиология» ввел Alexander Margulis в 1967 г., когда он произвел удаление камней из Т-образного желчного дренажа, используя в качестве контроля рентгеноскопию (Margulis A.R., Newton Т. Н., Najarian J.S., 1965; Margulis A.R., 1967). Однако пионерами интервенционной радиологии следует считать Charles Dotter и Melvin Judkins, которые еще в 1964 г. описали истинную интервенционную процедуру — расширение катетером артерии стенозированной атеросклеротической бляшкой (Dotter C.T., Judkins M.P., 1964).
Следует признать, что существующий русский аналог термина «интервенционная радиология» — «рентгенохирургия» не отвечает сегодняшним требованиям, поскольку для контроля интервенционных процедур стали применять и ультразвук, и магнитный резонанс. Поэтому мы используем исторически сложившийся в мировой литературе термин «интервенционная радиология» (ИР).
ИР — быстро развивающаяся специальность, особенно в онкологии. Она расширяет возможности обычных диагностических методик до активного выполнения терапевтических процедур под контролем одного из видов интроскопии. Концепция стала клинической действительностью с начала 70-х гг., когда S. Baum и М. Nusbaum сообщили об ангиографиче-ской методике диагностики и лечения желудочно-кишечного кровотечения (Baum S., Nusbaum M., 1971), a H.J. Burhenne описал эффективный чрескож-ный катетерный метод удаления желчных камней (Burhenne H.J., 1973). Последующие важные этапы развития ИР включили:
— использование ультразвука и РКТ для контроля аспирационной игольной биопсии и дренирования жидкостьсодержащих образований;
— расширение баллонными катетерами стриктур сосудов (ангиопластика);
— методы сосудистой эмболизации и эмболоте-рапии;
— чрескожные пункционные технологии для манипуляции на желчном и мочевом трактах.
В последнее время в клинической онкологии стало широко применяться восстановление просвета различных трубчатых структур с помощью специальных устройств (протезирование), а также создание искусственных соустий (анастомозов) между органами (для отведения физиологических и патологических жидкостей).
Одну из ведущих ролей в становлении ИР сыграл технический прогресс, который создал стимул для появления радиологических вмешательств, включающих рентгенотелевидение, ангиографическую технологию по методике Seldinger, ультразвук, РКТ и специальные медицинские инструменты типа дистанционно управляемого катетера, баллонного катетера, сверхскользкого проводника, сетчатого стента и тонкой иглы CHIBA с внутренним просветом 0,5 мм при наружном диаметре 0,7 мм.
В пользу ухода от большой хирургии и общей анестезии в сторону интервенционных радиологических процедур говорит уменьшение числа осложнений, времени пребывания в стационаре и стоимости лечения. По сравнению с большой хирургией малоинвазивные интервенционные радиологические операции имеют дополнительное преимущество в легкой повторяемости без большого дополнительного риска.
Нередко интервенционные радиологические методики предпочтительнее полноценного хирургического вмешательства соматически отягощенным и ослабленным онкологическим больным из-за высокого риска или невозможности выполнения общей анестезии.
Эти процедуры также могут использоваться для стабилизации состояния пациентов и улучшения метаболических и функциональных показателей перед предстоящей радикальной операции. Следовательно, ИР обладает бесспорной привлекательностью и как самостоятельный метод лечения, и как возможность расширения лечебных возможностей у ранее инкура-бельных больных.
В период формирования специальности интервенционные подходы использовали представители разных направлений в радиологии, но в основном это были специалисты с опытом проведения ангиографии и трактовки нейрорадиологии, а также специалисты по РКТ и УЗИ. Тем не менее ИР — все еще новая область, и существующие возможности метода, и терминологические определения должны, конечно, совершенствоваться.
В онкологической практике в настоящее время применяются различные ИР-вмешательства, которые условно можно разделить на следующие группы:
А. пункционные методики:
• биопсия (аспирационная, щипцовая);
д ренирование патологических жидкостных скоплений и физиологических жидкостей (затеки, гематомы, абсцессы, внутрипротоковая желчная ги-перпрессия, уростазы, гидроперикард и др.);
ертебропластика (укрепление специальным цементом тел позвонков при их литическом поражении опухолью);
• радиотермоабляция (прецизионное термическое разрушение опухолевого новообразования с помощью специального электрода, внедренного в опухоль пункционным способом под лучевым контролем);
• нейролизис (избавление от хронической боли путем специального точечного воздействия на нервные сплетения);
• гастростомия, лапаро- и торакоцентез пункци-онным методом.
Б. Методики, направленные на восстановление проходимости полых органов и трубчатых анатомических структур:
расширение просвета (дилатация стриктур пищеварительных, дыхательных, билиарных и мочевых путей);
тентирование трубчатых структур (желчные протоки, трахея, мочеточники, пищеварительная трубка);
настомозирование (компрессионные с использованием специальных магнитных элементов и пункционные соустья).
В. Внутрисосудистые вмешательства:
• эмболизация или эмболотерапия опухолей (ишемизирующее или химическое воздействие на опухолевую ткань с целью остановки ее роста или разрушения);
редварительная установка кава-фильтров для профилактики эмболии легочной артерии во время и после обширных операций у тяжелых онкологических больных;
• извлечение инородных тел из сосудов (оторвавшиеся ИР-катетеры, проводники и др.);
Темостаз, либо профилактика кровотечений (транскатетерная эмболизация кровоточащих сосудов и сосудистых фистул распадающихся опухолей, при послеоперационных кровотечениях, при кровотечениях, осложнивших ИР-манипуляции, либо то же, осуществляемое превентивно для предотвращения ожидаемых массивных кровотечений).
Г. окклюзия патологических соустий:
• закрытие патологических соустий ИР-установкой специальных стент-окклюдеров.
О перспективности данного направления в онкологии говорит тот факт, что количество выполняемых в ГУ РОНЦ им. Н.Н. Блохина РАМН ИР-процедур удваивается каждые 3 — 4 года как за счет увеличения количества уже освоенных методик, так и за счет внедрения новых.
Системы наведения и контроля
ИР-процедуры выполняются под флюороскопиче-ским, ультразвуковым или РКТ-контролем или в комбинации этих методов. Обычно выбирается та техника, которая лучше визуализирует патологический процесс и доступ к нему. В тех случаях, когда радиологические методы равноценны по информативности, выбирается либо тот, который проще и дешевле, либо тот, которым лучше владеет интервенционный радиолог.
Для билиарного дренирования, нефростомии, биопсии опухоли, аспирации кисты или дренирования абсцесса предпочтительна флюороскопическая установка на дуге или двухпроекционный аппарат, но и обычной однопроекционной рентгенодиагности-ческой машины бывает достаточно для проведения указанных процедур.
Ультразвуковой контроль пункции быстрее, дешевле, доступнее при экстренной ситуации и более гибок, чем РКТ. Однако, в отличие от УЗИ, возможности РКТ позволяют визуализировать иглу и в легочной ткани, и среди костных структур. Высокая чувствительность ультразвука в выявлении жидкости делает его методом выбора для контроля пункций и аспираций кист и абсцессов. Недавние технологические новшества УЗИ и РКТ увеличили скорость и качество получения изображения и таким образом увеличили точность позиционирования иглы. Эффект Допплера позволяет ультразвуковому методу с большой точностью дифференцировать от крови патологические жидкостные образования в сосудах, что дает возможность избежать серьезных осложнений. Последнее поколение томографов, оснащенных спиралью, широким гентри и возможностью нескольких «срезов» за один оборот трубки, представляют интервенционному радиологу дополнительные возможности, вплоть до работы в реальном масштабе времени РКТ-флюороскопии.
Комбинация флюороскопии, ультразвука и РКТ
Наличие в клинике всех указанных видов лучевого контроля позволяет их сочетать в различных вариантах, что, с одной стороны, увеличивает точность наведения при пункции, а с другой — дает возможность контролировать инструментальные манипуляции внутри патологического процесса.
На практике это выглядит так: пункция патологического очага, содержащего жидкость (абсцесс, киста, гематома и др.), осуществляется под контролем УЗИ или РКТ, а установка дренажа и укладка его рабочей части в полости — под контролем флюороскопии. В связи с этим некоторые крупные производители диагностической аппаратуры уже начали выпускать аппараты, сочетающие разные виды визуализации (УЗИ + флюороскопия, РКТ + флюороскопия).
Обезболиванием называется уменьшение боли при сохранении сознания. Для успешного выполнения интервенционных радиологических процедур адекватное обезболивание необходимо. Прежде всего радиолог согласует выполнение самой процедуры и вид обезболивания с врачом, направившим пациента, и самим пациентом. Многие больные пожилого возраста отягощены соматически. Большинство ИР-процедур выполняется в несколько этапов, причем должна быть обеспечена готовность пациента возвратиться в кабинет для дополнительных манипуляций, являющихся необходимыми для успеха окончательного лечения. Правильное планирование и знание доступных средств обезболивания и их потенциальных опасностей могут минимизировать дискомфорт для больного и облегчить врачу исполнение манипуляции.
Важным компонентом в проведении ИР-процедуры является премедикация. Первичная цель премедикации — успокоить больного. Радиологу нужен спокойный адекватный пациент, способный сотрудничать, вплоть до задержки дыхания и поворотов на столе. Вторая цель — облегчить боль. Это включает и ту боль, которая связана непосредственно с самой болезнью, и ту, которая может возникнуть во время процедуры.
Мы используем премедикацию и обезболивание наркотиками с целью:
1) снижения уже имеющейся боли от самой болезни и достижения предоперационной седации;
2) поддержания необходимого уровня препарата в крови в начале потенциально болезненной процедуры дополнительным введением наркотиков (при необходимости).
Наиболее серьезный неблагоприятный результат действия наркотиков — угнетение дыхания, глубина которого зависит от дозы. Это редкое осложнение в стандартных ситуациях, за исключением пожилых или тяжелых ослабленных больных, которым доза наркотического анальгетика должна быть уменьшена. Угнетение дыхания и все другие действия наркотика можно полностью снять налоксоном. Следует помнить, что наркотики стимулируют спазм гладкой мускулатуры и могут приводить к спазму фатерова сосочка и повышению давления в желчных протоках.
В последнее время для ИР-процедур, особенно на мочевом тракте, хорошо себя зарекомендовала дуральная анестезия.
Амбулаторные ИР-процедуры обычно кратки и малоболезненны, поэтому необходимость в премедикации возникает редко. Амбулаторным пациентам ИР-процедуры производятся натощак и в присутствии ответственного взрослого. Большинство амбулаторных процедур выполняется в первой половине дня для возможности постпроцедурного контроля (1—3 ч) за пациентом в условиях интервенционного кабинета.
Всем больным дополнительно пр оизводится местная анестезия прокаином (0,25—0,5%). Дозы препарата значительно варьируют от 5—10 мл при диагностической пункции до 50—100 мл при нефро-стомии. При непереносимости прокаина его можно заменить лидокаином.
Биопсия под лучевым контролем
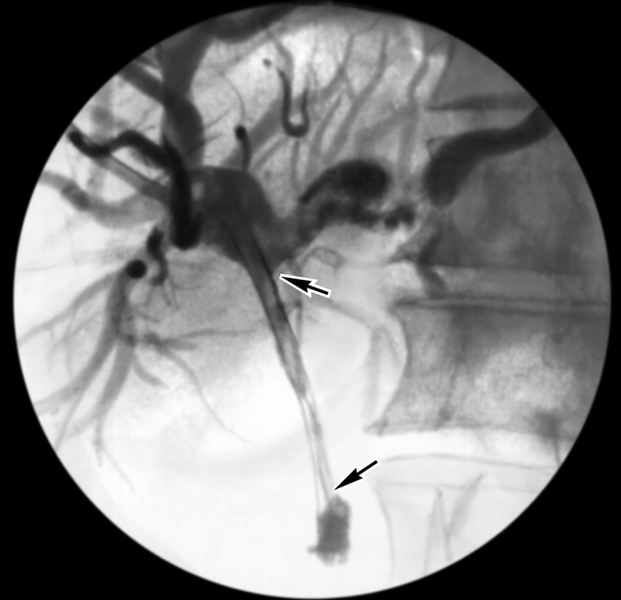
Лечение онкологических больных сегодня немыслимо без предварительного морфологического подтверждения опухолевого процесса. Существует много различных способов получения материала: мазки, цитологическое изучение физиологических и патологических жидкостей, операционный, эндоскопический и пункционный. Последний способ относится к ИР-процедурам, так как большая часть пункций производится под лучевым контролем. Сюда же можно отнести щипцовую и браш-биопсию опухолей желчных и мочевых ходов под контролем флюороскопии (рис. 1). Диагностическая эффективность биопсии составляет около 80—90%.
Дренирование патологических и физиологических жидкостей
Гнойно-септические осложнения являются довольно частым видом осложнений хирургического лечения больных в торакоабдоминальной онкологии. Послеоперационная летальность при хирургическом лечении одиночных абсцессов печени, по данным Д.П. Чухриенко и Я.С. Березницкого, составляет 29%, а при множественных — 98%.
В последние годы в ГУ РОНЦ им. Н.Н. Блохина РАМН лечение послеоперационных гнойных осложнений с формированием абсцессов происходит в абсолютном большинстве случаев при помощи пункционных чрескожных интервенционных методик. Радиологически контролируемое дренирование абсцесса — общепринятая, безопасная и эффективная процедура, нередко являющаяся альтернативой хирургическому вмешательству. Этот метод революционизировал традиционный подход к лечению абсцессов. Показания к чрескожному дренированию — наличие послеоперационных абсцессов брюшной и грудной полостей. Однокамерные абсцессы дренировать легче, многополостные абсцессы лучше лечить с использованием нескольких катетеров.
При клиническом подозрении на существование абсцесса его выявление и топическая локализация обычно осуществляются при помощи УЗИ и РКТ. Затем под контролем указанных методов производится пункция полости абсцесса, и при подтверждении гнойного содержимого устанавливаются лечебные дренажи уже под контролем флюороскопии (рис. 2 А—В).
Поиск и пункцию абсцесса предпочтительнее выполнять под контролем РКТ, так как этот метод наилучшим образом позволяет визуализировать петлю кишки и избежать ее повреждения. Трудны для выбора траектории подхода под РКТ абсцессы, расположенные под куполом диафрагмы. В этих случаях для выбора оптимального угла эффективнее использовать ультразвуковое наведение. Значительные трудности возникают также при подходах к гнойникам у задней стенки таза. Абсцессы могут быть осложненными и сообщаться с просветом кишки, но и они при правильном лечении обычно закрываются. Процедура проведения дренирования и выбор катетеров в большой степени зависят от опыта и требований врача.
После выполнения дренирования обычно проводится мягкая аспирация содержимого под низким давлением и промывание физиологическим раствором. В случаях длительного дренирования катетер целесообразно «укладывать» в полости абсцесса под контролем флюороскопии. Этим же методом целесообразно контролировать эффективность дренирования и выполнять различные лечебные мероприятия. Возможность удаления катетера определяется на основании традиционных хирургических и рентгенологических принципов:
— отсутствие клинических и лабораторных проявлений абсцесса;
— отсутствие отделяемого по дренажу и чистые промывные воды;
— отсутствие видимой полости абсцесса при УЗИ или РКТ и флюороскопии.
Обычно для чрескожного катетерного лечения не осложненных свищами абсцессов требуется от 3 до 16 дней, в среднем — неделя. При этом нормализация температуры и улучшение общего состояния пациента происходят уже в первые сутки после дренирования. Для лечения осложненных абсцессов иногда необходимо до 4—12 нед. Осложнения от самой процедуры дренирования мы встретили в 12,2%, а летальность — 1,1%. При этом среднее пребывание в стационаре составило 16 дней против 28 дней при традиционном оперативном лечении (Панкратенко О.А., 2006).
Методика чрескожного дренирования абсцессов брюшной полости у онкологических больных под контролем методов лучевой диагностики обладает несомненными преимуществами перед традиционным хирургическим лечением. Сегодня практически все гнойные полости, возникшие как осложнение после торакоабдоминальных операций, доступны ИР-лечению, и мы имеем опыт ведения более 600 подобных больных. На основании имеющегося опыта можно утверждать, что у онкологических больных 80—90% абсцессов могут быть успешно дренированы чрескожным путем под лучевым контролем без традиционной операции и наркоза.
Кисты, затеки, гематомы
После сложных операций у онкологических больных могут быть затеки крови, желчи, мочи, лимфы или образовываться осумкованные скопления секрета поджелудочной железы или желчных протоков. При выраженном послеоперационном нарушении анатомии хирургу бывает крайне трудно найти источник (за исключением кровеносного сосуда) и воздействовать на него. У ряда онкологических пациентов, в частности страдающих системными заболеваниями, в процессе лечения может скапливаться большое количество жидкости в полости перикарда, что требует ее удаления, особенно при опасности развития тампонады сердца, и последующего введения лекарств (рис. ЗА, Б).
Лечение таких осложнений входит в сферу деятельности интервенционных радиологов. Легче всего выполнить дренирование под контролем ультразвука, делая пункцию под мечевидным отростком, однако эту манипуляцию также легко можно выполнить и под рентгеноскопическим контролем. Методика и лучевой контроль в процессе манипуляций те же, что и при дренировании абсцессов. Выполнение этих процедур не требует общего обезболивания, они хорошо переносятся пациентами и легко повторяемы.
Хирургическое лечение онкологических больных с опухолями билиопанкреатодуоденальной зоны на высоте желтухи сопровождается высокой (20—40%) послеоперационной летальностью (Долгушин Б.И., Патютко Ю.И., Нечипай А.М., Кукушкин А.В., 2005). Поэтому в настоящее время в ГУ РОНЦ им. Н.Н. Блохина РАМН всем больным с механической желтухой предварительно проводится чрескожное чреспеченочное дренирование желчных протоков с последующей декомпрессией и катетерным восстановлением естественного тока желчи. Мы имеем опыт успешного интервенционного лечения более 1200 подобных больных.
Чрескожный чреспеченочный эндобилиарный доступ с возможностью манипулирования в протоках под контролем флюороскопии создал предпосылки для принципиально нового подхода к диагностике и лечению опухолей билиопанкреатодуоденальной области (печени, внутри- и внепеченочных желчных протоков, поджелудочной железы, фатерова сосочка, 12-перстной кишки):
1. Возможность контролируемой декомпрессии механической желтухи (рис. 4А).
2. Точное определение места и протяженности опухолевой стриктуры, взятие биопсии в оптимальном месте (см. рис. 1).
3. Бужирование и восстановление естественного тока желчи в 12-перстную кишку (рис. 4Б).
4. Возможность точного позиционирования и проведения внутрипротоковой лучевой терапии (рис. 5А, Б).
5. Протезирование протоков (рис. 6А, Б).
6. Послеоперационный мониторинг и профилактика недостаточности энтеробилиарных анастомозов (рис. 7А, Б).
7. Наложение магнитных холедоходуоденоанасто-мозов (рис. 8А, Д).
8. Улучшение качества жизни больного при невозможности специального противоопухолевого лечения.
Вмешательства на почках и мочевыводящих путях
Особую проблему ИР представляют больные с механическим нарушением оттока мочи по верхним мочевым путям. Это пациенты с блоком мочеточников, опухолями мочевого пузыря, матки, яичников, кишечника и неорганными злокачественными новообразованиями. Другую категорию пациентов с нарушением пассажа мочи составляют больные с осложнениями противоопухолевого лечения. Это, в первую очередь, осложнения лучевой терапии, реже — интраоперационные осложнения и еще реже — рубцовые изменения на месте опухолей после эффективного медикаментозного лечения. Все эти больные остро нуждаются в отведении мочи. В последнее годы в ГУ РОНЦ им. Н.Н. Блохина РАМН таким пациентам отведение мочи осуществляется интервенционным радиологическим пункционным методом, чрескожно, под рентгеновским или ультразвуковым контролем (рис. 9А).
Наличие нефростомы дает возможность производить диагностические и лечебные процедуры на верхних мочевых путях, контроль, коррекцию положения и замену нефростом, биопсию, баллонизацию стриктур, установку стента JJ (рис. 9Б, В) и металлических сетчатых стентов для обеспечения мочеотведения естественным путем. Мы располагаем опытом более 1300 подобных операций (Долгушин Б.И., Трофимов И.А., 2005).
Эмболизация и эмболотерапия
Эмболизация сосудов с целью ишемического и медикаментозного воздействия на опухолевую ткань
В поисках эффективного лечения неоперабельных опухолевых процессов интервенционные радиологи предложили использовать технические возможности селективной катетеризации артериальных сосудов, питающих опухоль, для прицельного введения противоопухолевых препаратов и эмболов для ишемизации новообразований. Отсюда возникло сразу 3 направления:
— внутриартериальная регионарная химиотерапия;
— ишемическая эмболизация артериальных сосудов, питающих опухоль;
— химиоэмболизация, использующая временное замедление кровотока в сосудистой сети при помощи масляных или микросферических эмболов для пролонгированного воздействия на опухоль, находящихся в них противоопухолевых препаратов.
показания к проведению химиоэмболизации печени:
1) злокачественные неоперабельные опухоли печени (билобарное поражение);
2) снижение уровня васкуляризации и уменьшение размеров опухоли в плане комбинированного лечения перед резекцией печени;
3) высокий уровень васкуляризации злокачественной опухоли.
Противопоказания к проведению химиоэмболизации печени:
1) диссеминация опухолевого процесса (отдаленные метастазы, асцит);
2) неблагоприятный анатомический вариант кровоснабжения печени, не позволяющий выполнить суперселективную катетеризацию;
3) дистрофические изменения печени (цирроз, жировой гепатоз).
Опираясь на многолетний опыт более 300 химио-эмболизаций печени больным с различными злокачественными опухолями печени, можно утверждать, что наилучшие результаты лечения получены в группе пациентов, имевших опухоли высокой степени васку-ляризации (гепатобластома, гепатоцеллюлярный рак, карциноид), а также при метастазах в печень РМЖ.
Так, при первичном раке печени частичная регрессия опухоли отмечена у 15%, а стабилизация опухолевого процесса — у 35% больных.
При лечении метастазов РМЖ частичный эффект получен у 10%, стабилизация опухолевого процесса — у 40% больных. Медиана выживаемости в этих группах больных увеличилась в 2 раза.
Химиоэмболизацию печеночных артерий для достижения длительного эффекта можно выполнять много раз.
Эмболизация артериальных сосудов с целью остановки кровотечения
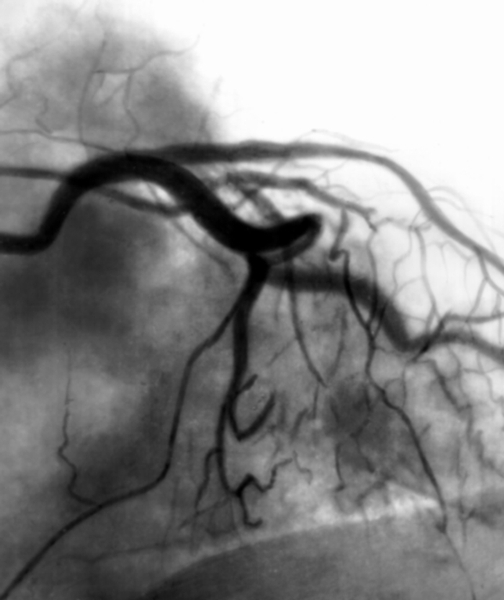
Иногда в практике интервенционного радиолога могут возникнуть осложнения во время пункции печени и дренирования желчных протоков, связанных с созданием патологического соустья между артериями и желчными протоками. Остановка такого кровотечения хирургическим путем выливается в сложнейшую операцию с плохо прогнозируемыми последствиями. Поэтому методом выбора является селективная эмболизация поврежденной артерии печени. Катетер вводится через бедренную артерию и устанавливается в кровоточащем сосуде. Под визуальным контролем дозировано вводится эмболизирующий материал. Тут же проведенное ангиографическое исследование подтверждает наличие эффекта. Операция проводится под местным обезболиванием и может быть легко повторена при рецидиве кровотечения (рис. 10А—В).
Эмболизация портальных вен одной доли печени перед ее резекцией для компенсаторной регенерации печеночной ткани другой доли
Успех хирургического лечения больных с изолированным поражением злокачественной опухолью правой доли печени (хирургически — правосторонняя гемигепатэктомия) зависит и от компенсаторных возможностей оставшейся после операции левой доли. В случаях, когда левая доля изначально анатомически мала, вероятность успешного исхода лечения проблематична из-за малого количества функциональной ткани печени, оставляемой после операции. Это зачастую не позволяет хирургам выполнить радикальное хирургическое лечение.
Количество функционирующей ткани в оставляемой левой доле печени можно увеличить, предварительно, за месяц до операции, выключив функцию удаляемой правой доли. Это достигается путем селективной эмболизации портальной системы правой доли печени. Указанная операция выполняется под местным обезболиванием путем чрескожной пункции печени и катетеризации воротной вены. В правую ветвь последней дозировано, под контролем флюороскопии, вводится эмболизирующий материал в количестве, необходимом для выключения доли из портального кровотока (рис. 11А—Г).
В результате выполненной операции функция печени ложится только на ее левую долю и печеночные клетки в ней начинают делиться. Через месяц увеличенная левая доля может взять на себя функцию всей печени и правосторонняя гемигепатэктомия может быть выполнена без угрозы печеночной недостаточности.
В отличие от системной (внутривенной) химиотерапии,регионарная (внутриартериальная)позволяет доставить к пораженному органу более высокую концентрацию противоопухолевого агента. Без учета чувствительности к противоопухолевым лекарствам наиболее благоприятны для проведения регионарной химиотерапии опухоли, расположенные в органах и тканях с одним источником кровоснабжения. К таковым, в первую очередь, относятся опухоли костей и мягких тканей конечностей.
Технически процедура заключается в установке небольшого специального катетера в артериальный сосуд проксимальнее ветвей, отходящих к опухоли. Это необходимо для включения в зону орошения не только всего объема опухоли, но и регионарных лимфатических узлов. Диаметр катетера подбирается таким образом, чтобы влияние на гемодинамику в сосуде было минимальным. При локализации опухоли в дистальной трети бедра и ниже катетер может устанавливаться либо антеградно, через бедренную артерию, либо перекрестно ретроградно, через противоположную бедренную артерию и через бифуркацию аорты. Последний вариант более универсален, так как он:
— может использоваться при любых локализациях опухолей в нижних конечностях;
— мало влияет на гемодинамику в пораженной конечности;
— легко выполним даже при выраженных контрактурах пораженной конечности.
Для профилактики осложнений при локализации опухоли ниже колена не следует спускать кончик катетера ниже средней трети бедра (бедренная артерия).
Для катетеризации верхней конечности лучше использовать бедренный доступ. При этом независимо от локализации опухоли в целях профилактики тромбоза кончик катетера устанавливается не дальше подмышечной артерии. Лучше для этих целей использовать подключичную артерию.
Указанная методика широко и с успехом применяется в ГУ РОНЦ им. Н.Н. Блохина РАМН. Мы имеем опыт наблюдения за 1200 больными, которым в схему лечения включена внутриартериальная химиотерапия. Достаточно сказать, что 5-летняя выживаемость пациентов с опухолями костей нижних конечностей, леченных с использованием регионарного подвода химиопрепаратов, увеличивается в ряде случаев в 2 раза (с 36 до 68%).
Извлечение инородных тел из сосудов и полостей сердца
В онкологической практике могут происходить отрывы катетеров, ирригаторов и других трубчатых инструментов, помещенных в сосудистое русло.
В практике интервенционного радиолога при выполнении внутриартериальных диагностических исследований катетеры могут отломиться и мигрировать с током крови. Эти катетеры, как правило, рентгеноконтрастны, и определение их локализации не представляет трудностей. После уточнения местоположения отломка в нужный сосуд вводится специальный инструмент (захватывающая петля) и через специальный шлюз отломок удаляется из сосудистого русла.
В отличие от артериального, в венозном русле чаще всего отрываются подключичные, обычно нерентгеноконтрастные катетеры. С током крови они, как правило, мигрируют либо в правое предсердие, либо в правый желудочек. Извлечение рентгенологически невидимого отломка также осуществляется специальными петлями и продолжительно по времени (0,5—2 ч). И в первом, и во втором случаях пациенты не нуждаются в общем обезболивании и в специальной подготовке для осуществления операции по извлечению инородного тела.
Установка кава-фильтров для профилактики эмболии легочной артерии
Последнее десятилетие в хирургической практике для профилактики эмболии легочной артерии используются специальные сетчатые устройства. Они разработаны для улавливания оторвавшихся тромбов из крупных венозных стволов нижних конечностей и таза. Это особенно актуально в онкологической практике, так как вероятность образования тромба у онкологического больного, в отличие от общехирургического, в 2 раза выше (подробнее см. соотв. раздел). У пожилых пациентов при длительном постельном режиме создаются особые предпосылки к формированию венозных тромбов. При обширных операциях или в послеоперационном периоде может произойти отрыв тромботических масс с соответствующими последствиями. Для профилактики этих тяжелых, часто смертельных осложнений используются специальные кава-фильтры, свободно пропускающие кровь и задерживающие тромботические массы (рис. 12А, Б).
Устанавливаются эти устройства в кабинете ИР под рентгенотелевизионным контролем через подключичную или яремную вены под местным обезболиванием. Существуют постоянные и временные фильтры (рис. 12В, Г). Последние удаляются после исчезновения угрозы эмболии. Удаление временного фильтра также производится через указанные вены без рассечения тканей.
Радиочастотная термоабляция вторичных опухолей печени
В последние годы в связи с техническими достижениями минимально инвазивная хирургия под лучевым контролем стала использоваться и в лечении опухолевых заболеваний мягких тканей, паренхиматозных органов и некоторых других структур.
Если речь идет об объемных опухолевых процессах (в печени, легких, почках, надпочечниках, щитовидной железе), хирурги стремятся выполнить резекцию в пределах здоровых тканей или удалить один из парных органов. К сожалению, нередко случаи, когда врачи сталкиваются с непреодолимой стеной неоперабельных случаев. Самые скромные цифры говорят о том, что до 80% случаев первичного рака печени и до 60% случаев ее метастатических поражений радикально неоперабельны. При этом в остальных случаях частота послеоперационных осложнений составляет 19—43%, а послеоперационная летальность колеблется в пределах 4—7% (Федоров В.Д., 2003). Минимально инвазивные способы лечения создают здесь новые возможности.
Из распространенных в последние годы способов чрескожных абляционных воздействий на опухоли все большее значение приобретает радиочастотный (РЧ) метод. Сутью его является разогрев опухоли под воздействием радиочастотных электрических токов. Под лучевым наведением в опухоль вводится специальный электрод, излучающий вокруг себя РЧ-токи. Радиочастотное воздействие заставляет колебаться с этой же частотой электрически заряженные внутриклеточные структуры (ионы). Выделяемое при этом тепло разогревает и коагулирует клетки (рис. 13А). Отличием ионного разогрева тканей от привычного нам в электрохирургии импедансного получения тепла является гораздо больший объем коагулята. Например, в монополярной электрохирургии температура уменьшается обратно пропорционально квадрату расстояния, поэтому в 3—5 мм от электрода при измерениях обнаруживается уже температура тела больного. А при РЧ-абляции могут коагулироваться очаги до 2,5—3 см диаметром. Наиболее мощные генераторы могут применяться при опухолях диаметром до 5—7 см.
Визуализация установки игольчатого электрода в центре опухоли возможна с помощью УЗКТ, РКТ и МРТ. Сегодня самым приемлемым способом для большинства клиник страны является ультразвук. При использовании для этих целей МРТ необходимо применять специальные электроды из титанового сплава. Кроме простоты и доступности, визуализация с помощью ультразвука позволяет видеть динамику изменений в печени в режиме реального времени (рис. 13Б). Это отличает РЧ-абляцию от других аналогичных методов, например, от лазерной, где истинную величину некротических изменений можно определить не ранее чем через 24 ч.
Обычно чрескожная РЧ-абляция проводится под местной анестезией с внутривенной седацией. Словесный контакт с больным важен на этапе установки игольчатого электрода. Эпидуральная, или спинномозговая, анестезия применяются при близости очага (и соответственно будущего коагулята) к глиссоновой капсуле.
Необходимо вкратце осветить вопрос об осложнениях, связанных с абляционными методами лечения. Цифры послеоперационных осложнений и летальности при хирургическом лечении больных опухолями печени контрастируют с результатами интерстициальной терапии. Так, смертность при РЧ-абляции равна 0,3%. По сообщению Т. Livraghi et al. (2003), общее количество осложнений РЧ-абляции у 2320 пациентов составило 2,2%. Аналогичные цифры при химиоабля-ции равны 3,2—4,6%; при криодеструкции — 13,1%.
Применение методики РЧ-абляции в России началось в 2002 г. При отборе больных для РЧ-абляции мы руководствовались следующими показаниями:
— наличие в печени 4—5 и менее опухолевых узлов (при метастазах нейроэндокринного рака допускается большее количество узлов);
— диаметр отдельного узла не более 5 см;
— расположение узлов не ближе 1 см от воротной или печеночных вен. Близость опухоли к крупным сосудам является нежелательным фактором, так как поток крови уносит тепло, охлаждая ткани, и новообразование прогревается неравномерно.
Противопоказания к гипертермической абляции:
— наличие внепеченочных проявлений заболевания;
Среднее время одного воздействия — 13 мин. Количество аппликаций электрода зависит от размеров очага. Так, к примеру, среднее количество воздействий на опухолевый очаг диаметром 3 см составляет 3 сеанса (Долгушин Б.И., Шолохов В.Н., Косырев В.Ю., 2005). Только в одном случае процедура осложнилась кровотечением, потребовавшим лапаротомии.
Переносимость процедуры РЧ-абляции в целом хорошая. Половина пациентов отмечают легкую и умеренную болезненность в течение первых суток. При воздействии на субкапсулярные узлы болевой синдром сохраняется до 2—3 сут. У двух больных после деструкции узлов, расположенных поддиа-фрагмально, развился реактивный плеврит.
У пациентов с метастазами более 3,5 см на 1—2-е сут после РЧ-абляции отмечалась лихорадка до фе-брильных цифр, продолжавшаяся 4—5 дней. При этом сдвига лейкоцитарной формулы не наблюдалось. Положительный эффект давал прием НПВС, что может указывать на резорбтивный генез лихорадки.
Главный вопрос лечения сводится к его эффективности. Мы осуществляли динамический контроль за размерами и структурой очагов в печени. Накануне выполняли УЗКТ и РКТ либо МРТ с внутривенным контрастированием. В ходе РЧ-абляции фиксировали зону воздействия по УЗКТ. На 7—8-е сут после лечения повторяли УЗКТ и РКТ либо МРТ с внутривенным контрастированием. На УЗКТ опухоль в печени сразу после радиочастотного воздействия выглядела как округлая гиперэхогенная диффузно неоднородная зона с нечеткими контурами, по размеру превосходящая опухоль. На РКТ и МРТ метастаз в печени на 7—8-е сут после РЧ-абляции выглядел как образование пониженной плотности с четкими контурами, превосходящее по размеру опухоль (рис. 13В, Г).
Если при повторном исследовании (через 7—8 дней) выявлялась зона, подозрительная на остаточную опухоль, выполнялась дополнительная прицельная процедура РЧ-воздействия. Далее, УЗКТ и РКТ либо МРТ проводится раз в месяц. Иногда целесообразно выполнить ПЭТ-исследование для определения радикальности лечения.
Таким образом, метод радиочастотной абляции может оказывать реальное деструктивное воздействие на узловые опухолевые образования в печени. Его развитие в России может оказать действенную медицинскую помощь значительной части больных с метастатическими поражениями печени, не операбельных к моменту обнаружения таких поражений. РЧ-генератор может применяться для абляции не только метастазов в печень, но и небольших первичных гепатокарцином, а также опухолевых поражений почек, легкого, костей, щитовидной и паращитовидных желез, надпочечников.
По данным различных авторов, метастатические опухоли скелета встречаются в 2—4 раза чаще, чем первичные, и занимают 3-е место по частоте поражения метастазами после легких и печени. Наиболее частым местом локализации метастазов является позвоночник — до 70%.
Болевой синдром является первым клиническим признаком поражения костной системы у 75% больных, хотя патологические переломы длинных трубчатых костей и позвоночника возникают у 5—10% из этого числа (Dijkstra P.D.S., 2001). Примерно у трети больных с метастатическим поражением костей скелета возникают различные осложнения: патологические переломы, гиперкальциемия, компрессия спинного мозга (Coleman R., 2001).
В настоящее время для лечения литических поражений позвоночника широко применяется чрескожная вертебропластика. Эта малоинвазивная интервенционная методика существует около 20 лет, впервые она была предложена французским врачом Н. Deramond в 1984 г. В буквальном переводе «вертебропластика» означает «укрепление тела позвонка». ИР-процедура заключается в чрескожном введении в литически измененные позвонки костного цемента на основе полиметилметакрилата.
Основной контингент больных, которым выполняется вертебропластика, — пациенты с гемангиомами и метастатическим поражением позвоночника, так как при данных заболеваниях наиболее часто происходит снижение плотности костной ткани, что значительно увеличивает степень риска и частоту возникновения патологических переломов.
показанием к вертебропластике является болевой синдром при патологическом переломе или его угрозе вследствие деструктивного остеолитического опухолевого поражения позвоночника.
Для выполнения этой операции все пациенты проходят клиническое обследование, включающее:
— оценку общего состояния больного;
— проведение лабораторных методов исследования (общий и биохимический анализ крови, коагулограмма, ЭКГ, рентгенография легких, определение группы крови и резус-фактора);
— оценку неврологического статуса (до и после вертебропластики);
— стандартную рентгенографию позвоночника в 2 проекциях;
Каждый больной обсуждается на мультидисципли-нарном консилиуме с участием хирурга, интервенционного радиолога, химио- и лучевого терапевтов для определения тактики лечения, так как выбор показаний и объем комбинированной терапии зависят от ряда факторов:
— морфологической формы опухолевого поражения;
— объема поражения позвонка и степени генерализации процесса;
— степени вовлечения спинного мозга;
— болевого статуса (важна субъективная оценка самого больного);
— неврологического статуса (объективная оценка);
— общего состояния больного;
— объема поражения кортикальной пластинки. Стандартное рентгенологическое исследование, включая компьютерную томографию, должно быть выполнено за несколько дней до проведения вер-тебропластики, чтобы оценить объем поражения, локализацию и объем литической деструкции, визуализировать вовлечение ножек позвонка в литический процесс. Также необходимо определить деструкцию кортикальной пластинки и наличие эпидурального или фораминального стеноза. Такую информацию часто можно получить, выполнив трехмерную реконструкцию пораженного сегмента.
Предоперационная оценка поражения позвонка очень важна, так как неправильно выбранный объем цемента или же неадекватный доступ могут привести к тяжелым осложнениям, попаданию цемента в позвоночный канал с компрессией спинного мозга или подлежащих структур. Поэтому вертебропластику необходимо проводить в условиях хирургического стационара, где имеется персонал, владеющий техникой нейрохирургических операций.
Сама процедура вертебропластики выполняется под контролем КТ с параллельным использованием в реальном масштабе времени флюороскопического контроля при введении костного цемента. Время выполнения операции в среднем составляет около 1 ч. Условия для проведения вертебропластики обычны для всех интервенционных процедур с обязательным соблюдением асептики и антисептики.
Пациенту, которому предстоит процедура вертебропластики, накануне проводится предоперационная подготовка: седация, очистительная клизма. За 30 мин до процедуры обязательна премедикация. Больного до интервенционного радиологического кабинета доставляют на лежачей каталке.
Положение больного на животе. Выполняется предоперационная подготовка: широкая обработка операционного поля и укрывание стерильным бельем.
Первым этапом производится РКТ-исследование пораженного отдела позвоночника для проведения горизонтальной и вертикальной разметки и определения траектории введения иглы (рис. 14А).
Далее производится местная анестезия точки введения иглы и инфильтрационная анестезия по пути введения до кортикального слоя позвонка. Следующим этапом выполняется одностороннее или двустороннее введение специальных игл для вертебропластики. Периодичность рентгенологического контроля положения игл зависит от топографического расположения пораженного позвонка и доступа. Доступ в тело позвонка осуществляется, как правило, транспедикулярно, что позволяет исключить попадание костного цемента в канал спинного мозга или фораминальное отверстие. Однако при расположении дефектов ближе к задней границе тела позвонка, а также на грудном отделе используется экстрапедикулярный доступ (между прилежащим ребром и поперечным отростком). В таком случае необходим более частый контроль положения иглы для исключения проникновения в грудную или брюшную полости.
После осуществления доступа в очаг деструкции берется биопсия для морфологической верификации диагноза. Далее аспирируется содержимое из области поражения, и сразу вводится костный цемент. Введение происходит строго под контролем электронно-оптического преобразователя. При доступе двумя иглами одновременно при введении цемента через одну иглу аспирируется избыточное содержимое через вторую иглу. После прекращения введения цемента через одну иглу выполняется РКТ-контроль области заполнения. Далее, при необходимости область поражения заполняется через вторую иглу (рис. 14Б).
Доза введенного цемента колеблется от 2 до 10 мл, в зависимости от уровня и объема поражения позвонка.
После удаления игл производится контрольная РКТ для определения степени заполнения полости, а также возможных мест утечек костного цемента в канал спинного мозга, фораминальное отверстие или окружающие мягкие ткани (рис. 14В).
В первые сутки больным назначаются антимикробная терапия антибиотиками широкого спектра действия, НПВС, анальгетики, так как часто наблюдаются транзиторное повышение температуры, кратковременное усиление болевого синдрома.
Полное или значительное уменьшение болей отмечено у 80% больных. Наступление анальгетиче-ского эффекта наблюдалось в течение первых 48 ч. Все пациенты активизированы на следующие сутки (Валиев А.К. и др., 2010).
Осложнения возникли у 10% больных. У одной пациентки отмечено усиление корешковых болей после вертебропластики, которые были купированы консервативно. Второй пациентке костный цемент попал в позвоночный канал с острым развитием клиники компрессии спинного мозга, что потребовало выполнения экстренной декомпрессивной ламинэктомии, удаления костного цемента. В послеоперационном периоде проводилось дополнительное консервативное лечение компрессионного синдрома, реабилитационные мероприятия.
Вертебропластика применяется в ГУ РОНЦ им. Н.Н. Блохина РАМН с декабря 2001 г. За время наблюдения у 2 пациентов с гемангиомами отмечалось транзиторное усиление болевого синдрома при значительном увеличении физической нагрузки через 3 и 5 мес после вертебропластики, который был купирован с помощью приема анальгетиков и повторной фиксации в корсете.
В группе больных со злокачественным поражением позвоночника успех большей частью зависел от комбинированного лечения. За этими пациентами велось более пристальное наблюдение, заключающееся в определении признаков прогрессирования или стабилизации процесса. Со стороны пораженного позвонка в данной группе за весь период наблюдения не было отмечено признаков прогрессирования заболевания. Ни у одного из больных не произошло коллапса тела позвонка.
таким образом, использование вертебропластики как самостоятельного метода при доброкачественных образованиях, так и в составе комбинированного лечения больных со злокачественными и метастатическими опухолями позвоночника позволяет в короткие сроки заметно улучшить качество жизни пациентов и избежать значительных осложнений.
Закрытие послеоперационных бронхоплевральных свищей
Лечение бронхоплевральных свищей, возникающих после пневмонэктомии у онкологических больных, — задача очень сложная, особенно в условиях инфицирования плевральной полости. Большинство таких больных имеют мало шансов на выздоровление, так как спонтанное закрытие дефекта наблюдается редко, а хирургическое пособие малоэффективно в условиях инфекции.
В ГУ РОНЦ им. Н.Н. Блохина РАМН разработана приоритетная технология закрытия бронхоплевральных дефектов с помощью имплантируемых под контролем флюороскопии металлополимерных комплексов, которые могут устанавливаться со стороны как трахеи, так и плевральной полости. Процедура проводится под общим обезболиванием с выключением самостоятельного дыхания. Первые операции дали обнадеживающие результаты, однако для рекомендации широкого использования это направление требует углубленного всестороннего исследования на большем материале.
Магнитные компрессионные анастомозы в лечении опухолевых и неопухолевых стриктур желчных протоков
Новый подход к восстановлению внутреннего желчеотведения в комплексном паллиативном лечении механической желтухи опухолевой этиологии с уровнем окклюзии не выше устья пузырного протока реализуется за счет рентгеноэндоскопических компрессионных билиодигестивных анастомозов с использованием специально сконструированных магнитных элементов. Больным с нерезектабельными окклюзиями терминального отдела общего желчного протока и высокой степенью операционного риска можно произвести следующие операции:
Суть метода, предложенного М.В. Авалиани, заключается во введении в анастомозируемые органы двух магнитов и приведении их во взаимодействие. Постоянная компрессия приводит к образованию пролежня-анастомоза (см. рис. 8А—Д). При этом магниты могут быть либо извлечены, либо отходят естественным путем.
Предлагаемый метод восстановления внутреннего желчеотведения сочетает преимущества хирургического способа (большой диаметр билиодигестивного соустья) с существенно более низкой травматичностью, сравнимой с эндопротезированием. Отсутствие швов при идеальном сопоставлении слоев соединяемых органов снижает риск рубцевания анастомоза. Предлагаемые способы восстановления внутреннего желчеотведения должны быть широко включены в арсенал методов паллиативного лечения у лиц с высокой степенью операционного риска.
Расширение стриктур трубчатых органов
Дилатация послеоперационных Рубцовых стриктур прямой кишки
После резекции прямой кишки в месте анастомоза могут возникать рубцовые стриктуры, которые иногда протекают весьма тяжело, плохо поддаются эндоскопическому воздействию и рецидивируют. В этих случаях можно использовать баллонную дилатацию рубцового сужения. Операция производится под местным обезболиванием и флюороскопическим контролем. Для установки расширительного специального баллона используется методика, разработанная Seldinger. Сначала в области стриктуры устанавливается гибкий проводник, по которому телескопически вводится баллонный дилататор. Баллон раздувается рентгеноконтрастной жидкостью, что позволяет легко дозировать степень воздействия на стриктуру (рис. 15А, Б).
В отличие от эндоскопического бужирования, при баллонизации слизистая кишки не повреждается, и увеличение просвета происходит за счет расширения подслизистого и мышечного слоев. Операция удовлетворительно переносится пациентами, легко повторяема и в плане подготовки требует накануне только очистительных клизм.
Дилатация послеоперационных рубцовыхстриктур пищевода
После резекции пищевода и наложения анастомозов оставшейся части пищевода с желудком или толстой кишкой также могут возникать рубцовые стриктуры, не поддающиеся эндоскопическому лечению. В этих случаях используется баллонное расширение рубцового сужения. Баллонный катетер устанавливается в пищевод через нос или рот. Манипуляция производится аналогично таковой при рубцовых стенозах толстой кишки. Для достижения стойкого эффекта иногда бывает достаточно выполнить от 2 до 4 процедур с интервалами 1—3 мес. Операция удовлетворительно переносится пациентами, легко повторяема и не требует специальной подготовки.
Дилатация рубцовых стриктур мочеточников и бронхов
Аналогично производится расширение рубцовых стриктур мочеточников и бронхов, вызванных лучевыми повреждениями. Часто рубцовая стриктура мочеточника, требующая баллонной пластики, возникает во время хирургических операций на органах малого таза.
Металлические сетчатые протезы в лечении стриктур
Стентирование опухолевых и рубцовых стриктур пищеварительной трубки
Рак пищевода и кардиального отдела желудка приводит к прогрессивной дисфагии, а в отсутствии лечения кахексия — обычная причина смерти этих больных. Радикальная операция с восстановлением естественного пассажа пищи — оптимальное решение. Но даже после хирургической резекции приблизительно у 20% пациентов остаются явления дисфагии, и может повторно возникнуть стриктура в зоне анастомоза. Лучевая терапия эффективна у 60—80% пациентов, но очевидное уменьшение симптомов дисфагии может наступить только после 4—6 нед от начала лечения. Кроме того, лучевая терапия приводит к рубцовой дисфагии более чем у 25%. Использование лазерной деструкции ограниченно из-за ее высокой стоимости, потребности частого использования и частоты рецидива опухоли. Кроме того, подслизистые или внешние структуры сужения недоступны лазерной обработке. Пищеводное стентирование металлическими сетчатыми протезами — привлекательный, простой и быстрый метод для снятия дисфагии, вызванной злокачественными опухолями (рис. 16А—Г).
Кроме того, показанием для стентирования пищевода является наличие патологического соустья между пищеводом и трахеей. Сетчатые протезы, покрытые специальной пластиковой пленкой, создают препятствие для попадания пищи из пищевода в трахею и тем самым предотвращают постоянное инфицирование легких.
Перспективно применение стентов при опухолях для восстановления проходимости левых отделов толстой кишки
Стентирование может использоваться либо как этап подготовки больного к плановой операции с одномоментным восстановлением непрерывности кишки у операбельных больных, либо как постоянный метод восстановления проходимости кишечника у неоперабельных больных с удовлетворительным качеством жизни (без наложения кишечной стомы). Кроме того, стенты можно устанавливать для купирования опухолевой и рубцовой стриктур в других достижимых для имплантации отделах (желудок, двенадцатиперстная кишка и желудочно-кишечные анастомозы).
Стентирование постлучевых опухолевых стриктур желчных протоков
В настоящее время ни у кого не вызывает сомнения целесообразность стентирования опухолевых стриктур желчных протоков у неоперабельных больных. Указанная методика восстанавливает естественный пассаж желчи и восстанавливает качество жизни (см. рис. 16А, Б).
Современное комплексное лечение опухолей внутри- и внепеченочных протоков с использованием хирургического и лучевого (дистанционная плюс внутрипросветная) методов дает обнадеживающие отдаленные результаты. Появилась группа больных с излеченными опухолями желчных протоков, но уже с рубцовыми стриктурами, хорошо поддающимися стентированию.
Высокие возможности ИР сегодня позволяют накладывать соустья не только между протоками, но и между протоками и желудком, что обеспечивает пациентам удовлетворительное качество жизни и высокую социальную адаптацию. Однако стенки указанных вновь созданных соустий надо «укреплять» для профилактики последующей облитерации. Для этих целей хорошо подходят сетчатые металлические протезы.
Стентирование стриктур других трубчатых органов
Получены первые обнадеживающие результаты стентирования трахеи и мочеточников. Однако опыт применения металлических сетчатых стентов указанных локализаций невелик и требует дальнейших исследований на большем клиническом материале.
Методика пункционной гастростомии
Специальное противоопухолевое лечения кура-бельных больных с нерезектабельными опухолями гортаноглотки, пищевода, а также больных, которые в силу разных обстоятельств отказываются от осуществимого у них хирургического лечения по поводу рака указанных локализаций, заключается в проведении дистанционного или сочетанного лучевого лечения. Однако возможности такого лечения нередко ограничиваются наличием стенотической стриктуры (рис. 17А), лучевая терапия при которой без обеспечения условий для энтерального питания больного невозможна или противопоказана. В процессе лучевого лечения развивается закономерный отек тканей в зоне облучения, при этом вы ражен ность стенотической стриктуры усугубляется. В результате эффективной лучевой терапии, приводящей к резорбции опухоли, проходимость пищеварительных путей восстанавливается, и в большинстве случаев отсутствует необходимость в хирургических реконструктивных вмешательствах либо в эндоскопическом (интервенционном) эндопротезировании этих органов. Раньше для обеспечения возможности проведения лучевой терапии у подобных больных предварительно выполняли хирургическую эзофагосто-мию (гастростомию), требующую тщательного ухода, доставляющую больным значительные неудобства, существен но ухудшающую качество их жизни. С учетом достигаемого в результате лучевой терапии восстановления проходимости пищеварительных путей способ обеспечения энтерального питания больных в период проведения лучевой терапии в идеале должен быть малоинвазивным, безопасным, легко переносимым больными, не требующим общего обезболивания, не ухудшающим качество их жизни. Таким требованиям соответствует интервенционная методика пункцион-ной гастростомии.
В рентгенохирургическом кабинете в положении больного лежа на спине после премедикации 1—2% раствором промедола и местного обезболивания полостей носа и гортаноглотки путем орошения слизистых 0,5% раствором лидокаина, трансназально, под рентгеноскопическим контролем производится введение и установка инсуффляционного катетера на атравматичном проводнике в пищеварительные пути дистальнее уровня их обтурации (манипуляция эффективна практически всегда, даже при отсутствии остаточного просвета и невозможности эндоскопического проведения инструмента).
По инсуффляционному катетеру в пищеварительные пути вводится воздух, достаточность введения которого оценивается по степени раздувания им желудка: желудок должен быть полностью расправленным, его передняя стенка должна прилежать к передней брюшной стенке, что хорошо видно при рентгеноскопическом контроле (рис. 17Б).
Выбирается точка на коже левого верхнего квадранта передней брюшной стенки левее срединной линии, которая при рентгеноскопическом контроле проецируется на заполненную воздухом полость желудка. Выполняется местная инфильтрационная анестезия 0,25% раствором новокаина. В избранной точке острием скальпеля делают насечку кожи, под рентгенотелевизионным контролем производят пункцию передней брюшной стенки и прилежащей к ней передней стенки желудка до проникновения пункционной иглы (троакара) в полость последнего. В зависимости от избранного варианта методики (методика по Сельдингеру, или троакарная методика) для формирования гастростомы применяют либо пункционную иглу, либо специальный троакар. Установленный чрескожно в полость желудка специальный катетер 10—14F с окончанием типа pig-tail имеет устройство для принудительной фиксации его изгибаемой рабочей части, позволяющее зафиксировать переднюю стенку желудка, надежно прижав ее к передней брюшной стенке. Правильность установки катетера удостоверяется транскатетерной гастрогра-фией (рис. 17В).
Пункционная гастростома обеспечивает осуществление энтерального питания больного в течение всего периода, необходимого для проведения лучевой терапии и восстановления проходимости пищеварительных путей в зоне их опухолевой стенотической стриктуры. После восстановления проходимости пищеварительных путей гастростомический катетер может быть удален без необходимости дополнительного закрытия катетерного канала передней брюшной стенки и стенки желудка. В случае неэффективного специального лечения, не приведшего к восстановлению проходимости пищеварительных путей в зоне их опухолевой стриктуры, гастростомический катетер может обеспечивать энтеральное питание больных сколько угодно долго.
Осложнения интервенционных радиологических процедур
Хирургический аспект методов интервенционной радиологии очень схож с чисто хирургическими подходами в абдоминальной онкологии и должен твердо соответствовать существующим хирургическим канонам. Ответственная интервенционная радиология, или хирургия, требуют концентрации всех усилий, чтобы минимизировать интра- и постпроцедурные осложнения. Манипуляции должны всегда производиться под тщательным рентгенологическим контролем с соблюдением всех хирургических принципов. Главные, угрожающие жизни осложнения во время брюшных интервенционных процедур происходят от прямой травмы или прокола полостных или паренхиматозных органов, сосудов, различных трубчатых систем, а также от повреждения распадающихся и инфицированных опухолей.
В то время как внутрибрюшное кровотечение или перитонит в значительной степени предопределены начальной остротой и могут привести к смерти пациента (без принятия неотложных хирургических мер), то с бактериемией и септическим шоком можно и должно бороться энергичными медицинскими мерами, включая антибиотики, препараты, повышающие кровяное давление, жидкости и кислород. Следует помнить, что интрапроцедурный септический шок может спровоцировать начало более тяжелого и необратимого сердечно-сосудистого шока. Следует обратить особое внимание до процедуры на пациентов, которые лихорадят или имеют характерные изменения в формуле крови. Они, как правило, особенно склонны к последующим септическим осложнениям. Всякий раз, когда существует вероятность осложнений интервенционных процедур, должна быть доступна полная хирургическая и реанимационная поддержка.
Таким образом, при достаточном опыте радиолога возможные осложнения ИР-процедур могут быть сведены до минимума, а уже имеющиеся — эффективно излечены.
Защита от ионизирующего излучения
Операции в интервенционной радиологии весьма трудоемки, продолжительны по времени флюороскопии, часто повторяются и в результате сопровождаются весьма существенными лучевыми нагрузками, требующими особого контроля.
Интервенционные процедуры по лучевой нагрузке превышают все другие виды рентгенодиагностических исследований по дозе на кожу кистей рук и приблизительно:
— в 10 раз выше, чем при обычной ангиографии;
— в 100 раз выше, чем при гастроинтестинальной флюороскопии или РКТ.
Чтобы уменьшить поглощенную дозу на пациента и персонал, нами будут рассмотрены принципы защиты в кабинете ИР от лучевого воздействия: временем; расстоянием; ограждением; полем.
1. Доза ионизирующего излучения непосредственно связана со временем экспозиции. Так, уменьшая экспозиционное время в 2 раза, мы вполовину уменьшаем лучевую дозу. Весь персонал кабинета, который не должен непосредственно присутствовать в флюороскопической группе в течение всей или части процедуры, может уменьшить свое экспозиционное время, просто выйдя из кабинета. Для других сотрудников лучевое время полностью управляется временем флюороскопии.
2. Доказано, что рентгеновские лучи изменяются, проходя через пространство, и уменьшение их интенсивности происходит обратно пропорционально квадрату расстояния от источника. Следовательно, если расстояние от источника удвоено, лучевая доза уменьшена в 4 раза от первоначального значения. Хотя эти отношения верны только для точечного источника, принцип сокращения лучевой дозы расстоянием полезен для персонала. Тем членам операционной бригады, которые не должны быть в непосредственной близости к пациенту, следует всегда оставаться так далеко от стола, как это возможно без потери качества работы.
3. Ослабление интенсивности рентгеновского луча всегда происходит при прохождении его через любое вещество. Небольшая толщина защитного материала может значительно уменьшить интенсивность рентгеновского излучения. Поэтому материальный эквивалент 0,5 мм свинца (номинальный эквивалент типичного защитного фартука) сокращает интенсивность рентгеновского излучения более чем на 90%. Приведенные примеры ослабления рентгеновских лучей очевидны, поэтому защитные фартуки должны не только всегда быть в любом рентгеновском кабинете, но и постоянно использоваться.
4. В дополнение ко времени, расстоянию и ограждению есть еще один важный параметр защиты — размер телевизионного поля. Количество рассеянного лучевого воздействия на ткани непосредственно связано с размером луча. Кроме того, диафрагмирование изображения положительно влияет не только на дозу, но и на качество изображения. Следовательно, ограничивая размер луча до самого маленького, который необходим, исследователь может уменьшать дозы на больного и персонал, одновременно улучшая качество изображения.
Распределение рассеянного излучения, окружающего компьютерный томограф (РКТ), весьма отличается от такового при флюороскопии. Размер луча на томографе уже, и рентгеновская трубка находится внутри гентри, обеспечивая защиту пациента. Дозы на голову и шею могут колебаться от 3 до 9 мГр при интервенционной процедуре, включающей позиционирование стола (около 10—20 «срезов»). Следует обратить внимание на то, что сбоку от гентри доза значительно уменьшается по сравнению с позицией спереди или позади от гентри. Маленький шаг к боку гентри радикально уменьшает лучевое воздействие.
Следует помнить, что, сокращая дозы облучения на пациента, мы также уменьшаем дозы, получаемые персоналом.
Доза на кожу пациента может быть уменьшена при использовании минимально возможного расстояния между ЭОПом и пациентом. Это зависит от автоматической регулировки генератором мощности рентгеновской трубки: чем меньше указанное расстояние, тем меньше мощность излучения. Уменьшение указанного расстояния ведет не только к уменьшению дозы облучения, но и значительно улучшает качество изображения. В течение длительных процедур там, где это возможно, надо пытаться изменить ориентацию луча так, чтобы облучению подвергались различные области кожи.
Таким образом, интервенционная радиология требует точного понимания и выполнения фундаментальных принципов лучевой защиты временем, расстоянием, защитными приспособлениями и полем.
Освоенные, разработанные, внедренные и широко применяемые разнонаправленные интервенционные радиологические методики показали свою высокую эффективность в лечении онкологических больных и востребованность в онкологической практике (рис. 18).
Опыт базовых клиник, успешно применяющих описанные выше методики, показал, что область практического применения интервенционных вмешательств в онкологии чрезвычайно широкая и включает в себя:
— решение задач радикального, паллиативного и симптоматического лечения;
— устранение тяжелых осложнений опухолевых заболеваний, препятствующих проведению хирургического, специального противоопухолевого или комбинированного лечения;
— достижение в отдельных направлениях результатов, сопоставимых с результатами хирургического лечения, но при существенно меньших частоте осложнений и уровне послеоперационной летальности;
— интегрируемость интервенционных вмешательств в алгоритм лечебных мероприятий у онкологических больных на разных этапах их клинического ведения (до-, после хирургического лечения; до-, во время, после химиолучевого лечения), способствующая повышению эффективности классических методов лечения в онкологии.
Арсенал интервенционно-радиологических методик успешно применяется не только посредством избирательного выполнения какого-либо отдельного вмешательства, но и путем комплексного применения разнонаправленных методик, сочетания которых между собой, равно как и их сочетание с хирургическим и специальным противоопухолевым лечением, могут быть различными.
Представленный материал осветил только часть общих вопросов, касающихся интервенционной радиологии. Эта специальность, сочетающая в себе ювелирные хирургические возможности под лучевым наведением и контролем, имеет в онкологии большое будущее. Интервенционные процедуры легче переносятся больными, дают меньше осложнений, легко повторяемы и гораздо дешевле традиционных хирургических операций. По мере развития технического прогресса интервенционная радиология в онкологии будет осваивать все новые и новые области применения.
1. Baum, S. [et al.] // Radiology. — 1971. — Vol. 98. — Р.497— 505.
2. Burhenne, H.J. // AJR — 1973. — Vol. 117. — P.388—399.
3. Dotter, С.Т. [et al.] // Circulation. — 1964. — Vol. 30. — P.654—670.
4. Margulis, A.R. // AJR. — 1967. — Vol. 99. — P.761—762.
5. Margulis, A.R. [et al.] // AJR. — 1965. — Vol. 93. — P.975.
6. Чухриенко, Д.П. Внутрибрюшные абсцессы и флегмоны / Д.П. Чухриенко, Я.С. Березницкий. — Киев: Здоровья, 1977. — 135 с.
8. Долгушин, Б.И. Антеградные эндобилиарные вмешательства в онкологии / Б.И. Долгушин, Ю.И. Патютко, А.М. Нечипай, А.В. Кукушкин. — М., 2005. — 175 с.
9. Долгушин, Б.И. Чрескожная пункционная нефростомия в онкологии / Б.И. Долгушин, И.А. Трофимов // Международный журнал интервенционной кардиоангиоло-гии. — 2005. — № 7. —С.21 (материалы II Российского съезда интервенционных кардиоангиологов, Россия, М., 2005.)
10. Валиев,А.К. Вертебропластика — метод выбора лечения болевого синдрома у больных с опухолевым поражением позвоночника / А.К. Валиев, Б.И. Долгушин, М.Д. Алиев [и др.] // Материалы III съезда онкологов и радиологов СНГ. — Минск, 2004. — С.255.
11. Dijkstra, P.D.S. Pathological fractures of long bones due to bone мetastases / P.D.S. Dijkstra. — 2001.
12. Coleman, R. Bone metastases from breast cancer and other solid tumors / R. Coleman. — ASCO, 2001.
13. Валиев, А.К. Чрескожная вертебропластика в онкологии: монография / А.К. Валиев, Э.Р. Мусаев, В.В. Тепляков [и др.]. — М., 2010.
14. Долгушин, Б.И. Осложнения радиочастотной термоабляции опухолей / Б.И. Долгушин, В.Н. Шолохов, В.Ю. Косырев // Новые технологии в диагностике, интервенционной радиологии и хирургии печени и поджелудочной железы: материалы конф., 8—10 июня 2005 г. — М., 2005. — С.89.
15. Долгушин, Б.И. Восстановление проходимости стриктур трубчатых органов металлическими сетчатыми протезами у неоперабельных онкологических больных пожилого возраста / Б.И. Долгушин, М.И. Нечушкин, В.А. Черкасов [и др.] // Клиническая геронтология. — 2005. — Т. 11, № 6. — С.15—25.
16. Долгушин, Б.И. Имплантация оригинального окклюдера — метод лечения послеоперационных бронхоплев-ральных и трахеоплевральных свищей / Б.И. Долгушин, А.М. Нечипай, В.А. Черкасов [и др.] // Международный журнал интервенционной кардиоангиологии. — 2005. — № 7. — С.21 (материалы II Российского съезда интервенционных кардиоангиологов, Россия, М., 2005).