Третичная структура белка что такое
Фиброин
Свойства
Фиброин является гетеродимером, образованным двумя белковыми цепями. Его первичная структура состоит из повторяющейся аминокислотной последовательности (Gly-Ser-Gly-Ala-Gly-Ala) n.
В свою очередь, повторяющиеся аминокислотные последовательности образуют антипараллельные складчатые β-слои, связанные водородными связями. Эта структура обуславливает высокий предел прочности нитей паутин и шелка. Более прочный, чем кевлар, фиброин вдобавок ещё и высоко эластичен. Эти качества делают его материалом, применяемым в различных областях, включая биомедицину и текстильное производство.
Структуры
Структура белка
По вторичной структуре белка семейство кератинов разделяется на две группы:
Для первичной структуры α-кератинов характерно большое содержание цистеина и множество дисульфидных связей.
В отличие от α-кератинов поперечные дисульфидные связи между соседними полипептидными цепями у β-кератинов отсутствуют. В полипептидной цепи каждый второй элемент — глицин. Характерно повторение последовательности «GSGAGA».
Для α-кератинов основным структурным компонентом являются цилиндрические микрофибриллы диаметром 75 А, состоящие из спирализованных, скрученных попарно протофибрилл.
Третичная структура белка
Под третичной структурой белка подразумевают пространственную ориентацию полипептидной спирали или способ укладки полипептидной цепи в определенном объеме. Поскольку ни первичная структура, ни типы спиралей или сочетания спиральных и линейных участков полипептидной цепи не дают представления об объеме, форме полипептидной цепи, перед исследователем всегда стоит необходимость определения трехмерной или пространственной конфигурации белка. Основную роль в решении этих задач сыграл рентгеноструктурный анализ с высокой разрешающей способностью. Как было отмечено, метод успешно решает две главные проблемы химии белков: закономерность последовательностей аминокислотных остатков в полипептиде и закономерность конфигурации молекулы белка. Межатомные расстояния в молекулах органических веществ составляют 0,1–0,2 нм, а максимальная разрешающая способность современных аппаратов равна 0,2 нм. Это не позволяет установить местоположение каждого атома, хотя вполне могут быть различимы отдельные сочетания атомов, особенно при введении в молекулу белков атомов тяжелых металлов (последние благодаря своей высокой электронной плотности используются в качестве точек отсчета при математической обработке рентгенограмм).
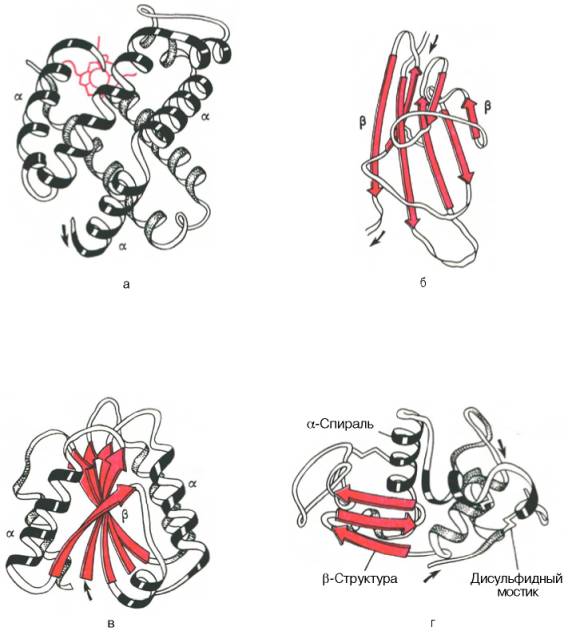
Рис. 1.19. Доменное строение глобулярных белков (по А. А. Болдыреву).
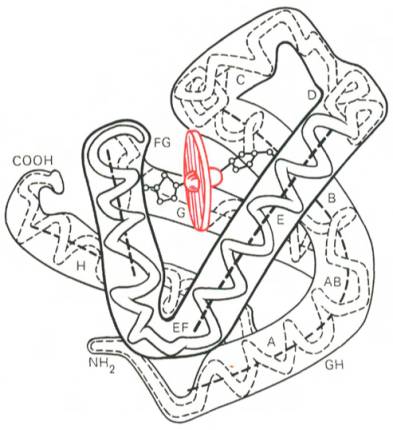
Рис. 1.20. Модель третичной структуры молекулы миоглобина (по Дж. Кендрью). Латинскими буквами обозначены структурные домены, красным цветом – гем.
Первым белком, третичная структура которого была выяснена Дж. Кендрью на основании рентгеноструктурного анализа, оказался мио-глобин кашалота. Это сравнительно небольшой белок с мол. м. 16700, содержащий 153 аминокислотных остатка (полностью выяснена первичная структура), представленный одной полипептидной цепью. Основная функция миоглобина – перенос кислорода в мышцах. Полипептидная цепь мио-глобина (рис. 1.20) представлена в виде изогнутой трубки, компактно уложенной вокруг гема (небелковый компонент, содержащий железо; см. главу 2).
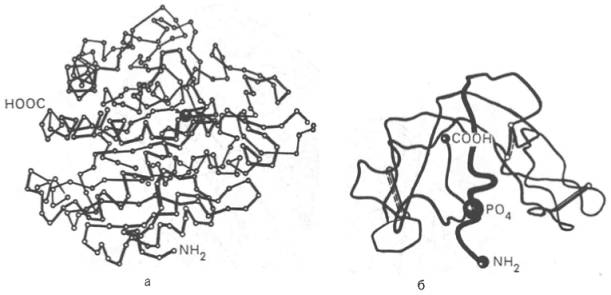
На протяжении последних десятилетий в связи с повышением разрешающей способности рентгеноструктурного метода была расшифрована третичная структура более 1000 белков, в том числе гемоглобина, пепсина, химотрипсина, рибонуклеазы, лизоцима, трипсина и его ингибитора, ряда фрагментов иммуноглобулинов человека, цитохрома С, карбоангидразы человека, аспартатаминотрансферазы, инсулина и др. Примеры трехмерной структуры некоторых из них представлены на рис. 1.21.
Рентгеноструктурный анализ позволяет определить конформацию и ход полипептидной цепи в пространстве, поэтому для каждого белка может быть построена объемная модель, отражающая местоположение линейных и спирализованных участков. При изучении глобулярных белков было показано, что пространственная структура белков в сильной степени зависит от ряда факторов, в частности от ионной силы и рН раствора, температуры и т.д. Новейшие методы дифракции рентгеновских лучей позволили расшифровать кристаллическую структуру более 100 ферментов. Для выяснения трехмерной структуры белков в последнее время успешно применяются также методы низкотемпературной вычислительной техники, а также математические и компьютерные методы определения объемной структуры на основании данных последовательностей аминокислот.
Рис. 1.21. Пространственная конфигурация карбоксипептидазы (а) и рибонуклеазы (б).
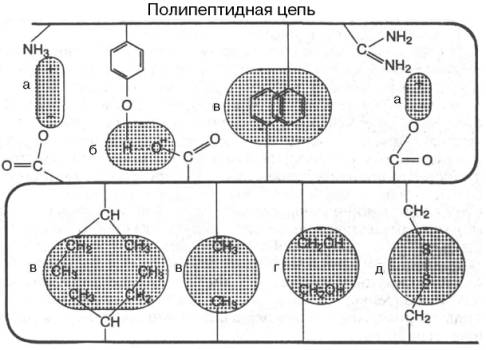
В настоящее время получены бесспорные доказательства, что в стабилизации пространственной структуры белков, помимо ковалентных связей (пептидные и дисульфидные связи), основную роль играют так называемые нековалентные связи (рис. 1.22). К этим связям относятся водородные связи, электростатические взаимодействия заряженных групп, межмолекулярные ван-дер-ваальсовы силы, взаимодействия неполярных боковых радикалов аминокислот, так называемые гидрофобные взаимодействия и т.д.
По современным представлениям, третичная структура белка после завершения его синтеза в рибосомах (см. главу 14) формируется совершенно автоматически, самопроизвольно и полностью предопределяется первичной структурой. Основной движущей силой в возникновении трехмерной структуры является взаимодействие радикалов аминокислот с молекулами воды. При этом неполярные гидрофобные радикалы аминокислот как бы погружаются внутрь белковой молекулы, образуя там сухие зоны, в то время как полярные радикалы оказываются ориентированными в сторону воды. В какой-то момент возникает термодинамически наиболее выгодная стабильная конформация молекулы. В такой форме белковая молекула характеризуется минимальной свободной энергией. Молекулы белков в водных растворах обычно принимают ряд стабильных конформаций, индуцируемых не только изменениями рН и температуры, но и низкомолекулярными соединениями. Различают две основные формы конформаций: Т-форму (от англ. tensed – напряженная) и R-форму (от англ. relaxed – расслабленная). Между этими формами осуществляются переходы, соответственно отражающиеся в биологических свойствах.
Рис. 1.22. Типы нековалентных связей, стабилизирующих третичную структуру белка.
В процессе укладки синтезированной полипептидной цепи, получившем название фолдинга – формирование нативной пространственной структуры, в клетках происходит отбор из множества стерически возможных состояний одной-единственной стабильной и биологически активной кон-формации, определяемой, вероятнее всего, первичной структурой. Описан ряд наследственных заболеваний человека, развитие которых связывают с нарушением вследствие мутаций процесса фолдинга (пигментозы, фиброзы и др.). Поэтому в настоящее время пристальное внимание исследователей приковано к выяснению зависимости между аминокислотной последовательностью синтезированной в клетке полипептидной цепи (первичная структура) и формированием пространственной трехмерной структуры, обеспечивающей белковой молекуле ее нативные свойства. Имеется немало экспериментальных доказательств, что этот процесс не является автоматическим, как предполагалось ранее, и, вероятнее всего, регулируется и контролируется также внутриклеточными молекулярными механизмами, детали которых пока полностью не раскрыты. Из клеток выделено несколько классов белков, названных шаперонами, или белками теплового шока, которые располагаются между N-концевым сигнальным пептидом и матричным белком. Предполагается, что основными функциями шаперонов являются способность предотвращать образование из полипептидной цепи неспецифических (хаотичных) беспорядочных клубков, или агрегатов белков, и обеспечение доставки (транспорта) их к субклеточным мишеням, создавая условия для завершения свертывания белковой молекулы. Эти результаты наводят на мысль о возможности существования «второй половины генетического кода», определяя тем самым повышенный интерес исследователей к проблеме свертывания полипептидной цепи и формирования ее нативной пространственной конформации.
Таким образом, линейная одномерная структура полипептидной цепи (т.е. последовательность аминокислотных остатков, обусловленная кодом белкового синтеза) наделена информацией другого типа – конформацион-ной, которая представляет собой образование белковой молекулы строго заданной формы с определенным пространственным расположением отдельных ее частей. Другими словами, третичная – объемная – структура белковой молекулы детерминирована аминокислотной последовательностью полипептидной цепи, а более конкретно – размером, формой и полярностью радикалов аминокислотных остатков. Эти представления могут служить основой для предсказания конформации белковой молекулы на основании аминокислотной последовательности. Следует указать, однако, что до сих пор представляется интригующей загадкой механизм этой тесной и тонкой связи между аминокислотной последовательностью и трехмерной структурой белковой молекулы. Оказывается, иногда полипептиды почти с одинаковыми последовательностями образуют разные структуры и, наоборот, полипептиды с разными последовательностями формируют одинаковую трехмерную структуру.
В свою очередь трехмерная структура белковой молекулы также содержит информацию, но уже совершенно нового типа, а именно функциональную, которую акад. В.А. Энгельгардт назвал интрамолекулярной информацией. Как будет показано далее, все биологические свойства белков (каталитические, гормональные, антигенные и др.) связаны с сохранностью их третичной структуры, которую принято называть нативной конформацией. Любые воздействия (термические, физические, химические), приводящие к нарушению этой конформации молекулы (разрыв водородных и других нековалентных связей), сопровождаются частичной или полной потерей белком его биологических свойств.
Параграф 58. белки вторичная и третичная структура
Автор текста – Анисимова Елена Сергеевна.
Авторские права защищены. Продавать текст нельзя. Курсив НЕ НУЖНО зубрить.
Замечания можно присылать по почте: exam_bch@mail.ru
https://vk.com/bch_5
ПАРАГРАФ 58:
«ВТОРИЧНАЯ И ТРЕТИЧНАЯ СТРУКТУРА белков».
(См. сначала п.56 и п.57.)
Полипептидная цепь (ППЦ) способна формировать в пространстве определённую структуру за счёт взаимодействия атомов;
эти структуры получили название вторичной и третичной структуры (см. далее).
58.1. ВТОРИЧНАЯ СТРУКТУРА БЕЛКА.
Один из самых распространённых способов изменить конформацию и активность молекул белков – это присоединение и отщепление фосфатной группы. Эти реакции осуществляются под действием ферментов протеинкиназ и протеинфосфатаз (активность которых, в свою очередь, регулируется гормонами).
Присоединение фосфата меняет конформацию белковой молекулы потому, что фосфат имеет отрицательный заряд; присоединие фосфата приводит к тому, что к его отрицательному заряду притягиваются положительно заряженные радикалы, а отрицательно заряженные радикалы отталкиваются от отрицательного заряда фосфата.
Кратко – изменение конформации белка приводит к изменению активности белка (так как приводит к исчезновению или к появлению активного центра). Причиной изменений конформации белка является изменение условий среды, в которой находится белок, или изменение химического состава белка.
58.5. Денатурация. См. параграф 3.
Это потеря активности белка в результате разрушения третичной (или четвертичной) структуры. При этом ППЦ не разрушается, первичная структура сохраняется.
Почему происходит потеря активности – потому что при разрушении третичной структуры исчезают активные центры – из-за того, что отдаляются друг от друга РАДИКАЛЫ, формировавшие активный центр.
Под действием чего происходит денатурация и почему? – Под действием факторов, которые называют денатураторами. Примеры денатураторов:
ВЫСОКАЯ ТЕМПЕРАТУРА (нагревание; повышение температуры тела выше 37 градусов),
повышение или ПОНИЖЕНИЕ рН в результате появления кислот или щелочей (отклонение от оптимального для данного белка рН, который для большинства белков – около 7),
определённые излучения (например, РАДИАЦИЯ), определённые химические вещества, особенно гидрофобные, растворители и т.д.
Все денатураторы (например, высокая температура) ПОТЕНЦИАЛЬНО ОПАСНЫ для организма именно потому, что приводят к потере активности белков, что приводит к нарушению процессов в организме и гибели клеток.
При исчезновении денатурирующего фактора ППЦ иногда могут снова сформировать третичную структуру, что может привести к возвращению активности белка.
Третичные белки
Вы будете перенаправлены на Автор24
Белки – это состоящие из углерода, водорода, кислорода, серы и азота органические высокомолекулярные соединения.
Третичная структура белка – это пространственное строение (а также конформация) всей белковой молекулы, состоящей из одной цепи.
Третичные белки
По форме третичная структура белка может быть:
Фибриллярные белки имеют вытянутую форму (палочки, веретена, нити). Такие видоизменения белковой структуры не являются редкостью, но основным типом третичной структуры белка называют глобулу. Глобулярные белки, как правило имеют эллипсовидную форму,
Однако конфигурация третичной структуры белков еще не дает основания полагать, что фибриллярные белки имеют только β-структуру, а глобулярные α-спиральные. Эти структуры могут меняться. Изменение конфигурации третичной структуры зависит от многих факторов, но всегда несет адаптивное значение.
Например, α-кератин и парамиозин относятся к фибриллярным белкам, но при этом имеет палочковидную форму.
Третичная структура белка отличается тем, что обладает более высокой степенью компактности, чем исходная цепь первичной структуры. Третичная структура белка формируется совершенно автоматически, самопроизвольно. Основной движущей силой, которая приводит к образованию третичной структуры, является взаимодействие радикалов аминокислот с молекулами воды. При этом глобула становится термодинамической стабильной структурой, выгодной для белка. На дальнейшую конформацию белковой структуры влияют факторы рН и ионной силы раствора, а также взаимодействие белковых молекул с другими веществами.
Только после того, как белок приобретает собственную уникальную третичную структур, он может проявлять весь спектр своих свойств: ферментативных, антигенных, а также многих других. Именно третичная структура белка формирует активные центры ферментативных молекул. Любое воздействие на него приводит к разрушению третичной структуры, с потерей ее основных свойств.
Готовые работы на аналогичную тему
Свойства третичной структуры белка
Третичная структура в значительной степени определяется первичной структурой. На коечную форму белка при его конформации существенно влияет окружающая среда. Для того, чтобы третичная структура белка приобретала стабильную форму, необходимо наличие:
При взаимодействии с окружающими молекулами воды белковая молекула «стремится» приобрести такую форму, чтобы неполярные белковые группы оказались изолированными от водного раствора, а на поверхности белковой молекулы оказывались полярные гидрофильные боковые группы.
Третичная структура также характерна для нуклеиновых кислот, а именно РНК. Большинство молекул белков имеют полипептидные цепи, которые особым образом сворачиваются в компактную глобулу.
Внутри глобулы выделяют три типа связей, благодаря которым она удерживается:
Все связи, удерживающие третичную структуру белка, делятся на слабые и сильные. К слабым связям относят: гидрофобные связи, водородные связи, ионные и электростатические связи.
К сильному типу связей относят: дисульфидную связь, псевдопептидную связь, сложно-эфирную связь.
За последнее время ученые открыли специализированные клеточные белки и ферментативные белки, регулирующие процесс сворачивания вновь созданных полипептидных цепей в обновленную третичную структуру. Например, фермент протеиндисульфидизомераза – катализирует расщепление неправильно образованных дисульфидных связей и формирует новые S-S-связи.
Кроме того, третичная структура белка поддерживается специфическими гидрофобными взаимодействиями. Если говорить о количественном отношении, то важны именно гидрофобные взаимодействия.
Для того, чтобы на практике определить наличие третичной структуры белка используют рентгеновский анализ. Основные типы таких экспериментов проводились Дж. Кендрью и М. Перцу. К началу 1959 года с помощью рентгеновского анализа ученые определили вторичную и третичную структуру белка мышц миоглобина, они также предложили модель молекулы данного белка. За эту работу ученые получили Нобелевскую премию.
Сегодня у миоглобина известны:
Третичная структура белка обладает несколькими особенностями, например:
Другие белки в основной массе также имеют все виды структур от первичной до третичной (иногда четвертичной).
Подводя итог всему вышесказанному, можно сделать вывод о том, что определение третичной структуры является достаточно трудоемким процессом. В последнее время молекулярные биологи все большее количество усилий затрачивают на попытки использовать компьютеры и другую технику, которая может позволить «предсказать» строение третичной структуры на основе уже имеющихся сведений о первичной и вторичной структурах.
Полученные сведения смогли бы помочь сконструировать белок определенной структуры, который предназначен для выполнения специфических функций. Это могло бы стать прорывом в промышленности и медицине.
Третичная структура белков
Содержание
Связь с первичной структурой
Третичная структура в значительной степени предопределена первичной структурой. Усилия по предсказанию третичной структуры белка основываясь на первичной структуре известна как задача предсказания структуры белка. Однако, окружающая среда, в которой белок сворачивается существенно определяет конечную форму, но обычно непосредственно не принимается во внимание текущими методами предсказания. Большинство таких методов полагаются на сравнения с уже известными структурами, и таким образом включают окружающую среду косвенно.
Третичная структура у белков
В стабилизации третичной структуры белка принимают участие:
Третичная структура у РНК
См. также
Литература
Примечания
Полезное
Смотреть что такое «Третичная структура белков» в других словарях:
третичная структура белков — – пространственная организация полипептидной цепи, формируемая в результате внутримолекулярных специфических и универсальных взаимодействий между радикалами аминокислотных остатков … Краткий словарь биохимических терминов
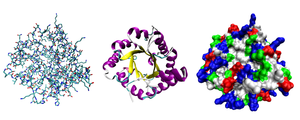
Третичная структура — Разные способы изображения трёхмерной структуры белка на примере фермента триозофосфатизомеразы. Слева «палочковая» модель, с изображением всех атомов и связей между ними; цветами показаны элементы. В середине изображены структурные мотивы … Википедия
Вторичная структура белков — Вторичная структура конформационное расположение главной цепи (англ. backbone) макромолекулы (например, полипептидная цепь белка), независимо от конформации боковых цепей или отношения к другим сегментам [1]. В описании вторичной… … Википедия
МОДИФИКАЦИЯ БЕЛКОВ — (от позднелат. modificatio изменение) биогенная, происходит после завершения трансляции матричной рибонуклеиновой к ты, или мРНК, (синтез белка на мРНК матрице) или до ее завершения. В первом случае М. б. наз. п о с т т р а н с л я ц и о н н о й … Химическая энциклопедия
Вторичная структура — Вторичная структура конформационное расположение главной цепи (англ. backbone) макромолекулы (например, полипептидная цепь белка), независимо от конформации боковых цепей или отношения к другим сегментам [1]. В описании вторичной… … Википедия
Белка структура — основными структурными единицами (мономерами) белков являются остатки аминокислот, соединенные друг с другом пептидными связями в длинные цепи. Отдельные цепи могут притягиваться друг к другу или образовывать петли и загибаться назад, так что… … Начала современного естествознания
БЕЛКИ (органические соединения) — БЕЛКИ, высокомолекулярные органические соединения, биополимеры, построенные из 20 видов L a аминокислотных остатков, соединенных в определенной последовательности в длинные цепи. Молекулярная масса белков варьируется от 5 тыс. до 1 млн. Название… … Энциклопедический словарь
Биополимер — Биополимеры класс полимеров, встречающихся в природе в естественном виде, входящие в состав живых организмов: белки, нуклеиновые кислоты, полисахариды. Биополимеры состоят из одинаковых (или разных) звеньев мономеров. Мономеры белков … … Википедия
Биополимеры — Биополимеры класс полимеров, встречающихся в природе в естественном виде, входящие в состав живых организмов: белки, нуклеиновые кислоты, полисахариды, лигнин. Биополимеры состоят из одинаковых (или схожих) звеньев мономеров. Мономеры … Википедия
Протеом — термин для обозначения всей совокупности белков (протеинов) организма, производимых клеткой, тканью или организмом в определённый период времени. Или, более строго, это совокупность экспрессированных протеинов в данном типе клеток или в организме … Википедия